6.3物质的溶解性同步练习(含答案)沪教版化学九年级下册
文档属性
| 名称 | 6.3物质的溶解性同步练习(含答案)沪教版化学九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 761.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 16:31:33 | ||
图片预览



文档简介
6.3物质的溶解性
一、多选题
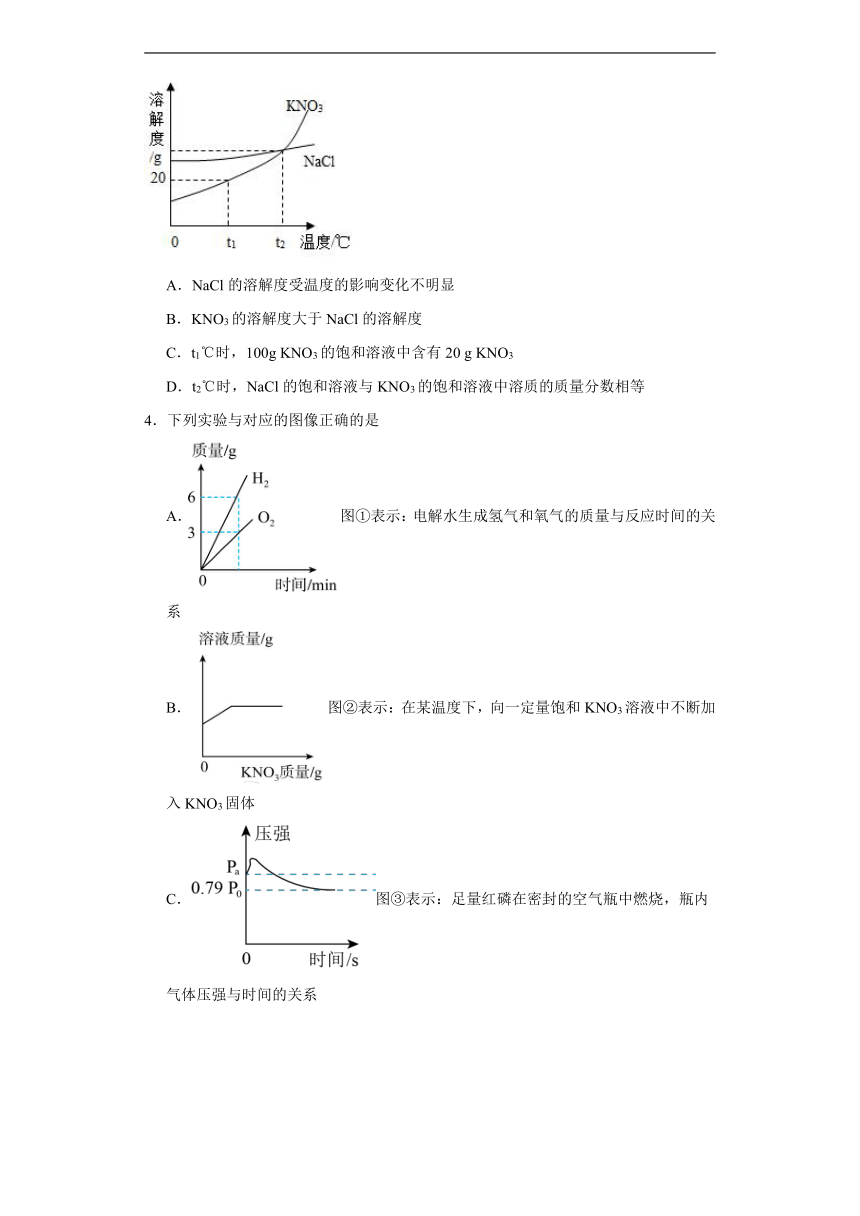
1.如图是甲、乙、丙三种固体物质的溶解度曲线。则有关叙述正确的是
A.t1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲
B.t2℃时,20g丙能溶解于50g水中形成70g溶液
C.若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,所得溶液溶质质量分数的大小关系为:乙>甲=丙
2.如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的
是
A.甲中混有少量杂质乙,可采用降温结晶的方法进行提纯
B.t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:乙>甲=丙
C.t3℃时,等质量的甲、乙、丙的溶液,甲溶液所含的溶质多
D.t1℃时,60g水中溶解18g甲可得到其饱和溶液
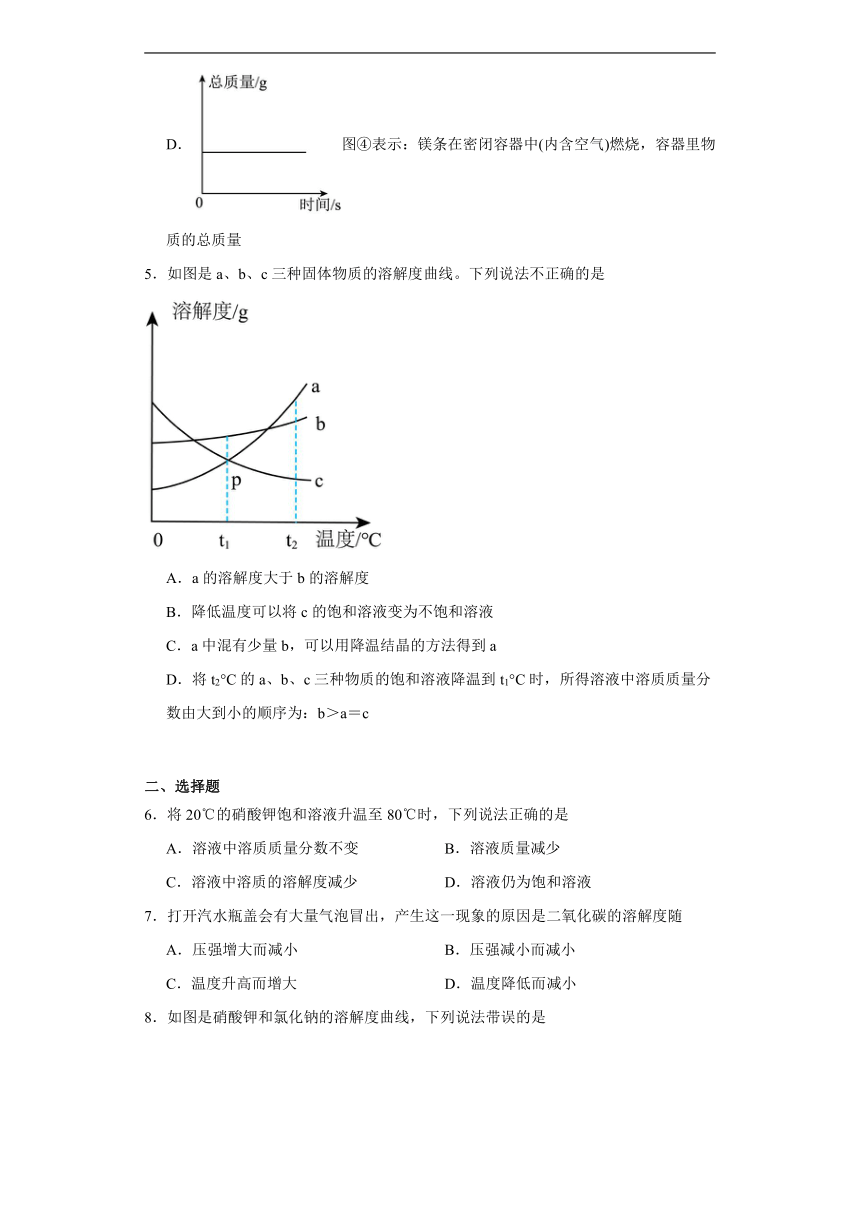
3.右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度受温度的影响变化不明显
B.KNO3的溶解度大于NaCl的溶解度
C.t1℃时,100g KNO3的饱和溶液中含有20 g KNO3
D.t2℃时,NaCl的饱和溶液与KNO3的饱和溶液中溶质的质量分数相等
4.下列实验与对应的图像正确的是
A.图①表示:电解水生成氢气和氧气的质量与反应时间的关系
B.图②表示:在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
C.图③表示:足量红磷在密封的空气瓶中燃烧,瓶内气体压强与时间的关系
D.图④表示:镁条在密闭容器中(内含空气)燃烧,容器里物质的总质量
5.如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是
A.a的溶解度大于b的溶解度
B.降低温度可以将c的饱和溶液变为不饱和溶液
C.a中混有少量b,可以用降温结晶的方法得到a
D.将t2°C的a、b、c三种物质的饱和溶液降温到t1°C时,所得溶液中溶质质量分数由大到小的顺序为:b>a=c
二、选择题
6.将20℃的硝酸钾饱和溶液升温至80℃时,下列说法正确的是
A.溶液中溶质质量分数不变 B.溶液质量减少
C.溶液中溶质的溶解度减少 D.溶液仍为饱和溶液
7.打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随
A.压强增大而减小 B.压强减小而减小
C.温度升高而增大 D.温度降低而减小
8.如图是硝酸钾和氯化钠的溶解度曲线,下列说法带误的是
A.t℃时,NaCl和KNO3的溶解度相等
B.20℃时,100gNaCl饱和溶液中溶质的质量为36g
C.50℃时,采用降温结晶的方法除去KNO3中混有的少量NaC1
D.将50℃的NaCl和KNO3饱和溶液分别降温至20℃、所得溶液中溶质质量分数关系为NaCl> KNO3
9.甲、乙两种固体物质的溶解度曲线如图。下列说法正确的是
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和溶液
D.t℃乙物质的饱和溶液降到20℃时,溶液中溶质质量分数增大
10.运用溶解度表与溶解度曲线,下列说法正确的是
温度 10 30 50 60
溶解度 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
A.B是硝酸钾的溶解度曲线。
B.将一定量50℃的A、B溶液降温到30℃时,析出的晶体A一定比B多
C.10℃时,将40g氯化钠溶于100g水中,所得溶液溶质的质量分数约为28.6%
D.可用冷却热饱和溶液的方法提纯含有杂质B的A
11.25℃时50g水最多溶解5gA;60℃时,100g水最多溶解10gB,则比较A,B溶解度大小为
A.不能比较 B.A=B C.A>B D.A12.如图是A、B两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至℃,这时说法正确的是
A.二者均由晶体析出 B.只有A有晶体析出
C.只有B有晶体析出 D.A物质的溶解度大于B物质的溶解度
13.如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是
A.可用降温结晶的方法将物质乙从甲、乙的混合物中分离出来
B.甲、乙物质都是易溶物
C.甲的饱和溶液从30℃降温至10℃后仍然饱和
D.10℃时,饱和的甲、乙混合溶液中所含甲、乙的质量不一定相等
14.下列有关溶液的叙述错误的是( )
A.溶液是均一、稳定的混合物
B.一定条件下,饱和溶液和不饱和溶液可以相互转化
C.固体NaOH溶于水时,溶液温度升高
D.溶液中的溶剂只能是水
15.下列是对一瓶饱和氢氧化钠溶液的叙述,说法不正确的是
A.该溶液可以导电
B.外界条件不改变,氢氧化钠不会从溶液中分离出来
C.溶液均一、稳定是因为钠离子和氢氧根离子均匀分散在水中静止不动
D.改变条件,能够使氢氧化钠的饱和溶液与不饱和溶液相互转化
三、综合应用题
16.水是一种重要的自然资源,是生活、生产必不可少的物质.
(1)如图所示,实验I是制备蒸馏水的装置,实验II是电解水的装置.
①实验Ⅰ中水从A转移到B中,体现分子的性质是 .
②实验Ⅱ中反应的化学方程式是 .试管D中产生的气体可以使带火星的木条复燃,当试管D中气体的体积为n时,试管C中气体体积约为 .
(2)如图是甲、乙两种固体物质的溶解度曲线.
①t2℃时,甲、乙两种物质的饱和溶液所含溶质的质量相同,则溶液质量的大小关系为甲 乙(填“>”、“<”或“=”).
②将甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 (填字母序号).
A 溶剂的质量一定变小 B 溶质的质量可能不变 C 溶质的质量分数一定变大 D 溶液的质量一定变大 E 该饱和溶液还可以溶解其它物质
(3)下图是硝酸钾的溶解度曲线.某同学进行了如下实验,得到相应的溶液①~⑤.下列说法正确的是 (填字母序号).
A ④→⑤可析出53.9g KNO3晶体
B ②③⑤中溶质的质量分数相等
C ①③④均为不饱和溶液
D 保持温度不变,若在④中加入6gKNO3固体可得到饱和溶液.
17.水是构成一切生物体的基本成分,是生命之源。
(1)验证水的组成。
I、观察图1,b管连接的是电源 (选填“正”或“负”)极,电解水的化学方程式是 。
II、分析图2,点燃氢气前,可选用 干燥氢气(填序号)。
A.生石灰 B.熟石灰 C.无水硫酸铜 D.硫酸铜晶体
“干燥氢气”的目的是 。
(2)水是一种常用的溶剂,不同物质在水中的溶解能力不同。
下表是NaCl、CaCl2的部分溶解度数据:
温度(℃) 20 40 60 80 100
溶解度(g/100g水) NaCl 36.0 36.6 37.1 38.0
CaCl2 27.6 39.8 41.4 43.2
由上表可知,20℃时,NaCl的溶解度是 g/100g水;60℃时,10g水中最多能溶解CaCl2 g。
(3)某NaCl样品中混有少量CaCl2,可利用两物质溶解度的差异进行提纯。称取30g样品进行如下实验:
I、溶液A是该温度下NaCl的 (填“饱和”或“不饱和”)溶液。
II、30g样品中含CaCl2的质量是 g。
III、分析上述实验,说明步骤三趁热过滤的温度保持在60℃还是80℃更合适?请结合相关数据分析说明
18.有一份由硝酸钾、硫粉和碳粉均匀混合成的样品,请根据下列资料和分离该样品中各物质的实验方案,分析它们的含量。
资料1:硝酸钾、硫和碳在不同溶剂中的溶解性
硝酸钾 硫 碳
水 易溶 难溶 难溶
二硫化碳 难溶 易溶 难溶
资料2:不同温度下硝酸钾的溶解度
温度(℃) 20 40 60 80
硝酸钾的溶解度(g/100g 水) 31.6 63.9 110 169
(1)分析硝酸钾的含量。分别在20℃、40℃和60℃下,将10g样品加入10g水中,充分溶解后,剩余固体的质量如下表所示。
实验编号 甲 乙 丙
温度(℃) 20 40 60
剩余固体的质量(g) 6.84 3.61 2.5
①甲组实验中10g水溶解了 g硝酸钾。
②乙组实验所得溶液中硝酸钾的质量分数为 (只需要列式)。
③丙组实验所得溶液是硝酸钾的 (选填“饱和”或“不饱和”)溶液。
④10g样品中含硝酸钾 g。
(2)分析硫和碳的含量。取上述丙组实验中剩余的固体按下列流程操作。
①操作b的名称是 。溶液c中溶质是 ,溶剂是 。
②10g样品中含碳 g,含硫 g。
③若加入溶剂a的量太少,会对分析结果造成怎样的影响? 。
参考答案:
1.AC
2.BC
3.AD
4.CD
5.AD
6.A
7.B
8.B
9.B
10.D
11.A
12.C
13.A
14.D
15.C
16. 分子在不断运动 2H2O2H2↑+O2↑ 2n < BE CD
17.(1) 负 AC/CA 防止干扰对生成物水的检验
(2) 36.0 3.98
(3) 不饱和 4.09 60℃更合适;因为60℃时过滤,CaCl2不析出,析出NaCl的质量是22.29g,比80℃时析出的NaCl更多(或因为60℃时过滤,CaCl2不析出,析出NaCl的质量比80℃时多0.09g)
18.(1) 3.16 或 不饱和 7.5
(2) 过滤 硫或S 二硫化碳或 1.2 1.3 测出碳的含量偏大,硫的含量偏小
一、多选题
1.如图是甲、乙、丙三种固体物质的溶解度曲线。则有关叙述正确的是
A.t1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲
B.t2℃时,20g丙能溶解于50g水中形成70g溶液
C.若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,所得溶液溶质质量分数的大小关系为:乙>甲=丙
2.如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的
是
A.甲中混有少量杂质乙,可采用降温结晶的方法进行提纯
B.t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:乙>甲=丙
C.t3℃时,等质量的甲、乙、丙的溶液,甲溶液所含的溶质多
D.t1℃时,60g水中溶解18g甲可得到其饱和溶液
3.右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度受温度的影响变化不明显
B.KNO3的溶解度大于NaCl的溶解度
C.t1℃时,100g KNO3的饱和溶液中含有20 g KNO3
D.t2℃时,NaCl的饱和溶液与KNO3的饱和溶液中溶质的质量分数相等
4.下列实验与对应的图像正确的是
A.图①表示:电解水生成氢气和氧气的质量与反应时间的关系
B.图②表示:在某温度下,向一定量饱和KNO3溶液中不断加入KNO3固体
C.图③表示:足量红磷在密封的空气瓶中燃烧,瓶内气体压强与时间的关系
D.图④表示:镁条在密闭容器中(内含空气)燃烧,容器里物质的总质量
5.如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是
A.a的溶解度大于b的溶解度
B.降低温度可以将c的饱和溶液变为不饱和溶液
C.a中混有少量b,可以用降温结晶的方法得到a
D.将t2°C的a、b、c三种物质的饱和溶液降温到t1°C时,所得溶液中溶质质量分数由大到小的顺序为:b>a=c
二、选择题
6.将20℃的硝酸钾饱和溶液升温至80℃时,下列说法正确的是
A.溶液中溶质质量分数不变 B.溶液质量减少
C.溶液中溶质的溶解度减少 D.溶液仍为饱和溶液
7.打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随
A.压强增大而减小 B.压强减小而减小
C.温度升高而增大 D.温度降低而减小
8.如图是硝酸钾和氯化钠的溶解度曲线,下列说法带误的是
A.t℃时,NaCl和KNO3的溶解度相等
B.20℃时,100gNaCl饱和溶液中溶质的质量为36g
C.50℃时,采用降温结晶的方法除去KNO3中混有的少量NaC1
D.将50℃的NaCl和KNO3饱和溶液分别降温至20℃、所得溶液中溶质质量分数关系为NaCl> KNO3
9.甲、乙两种固体物质的溶解度曲线如图。下列说法正确的是
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和溶液
D.t℃乙物质的饱和溶液降到20℃时,溶液中溶质质量分数增大
10.运用溶解度表与溶解度曲线,下列说法正确的是
温度 10 30 50 60
溶解度 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
A.B是硝酸钾的溶解度曲线。
B.将一定量50℃的A、B溶液降温到30℃时,析出的晶体A一定比B多
C.10℃时,将40g氯化钠溶于100g水中,所得溶液溶质的质量分数约为28.6%
D.可用冷却热饱和溶液的方法提纯含有杂质B的A
11.25℃时50g水最多溶解5gA;60℃时,100g水最多溶解10gB,则比较A,B溶解度大小为
A.不能比较 B.A=B C.A>B D.A
A.二者均由晶体析出 B.只有A有晶体析出
C.只有B有晶体析出 D.A物质的溶解度大于B物质的溶解度
13.如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是
A.可用降温结晶的方法将物质乙从甲、乙的混合物中分离出来
B.甲、乙物质都是易溶物
C.甲的饱和溶液从30℃降温至10℃后仍然饱和
D.10℃时,饱和的甲、乙混合溶液中所含甲、乙的质量不一定相等
14.下列有关溶液的叙述错误的是( )
A.溶液是均一、稳定的混合物
B.一定条件下,饱和溶液和不饱和溶液可以相互转化
C.固体NaOH溶于水时,溶液温度升高
D.溶液中的溶剂只能是水
15.下列是对一瓶饱和氢氧化钠溶液的叙述,说法不正确的是
A.该溶液可以导电
B.外界条件不改变,氢氧化钠不会从溶液中分离出来
C.溶液均一、稳定是因为钠离子和氢氧根离子均匀分散在水中静止不动
D.改变条件,能够使氢氧化钠的饱和溶液与不饱和溶液相互转化
三、综合应用题
16.水是一种重要的自然资源,是生活、生产必不可少的物质.
(1)如图所示,实验I是制备蒸馏水的装置,实验II是电解水的装置.
①实验Ⅰ中水从A转移到B中,体现分子的性质是 .
②实验Ⅱ中反应的化学方程式是 .试管D中产生的气体可以使带火星的木条复燃,当试管D中气体的体积为n时,试管C中气体体积约为 .
(2)如图是甲、乙两种固体物质的溶解度曲线.
①t2℃时,甲、乙两种物质的饱和溶液所含溶质的质量相同,则溶液质量的大小关系为甲 乙(填“>”、“<”或“=”).
②将甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 (填字母序号).
A 溶剂的质量一定变小 B 溶质的质量可能不变 C 溶质的质量分数一定变大 D 溶液的质量一定变大 E 该饱和溶液还可以溶解其它物质
(3)下图是硝酸钾的溶解度曲线.某同学进行了如下实验,得到相应的溶液①~⑤.下列说法正确的是 (填字母序号).
A ④→⑤可析出53.9g KNO3晶体
B ②③⑤中溶质的质量分数相等
C ①③④均为不饱和溶液
D 保持温度不变,若在④中加入6gKNO3固体可得到饱和溶液.
17.水是构成一切生物体的基本成分,是生命之源。
(1)验证水的组成。
I、观察图1,b管连接的是电源 (选填“正”或“负”)极,电解水的化学方程式是 。
II、分析图2,点燃氢气前,可选用 干燥氢气(填序号)。
A.生石灰 B.熟石灰 C.无水硫酸铜 D.硫酸铜晶体
“干燥氢气”的目的是 。
(2)水是一种常用的溶剂,不同物质在水中的溶解能力不同。
下表是NaCl、CaCl2的部分溶解度数据:
温度(℃) 20 40 60 80 100
溶解度(g/100g水) NaCl 36.0 36.6 37.1 38.0
CaCl2 27.6 39.8 41.4 43.2
由上表可知,20℃时,NaCl的溶解度是 g/100g水;60℃时,10g水中最多能溶解CaCl2 g。
(3)某NaCl样品中混有少量CaCl2,可利用两物质溶解度的差异进行提纯。称取30g样品进行如下实验:
I、溶液A是该温度下NaCl的 (填“饱和”或“不饱和”)溶液。
II、30g样品中含CaCl2的质量是 g。
III、分析上述实验,说明步骤三趁热过滤的温度保持在60℃还是80℃更合适?请结合相关数据分析说明
18.有一份由硝酸钾、硫粉和碳粉均匀混合成的样品,请根据下列资料和分离该样品中各物质的实验方案,分析它们的含量。
资料1:硝酸钾、硫和碳在不同溶剂中的溶解性
硝酸钾 硫 碳
水 易溶 难溶 难溶
二硫化碳 难溶 易溶 难溶
资料2:不同温度下硝酸钾的溶解度
温度(℃) 20 40 60 80
硝酸钾的溶解度(g/100g 水) 31.6 63.9 110 169
(1)分析硝酸钾的含量。分别在20℃、40℃和60℃下,将10g样品加入10g水中,充分溶解后,剩余固体的质量如下表所示。
实验编号 甲 乙 丙
温度(℃) 20 40 60
剩余固体的质量(g) 6.84 3.61 2.5
①甲组实验中10g水溶解了 g硝酸钾。
②乙组实验所得溶液中硝酸钾的质量分数为 (只需要列式)。
③丙组实验所得溶液是硝酸钾的 (选填“饱和”或“不饱和”)溶液。
④10g样品中含硝酸钾 g。
(2)分析硫和碳的含量。取上述丙组实验中剩余的固体按下列流程操作。
①操作b的名称是 。溶液c中溶质是 ,溶剂是 。
②10g样品中含碳 g,含硫 g。
③若加入溶剂a的量太少,会对分析结果造成怎样的影响? 。
参考答案:
1.AC
2.BC
3.AD
4.CD
5.AD
6.A
7.B
8.B
9.B
10.D
11.A
12.C
13.A
14.D
15.C
16. 分子在不断运动 2H2O2H2↑+O2↑ 2n < BE CD
17.(1) 负 AC/CA 防止干扰对生成物水的检验
(2) 36.0 3.98
(3) 不饱和 4.09 60℃更合适;因为60℃时过滤,CaCl2不析出,析出NaCl的质量是22.29g,比80℃时析出的NaCl更多(或因为60℃时过滤,CaCl2不析出,析出NaCl的质量比80℃时多0.09g)
18.(1) 3.16 或 不饱和 7.5
(2) 过滤 硫或S 二硫化碳或 1.2 1.3 测出碳的含量偏大,硫的含量偏小
