7.2常见的酸和碱同步练习(含答案)沪教版化学九年级下册
文档属性
| 名称 | 7.2常见的酸和碱同步练习(含答案)沪教版化学九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 220.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 16:25:49 | ||
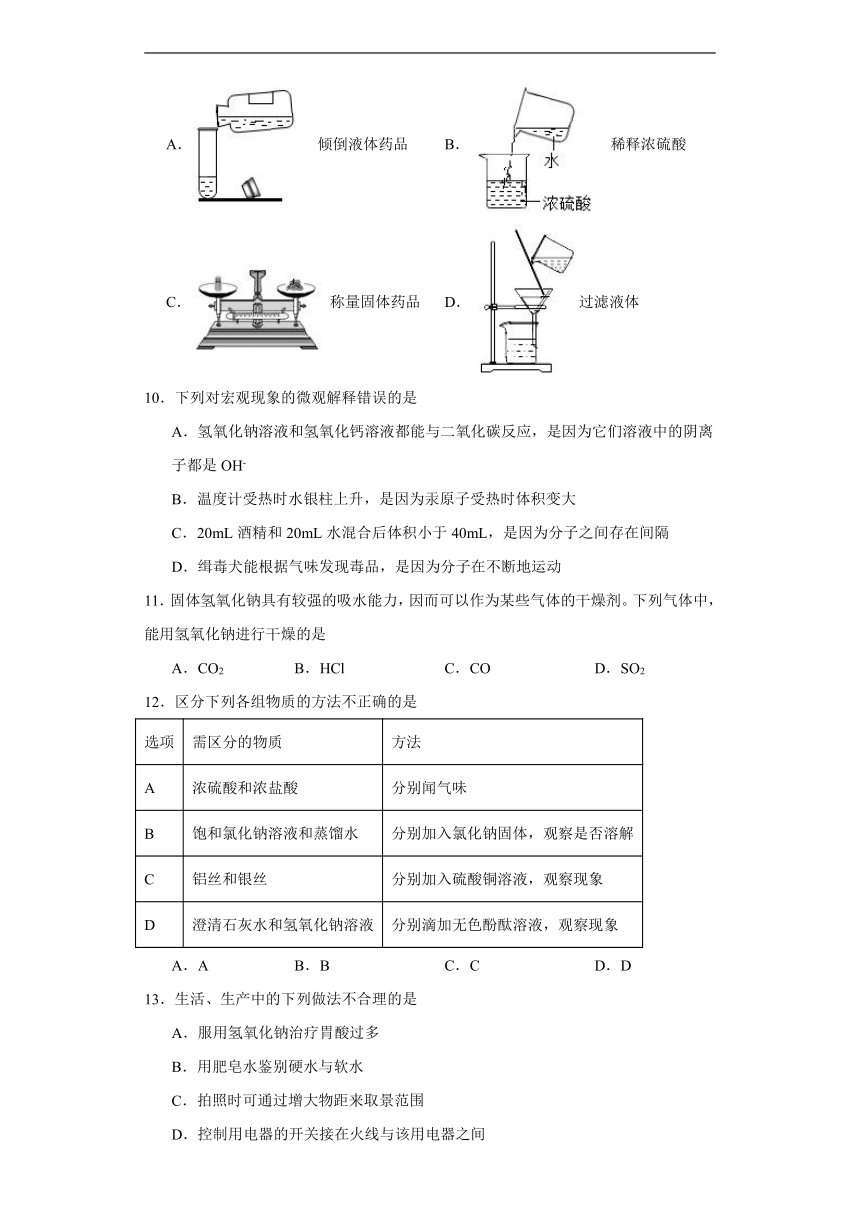
图片预览



文档简介
7.2常见的酸和碱
一、多选题
1.下列实验方案设计中,正确的是
A.鉴别硬水和软水,先分别取样加入少量肥皂水振荡,再观察现象
B.检验蜡烛中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察有无水雾
C.实验证明氢氧化钠是否变质,加入一滴稀盐酸,没有观察到气泡说明没有变质
D.实验室制备纯净的二氧化碳,用碳酸钙与浓盐酸反应,将产生的气体经浓硫酸干燥后收集
2.现有MgSO4、ZnSO4和CuSO4的混合溶液100g,加入6g铁粉,充分反应后过滤,得到一定温度下的不饱和滤液和滤渣。下列有关说法中,不合理的是
A.滤液一定是无色溶液 B.所得溶液中一定含有Zn2+、Mg2+、Fe2+
C.滤渣的质量一定小于6g D.滤渣中一定含有单质Fe和单质Cu
3.把200g一定溶质质量分数的稀盐酸平均分成两份,分别加入两个相同的烧杯中,放在已调平的天平左右两盘上,此时天平平衡,然后在左盘烧杯中加入5.6g铁粉。下列有关说法正确的是
A.若在右盘烧杯中加入5.6g锌粉,反应停止后,天平可能平衡
B.若在右盘烧杯中加入5.6g黄铜粉,反应停止后,天平不可能平衡
C.在右盘烧杯中加入5.6g镁粉,反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%
D.在右盘烧杯中加入5.6g铝粉,反应停止后,若天平不平衡,则左、右两盘烧杯中金属一定都无剩余
4.除去下列物质中的杂质,所用试剂和方法均正确的是
物质 杂质 所用试剂或方法
A CO2 CO 点燃
B Cu Fe 足量的稀盐酸
C N2 O2 灼热的铜网
D 炭粉 MnO2 加水过滤
A.A B.B C.C D.D
5.向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生,根据实验现象分析判断下列说法中不正确的是
A.滤液的颜色呈蓝色 B.滤液中可能存在Fe2+
C.滤渣中一定含有Fe、Cu、Zn D.滤渣中一定含有Fe和Cu可能含有Zn
二、选择题
6.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
7.下列有关实验操作的“先”与“后”的说法中,正确的是
A.制取气体时,一般先在容器中装入固体药品,然后再检查该套装置的气密性
B.加热KMnO4并用排水法收集O2的实验结束时,先熄灭酒精灯,后移出导管
C.稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌
D.加热试管时,先使试管均匀受热,后用酒精灯的外焰集中在药品的部位加热
8.下列某小组同学设计的四组试剂中,能用来验证锌、铜、银的金属活动性强弱的是( )
(1)锌片、银片、硝酸铜溶液
(2)银片、硝酸锌溶液、硝酸铜溶液
(3)铜片、硝酸锌溶液、硝酸银溶液
(4)锌片、铜片、硝酸银溶液
A.(1)(2)
B.(2)(3)
C.(3)(4)
D.(1)(3)
9.下列实验操作中,正确的是( )
A.倾倒液体药品 B.稀释浓硫酸
C.称量固体药品 D.过滤液体
10.下列对宏观现象的微观解释错误的是
A.氢氧化钠溶液和氢氧化钙溶液都能与二氧化碳反应,是因为它们溶液中的阴离子都是OH-
B.温度计受热时水银柱上升,是因为汞原子受热时体积变大
C.20mL酒精和20mL水混合后体积小于40mL,是因为分子之间存在间隔
D.缉毒犬能根据气味发现毒品,是因为分子在不断地运动
11.固体氢氧化钠具有较强的吸水能力,因而可以作为某些气体的干燥剂。下列气体中,能用氢氧化钠进行干燥的是
A.CO2 B.HCl C.CO D.SO2
12.区分下列各组物质的方法不正确的是
选项 需区分的物质 方法
A 浓硫酸和浓盐酸 分别闻气味
B 饱和氯化钠溶液和蒸馏水 分别加入氯化钠固体,观察是否溶解
C 铝丝和银丝 分别加入硫酸铜溶液,观察现象
D 澄清石灰水和氢氧化钠溶液 分别滴加无色酚酞溶液,观察现象
A.A B.B C.C D.D
13.生活、生产中的下列做法不合理的是
A.服用氢氧化钠治疗胃酸过多
B.用肥皂水鉴别硬水与软水
C.拍照时可通过增大物距来取景范围
D.控制用电器的开关接在火线与该用电器之间
14.下列劳动项目所涉及的化学知识正确的是
选项 劳动项目 化学知识
A 用石灰浆刷墙 氢氧化钙能与氧气反应
B 利用明矾来净化金鱼缸内的水 明矾是净水的絮凝剂
C 用生石灰制作发热包 CaO与水反应吸收热量
D 修车师傅用汽油清洗手上的油污 汽油能乳化油污
A.A B.B C.C D.D
15.将形状相同的等质量的铝、铁同时分别放入两份相同的稀盐酸中,生成 H2 的质量与反应时间的关系如图所示。 下列分析错误的是
A.x、y 分别为铝、铁
B.两份盐酸均完全反应
C.参与反应的铝、铁原子个数比为 2:1
D.反应结束时,铝一定有剩余,铁可能有剩余。
三、综合应用题
16.人类的生产、生活离不开金属,金属材料的应用推动了社会发展。
(1)锌是人体必需的微量元素,缺锌会导致生长迟缓。下图为锌元素在元素周期表中的信息及原子结构示意图,下列说法不正确的是
a.锌原子的质量为65.38g
b.锌原子的原子序数为30
c.锌原子核外有四个电子层
d.锌在反应中易失去电子
(2)①铝的化学性质活泼,为什么铝制品却很耐腐蚀 ?
②铁制品长期暴露在空气中会发生锈蚀,生活中常用稀盐酸除铁锈(主要成分Fe2O3),反应的化学方程式为 。
(3)如图是模拟一氧化碳还原氧化铁的实验装置图。
①玻璃管中观察到的现象是 。
②该装置末端处酒精灯的作用是什么? 。
(4)某化学小组用一定量AgNO3、Cu(NO3)2和Al(NO3)3的混合溶液进行了下图实验。对固体乙的成分,同学们作出如下猜想:I.只有Ag;Ⅱ.Ag、Cu;Ⅲ.Zn、Cu;Ⅳ.Ag、Cu、Zn。
①写出上述不合理的猜想,并说明理由 。
②若猜想Ⅱ成立,则溶液甲中一定含有哪些溶质?(写化学式) 。
(5)我国工业上利用“铝热反应”焊接钢轨、冶炼难溶性金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。现要用铝与四氧化三铁反应来制取铁,若要制取12.6t的铁,理论上需要铝的质量是多少?
17.铁是生产、生活中应用最广泛的金属。
(1) 2020年跨年之际,一场突如其来的新冠肺炎疫情从武汉波及全国。为收治病人,我国仅用了十天时间就建成了火神山医院。如图为正在建设时的火神山医院的钢结构。
①钢属于 材料;
②钢制品表面刷漆能防止生锈,原理是 。
(2)小强用“W”型玻璃管模拟工业炼铁的实验。
①写出a处反应的化学方程式 。
②为什么要进行尾气处理 。
(3)将一定量的铁粉加入到Cu(NO3)2、AgNO3的混合溶液中,充分反应后过滤,滤液呈蓝色。
①写出一定发生的反应的化学方程式 ;
②分析滤液的成分 ;
③反应后滤液的质量比反应前混合溶液的质量增大、减小还是不变
(4)在铁路建设中,常用下列反应实现钢轨对接: 。若建设中需要56kg铁,则消耗三氧化二铁的质量是多少
18.金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用“长征三号乙”运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”可用方程式表示为 。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤液中一定含有的金属离子是 。
(3)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有20g铜锌合金,与100g质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
参考答案:
1.AB
2.ACD
3.AC
4.BC
5.AC
6.A
7.D
8.D
9.D
10.B
11.C
12.D
13.A
14.B
15.C
16.(1)a
(2) 常温下,铝与空气中的氧气反应生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化 Fe2O3+6HCl=2FeCl3+3H2O
(3) 固体由红色变为黑色 燃烧掉尾气中的一氧化碳,防止污染空气
(4) Ⅲ的猜想不合理,因为固体中一定含有Ag Al(NO3)3、Zn(NO3)2
(5)5.4t
17. 金属 隔绝氧气和水 尾气中含有有毒气体一氧化碳 滤液中一定含有硝酸铜和生成的硝酸亚铁,可能含有没反应完全的硝酸银 减少 80kg
18.(1)高
(2) Fe+CuSO4=FeSO4+Cu Mg2+、Cu2+
(3)解:参加反应的纯硫酸的质量=100g×19.6%=19.6g
设合金中锌的质量为x
=
x=13g
合金中铜的质量=20g 13g=7g
铜锌合金中铜的质量分数=×100%=35%
答:铜锌合金中铜的质量分数为35%。
一、多选题
1.下列实验方案设计中,正确的是
A.鉴别硬水和软水,先分别取样加入少量肥皂水振荡,再观察现象
B.检验蜡烛中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察有无水雾
C.实验证明氢氧化钠是否变质,加入一滴稀盐酸,没有观察到气泡说明没有变质
D.实验室制备纯净的二氧化碳,用碳酸钙与浓盐酸反应,将产生的气体经浓硫酸干燥后收集
2.现有MgSO4、ZnSO4和CuSO4的混合溶液100g,加入6g铁粉,充分反应后过滤,得到一定温度下的不饱和滤液和滤渣。下列有关说法中,不合理的是
A.滤液一定是无色溶液 B.所得溶液中一定含有Zn2+、Mg2+、Fe2+
C.滤渣的质量一定小于6g D.滤渣中一定含有单质Fe和单质Cu
3.把200g一定溶质质量分数的稀盐酸平均分成两份,分别加入两个相同的烧杯中,放在已调平的天平左右两盘上,此时天平平衡,然后在左盘烧杯中加入5.6g铁粉。下列有关说法正确的是
A.若在右盘烧杯中加入5.6g锌粉,反应停止后,天平可能平衡
B.若在右盘烧杯中加入5.6g黄铜粉,反应停止后,天平不可能平衡
C.在右盘烧杯中加入5.6g镁粉,反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%
D.在右盘烧杯中加入5.6g铝粉,反应停止后,若天平不平衡,则左、右两盘烧杯中金属一定都无剩余
4.除去下列物质中的杂质,所用试剂和方法均正确的是
物质 杂质 所用试剂或方法
A CO2 CO 点燃
B Cu Fe 足量的稀盐酸
C N2 O2 灼热的铜网
D 炭粉 MnO2 加水过滤
A.A B.B C.C D.D
5.向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液和滤渣,向滤渣中加入稀盐酸,有气泡产生,根据实验现象分析判断下列说法中不正确的是
A.滤液的颜色呈蓝色 B.滤液中可能存在Fe2+
C.滤渣中一定含有Fe、Cu、Zn D.滤渣中一定含有Fe和Cu可能含有Zn
二、选择题
6.某同学将铁粉和铜粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和蓝色滤液。下列判断中,不正确的是
a 滤渣中一定含有铜 b 滤液中一定含有 Cu2+ c 滤液中一定含有Fe2+d向滤渣中加稀盐酸可能有气泡 e 所得滤液质量一定比原溶液质量小
A.ad B.be C.abe D.acd
7.下列有关实验操作的“先”与“后”的说法中,正确的是
A.制取气体时,一般先在容器中装入固体药品,然后再检查该套装置的气密性
B.加热KMnO4并用排水法收集O2的实验结束时,先熄灭酒精灯,后移出导管
C.稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌
D.加热试管时,先使试管均匀受热,后用酒精灯的外焰集中在药品的部位加热
8.下列某小组同学设计的四组试剂中,能用来验证锌、铜、银的金属活动性强弱的是( )
(1)锌片、银片、硝酸铜溶液
(2)银片、硝酸锌溶液、硝酸铜溶液
(3)铜片、硝酸锌溶液、硝酸银溶液
(4)锌片、铜片、硝酸银溶液
A.(1)(2)
B.(2)(3)
C.(3)(4)
D.(1)(3)
9.下列实验操作中,正确的是( )
A.倾倒液体药品 B.稀释浓硫酸
C.称量固体药品 D.过滤液体
10.下列对宏观现象的微观解释错误的是
A.氢氧化钠溶液和氢氧化钙溶液都能与二氧化碳反应,是因为它们溶液中的阴离子都是OH-
B.温度计受热时水银柱上升,是因为汞原子受热时体积变大
C.20mL酒精和20mL水混合后体积小于40mL,是因为分子之间存在间隔
D.缉毒犬能根据气味发现毒品,是因为分子在不断地运动
11.固体氢氧化钠具有较强的吸水能力,因而可以作为某些气体的干燥剂。下列气体中,能用氢氧化钠进行干燥的是
A.CO2 B.HCl C.CO D.SO2
12.区分下列各组物质的方法不正确的是
选项 需区分的物质 方法
A 浓硫酸和浓盐酸 分别闻气味
B 饱和氯化钠溶液和蒸馏水 分别加入氯化钠固体,观察是否溶解
C 铝丝和银丝 分别加入硫酸铜溶液,观察现象
D 澄清石灰水和氢氧化钠溶液 分别滴加无色酚酞溶液,观察现象
A.A B.B C.C D.D
13.生活、生产中的下列做法不合理的是
A.服用氢氧化钠治疗胃酸过多
B.用肥皂水鉴别硬水与软水
C.拍照时可通过增大物距来取景范围
D.控制用电器的开关接在火线与该用电器之间
14.下列劳动项目所涉及的化学知识正确的是
选项 劳动项目 化学知识
A 用石灰浆刷墙 氢氧化钙能与氧气反应
B 利用明矾来净化金鱼缸内的水 明矾是净水的絮凝剂
C 用生石灰制作发热包 CaO与水反应吸收热量
D 修车师傅用汽油清洗手上的油污 汽油能乳化油污
A.A B.B C.C D.D
15.将形状相同的等质量的铝、铁同时分别放入两份相同的稀盐酸中,生成 H2 的质量与反应时间的关系如图所示。 下列分析错误的是
A.x、y 分别为铝、铁
B.两份盐酸均完全反应
C.参与反应的铝、铁原子个数比为 2:1
D.反应结束时,铝一定有剩余,铁可能有剩余。
三、综合应用题
16.人类的生产、生活离不开金属,金属材料的应用推动了社会发展。
(1)锌是人体必需的微量元素,缺锌会导致生长迟缓。下图为锌元素在元素周期表中的信息及原子结构示意图,下列说法不正确的是
a.锌原子的质量为65.38g
b.锌原子的原子序数为30
c.锌原子核外有四个电子层
d.锌在反应中易失去电子
(2)①铝的化学性质活泼,为什么铝制品却很耐腐蚀 ?
②铁制品长期暴露在空气中会发生锈蚀,生活中常用稀盐酸除铁锈(主要成分Fe2O3),反应的化学方程式为 。
(3)如图是模拟一氧化碳还原氧化铁的实验装置图。
①玻璃管中观察到的现象是 。
②该装置末端处酒精灯的作用是什么? 。
(4)某化学小组用一定量AgNO3、Cu(NO3)2和Al(NO3)3的混合溶液进行了下图实验。对固体乙的成分,同学们作出如下猜想:I.只有Ag;Ⅱ.Ag、Cu;Ⅲ.Zn、Cu;Ⅳ.Ag、Cu、Zn。
①写出上述不合理的猜想,并说明理由 。
②若猜想Ⅱ成立,则溶液甲中一定含有哪些溶质?(写化学式) 。
(5)我国工业上利用“铝热反应”焊接钢轨、冶炼难溶性金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。现要用铝与四氧化三铁反应来制取铁,若要制取12.6t的铁,理论上需要铝的质量是多少?
17.铁是生产、生活中应用最广泛的金属。
(1) 2020年跨年之际,一场突如其来的新冠肺炎疫情从武汉波及全国。为收治病人,我国仅用了十天时间就建成了火神山医院。如图为正在建设时的火神山医院的钢结构。
①钢属于 材料;
②钢制品表面刷漆能防止生锈,原理是 。
(2)小强用“W”型玻璃管模拟工业炼铁的实验。
①写出a处反应的化学方程式 。
②为什么要进行尾气处理 。
(3)将一定量的铁粉加入到Cu(NO3)2、AgNO3的混合溶液中,充分反应后过滤,滤液呈蓝色。
①写出一定发生的反应的化学方程式 ;
②分析滤液的成分 ;
③反应后滤液的质量比反应前混合溶液的质量增大、减小还是不变
(4)在铁路建设中,常用下列反应实现钢轨对接: 。若建设中需要56kg铁,则消耗三氧化二铁的质量是多少
18.金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用“长征三号乙”运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”可用方程式表示为 。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤液中一定含有的金属离子是 。
(3)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有20g铜锌合金,与100g质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
参考答案:
1.AB
2.ACD
3.AC
4.BC
5.AC
6.A
7.D
8.D
9.D
10.B
11.C
12.D
13.A
14.B
15.C
16.(1)a
(2) 常温下,铝与空气中的氧气反应生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化 Fe2O3+6HCl=2FeCl3+3H2O
(3) 固体由红色变为黑色 燃烧掉尾气中的一氧化碳,防止污染空气
(4) Ⅲ的猜想不合理,因为固体中一定含有Ag Al(NO3)3、Zn(NO3)2
(5)5.4t
17. 金属 隔绝氧气和水 尾气中含有有毒气体一氧化碳 滤液中一定含有硝酸铜和生成的硝酸亚铁,可能含有没反应完全的硝酸银 减少 80kg
18.(1)高
(2) Fe+CuSO4=FeSO4+Cu Mg2+、Cu2+
(3)解:参加反应的纯硫酸的质量=100g×19.6%=19.6g
设合金中锌的质量为x
=
x=13g
合金中铜的质量=20g 13g=7g
铜锌合金中铜的质量分数=×100%=35%
答:铜锌合金中铜的质量分数为35%。
