浙教版科学 八下3.3化学方程式同步练习(优生加练)(含答案)
文档属性
| 名称 | 浙教版科学 八下3.3化学方程式同步练习(优生加练)(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 448.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-12 09:18:08 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
3.3化学方程式同步练习(优生加练)
一、单选题
1.某密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前及反应过程中两个时刻各物质的质量分数如上图所示,图中a、b、c分别表示相应物质的质量分数,下列说法正确的是( )
A.a=54% B.b=6%
C.以上发生的反应属于化合反应 D.丁物质一定时该反应的催化剂
2.在反应2A+3B=2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为( )
A.8∶12∶11∶9
B.16∶36∶22∶36
C.16∶16∶22∶9
D.2∶3∶2∶4
3.如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是( )
A.该反应的基本反应类型为置换反应
B.反应前后原子的种类和数目保持不变
C.由大量微观甲“ ”聚集成的物质是单质
D.参加反应的甲、乙两种反应物的分子个数比为1:1
4.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如图刻度纸所示(例如:丙的质量为5g,丁的质量为3g),充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应
B.丙一定是催化剂
C.反应后丁的质量为8g
D.反应生成的乙和丁的质量比为1∶1
5.将质量为15 g的大理石加入烧杯中,再加入120 g溶质质量分数为7.3%的稀盐酸,充分反应后(该大理石所含杂质既不溶于水也不参加反应),所得溶液的质量为125.6 g(不考虑溶液中残留的二氧化碳),则大理石的纯度约为( )
A.66.7% B.80% C.90% D.90.9%
二、填空题
6.已知在化学变化中元素的质量在反应前后不变,现有1.6g某物质在氧气中燃烧,生成4.4g二氧化碳和3.6g水,则①一定含有C、H元素;②一定不含有O元素;③可能含有氧元素;④一定含有O元素;其中正确的是 。分子中C、H原子的个数比为 。
7. 1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德 埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序是 (将下面五张图按反应过程顺序用序号排列).
(2)氢气与氮气反应时的化学计量数比是 ;该反应属于 反应.
8.(1)下列氮肥含氮量由高到低是排列顺序是: (用序号表示).
常见氮肥 ①NH4NO3 ②NH4HCO3 ③CO(NH2)2
相对分子质量 80 79 60
(2)治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置.使NO和CO反应生成N2和CO2,写出该反应的化学方程式 .
(3)有机物中碳氢化合物可用CxHy表示,其完全燃烧的化学方程式:CxHy+(x+)O2xCO2+H2O.判断等质量的①CH4,②C2H2,③C2H4,三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是 .(用序号表示)
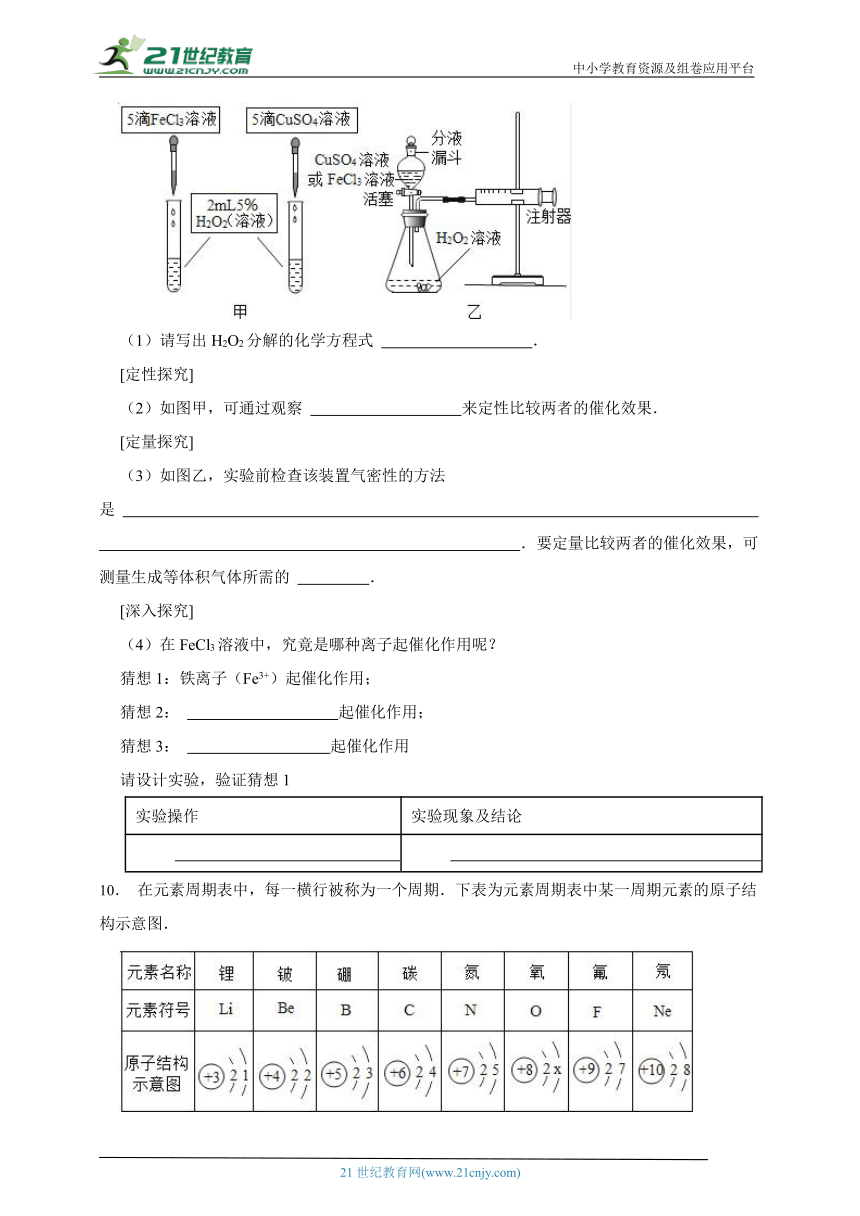
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
(1)请写出H2O2分解的化学方程式 .
[定性探究]
(2)如图甲,可通过观察 来定性比较两者的催化效果.
[定量探究]
(3)如图乙,实验前检查该装置气密性的方法是 .要定量比较两者的催化效果,可测量生成等体积气体所需的 .
[深入探究]
(4)在FeCl3溶液中,究竟是哪种离子起催化作用呢?
猜想1:铁离子(Fe3+)起催化作用;
猜想2: 起催化作用;
猜想3: 起催化作用
请设计实验,验证猜想1
实验操作 实验现象及结论
10. 在元素周期表中,每一横行被称为一个周期.下表为元素周期表中某一周期元素的原子结构示意图.
(1)表中氧原子最外层电子数x= .
(2)表中不同种元素最本质的区别是原子中 不同.
(3)上述元素在周期表中处于同一周期的原因是 .
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原因是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅(SiF4)气体和水,该反应的化学方程式为 .
11.下列变化:
推测:X 为 , Y 为 ,B 为 ,黄色溶液与X的反应方程式为 。
12.(1)下列是各类烷烃的化学式:甲烷CH4 ,乙烷C2H6 ,丙烷C3H8。一种烷烃的一个分子中含有44个氢原子,则其含有 个碳原子。
(2)已知镁条在空气中燃烧,不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(Mg3N2)。若有24g镁在空气中完全燃烧,则所得产物的总质量m 40g (填:“>”、“=”或“<”)。
三、实验探究题
13. 黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜.主要步骤如图所示:
(1)Fe2(SO4)3与铁反应的化学方程式:xFe2(SO4)3+yFe=zFeSO4,其中x、y、z为化学计量数,z的值为 .
(2)步骤Ⅰ中,生成铜的化学方程式: .
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .
(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是 (填化学式).
(5)步骤Ⅲ回收铜的方法为 .
14.某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种,现将该气体依次通过下图所示装置,观察到:①A装置内未出现浑浊;②D装置内无水硫酸铜变蓝;③E装置末尾的气球变大,假设每部反应都是完全的。请回答:
请回答下列问题:
(1)请写出甲烷完全燃烧的化学方程式:
(2)实验过程中记录的实验数据如表中所示, 则该气体的成分为: 。
D 装置总质量 E 装置总质量
反应前 156.6g 356.8g
反应后 158.4g 361.2g
四、解答题
15.中国“天宫”空间站设计有水处理系统,通过低压蒸馏将宇航员的汗液、尿液等进行回收处理,并用于电解制氧气。
(1)尿素[CO(NH2)2]加热蒸馏时会产生有毒的三聚氰胺(C3N6H6),请完成尿素在高温下分解时的化学方程式:6CO(NH2)2C3H6N6+6NH3↑+3 个。
(2)3名宇航员每天约需消耗氧气1650升,若每天净化回收5.4千克水并全部用于电解制氧气,能否满足宇航员呼吸所需?(已知:2H2O2H2↑+O2↑,ρ氧气=1.3克/升)
16.某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下表所示:
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成 CO 的质量/g 1.54 3.08 4.4 m
(1)哪几项反应中盐酸有剩余 。
(2)m= 。
(3)试计算这种石灰石矿中碳酸钙的质量分数。
答案解析部分
1.【答案】C
【知识点】质量守恒定律及其应用;根据化学反应方程式的计算
【解析】【分析】由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%-42%=28%,故甲是反应物;反应前乙的质量分数为14%,反应后乙的质量分数为1-42%-40%-10%=8%,乙的质量分数减少了14%-8%=6%,故乙是反应物;反应前丙的质量分数为6%,丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
【解答】A、参加反应的甲和乙质量比为28%:6%,当乙的质量分数为11%时,减少了14%-11%=3%,则甲的质量分数应减少14%,则a=70%-14%=56%,所以A不符合题意。
B、反应后乙的质量分数为1-42%-40%-10%=8%, b=8%,所以B不符合题意。
C、通过分析可知,反应物是甲物质、乙物质,生成物质是丙物质,所以该反应属于化合反应,所以C符合题意。
D、丁物质可能是该反应的催化剂,也可能没有参与反应。所以D不符合题意。
所以选C。
2.【答案】C
【知识点】化学方程式的概念、读法和含义
【解析】【分析】质量比等于相对分子质量比乘以化学方程式前的系数。
【解答】所以A,B,C,D的质量比为2XA:3XB:2XC:4XD=8∶12∶11∶9,所以A、B、C、D的相对分子质量之比=:::=16:16:22:9。
答案选C。
3.【答案】B
【知识点】化学方程式的概念、读法和含义
【解析】【解答】A、由图示可知,该反应中有一种单质和一种化合物反应生成一种化合物,不是置换反应;故A正确;
B、化学反应遵循质量守恒定律,反应前后原子的种类和数目保持不变;故B正确;
C、由图示可知,由大量微观甲“”聚集成的物质是化合物,故C不正确;
D、实际反应的微观变化过程示意图可表示 ,参加反应的甲、乙两种反应物的分子个数比为2:1;故D不正确.
故选B.
【分析】由微观模型示意图可看出,分子是由原子构成的,反应物是一种化合物分子和一种单质分子,生成物是一种化合物分子,在反应前后原子的数目没有变化,只是进行了重新组合.
4.【答案】D
【知识点】催化剂在化学反应中的作用;根据化学反应方程式的计算
【解析】【分析】由质量守恒定律可知在化学反应中参与反应的物质质量等于生成物的物质质量。
【解答】A.甲的质量减小,乙和丁的质量增加,而丙的质量不变,故为分解反应;
B.丙可能与化学反应无关;
C.反应后丁的质量为11g;
D.生成乙的质量为8g,丁的质量也为8g,故其质量比为1:1;
故答案为:D
5.【答案】A
【知识点】根据化学反应方程式的计算
【解析】【分析】碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,由于不能确定盐酸是否完全反应,不能用稀盐酸的质量、溶质的质量分数进行计算。可根据液体质量差量法,由反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出大理石的纯度。【解答】设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑ 溶液质量增加
100 44 100-44=56
x 125.6g-120g=5.6g
解得:x=10g;
大理石的纯度约为。
故选A。
6.【答案】①②;1:4
【知识点】有关化学式的计算和推断;质量守恒定律及其应用
【解析】【分析】(1)首先根据质量守恒定律计算出参加反应的氧气的质量,再根据“元素质量=物质质量×元素质量分数”分别计算出二氧化碳和水中氧元素的质量,然后相加,与参加反应的氧气的质量进行比较即可。
(2)分子中原子的个数之比等于元素的实际质量与相对原子质量的比值之比。
【解答】(1)根据质量守恒定律可知,参加反应的氧气质量为:4.4g+3.6g-1.6g=6.4g;
二氧化碳中氧元素的质量;;
水中氧元素的质量:;
则生成物中氧元素的总质量:3.2g+3.2g=6.4g;
比较可知,这种物质中肯定存在C、H元素,没有O元素。
则正确的是①②。
(2)分子C、H的原子个数比:
7.【答案】(1)⑤④①②③
(2)3:1;化合
【知识点】化学方程式的概念、读法和含义
【解析】【解答】(1)化学反应的本质是反应物的分子分解成原子,原子再重新组合生成新的分子;催化剂能加快反应说明催化剂一定参加了反应;氮气和氢气在催化剂表面合成氨反应过程的顺序为:氮气和氢气向催化剂靠近,氮气和氢气与催化剂混合,在催化剂的作用下氮气分子和氢气分子分裂成氮原子和氢原子,氮原子和氢原子在催化剂的作用下生成氨分子,氨分子离开催化剂.故填:⑤④①②③.(2)由图中可知,每3个氢分子和1个氮气分子生成2个氨分子,氢气与氮气反应时的化学计量数比是3:1.该反应中反应物是氮气和氢气两种物质,生成物是氨气一种,属于化合反应.故填:化合.
【分析】本题主要是了解化学反应的实质,催化剂的特点,以及化学方程式的意义等方面内容。
8.【答案】③①②;2CO+2NO2CO2+N2;①③②
【知识点】书写化学方程式、文字表达式
【解析】【解答】(1)解:在硝酸铵中,NH4NO3﹣﹣﹣﹣﹣2N
80 28
在碳酸氢铵中,2NH4HCO3﹣﹣﹣﹣﹣2N
158 28
在尿素中,CO(NH2)2﹣﹣﹣﹣﹣﹣2N
60 28
由此可见,尿素中氮元素的含量最高,碳酸氢铵中氮元素的含量最低.故填:③①②;
(2)一氧化碳和一氧化氮在催化剂的条件下生成氮气和二氧化碳,化学反应方程式是:2CO+2NO2CO2+N2.故填:2CO+2NO2CO2+N2;
(3)设:三种物质的质量均为x,
①甲烷完全燃烧需要氧气的质量为a,CH4燃烧的方程式为:CH4+2O2CO2+2H2O
16 64
x a
a=4x
②C2H2完全燃烧需要氧气的质量为b,燃烧的方程式为:2C2H2+5O24CO2+2H2O
52 160
x b
b=x
③C2H4完全燃烧需要氧气的质量为c,燃烧的方程式为:C2H4+3O22CO2+2H2O
28 96
x c
c=
故填:①③②.
【分析】(1)根据化合物中元素的质量分数的计算方法来分析解答;
(2)根据一氧化碳和一氧化氮经过催化作用生成二氧化碳和氮气进行分析;
(3)根据化学方程式来分析解答.
9.【答案】2H2O22H2O+O2↑;产生气泡的速率;先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;时间;氯离子(Cl﹣);水分子(H2O);取少量的过氧化氢溶液,向其中滴加氯化钠溶液,观察现象;若观察到没有迅速产生气泡,说明氯离子没有催化作用,是铁离子所起的催化作用
【知识点】催化剂在化学反应中的作用;书写化学方程式、文字表达式
【解析】【解答】(1)过氧化氢在催化剂的作用下分解为氧气和水,故填:2H2O22H2O+O2↑;
(2)比较两种物质对过氧化氢分解速率的影响,可以观察二者产生气泡的速率;故填:产生气泡的速率;
(3)检查该装置的气密性,可先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好;故填:先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;时间;
(4)氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;检验是否是铁离子所起的催化作用,可以选择氯化钠溶液来进行检验.故答案为:氯离子(Cl﹣);水分子(H2O);
实验操作:取少量的过氧化氢溶液,向其中滴加氯化钠溶液,观察现象;
实验现象及结论:若观察到没有迅速产生气泡,说明氯离子没有催化作用,是铁离子所起的催化作用.
【分析】(1)过氧化氢在催化剂的作用下分解为水和氧气;
(2)催化效果越好,产生气泡的速率越快;
(3)根据检查装置气密性的方法以及比较催化效果的方法来分析;
(4)氯化铁溶液中存在铁离子、氯离子和水分子.要想验证是否是铁离子的催化作用,可选择其他含铁离子的可溶性盐来进行实验.
10.【答案】6;质子数(或核电荷数);都具有两个电子层(或电子层数都为两层;电子层数相同);4HF+SiO2=SiF4↑+2H2O
【知识点】元素周期表;书写化学方程式、文字表达式
【解析】【解答】(1)氧的质子数是8,核外电子数等于核内质子数,所以X是6;
(2)决定元素种类的是质子数或核电荷数,所以表中不同种元素最本质的区别是原子中质子数不同;
(3)上述元素核外都是2个电子层,都属于第二周期,所以周期数等于核外电子层数;
(4)氢氟酸与玻璃的主要成分二氧化硅发生反应,生成四氟化硅气体和水,反应的化学方程式为:4HF+SiO2=SiF4↑+2H2O.
故答案为:(1)6;(2)质子数(或核电荷数);(3)都具有两个电子层(或电子层数都为两层;电子层数相同.注:其它合理答案也得分.);
(4)4HF+SiO2=SiF4↑+2H2O.
【分析】(1)根据核外电子排布的特点考虑;(2)决定元素种类的是质子数或核电荷数;(3)通过表中数据观察规律;(4)根据题意,氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,写出反应的化学方程式即可.
11.【答案】氢氧化钠或氢氧化钡;氯化钡或硫酸钠;氢氧化铁;Fe2(SO4)3 +6NaOH==2Fe(OH)3↓ + 3Na2SO4 或 2FeCl3+3Ba(OH)2=2Fe(OH)3↓ +3BaCl2
【知识点】书写化学方程式、文字表达式
【解析】【解答】若A为硫酸钠溶液,根据C 、D可以确定Y为氯化钡溶液,由于B为氢氧化铁,反推出X为氢氧化钠溶液,黄色溶液为硫酸铁铁溶液;若A为氯化钡溶液,则Y为硫酸钠溶液,则X为氢氧化钠溶液,黄色溶液为氯化铁溶液,因此可以确定X为氢氧化钠或氢氧化钡溶液,Y为氯化钡或硫酸钠溶液,B为氢氧化铁,反应的化学方程式为Fe2(SO4)3 +6NaOH==2Fe(OH)3↓ + 3Na2SO4 或 2FeCl3+3Ba(OH)2=2Fe(OH)3↓ +3BaCl2
【分析】根据C不溶于稀硝酸,可知,C为氯化银或硫酸钡,但D为氯化钠,就说明C只能是硫酸钡,则A和Y就只能是硫酸钠和氯化钡中的一种。若A为硫酸钠溶液,X则为氢氧化钠溶液,黄色溶液为硫酸铁,若A为氯化钠溶液,则X为氢氧化钡溶液,黄色溶液为氯化铁。
12.【答案】(1)21
(2)<
【知识点】有关化学式的计算和推断;根据化学反应方程式的计算
【解析】【分析】(1)根据烷烃的化学式:甲烷CH4,乙烷C2H6,丙烷C3H8,烷烃的的化学式的通式可表示为CnH2n+2,进行分析解答。
(2)根据镁条在空气中燃烧,不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(Mg3N2),写出方程式计算即可。【解答】(1)由烷烃的化学式:甲烷CH4,乙烷C2H6,丙烷C3H8
,可以看出烷烃的化学式的通式可表示为CnH2n+2;
一种烷烃的一个分子中含有44个氢原子,2n+2=44,
解得:n=21。
(2)如果全部生成MgO,
则2Mg+O22MgO
48 80
24g x
;
解得: x=40g
如果全部生成Mg3N2,则
3Mg+N2Mg3N2
72 100
24g y
;
解得:y≈33.3g;
而实际情况介于两者之间,则m<40g。
13.【答案】(1)3
(2)Fe+CuSO4=Cu+FeSO4
(3)铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁
(4)Na2CO3
(5)加入过量的稀硫酸,过滤、洗涤、干燥
【知识点】化学方程式的配平;书写化学方程式、文字表达式
【解析】【解答】(1)通过分析xFe2(SO4)3+yFe=zFeSO4可知,依据化合价的升降,将方程式配平,所以Fe2(SO4)3+2Fe=3FeSO4,z的值为3;
(2)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(3)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;
(4)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.
故答案为:(1)3;
(2)Fe+CuSO4=Cu+FeSO4;
(3)铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(4)Na2CO3;
(5)加入过量的稀硫酸,过滤、洗涤、干燥.
【分析】(1)根据质量守恒定律进行分析;
(2)根据溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(3)根据铁锈和硫酸反应生成硫酸铁和水,硫酸铁和铁会生成硫酸亚铁进行分析;
(4)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(5)根据不溶物中含有置换出的铜和反应剩余的铁进行分析.
14.【答案】(1)CH4+2O2CO2+2H2O
(2)N2、CH4、CO
【知识点】书写化学方程式、文字表达式;根据化学反应方程式的计算
【解析】【分析】(1)根据反应物、反应条件和生成物,写出反应的化学方程式。
(2)①二氧化碳能够使澄清的石灰水变浑浊,据此分析是否存在二氧化碳;
②根据甲烷和一氧化碳燃烧产物的不同判断是否存在甲烷;
③根据氮气的化学性质稳定分析是否存在氮气;
④D装置质量的增加量为甲烷燃烧生成水的质量,写出甲烷燃烧的方程式,根据水的质量计算出生成二氧化碳的质量,再与E装置质量的增大量进行比较,从而确定是否存在一氧化碳气体即可。
【解答】(1)甲烷燃烧,即甲烷和氧气在点燃的条件下反应,生成二氧化碳和水,则反应的方程式为: CH4+2O2CO2+2H2O 。
(2)①二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,①A装置内未见有浑浊出现,说明气体中一定不含二氧化碳;
②甲烷、一氧化碳都能燃烧,但只有甲烷燃烧能生成水,②D装置内无水硫酸铜变蓝,所以气体中一定含有甲烷;
③由于氮气的化学性质稳定,不燃烧,不与浓硫酸、氢氧化钠、氢氧化钙、硫酸铜反应,不能被吸收,反应生成的二氧化碳能被石灰水和氢氧化钠溶液吸收,反应生成的水能被浓硫酸吸收,所以最终收集到的气体是氮气;
④能让D装置质量增加1.8g的只有水,此水可由甲烷在装置C中燃烧生成,设此时生成二氧化碳x,
则
CH4+2O2CO2+2H2O
44 18×2
x 1.8
;
解得:x=2.2g。
但现在E装置共增重4.4g,即生成的二氧化碳明显偏多
所以C装置中有甲烷、一氧化碳两种气体燃烧。
那么该混合气体中有甲烷、一氧化碳、氮气。
15.【答案】(1)CO2
(2)解:氧气的质量为1650L×1.3克/升=2145 克=2.145千克
设电解5.4千克水,产生氧气为x
2H2O 2H2↑+O2↑
36 32
5.4千克 x
36/32=5.4千克/x,x=4.8千克
4.8千克>2.145千克
答:能满足航天员呼吸所需。
【知识点】质量守恒定律及其应用;根据化学反应方程式的计算
【解析】【分析】(1)根据质量守恒定律可知,反应前后原子的种类和个数保持不变;
(2)根据m=ρV计算宇航员每天需要消耗氧气的质量。
写出水电解生成氧气的方程式,利用水的质量计算出生成氧气的质量,最后与前面计算出的质量进行比较即可。
【解答】(1)根据化学方程式 6CO(NH2)2C3H6N6+6NH3↑+3X得到:6C+6O+12N+24H=3C+12N+24H+3X,解得:3X=3C+6O=3CO2,即X=CO2。
16.【答案】(1)1、2
(2)4.4
(3)70%
【知识点】根据化学反应方程式的计算
【解析】【分析】(1)根据表格数据分析石灰石和产生二氧化碳质量之间的关系,据此推算第3次实验中二氧化碳的产生理论值,并与实际值比较,从而确定石灰石有剩余,还是稀盐酸有剩余即可;
(2)将实验3和4比较,根据石灰石是否完全反应计算m的数值;
(3)写出碳酸钙与稀盐酸反应的方程式,根据二氧化碳的质量计算参加反应的碳酸钙质量,最后与样品质量做比即可。
【解答】(1)取稀盐酸200g,平均分成4份进行实验,每次实验使用稀盐酸50g。根据实验结果数据表,5g石灰石完全反应可以生成二氧化碳1.54g,,若15g石灰石完全反应生成二氧化碳质量=1.54g×3=4.62g,而实验中仅放出4.4g二氧化碳,说明第三次加入样品时石灰石没有完全反应,没有完全反应是由于稀盐酸不足;而第3次实验中加入样品后生成的二氧化碳质量增加,所以可以判断前两次实验中盐酸有剩余;
(2)根据①中的分析可以知道,第3次中盐酸量不足,所以第4次加入的样品不能再反应,生成的气体仍为4.4g,即m=4.4;
(3)设这种石灰石矿中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.54g
;
解得:x=3.5g;
所以石灰石中碳酸钙的质量分数为:。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.3化学方程式同步练习(优生加练)
一、单选题
1.某密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前及反应过程中两个时刻各物质的质量分数如上图所示,图中a、b、c分别表示相应物质的质量分数,下列说法正确的是( )
A.a=54% B.b=6%
C.以上发生的反应属于化合反应 D.丁物质一定时该反应的催化剂
2.在反应2A+3B=2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为( )
A.8∶12∶11∶9
B.16∶36∶22∶36
C.16∶16∶22∶9
D.2∶3∶2∶4
3.如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是( )
A.该反应的基本反应类型为置换反应
B.反应前后原子的种类和数目保持不变
C.由大量微观甲“ ”聚集成的物质是单质
D.参加反应的甲、乙两种反应物的分子个数比为1:1
4.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如图刻度纸所示(例如:丙的质量为5g,丁的质量为3g),充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应
B.丙一定是催化剂
C.反应后丁的质量为8g
D.反应生成的乙和丁的质量比为1∶1
5.将质量为15 g的大理石加入烧杯中,再加入120 g溶质质量分数为7.3%的稀盐酸,充分反应后(该大理石所含杂质既不溶于水也不参加反应),所得溶液的质量为125.6 g(不考虑溶液中残留的二氧化碳),则大理石的纯度约为( )
A.66.7% B.80% C.90% D.90.9%
二、填空题
6.已知在化学变化中元素的质量在反应前后不变,现有1.6g某物质在氧气中燃烧,生成4.4g二氧化碳和3.6g水,则①一定含有C、H元素;②一定不含有O元素;③可能含有氧元素;④一定含有O元素;其中正确的是 。分子中C、H原子的个数比为 。
7. 1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德 埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序是 (将下面五张图按反应过程顺序用序号排列).
(2)氢气与氮气反应时的化学计量数比是 ;该反应属于 反应.
8.(1)下列氮肥含氮量由高到低是排列顺序是: (用序号表示).
常见氮肥 ①NH4NO3 ②NH4HCO3 ③CO(NH2)2
相对分子质量 80 79 60
(2)治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置.使NO和CO反应生成N2和CO2,写出该反应的化学方程式 .
(3)有机物中碳氢化合物可用CxHy表示,其完全燃烧的化学方程式:CxHy+(x+)O2xCO2+H2O.判断等质量的①CH4,②C2H2,③C2H4,三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是 .(用序号表示)
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
(1)请写出H2O2分解的化学方程式 .
[定性探究]
(2)如图甲,可通过观察 来定性比较两者的催化效果.
[定量探究]
(3)如图乙,实验前检查该装置气密性的方法是 .要定量比较两者的催化效果,可测量生成等体积气体所需的 .
[深入探究]
(4)在FeCl3溶液中,究竟是哪种离子起催化作用呢?
猜想1:铁离子(Fe3+)起催化作用;
猜想2: 起催化作用;
猜想3: 起催化作用
请设计实验,验证猜想1
实验操作 实验现象及结论
10. 在元素周期表中,每一横行被称为一个周期.下表为元素周期表中某一周期元素的原子结构示意图.
(1)表中氧原子最外层电子数x= .
(2)表中不同种元素最本质的区别是原子中 不同.
(3)上述元素在周期表中处于同一周期的原因是 .
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原因是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅(SiF4)气体和水,该反应的化学方程式为 .
11.下列变化:
推测:X 为 , Y 为 ,B 为 ,黄色溶液与X的反应方程式为 。
12.(1)下列是各类烷烃的化学式:甲烷CH4 ,乙烷C2H6 ,丙烷C3H8。一种烷烃的一个分子中含有44个氢原子,则其含有 个碳原子。
(2)已知镁条在空气中燃烧,不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(Mg3N2)。若有24g镁在空气中完全燃烧,则所得产物的总质量m 40g (填:“>”、“=”或“<”)。
三、实验探究题
13. 黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜.主要步骤如图所示:
(1)Fe2(SO4)3与铁反应的化学方程式:xFe2(SO4)3+yFe=zFeSO4,其中x、y、z为化学计量数,z的值为 .
(2)步骤Ⅰ中,生成铜的化学方程式: .
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .
(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是 (填化学式).
(5)步骤Ⅲ回收铜的方法为 .
14.某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种,现将该气体依次通过下图所示装置,观察到:①A装置内未出现浑浊;②D装置内无水硫酸铜变蓝;③E装置末尾的气球变大,假设每部反应都是完全的。请回答:
请回答下列问题:
(1)请写出甲烷完全燃烧的化学方程式:
(2)实验过程中记录的实验数据如表中所示, 则该气体的成分为: 。
D 装置总质量 E 装置总质量
反应前 156.6g 356.8g
反应后 158.4g 361.2g
四、解答题
15.中国“天宫”空间站设计有水处理系统,通过低压蒸馏将宇航员的汗液、尿液等进行回收处理,并用于电解制氧气。
(1)尿素[CO(NH2)2]加热蒸馏时会产生有毒的三聚氰胺(C3N6H6),请完成尿素在高温下分解时的化学方程式:6CO(NH2)2C3H6N6+6NH3↑+3 个。
(2)3名宇航员每天约需消耗氧气1650升,若每天净化回收5.4千克水并全部用于电解制氧气,能否满足宇航员呼吸所需?(已知:2H2O2H2↑+O2↑,ρ氧气=1.3克/升)
16.某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下表所示:
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成 CO 的质量/g 1.54 3.08 4.4 m
(1)哪几项反应中盐酸有剩余 。
(2)m= 。
(3)试计算这种石灰石矿中碳酸钙的质量分数。
答案解析部分
1.【答案】C
【知识点】质量守恒定律及其应用;根据化学反应方程式的计算
【解析】【分析】由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%-42%=28%,故甲是反应物;反应前乙的质量分数为14%,反应后乙的质量分数为1-42%-40%-10%=8%,乙的质量分数减少了14%-8%=6%,故乙是反应物;反应前丙的质量分数为6%,丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
【解答】A、参加反应的甲和乙质量比为28%:6%,当乙的质量分数为11%时,减少了14%-11%=3%,则甲的质量分数应减少14%,则a=70%-14%=56%,所以A不符合题意。
B、反应后乙的质量分数为1-42%-40%-10%=8%, b=8%,所以B不符合题意。
C、通过分析可知,反应物是甲物质、乙物质,生成物质是丙物质,所以该反应属于化合反应,所以C符合题意。
D、丁物质可能是该反应的催化剂,也可能没有参与反应。所以D不符合题意。
所以选C。
2.【答案】C
【知识点】化学方程式的概念、读法和含义
【解析】【分析】质量比等于相对分子质量比乘以化学方程式前的系数。
【解答】所以A,B,C,D的质量比为2XA:3XB:2XC:4XD=8∶12∶11∶9,所以A、B、C、D的相对分子质量之比=:::=16:16:22:9。
答案选C。
3.【答案】B
【知识点】化学方程式的概念、读法和含义
【解析】【解答】A、由图示可知,该反应中有一种单质和一种化合物反应生成一种化合物,不是置换反应;故A正确;
B、化学反应遵循质量守恒定律,反应前后原子的种类和数目保持不变;故B正确;
C、由图示可知,由大量微观甲“”聚集成的物质是化合物,故C不正确;
D、实际反应的微观变化过程示意图可表示 ,参加反应的甲、乙两种反应物的分子个数比为2:1;故D不正确.
故选B.
【分析】由微观模型示意图可看出,分子是由原子构成的,反应物是一种化合物分子和一种单质分子,生成物是一种化合物分子,在反应前后原子的数目没有变化,只是进行了重新组合.
4.【答案】D
【知识点】催化剂在化学反应中的作用;根据化学反应方程式的计算
【解析】【分析】由质量守恒定律可知在化学反应中参与反应的物质质量等于生成物的物质质量。
【解答】A.甲的质量减小,乙和丁的质量增加,而丙的质量不变,故为分解反应;
B.丙可能与化学反应无关;
C.反应后丁的质量为11g;
D.生成乙的质量为8g,丁的质量也为8g,故其质量比为1:1;
故答案为:D
5.【答案】A
【知识点】根据化学反应方程式的计算
【解析】【分析】碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,由于不能确定盐酸是否完全反应,不能用稀盐酸的质量、溶质的质量分数进行计算。可根据液体质量差量法,由反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出大理石的纯度。【解答】设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑ 溶液质量增加
100 44 100-44=56
x 125.6g-120g=5.6g
解得:x=10g;
大理石的纯度约为。
故选A。
6.【答案】①②;1:4
【知识点】有关化学式的计算和推断;质量守恒定律及其应用
【解析】【分析】(1)首先根据质量守恒定律计算出参加反应的氧气的质量,再根据“元素质量=物质质量×元素质量分数”分别计算出二氧化碳和水中氧元素的质量,然后相加,与参加反应的氧气的质量进行比较即可。
(2)分子中原子的个数之比等于元素的实际质量与相对原子质量的比值之比。
【解答】(1)根据质量守恒定律可知,参加反应的氧气质量为:4.4g+3.6g-1.6g=6.4g;
二氧化碳中氧元素的质量;;
水中氧元素的质量:;
则生成物中氧元素的总质量:3.2g+3.2g=6.4g;
比较可知,这种物质中肯定存在C、H元素,没有O元素。
则正确的是①②。
(2)分子C、H的原子个数比:
7.【答案】(1)⑤④①②③
(2)3:1;化合
【知识点】化学方程式的概念、读法和含义
【解析】【解答】(1)化学反应的本质是反应物的分子分解成原子,原子再重新组合生成新的分子;催化剂能加快反应说明催化剂一定参加了反应;氮气和氢气在催化剂表面合成氨反应过程的顺序为:氮气和氢气向催化剂靠近,氮气和氢气与催化剂混合,在催化剂的作用下氮气分子和氢气分子分裂成氮原子和氢原子,氮原子和氢原子在催化剂的作用下生成氨分子,氨分子离开催化剂.故填:⑤④①②③.(2)由图中可知,每3个氢分子和1个氮气分子生成2个氨分子,氢气与氮气反应时的化学计量数比是3:1.该反应中反应物是氮气和氢气两种物质,生成物是氨气一种,属于化合反应.故填:化合.
【分析】本题主要是了解化学反应的实质,催化剂的特点,以及化学方程式的意义等方面内容。
8.【答案】③①②;2CO+2NO2CO2+N2;①③②
【知识点】书写化学方程式、文字表达式
【解析】【解答】(1)解:在硝酸铵中,NH4NO3﹣﹣﹣﹣﹣2N
80 28
在碳酸氢铵中,2NH4HCO3﹣﹣﹣﹣﹣2N
158 28
在尿素中,CO(NH2)2﹣﹣﹣﹣﹣﹣2N
60 28
由此可见,尿素中氮元素的含量最高,碳酸氢铵中氮元素的含量最低.故填:③①②;
(2)一氧化碳和一氧化氮在催化剂的条件下生成氮气和二氧化碳,化学反应方程式是:2CO+2NO2CO2+N2.故填:2CO+2NO2CO2+N2;
(3)设:三种物质的质量均为x,
①甲烷完全燃烧需要氧气的质量为a,CH4燃烧的方程式为:CH4+2O2CO2+2H2O
16 64
x a
a=4x
②C2H2完全燃烧需要氧气的质量为b,燃烧的方程式为:2C2H2+5O24CO2+2H2O
52 160
x b
b=x
③C2H4完全燃烧需要氧气的质量为c,燃烧的方程式为:C2H4+3O22CO2+2H2O
28 96
x c
c=
故填:①③②.
【分析】(1)根据化合物中元素的质量分数的计算方法来分析解答;
(2)根据一氧化碳和一氧化氮经过催化作用生成二氧化碳和氮气进行分析;
(3)根据化学方程式来分析解答.
9.【答案】2H2O22H2O+O2↑;产生气泡的速率;先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;时间;氯离子(Cl﹣);水分子(H2O);取少量的过氧化氢溶液,向其中滴加氯化钠溶液,观察现象;若观察到没有迅速产生气泡,说明氯离子没有催化作用,是铁离子所起的催化作用
【知识点】催化剂在化学反应中的作用;书写化学方程式、文字表达式
【解析】【解答】(1)过氧化氢在催化剂的作用下分解为氧气和水,故填:2H2O22H2O+O2↑;
(2)比较两种物质对过氧化氢分解速率的影响,可以观察二者产生气泡的速率;故填:产生气泡的速率;
(3)检查该装置的气密性,可先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好;故填:先将分液漏斗的活塞关闭,然后用双手紧握锥形瓶的外壁,然后观察注射器的活塞是否向外移动,若向外移动,说明该装置的气密性是良好的;时间;
(4)氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;检验是否是铁离子所起的催化作用,可以选择氯化钠溶液来进行检验.故答案为:氯离子(Cl﹣);水分子(H2O);
实验操作:取少量的过氧化氢溶液,向其中滴加氯化钠溶液,观察现象;
实验现象及结论:若观察到没有迅速产生气泡,说明氯离子没有催化作用,是铁离子所起的催化作用.
【分析】(1)过氧化氢在催化剂的作用下分解为水和氧气;
(2)催化效果越好,产生气泡的速率越快;
(3)根据检查装置气密性的方法以及比较催化效果的方法来分析;
(4)氯化铁溶液中存在铁离子、氯离子和水分子.要想验证是否是铁离子的催化作用,可选择其他含铁离子的可溶性盐来进行实验.
10.【答案】6;质子数(或核电荷数);都具有两个电子层(或电子层数都为两层;电子层数相同);4HF+SiO2=SiF4↑+2H2O
【知识点】元素周期表;书写化学方程式、文字表达式
【解析】【解答】(1)氧的质子数是8,核外电子数等于核内质子数,所以X是6;
(2)决定元素种类的是质子数或核电荷数,所以表中不同种元素最本质的区别是原子中质子数不同;
(3)上述元素核外都是2个电子层,都属于第二周期,所以周期数等于核外电子层数;
(4)氢氟酸与玻璃的主要成分二氧化硅发生反应,生成四氟化硅气体和水,反应的化学方程式为:4HF+SiO2=SiF4↑+2H2O.
故答案为:(1)6;(2)质子数(或核电荷数);(3)都具有两个电子层(或电子层数都为两层;电子层数相同.注:其它合理答案也得分.);
(4)4HF+SiO2=SiF4↑+2H2O.
【分析】(1)根据核外电子排布的特点考虑;(2)决定元素种类的是质子数或核电荷数;(3)通过表中数据观察规律;(4)根据题意,氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,写出反应的化学方程式即可.
11.【答案】氢氧化钠或氢氧化钡;氯化钡或硫酸钠;氢氧化铁;Fe2(SO4)3 +6NaOH==2Fe(OH)3↓ + 3Na2SO4 或 2FeCl3+3Ba(OH)2=2Fe(OH)3↓ +3BaCl2
【知识点】书写化学方程式、文字表达式
【解析】【解答】若A为硫酸钠溶液,根据C 、D可以确定Y为氯化钡溶液,由于B为氢氧化铁,反推出X为氢氧化钠溶液,黄色溶液为硫酸铁铁溶液;若A为氯化钡溶液,则Y为硫酸钠溶液,则X为氢氧化钠溶液,黄色溶液为氯化铁溶液,因此可以确定X为氢氧化钠或氢氧化钡溶液,Y为氯化钡或硫酸钠溶液,B为氢氧化铁,反应的化学方程式为Fe2(SO4)3 +6NaOH==2Fe(OH)3↓ + 3Na2SO4 或 2FeCl3+3Ba(OH)2=2Fe(OH)3↓ +3BaCl2
【分析】根据C不溶于稀硝酸,可知,C为氯化银或硫酸钡,但D为氯化钠,就说明C只能是硫酸钡,则A和Y就只能是硫酸钠和氯化钡中的一种。若A为硫酸钠溶液,X则为氢氧化钠溶液,黄色溶液为硫酸铁,若A为氯化钠溶液,则X为氢氧化钡溶液,黄色溶液为氯化铁。
12.【答案】(1)21
(2)<
【知识点】有关化学式的计算和推断;根据化学反应方程式的计算
【解析】【分析】(1)根据烷烃的化学式:甲烷CH4,乙烷C2H6,丙烷C3H8,烷烃的的化学式的通式可表示为CnH2n+2,进行分析解答。
(2)根据镁条在空气中燃烧,不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(Mg3N2),写出方程式计算即可。【解答】(1)由烷烃的化学式:甲烷CH4,乙烷C2H6,丙烷C3H8
,可以看出烷烃的化学式的通式可表示为CnH2n+2;
一种烷烃的一个分子中含有44个氢原子,2n+2=44,
解得:n=21。
(2)如果全部生成MgO,
则2Mg+O22MgO
48 80
24g x
;
解得: x=40g
如果全部生成Mg3N2,则
3Mg+N2Mg3N2
72 100
24g y
;
解得:y≈33.3g;
而实际情况介于两者之间,则m<40g。
13.【答案】(1)3
(2)Fe+CuSO4=Cu+FeSO4
(3)铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁
(4)Na2CO3
(5)加入过量的稀硫酸,过滤、洗涤、干燥
【知识点】化学方程式的配平;书写化学方程式、文字表达式
【解析】【解答】(1)通过分析xFe2(SO4)3+yFe=zFeSO4可知,依据化合价的升降,将方程式配平,所以Fe2(SO4)3+2Fe=3FeSO4,z的值为3;
(2)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(3)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;
(4)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.
故答案为:(1)3;
(2)Fe+CuSO4=Cu+FeSO4;
(3)铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;
(4)Na2CO3;
(5)加入过量的稀硫酸,过滤、洗涤、干燥.
【分析】(1)根据质量守恒定律进行分析;
(2)根据溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(3)根据铁锈和硫酸反应生成硫酸铁和水,硫酸铁和铁会生成硫酸亚铁进行分析;
(4)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(5)根据不溶物中含有置换出的铜和反应剩余的铁进行分析.
14.【答案】(1)CH4+2O2CO2+2H2O
(2)N2、CH4、CO
【知识点】书写化学方程式、文字表达式;根据化学反应方程式的计算
【解析】【分析】(1)根据反应物、反应条件和生成物,写出反应的化学方程式。
(2)①二氧化碳能够使澄清的石灰水变浑浊,据此分析是否存在二氧化碳;
②根据甲烷和一氧化碳燃烧产物的不同判断是否存在甲烷;
③根据氮气的化学性质稳定分析是否存在氮气;
④D装置质量的增加量为甲烷燃烧生成水的质量,写出甲烷燃烧的方程式,根据水的质量计算出生成二氧化碳的质量,再与E装置质量的增大量进行比较,从而确定是否存在一氧化碳气体即可。
【解答】(1)甲烷燃烧,即甲烷和氧气在点燃的条件下反应,生成二氧化碳和水,则反应的方程式为: CH4+2O2CO2+2H2O 。
(2)①二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,①A装置内未见有浑浊出现,说明气体中一定不含二氧化碳;
②甲烷、一氧化碳都能燃烧,但只有甲烷燃烧能生成水,②D装置内无水硫酸铜变蓝,所以气体中一定含有甲烷;
③由于氮气的化学性质稳定,不燃烧,不与浓硫酸、氢氧化钠、氢氧化钙、硫酸铜反应,不能被吸收,反应生成的二氧化碳能被石灰水和氢氧化钠溶液吸收,反应生成的水能被浓硫酸吸收,所以最终收集到的气体是氮气;
④能让D装置质量增加1.8g的只有水,此水可由甲烷在装置C中燃烧生成,设此时生成二氧化碳x,
则
CH4+2O2CO2+2H2O
44 18×2
x 1.8
;
解得:x=2.2g。
但现在E装置共增重4.4g,即生成的二氧化碳明显偏多
所以C装置中有甲烷、一氧化碳两种气体燃烧。
那么该混合气体中有甲烷、一氧化碳、氮气。
15.【答案】(1)CO2
(2)解:氧气的质量为1650L×1.3克/升=2145 克=2.145千克
设电解5.4千克水,产生氧气为x
2H2O 2H2↑+O2↑
36 32
5.4千克 x
36/32=5.4千克/x,x=4.8千克
4.8千克>2.145千克
答:能满足航天员呼吸所需。
【知识点】质量守恒定律及其应用;根据化学反应方程式的计算
【解析】【分析】(1)根据质量守恒定律可知,反应前后原子的种类和个数保持不变;
(2)根据m=ρV计算宇航员每天需要消耗氧气的质量。
写出水电解生成氧气的方程式,利用水的质量计算出生成氧气的质量,最后与前面计算出的质量进行比较即可。
【解答】(1)根据化学方程式 6CO(NH2)2C3H6N6+6NH3↑+3X得到:6C+6O+12N+24H=3C+12N+24H+3X,解得:3X=3C+6O=3CO2,即X=CO2。
16.【答案】(1)1、2
(2)4.4
(3)70%
【知识点】根据化学反应方程式的计算
【解析】【分析】(1)根据表格数据分析石灰石和产生二氧化碳质量之间的关系,据此推算第3次实验中二氧化碳的产生理论值,并与实际值比较,从而确定石灰石有剩余,还是稀盐酸有剩余即可;
(2)将实验3和4比较,根据石灰石是否完全反应计算m的数值;
(3)写出碳酸钙与稀盐酸反应的方程式,根据二氧化碳的质量计算参加反应的碳酸钙质量,最后与样品质量做比即可。
【解答】(1)取稀盐酸200g,平均分成4份进行实验,每次实验使用稀盐酸50g。根据实验结果数据表,5g石灰石完全反应可以生成二氧化碳1.54g,,若15g石灰石完全反应生成二氧化碳质量=1.54g×3=4.62g,而实验中仅放出4.4g二氧化碳,说明第三次加入样品时石灰石没有完全反应,没有完全反应是由于稀盐酸不足;而第3次实验中加入样品后生成的二氧化碳质量增加,所以可以判断前两次实验中盐酸有剩余;
(2)根据①中的分析可以知道,第3次中盐酸量不足,所以第4次加入的样品不能再反应,生成的气体仍为4.4g,即m=4.4;
(3)设这种石灰石矿中碳酸钙的质量为x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.54g
;
解得:x=3.5g;
所以石灰石中碳酸钙的质量分数为:。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
