第2章 微粒的模型与符号 单元测试题 (含解析)
文档属性
| 名称 | 第2章 微粒的模型与符号 单元测试题 (含解析) | 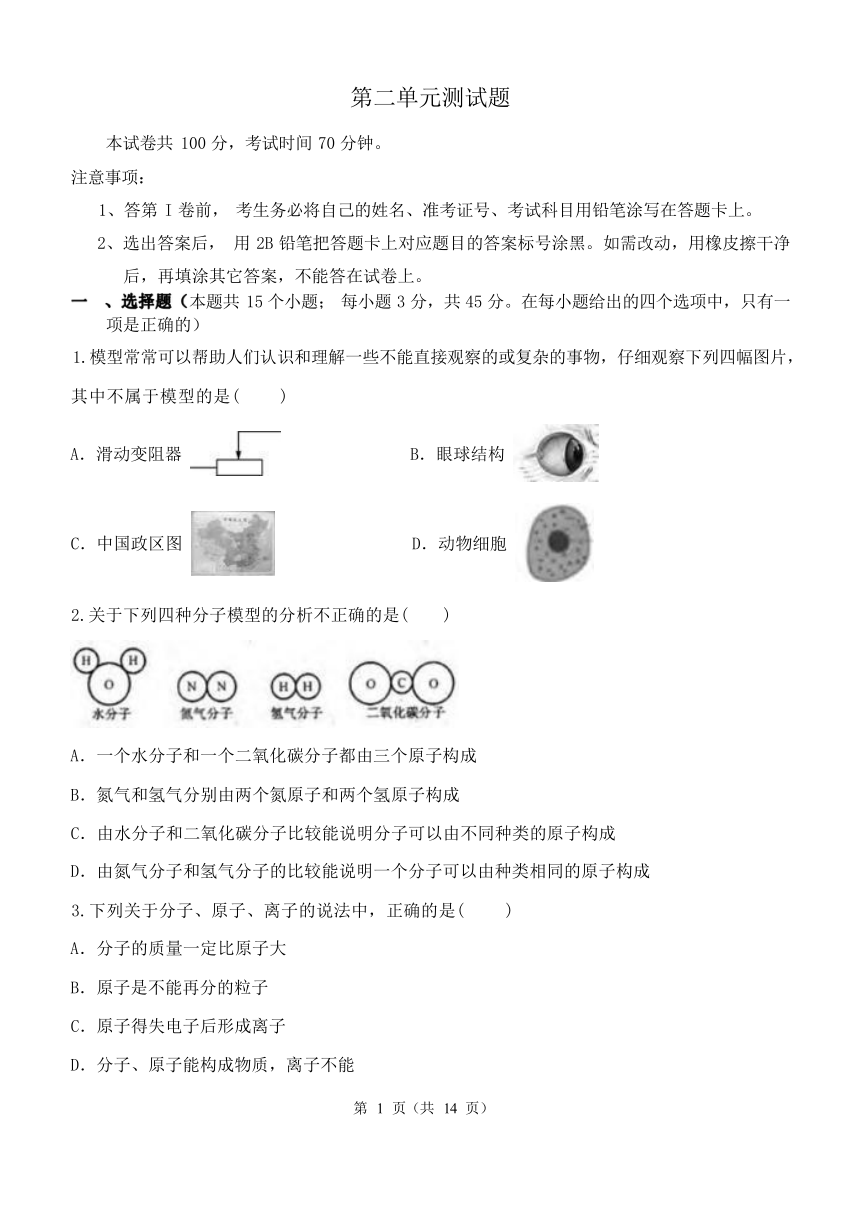 | |
| 格式 | docx | ||
| 文件大小 | 140.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-10 15:50:49 | ||
图片预览





文档简介
第二单元测试题
本试卷共 100 分,考试时间 70 分钟。
注意事项:
1、答第 I 卷前, 考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、选出答案后, 用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再填涂其它答案,不能答在试卷上。
一 、选择题(本题共 15 个小题; 每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项是正确的)
1.模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物,仔细观察下列四幅图片,
其中不属于模型的是( )
A.滑动变阻器 B.眼球结构
C.中国政区图 D.动物细胞
2.关于下列四种分子模型的分析不正确的是( )
A.一个水分子和一个二氧化碳分子都由三个原子构成
B.氮气和氢气分别由两个氮原子和两个氢原子构成
C.由水分子和二氧化碳分子比较能说明分子可以由不同种类的原子构成
D.由氮气分子和氢气分子的比较能说明一个分子可以由种类相同的原子构成
3.下列关于分子、原子、离子的说法中,正确的是( )
A.分子的质量一定比原子大
B.原子是不能再分的粒子
C.原子得失电子后形成离子
D.分子、原子能构成物质,离子不能
第 1 页(共 14 页)
4.据报道,1994 年 12 月, 科学家发现了—种新元素,它的原子核内有 111 个质子数,161 个中
子。该元素的核电荷数为 ( )
A.433 B.161 C.272 D.111
5.如图表示四种原子的结构模型, 下列说法正确的是( )
A. 甲、丁的相对原子质量相同 B. 乙、丁不属于同一种元素
C. 甲、丙的核电荷数不同 D. 甲、乙为互为同位素原子
6.地壳中含量最多的金属元素是( )
A .氧 B .硅 C .铝 D .铁
7.下列各组都是非金属元素的是( )
A.S Si Fe B.P H O
C.Cu C Cl D.Al C Ca
8.在氧气(O2)、二氧化碳(CO2)两种物质中( )
A.都含有氧气分子 B.都含有两个氧原子
C.都含有氧元素 D.都含有两个氧元素
9.下列关于 Al、Al3+两种粒子的判断中不正确的是
A.核电荷数相同 B.质量几乎相等
C.Al3+ 比 Al 稳定 D.电子层数相同
10.某同学认为“O2 ”表示的意义有以下几种说法:①表示氧元素;②表示氧气这种物质; ③表 示 1 个氧分子;④表示 2 个氧原子;⑤表示氧气是一种无色气体;⑥表示 1 个氧分子由 2 个氧原
子构成。其中正确的是( )
A. ②④⑤ B. ②③⑥ C. ①②③④ D. ②③⑤⑥
11.在化学世界里没有生命的阿拉伯数字也变得鲜活起来,它们在不同的位置表示着不同的含
义.下列化学符号中数字“2”表示的意义正确的是( )
A.Mg2+ :一个镁离子带 2 个单位正电荷
第 2 页(共 14 页)
B.CO2 :二氧化碳分子中含有氧原子
C.2H:2 个氢元素
D. 氧化钙的化合价为+2 价
12.在以下物质中, 氯元素的化合价为+5 价的是( )
A.HCl B.Cl2 C.HClO3 D.ClO2
13.维生素 A1 中 C 的质量分数为 83.9%,H 的质量分数为 10.5%,O 的质量分数为 5.6%,其式量是
286,则维生素 A1 化学式为( )
A.C19H28O2 B.C20H14O2 C.C20H30O D.C19H42O
14.p 克某结晶水合物 A·nH O,受热失去全部结晶水后,质量变为 q 克, 由此可以得知该结晶水
合物的相对分子质量为 ( )
A. B . C . D .
15.现有①FeO、②Fe2O3、③Fe3O4 三种含铁的氧化物, 其中含铁元素的质量分数按由大到小的顺
序排列为( )
A. ①>②>③ B. ①>③>② C. ③>②>① D. ②>③>①
二 、填空题(20 分)把答案填在题中的横线上或按题目要求作答
16.用化学用语填空:
(1)甲烷 ;(2)硫离子 ;(3)氦原子 ;(4)氯酸钾 . 17.原子、分子、离子都是构成物质的微观离子, 比如氯化钠是由 构成的,图中 B 处应 填入 (填“原子”、“分子 ”或“离子 ”)。
18.德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究, 催生了汽车尾气净化
装置, 实现了汽车尾气中一氧化碳的清洁排放。
(1)2pt 和1pt是铂元素的两种同位素原子,则这两种原子的中子个数相差 个。
(2)图示是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化历
第 3 页(共 14 页)
程,则其先后顺序为 。 (用图中的序号排列)
19.质子数最少的元素是 ,地壳中含量最多的金属元素是 ,水中含量最多的
元素是 ,常温下单质是液态的金属元素是 。前 20 号元素的符号中含有“C”
的元素是 ;符号中含有“N”的元素是 。 (均填元素符号)
20.N(NO 2 )3 是科学家最新发现的一种火箭燃料.
(1)N(NO 2 )3 的相对分子质量是 .
(2)N(NO 2 )3 ,中氮元素和氧元素的质量比是 .
三 、实验探究题(12 分) 把答案填在题中的横线上或按题目要求作答
21.试用分子和原子的知识来说出下列两种变化的本质区别。
(1)水受热变成水蒸气; (2)水通电变成氢气和氧气。
22.为纪念门捷列夫发明的元素周期表诞生 150 周年,联合国大会宣布 2019 年是“ 国际化学元素
周期表年 ”。
材料一:门捷列夫将元素按照相对原子质量从小到大排列后,发现元素的化学性质成周期性出现,
故将相似化学性质的元素排在同一列。
材料二:门捷列夫无可非议地成为元素周期律的主要发现者, 因为门捷列夫的元素周期表有强大
的预测功能。
第 4 页(共 14 页)
材料三:氟是一种非金属化学元素, 氟元素的单质是 F2,它是一种淡黄色有剧毒的气体。氟气的
腐蚀性很强,化学性质极为活泼,是氧化性最强的物质之一。
硫是一种非金属元素, 通常单质硫是黄色的品体。硫元素在自然界中通常以化合物或单质的形式
存在。硫单质难溶于水, 微溶于酒精对人体而言, 单质硫通常是无毒无害的。
(1)根据现代周期表的元素排布特点,下列哪两种元素的化学性质相似? ( )
A.F、Ne B.N、O C.N、S D.N、P
(2)结合材料中图 1 和图 2,现在的元素周期表编制与门捷列夫的元素周期表排列规律有什么 相矛盾的地方?
(3)溴是一种化学元素,相对原子质量是 79.9, 溴单质是红黑色液体,溴蒸气具有腐蚀性,
并且有毒。请你结合材料预测溴在图 2 元素周期表中的位置(选择标准序号),并说明理由。
四 、解答题(23 分)解答应写出必要的文字说明、方程式和重要演算步骤。只写出最后答案 的不能得分。 有数值计算的题,答案中必须明确写出数值和单位。
23.碘是人体必需的微量元素之一,有“智力元素 ”之称。
(1)生活中常见的含碘元素的物质为:碘酒一一含碘单质 I2;碘片和藻类食物——含碘化钾 KI; 加碘盐——含碘酸钾 KIO3 。下列对 I2、KI、KIO3 中碘元素的化合价计算正确的是: (填序
号)。
A.+1、-1、+5 B.0、+1、+5 C.0、-1、+5
(2)碘能与水发生化学反应,生成两种化合物。如图 2 所示:
第 5 页(共 14 页)
写出反应过程中,属于化合物的物质的化学式 。
(3)适当食用加碘盐(含碘酸钾)可预防碘缺乏, 但服用碘酒(有效成分为 l2)却会引起碘中毒。
KIO3 和 I2 性质的不同的原因是 。
24.玫瑰花中含有香茅醇、橙花醇和丁香油酚(C10H12O2)等物质。
请计算下列问题。
(1)丁香油酚的相对分子质量为 。
(2)丁香油酚中碳、氢、氧三种元素的质量比为 。
(3)丁香油酚中碳元素的质量分数为 。 (结果精确到 0.1%)
(4)16.4 g 丁香油酚中含 g 氧元素。 (结果精确到 0.1 g)
25.复旦大学官方微博发布消息称, 该校 2010 级硕士研究生黄洋由于中毒经抢救无效, 于当天下 午 3 点 23 分在上海中山医院去世.上海警方表示, 在该生寝室饮水机内残留水中检测出某有毒
化合物成分,投毒物疑为四氧嘧啶, 化学式为 C4H2N2O4 .问:
(1)每个四氧嘧啶分子中有 个原子.
(2)四氧嘧啶中碳元素与氮元素的质量比是多少? (化成最简整数比)
(3)C4H2N2O4 中氧元素的质量分数为多少? (列式计算,保留一位小数)
(4)多少克 C4H2N2O4 中含氮元素的质量与 153 克氨气(NH3 )中的氮元素的质量相等?(列式计
算)
第 6 页(共 14 页)
第二单元测试题答案解析
本试卷共 100 分,考试时间 70 分钟。
注意事项:
1、答第 I 卷前, 考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、选出答案后, 用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再填涂其它答案,不能答在试卷上。
一 、选择题(本题共 15 个小题; 每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项是正确的)
1.A
【解析】模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物 ,在科学中更能
生动的帮助学生了解和熟悉所学的事物。
A.此图为滑动变阻器的符号,不是模型, A 符合题意。
B、科学中了解眼睛,用代表眼睛的模型更能学习和观察关于眼睛的知识,此图眼球结构就是眼
睛的模型, B 不符合题意。
C、地图是地理环境的缩影,整个地理环境的缩影, 地图是符号模型也是数学模型, C 不符合题
意。
D、此图可以抽象的表达动物细胞结构,它是属于模型因为有利于更生动地学习与观察动物细胞
的结构,D 不符合题意。
2.B
【解析】分析分子模型确定分子的构成即可。
A.一个水分子和一个二氧化碳分子都由三个原子构成, 故 A 正确不合题意;
B.氮气和氢气分别由氮分子和氢分子构成, 而一个氮分子由两个氮原子构成,一个氢分子由两个
氢原子构成,故 B 错误符合题意;
C.水分子由氢原子和氧原子构成,二氧化碳分子由碳原子和氧原子构成, 那么能说明分子可以由
不同种类的原子构成,故 C 正确不合题意;
D.氮气分子只由氮原子构成,而氢气分子只由氢原子构成,那么能说明一个分子可以由种类相同
的原子构成,故 D 正确不合题意。
第 7 页(共 14 页)
3.C
【解析】(1)分子的质量等于构成它的原子的质量与个数的乘积之和;如果构成它的原子个数太
少,原子质量很小, 分子的质量不一定大;
(2)原子由原子核和核外电子构成;
(3)原子的正电荷数和负电荷数相等,当它得到电子时, 负电荷数多, 变成带负电荷的离子;
当它失去电子时,正电荷多,变成带正电荷的离子;
(4)分子,原子和离子都是构成物质的基本微粒。
A.H2 分子的分子量是 2,而 O 原子的原子量是 16,因此分子质量不一定比原子质量大, 故 A 错
误;
B.原子由原子核和核外电子构成,因此原子可以再分, 故 B 错误;
C.原子得失电子后形成离子, 故 C 正确;
D.分子、原子和离子都能构成物质, 故 D 错误。
故选 C。
4.D
【解析】在原子中, 质子数=核电荷数=核外电子数,据此选择。
根据元素的核电荷数=质子数可知,该元素的核电荷数为 111,故 D 正确,而 A.B、C 错误。
故选 D。
5.A
6.C
【解析】根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁进行分析解答本题。 地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝, 铁,因此地壳中含量最多的金属元
素是 Al。
7.B
【解析】一般情况下, 名字中含有金字旁的都是金属元素,没有金字旁的都是非金属元素,据此
选择。
A.Fe 是金属元素, 故 A 不合题意;
B.P 是磷元素、 H 是氢元素、O 是氧元素, 它们都是非金属元素,故 B 符合题意; 第 8 页(共 14 页)
C.Cu 是金属元素, 故 C 不合题意;
D.Al 是金属元素, 故 D 不合题意。
故选 B。
8.C
【解析】从宏观角度看, 物质由元素组成;从微观角度看,物质由分子、原子、离子构成;
氧气中含有氧气分子,二氧化碳中含有二氧化碳分子, A 错误;应是每个氧气分子和二氧化碳分
子中都含有两个氧原子, B 错误;元素是宏观概念,只讲种类,不讲个数, D 错误。
故答案为: C。
9.D
【详解】
A.因它们是同种元素形成的微粒,质子数相同,故核电荷数相同, 故正确;
B、铝原子失去电子形成铝离子, 电子的质量很小, 可以忽略不计, 故质量几乎相等,故正确;
C、铝离子是稳定结构, 铝原子易失去电子,不稳定,故铝离子比铝原子稳定,故正确;
D、铝原子失去电子形成铝离子, 二者的电子层数不同,故错误。
故选 D。
10.B
【解析】根据化学式的意义分析判断。
“O2 ”表示的意义如下:表示氧气这种物质; 表示 1 个氧分子;表示 1 个氧分子由 2 个氧原子
构成, 故②③⑥正确。
故选 B。
11.A
【解析】A.Mg2+ 中数字 2 表示一个镁离子带 2 个单位正电荷; 故 A 正确;
B.CO2 中数字 2 表示 1 个二氧化碳分子中含有 2 个氧原子; 故 B 错误;
C.2H 中数字 2 表示 2 个氢原子; 故 C 错误;
D.根据标在元素符号正上方的数字表示该元素化合价的数值;
故选: A.
第 9 页(共 14 页)
根据元素符号右上角的数字表示离子所带电荷数,标在元素符号右下角的数字表示一个分子中所 含原子的个数;标在元素符号前面的数字表示原子的个数;元素符号正上方的数字表示该元素化
合价的数值;进行解答;
12.C
【解析】A.氢元素显+1 价,设氯元素的化合价是 x,根据在化合物中正负化合价代数和为零,
可得:(+1)+x=0,则 x=﹣1 价;
B、根据单质中元素的化合价为 0,Cl2 属于单质, 故氯元素的化合价为 0;
C、氢元素显+1 价, 氧元素显﹣2 价,设氯元素的化合价是 y,根据在化合物中正负化合价代数
和为零,可得:(+1)+y+(﹣2) ×3=0,则 y=+5 价;
D、氧元素显﹣2 价,设氯元素的化合价是 z,根据在化合物中正负化合价代数和为零,可得:z+
(﹣2) ×2=0,则 z=+4 价,故氯元素的化合价为+5 价的是 C.故选:C.
根据单质中元素的化合价为 0、在化合物中正负化合价代数和为零, 结合各选项中的化学式进行
解答本题.
13.C
【解析】 根据元素质量分数=相对原子质量×原子个数/相对分子质量、式量为分子中各原子的
相对原子质量之和分析。
A 中物质式量为 12×19+28+16×2=288,错误;
B 中物质式量为 12×20+14+16×2=286,碳元素质量分数为 × 100%=83.9%,氢元素质量分
数为 × 100%=4.9%,错误;
C 中物质式量为 12×20+30+16=286, C 的质量分数为 83.9%,H 的质量分数为 10.5%,O 的质量
分数为 5.6%, 正确;
D 中物质式量为 12×19+42+16=286,碳元素质量分数为19 × 100%=80%,错误;
故选 C。
14.A
15.B
第 10 页(共 14 页)
【解析】元素的质量分数=相对原量×n × 100%。
①FeO 中铁元素的质量分数: × 100% ≈ 77.78%;
②Fe2O3 中铁元素的质量分数: × 100% ≈ 70%;
③Fe3O3 中铁元素的质量分数: × 100% ≈ 72.4%。
则铁元素的质量分数从大到小的顺序排列为: ①>③>②。
故选 B。
二 、填空题(20 分) 把答案填在题中的横线上或按题目要求作答
16.CH4 ;S2﹣ ; He;KClO3
【解析】(1)甲烷可以表示为 CH4;(2)硫离子可以表示为 S2﹣ ;(3)氦原子可以表示为 He;(4)
氯酸钾可以表示为 KClO3 .
故答案为:(1)CH4 ;(2)S2﹣ ; (3)He;(4)KClO3 .
本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还 是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义, 并能根据物质
化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
17.钠离子和氯离子;原子
18.(1)4
(2)①④⑤③②
【解析】(1)根据相对原子质量=质子数+中子数分析;
(2)根据化学变化的实质是分子分成原子,原子重新结合成新分子分析。
(1) 2pt 和1pt是铂元素的两种同位素原子, 这两种原子的质子数相等, 都为 78,则中子
个数相差 202-198=4。
(2)一氧化碳和二氧化氮在金属铂表面催化下反应,先 一氧化碳和二氧化氮分子分成碳、氧、 氮原子,然后碳、氧、氮原子重新组成,生成氮分子和二氧化碳分子,先后顺序为 ①④⑤③② 。
故答案为:(1)4;(2) ①④⑤③② 。
19.H;Al;O;Hg;C、CI、Ca;N、Ne、Na
第 11 页(共 14 页)
【解析】根据对元素周期表的认识, 以及对常见元素的了解分析解答。
质子数最少的元素是 H,地壳中含量最多的金属元素是 Al,水中含量最多的元素是 O,常温下单 质是液态的金属元素是 Hg。前 20 号元素的符号中含有“C”的元素是 C、Cl、Ca ;符号中含有
“N”的元素是 N、Ne、Na。
20.(1)152
(2)7:12
【解析】解:(1)N(NO 2 )3 的相对分子质量=14×4+16×6=152,故填: 152;
(2)依据元素的质量比等于各元素相对原子质量和的比,所以 N(NO2)3 中氮元素和氧元素的质
量比是(14×4):(16×6)=7:12,故填:7:12.
(1)根据相对分子质量为组成分子的各原子的相对原子质量之和, 进行分析解答;
(2)依据元素的质量比等于各元素相对原子质量和的比分析解答即可.
三 、实验探究题(12 分) 把答案填在题中的横线上或按题目要求作答
21.分子是否能分成原子并重新组合成新的分子(或分子是否可以再分或答案合理即可)
【详解】
(1)水受热变成水蒸气时,分子之间的间隔增大,而水分子本身没有发生改变;
(2)水通电变成氢气和氧气时,首先水分子被破坏为氢原子和氧原子,然后原子再重新组合,构 成氧分子和氢分子,所以这两种变化的本质区别就是: 分子是否能分成原子并重新组合成新的分
子,故填分子是否能分成原子并重新组合成新的分子。
22.(1)D
(2)门捷列夫是根据元素的相对原子质量由小到大排列的,而现在的元素周期表中,83 号元素
的相对原子质量与 84 号元素相对原子质量相等。
(3)②, 溴的相对原子质量为 79.9,相对原子质量位于 33 号和 36 号之间,所以只可能位于①② 两个位置,而同一族的化学性质相似,氟和溴的单质都有毒,硫单质通常是无毒无害的,所以溴
只可能与氟在同一族。
【解析】(1)在元素周期表中,将具有相同的最外层电子数的元素排成一列,称为一个族。同族
元素具有相同的化学性质。
第 12 页(共 14 页)
(2)注意 83 号元素和 84 号元素的相对原子质量大小即可。
(4)将它的相对原子质量与周期表中进行比较,从而确定大致位置,再根据它的化学性质确定
与哪种元素在同一族即可。
【解答】(1)根据元素周期表可知,N 和 P 在同一列, 即在同一族,二者具有相同的最外层电子
数,因此具有相似的化学性质, 故选 D。
(2)结合材料中图 1 和图 2,现在的元素周期表编制与门捷列夫的元素周期表排列规律的矛盾 之处: 门捷列夫是根据元素的相对原子质量由小到大排列的, 而现在的元素周期表中, 83 号元
素的相对原子质量与 84 号元素相对原子质量相等。
(3)溴应该在元素周期表的位置②处,理由是:溴的相对原子质量为 79.9,相对原子质量位于 33 号和 36 号之间, 所以只可能位于①②两个位置, 而同一族的化学性质相似,氟和溴的单质都
有毒, 硫单质通常是无毒无害的,所以溴只可能与氟在同一族。
四 、解答题(23 分)解答应写出必要的文字说明、方程式和重要演算步骤。只写出最后答案 的不能得分。 有数值计算的题,答案中必须明确写出数值和单位。
23.(1)C
(2)H2O、HI、HIO
(3)构成的微粒不同
【解析】(1)根据单质中元素化合价为 0,化合物中元素化合价代数和为 0 分析;
(2)根据化合物为不同种元素组成的纯净物分析;
(3)根据不同种微粒物质性质不同分析。
(1)由单质中元素化合价为 0,化合物中元素化合价代数和为 0 可知, I2、KI、KIO3 中碘元素
的化合价分别为 0、-1、+5,故选 C;
(2)反应前两物质化学式分别为 H2O 和 I2 ,H2O 属于化合物,I2 属于单质;反应后物质化学式为
HI 和 HIO,两物质属于化合物;
(3) KIO3 和 I2 性质的不同的原因是构成的微粒不同;
故答案为:(1)C;(2) H2O、HI、HIO ;(3)构成的微粒不同。
24.(1)164
第 13 页(共 14 页)
(2)30:3:8
(3)73.2%
(4)3.2
(1)相对分子质量等于相对原子质量和个数的乘积之和;
(2)元素的质量之比等于相对原子质量和个数的乘积之比;
(3)碳元素的质量分数=质量×n;
(4)首先计算出氧元素的质量分数, 然后用丁香油酚的质量×氧元素的质量分数即可。
【解析】(1)丁香油酚的相对分子质量为:12×10+1×12+16×2=164;
(2)丁香油酚中碳、氢、氧三种元素的质量比:(12×10):(1×12):(16×2)=30:3:8.
(3)丁香油酚中碳元素的质量分数为:10 × 100% ≈ 73.2%;
(4)6.4 g 丁香油酚中含氧元素质量:16.4g × = 3.2g。
25.(1)12
(2)解: 四氧嘧啶中碳元素与氮元素的质量比为 4×12:2×14=12:7
(3)解: C4H2N2O4 中氧元素的质量分数为 12×4+1××2+16×4 × 100% =45.1%
(4)解: 设 x 质量的 C4H2N2O4 中含氮元素的质量与 153 克氨气(NH3 )中的氮元素的质量相等.
x× 12×4+1××2+16×4 ×100%=153g× ×100%
x=639g
(1)根据四氧嘧啶分子的构成进行分析解答.(2)根据化合物中各元素质量比=各原子的相对原
子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数= 相对个数
×100%,进行分析解答.(4)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,
进行分析解答.
【解析】解:(1)每个四氧嘧啶分子中有 4 个碳原子、 2 个氢原子、2 个氮原子、 4 个用原子个
原子, 一共有 12 个原子.
第 14 页(共 14 页)
本试卷共 100 分,考试时间 70 分钟。
注意事项:
1、答第 I 卷前, 考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、选出答案后, 用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再填涂其它答案,不能答在试卷上。
一 、选择题(本题共 15 个小题; 每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项是正确的)
1.模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物,仔细观察下列四幅图片,
其中不属于模型的是( )
A.滑动变阻器 B.眼球结构
C.中国政区图 D.动物细胞
2.关于下列四种分子模型的分析不正确的是( )
A.一个水分子和一个二氧化碳分子都由三个原子构成
B.氮气和氢气分别由两个氮原子和两个氢原子构成
C.由水分子和二氧化碳分子比较能说明分子可以由不同种类的原子构成
D.由氮气分子和氢气分子的比较能说明一个分子可以由种类相同的原子构成
3.下列关于分子、原子、离子的说法中,正确的是( )
A.分子的质量一定比原子大
B.原子是不能再分的粒子
C.原子得失电子后形成离子
D.分子、原子能构成物质,离子不能
第 1 页(共 14 页)
4.据报道,1994 年 12 月, 科学家发现了—种新元素,它的原子核内有 111 个质子数,161 个中
子。该元素的核电荷数为 ( )
A.433 B.161 C.272 D.111
5.如图表示四种原子的结构模型, 下列说法正确的是( )
A. 甲、丁的相对原子质量相同 B. 乙、丁不属于同一种元素
C. 甲、丙的核电荷数不同 D. 甲、乙为互为同位素原子
6.地壳中含量最多的金属元素是( )
A .氧 B .硅 C .铝 D .铁
7.下列各组都是非金属元素的是( )
A.S Si Fe B.P H O
C.Cu C Cl D.Al C Ca
8.在氧气(O2)、二氧化碳(CO2)两种物质中( )
A.都含有氧气分子 B.都含有两个氧原子
C.都含有氧元素 D.都含有两个氧元素
9.下列关于 Al、Al3+两种粒子的判断中不正确的是
A.核电荷数相同 B.质量几乎相等
C.Al3+ 比 Al 稳定 D.电子层数相同
10.某同学认为“O2 ”表示的意义有以下几种说法:①表示氧元素;②表示氧气这种物质; ③表 示 1 个氧分子;④表示 2 个氧原子;⑤表示氧气是一种无色气体;⑥表示 1 个氧分子由 2 个氧原
子构成。其中正确的是( )
A. ②④⑤ B. ②③⑥ C. ①②③④ D. ②③⑤⑥
11.在化学世界里没有生命的阿拉伯数字也变得鲜活起来,它们在不同的位置表示着不同的含
义.下列化学符号中数字“2”表示的意义正确的是( )
A.Mg2+ :一个镁离子带 2 个单位正电荷
第 2 页(共 14 页)
B.CO2 :二氧化碳分子中含有氧原子
C.2H:2 个氢元素
D. 氧化钙的化合价为+2 价
12.在以下物质中, 氯元素的化合价为+5 价的是( )
A.HCl B.Cl2 C.HClO3 D.ClO2
13.维生素 A1 中 C 的质量分数为 83.9%,H 的质量分数为 10.5%,O 的质量分数为 5.6%,其式量是
286,则维生素 A1 化学式为( )
A.C19H28O2 B.C20H14O2 C.C20H30O D.C19H42O
14.p 克某结晶水合物 A·nH O,受热失去全部结晶水后,质量变为 q 克, 由此可以得知该结晶水
合物的相对分子质量为 ( )
A. B . C . D .
15.现有①FeO、②Fe2O3、③Fe3O4 三种含铁的氧化物, 其中含铁元素的质量分数按由大到小的顺
序排列为( )
A. ①>②>③ B. ①>③>② C. ③>②>① D. ②>③>①
二 、填空题(20 分)把答案填在题中的横线上或按题目要求作答
16.用化学用语填空:
(1)甲烷 ;(2)硫离子 ;(3)氦原子 ;(4)氯酸钾 . 17.原子、分子、离子都是构成物质的微观离子, 比如氯化钠是由 构成的,图中 B 处应 填入 (填“原子”、“分子 ”或“离子 ”)。
18.德国科学家埃特尔对一氧化碳在金属铂表面催化下的氧化反应的研究, 催生了汽车尾气净化
装置, 实现了汽车尾气中一氧化碳的清洁排放。
(1)2pt 和1pt是铂元素的两种同位素原子,则这两种原子的中子个数相差 个。
(2)图示是汽车尾气净化装置里,一氧化碳和二氧化氮在金属铂表面催化下反应的微粒变化历
第 3 页(共 14 页)
程,则其先后顺序为 。 (用图中的序号排列)
19.质子数最少的元素是 ,地壳中含量最多的金属元素是 ,水中含量最多的
元素是 ,常温下单质是液态的金属元素是 。前 20 号元素的符号中含有“C”
的元素是 ;符号中含有“N”的元素是 。 (均填元素符号)
20.N(NO 2 )3 是科学家最新发现的一种火箭燃料.
(1)N(NO 2 )3 的相对分子质量是 .
(2)N(NO 2 )3 ,中氮元素和氧元素的质量比是 .
三 、实验探究题(12 分) 把答案填在题中的横线上或按题目要求作答
21.试用分子和原子的知识来说出下列两种变化的本质区别。
(1)水受热变成水蒸气; (2)水通电变成氢气和氧气。
22.为纪念门捷列夫发明的元素周期表诞生 150 周年,联合国大会宣布 2019 年是“ 国际化学元素
周期表年 ”。
材料一:门捷列夫将元素按照相对原子质量从小到大排列后,发现元素的化学性质成周期性出现,
故将相似化学性质的元素排在同一列。
材料二:门捷列夫无可非议地成为元素周期律的主要发现者, 因为门捷列夫的元素周期表有强大
的预测功能。
第 4 页(共 14 页)
材料三:氟是一种非金属化学元素, 氟元素的单质是 F2,它是一种淡黄色有剧毒的气体。氟气的
腐蚀性很强,化学性质极为活泼,是氧化性最强的物质之一。
硫是一种非金属元素, 通常单质硫是黄色的品体。硫元素在自然界中通常以化合物或单质的形式
存在。硫单质难溶于水, 微溶于酒精对人体而言, 单质硫通常是无毒无害的。
(1)根据现代周期表的元素排布特点,下列哪两种元素的化学性质相似? ( )
A.F、Ne B.N、O C.N、S D.N、P
(2)结合材料中图 1 和图 2,现在的元素周期表编制与门捷列夫的元素周期表排列规律有什么 相矛盾的地方?
(3)溴是一种化学元素,相对原子质量是 79.9, 溴单质是红黑色液体,溴蒸气具有腐蚀性,
并且有毒。请你结合材料预测溴在图 2 元素周期表中的位置(选择标准序号),并说明理由。
四 、解答题(23 分)解答应写出必要的文字说明、方程式和重要演算步骤。只写出最后答案 的不能得分。 有数值计算的题,答案中必须明确写出数值和单位。
23.碘是人体必需的微量元素之一,有“智力元素 ”之称。
(1)生活中常见的含碘元素的物质为:碘酒一一含碘单质 I2;碘片和藻类食物——含碘化钾 KI; 加碘盐——含碘酸钾 KIO3 。下列对 I2、KI、KIO3 中碘元素的化合价计算正确的是: (填序
号)。
A.+1、-1、+5 B.0、+1、+5 C.0、-1、+5
(2)碘能与水发生化学反应,生成两种化合物。如图 2 所示:
第 5 页(共 14 页)
写出反应过程中,属于化合物的物质的化学式 。
(3)适当食用加碘盐(含碘酸钾)可预防碘缺乏, 但服用碘酒(有效成分为 l2)却会引起碘中毒。
KIO3 和 I2 性质的不同的原因是 。
24.玫瑰花中含有香茅醇、橙花醇和丁香油酚(C10H12O2)等物质。
请计算下列问题。
(1)丁香油酚的相对分子质量为 。
(2)丁香油酚中碳、氢、氧三种元素的质量比为 。
(3)丁香油酚中碳元素的质量分数为 。 (结果精确到 0.1%)
(4)16.4 g 丁香油酚中含 g 氧元素。 (结果精确到 0.1 g)
25.复旦大学官方微博发布消息称, 该校 2010 级硕士研究生黄洋由于中毒经抢救无效, 于当天下 午 3 点 23 分在上海中山医院去世.上海警方表示, 在该生寝室饮水机内残留水中检测出某有毒
化合物成分,投毒物疑为四氧嘧啶, 化学式为 C4H2N2O4 .问:
(1)每个四氧嘧啶分子中有 个原子.
(2)四氧嘧啶中碳元素与氮元素的质量比是多少? (化成最简整数比)
(3)C4H2N2O4 中氧元素的质量分数为多少? (列式计算,保留一位小数)
(4)多少克 C4H2N2O4 中含氮元素的质量与 153 克氨气(NH3 )中的氮元素的质量相等?(列式计
算)
第 6 页(共 14 页)
第二单元测试题答案解析
本试卷共 100 分,考试时间 70 分钟。
注意事项:
1、答第 I 卷前, 考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、选出答案后, 用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再填涂其它答案,不能答在试卷上。
一 、选择题(本题共 15 个小题; 每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一 项是正确的)
1.A
【解析】模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物 ,在科学中更能
生动的帮助学生了解和熟悉所学的事物。
A.此图为滑动变阻器的符号,不是模型, A 符合题意。
B、科学中了解眼睛,用代表眼睛的模型更能学习和观察关于眼睛的知识,此图眼球结构就是眼
睛的模型, B 不符合题意。
C、地图是地理环境的缩影,整个地理环境的缩影, 地图是符号模型也是数学模型, C 不符合题
意。
D、此图可以抽象的表达动物细胞结构,它是属于模型因为有利于更生动地学习与观察动物细胞
的结构,D 不符合题意。
2.B
【解析】分析分子模型确定分子的构成即可。
A.一个水分子和一个二氧化碳分子都由三个原子构成, 故 A 正确不合题意;
B.氮气和氢气分别由氮分子和氢分子构成, 而一个氮分子由两个氮原子构成,一个氢分子由两个
氢原子构成,故 B 错误符合题意;
C.水分子由氢原子和氧原子构成,二氧化碳分子由碳原子和氧原子构成, 那么能说明分子可以由
不同种类的原子构成,故 C 正确不合题意;
D.氮气分子只由氮原子构成,而氢气分子只由氢原子构成,那么能说明一个分子可以由种类相同
的原子构成,故 D 正确不合题意。
第 7 页(共 14 页)
3.C
【解析】(1)分子的质量等于构成它的原子的质量与个数的乘积之和;如果构成它的原子个数太
少,原子质量很小, 分子的质量不一定大;
(2)原子由原子核和核外电子构成;
(3)原子的正电荷数和负电荷数相等,当它得到电子时, 负电荷数多, 变成带负电荷的离子;
当它失去电子时,正电荷多,变成带正电荷的离子;
(4)分子,原子和离子都是构成物质的基本微粒。
A.H2 分子的分子量是 2,而 O 原子的原子量是 16,因此分子质量不一定比原子质量大, 故 A 错
误;
B.原子由原子核和核外电子构成,因此原子可以再分, 故 B 错误;
C.原子得失电子后形成离子, 故 C 正确;
D.分子、原子和离子都能构成物质, 故 D 错误。
故选 C。
4.D
【解析】在原子中, 质子数=核电荷数=核外电子数,据此选择。
根据元素的核电荷数=质子数可知,该元素的核电荷数为 111,故 D 正确,而 A.B、C 错误。
故选 D。
5.A
6.C
【解析】根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁进行分析解答本题。 地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝, 铁,因此地壳中含量最多的金属元
素是 Al。
7.B
【解析】一般情况下, 名字中含有金字旁的都是金属元素,没有金字旁的都是非金属元素,据此
选择。
A.Fe 是金属元素, 故 A 不合题意;
B.P 是磷元素、 H 是氢元素、O 是氧元素, 它们都是非金属元素,故 B 符合题意; 第 8 页(共 14 页)
C.Cu 是金属元素, 故 C 不合题意;
D.Al 是金属元素, 故 D 不合题意。
故选 B。
8.C
【解析】从宏观角度看, 物质由元素组成;从微观角度看,物质由分子、原子、离子构成;
氧气中含有氧气分子,二氧化碳中含有二氧化碳分子, A 错误;应是每个氧气分子和二氧化碳分
子中都含有两个氧原子, B 错误;元素是宏观概念,只讲种类,不讲个数, D 错误。
故答案为: C。
9.D
【详解】
A.因它们是同种元素形成的微粒,质子数相同,故核电荷数相同, 故正确;
B、铝原子失去电子形成铝离子, 电子的质量很小, 可以忽略不计, 故质量几乎相等,故正确;
C、铝离子是稳定结构, 铝原子易失去电子,不稳定,故铝离子比铝原子稳定,故正确;
D、铝原子失去电子形成铝离子, 二者的电子层数不同,故错误。
故选 D。
10.B
【解析】根据化学式的意义分析判断。
“O2 ”表示的意义如下:表示氧气这种物质; 表示 1 个氧分子;表示 1 个氧分子由 2 个氧原子
构成, 故②③⑥正确。
故选 B。
11.A
【解析】A.Mg2+ 中数字 2 表示一个镁离子带 2 个单位正电荷; 故 A 正确;
B.CO2 中数字 2 表示 1 个二氧化碳分子中含有 2 个氧原子; 故 B 错误;
C.2H 中数字 2 表示 2 个氢原子; 故 C 错误;
D.根据标在元素符号正上方的数字表示该元素化合价的数值;
故选: A.
第 9 页(共 14 页)
根据元素符号右上角的数字表示离子所带电荷数,标在元素符号右下角的数字表示一个分子中所 含原子的个数;标在元素符号前面的数字表示原子的个数;元素符号正上方的数字表示该元素化
合价的数值;进行解答;
12.C
【解析】A.氢元素显+1 价,设氯元素的化合价是 x,根据在化合物中正负化合价代数和为零,
可得:(+1)+x=0,则 x=﹣1 价;
B、根据单质中元素的化合价为 0,Cl2 属于单质, 故氯元素的化合价为 0;
C、氢元素显+1 价, 氧元素显﹣2 价,设氯元素的化合价是 y,根据在化合物中正负化合价代数
和为零,可得:(+1)+y+(﹣2) ×3=0,则 y=+5 价;
D、氧元素显﹣2 价,设氯元素的化合价是 z,根据在化合物中正负化合价代数和为零,可得:z+
(﹣2) ×2=0,则 z=+4 价,故氯元素的化合价为+5 价的是 C.故选:C.
根据单质中元素的化合价为 0、在化合物中正负化合价代数和为零, 结合各选项中的化学式进行
解答本题.
13.C
【解析】 根据元素质量分数=相对原子质量×原子个数/相对分子质量、式量为分子中各原子的
相对原子质量之和分析。
A 中物质式量为 12×19+28+16×2=288,错误;
B 中物质式量为 12×20+14+16×2=286,碳元素质量分数为 × 100%=83.9%,氢元素质量分
数为 × 100%=4.9%,错误;
C 中物质式量为 12×20+30+16=286, C 的质量分数为 83.9%,H 的质量分数为 10.5%,O 的质量
分数为 5.6%, 正确;
D 中物质式量为 12×19+42+16=286,碳元素质量分数为19 × 100%=80%,错误;
故选 C。
14.A
15.B
第 10 页(共 14 页)
【解析】元素的质量分数=相对原量×n × 100%。
①FeO 中铁元素的质量分数: × 100% ≈ 77.78%;
②Fe2O3 中铁元素的质量分数: × 100% ≈ 70%;
③Fe3O3 中铁元素的质量分数: × 100% ≈ 72.4%。
则铁元素的质量分数从大到小的顺序排列为: ①>③>②。
故选 B。
二 、填空题(20 分) 把答案填在题中的横线上或按题目要求作答
16.CH4 ;S2﹣ ; He;KClO3
【解析】(1)甲烷可以表示为 CH4;(2)硫离子可以表示为 S2﹣ ;(3)氦原子可以表示为 He;(4)
氯酸钾可以表示为 KClO3 .
故答案为:(1)CH4 ;(2)S2﹣ ; (3)He;(4)KClO3 .
本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还 是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义, 并能根据物质
化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
17.钠离子和氯离子;原子
18.(1)4
(2)①④⑤③②
【解析】(1)根据相对原子质量=质子数+中子数分析;
(2)根据化学变化的实质是分子分成原子,原子重新结合成新分子分析。
(1) 2pt 和1pt是铂元素的两种同位素原子, 这两种原子的质子数相等, 都为 78,则中子
个数相差 202-198=4。
(2)一氧化碳和二氧化氮在金属铂表面催化下反应,先 一氧化碳和二氧化氮分子分成碳、氧、 氮原子,然后碳、氧、氮原子重新组成,生成氮分子和二氧化碳分子,先后顺序为 ①④⑤③② 。
故答案为:(1)4;(2) ①④⑤③② 。
19.H;Al;O;Hg;C、CI、Ca;N、Ne、Na
第 11 页(共 14 页)
【解析】根据对元素周期表的认识, 以及对常见元素的了解分析解答。
质子数最少的元素是 H,地壳中含量最多的金属元素是 Al,水中含量最多的元素是 O,常温下单 质是液态的金属元素是 Hg。前 20 号元素的符号中含有“C”的元素是 C、Cl、Ca ;符号中含有
“N”的元素是 N、Ne、Na。
20.(1)152
(2)7:12
【解析】解:(1)N(NO 2 )3 的相对分子质量=14×4+16×6=152,故填: 152;
(2)依据元素的质量比等于各元素相对原子质量和的比,所以 N(NO2)3 中氮元素和氧元素的质
量比是(14×4):(16×6)=7:12,故填:7:12.
(1)根据相对分子质量为组成分子的各原子的相对原子质量之和, 进行分析解答;
(2)依据元素的质量比等于各元素相对原子质量和的比分析解答即可.
三 、实验探究题(12 分) 把答案填在题中的横线上或按题目要求作答
21.分子是否能分成原子并重新组合成新的分子(或分子是否可以再分或答案合理即可)
【详解】
(1)水受热变成水蒸气时,分子之间的间隔增大,而水分子本身没有发生改变;
(2)水通电变成氢气和氧气时,首先水分子被破坏为氢原子和氧原子,然后原子再重新组合,构 成氧分子和氢分子,所以这两种变化的本质区别就是: 分子是否能分成原子并重新组合成新的分
子,故填分子是否能分成原子并重新组合成新的分子。
22.(1)D
(2)门捷列夫是根据元素的相对原子质量由小到大排列的,而现在的元素周期表中,83 号元素
的相对原子质量与 84 号元素相对原子质量相等。
(3)②, 溴的相对原子质量为 79.9,相对原子质量位于 33 号和 36 号之间,所以只可能位于①② 两个位置,而同一族的化学性质相似,氟和溴的单质都有毒,硫单质通常是无毒无害的,所以溴
只可能与氟在同一族。
【解析】(1)在元素周期表中,将具有相同的最外层电子数的元素排成一列,称为一个族。同族
元素具有相同的化学性质。
第 12 页(共 14 页)
(2)注意 83 号元素和 84 号元素的相对原子质量大小即可。
(4)将它的相对原子质量与周期表中进行比较,从而确定大致位置,再根据它的化学性质确定
与哪种元素在同一族即可。
【解答】(1)根据元素周期表可知,N 和 P 在同一列, 即在同一族,二者具有相同的最外层电子
数,因此具有相似的化学性质, 故选 D。
(2)结合材料中图 1 和图 2,现在的元素周期表编制与门捷列夫的元素周期表排列规律的矛盾 之处: 门捷列夫是根据元素的相对原子质量由小到大排列的, 而现在的元素周期表中, 83 号元
素的相对原子质量与 84 号元素相对原子质量相等。
(3)溴应该在元素周期表的位置②处,理由是:溴的相对原子质量为 79.9,相对原子质量位于 33 号和 36 号之间, 所以只可能位于①②两个位置, 而同一族的化学性质相似,氟和溴的单质都
有毒, 硫单质通常是无毒无害的,所以溴只可能与氟在同一族。
四 、解答题(23 分)解答应写出必要的文字说明、方程式和重要演算步骤。只写出最后答案 的不能得分。 有数值计算的题,答案中必须明确写出数值和单位。
23.(1)C
(2)H2O、HI、HIO
(3)构成的微粒不同
【解析】(1)根据单质中元素化合价为 0,化合物中元素化合价代数和为 0 分析;
(2)根据化合物为不同种元素组成的纯净物分析;
(3)根据不同种微粒物质性质不同分析。
(1)由单质中元素化合价为 0,化合物中元素化合价代数和为 0 可知, I2、KI、KIO3 中碘元素
的化合价分别为 0、-1、+5,故选 C;
(2)反应前两物质化学式分别为 H2O 和 I2 ,H2O 属于化合物,I2 属于单质;反应后物质化学式为
HI 和 HIO,两物质属于化合物;
(3) KIO3 和 I2 性质的不同的原因是构成的微粒不同;
故答案为:(1)C;(2) H2O、HI、HIO ;(3)构成的微粒不同。
24.(1)164
第 13 页(共 14 页)
(2)30:3:8
(3)73.2%
(4)3.2
(1)相对分子质量等于相对原子质量和个数的乘积之和;
(2)元素的质量之比等于相对原子质量和个数的乘积之比;
(3)碳元素的质量分数=质量×n;
(4)首先计算出氧元素的质量分数, 然后用丁香油酚的质量×氧元素的质量分数即可。
【解析】(1)丁香油酚的相对分子质量为:12×10+1×12+16×2=164;
(2)丁香油酚中碳、氢、氧三种元素的质量比:(12×10):(1×12):(16×2)=30:3:8.
(3)丁香油酚中碳元素的质量分数为:10 × 100% ≈ 73.2%;
(4)6.4 g 丁香油酚中含氧元素质量:16.4g × = 3.2g。
25.(1)12
(2)解: 四氧嘧啶中碳元素与氮元素的质量比为 4×12:2×14=12:7
(3)解: C4H2N2O4 中氧元素的质量分数为 12×4+1××2+16×4 × 100% =45.1%
(4)解: 设 x 质量的 C4H2N2O4 中含氮元素的质量与 153 克氨气(NH3 )中的氮元素的质量相等.
x× 12×4+1××2+16×4 ×100%=153g× ×100%
x=639g
(1)根据四氧嘧啶分子的构成进行分析解答.(2)根据化合物中各元素质量比=各原子的相对原
子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数= 相对个数
×100%,进行分析解答.(4)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,
进行分析解答.
【解析】解:(1)每个四氧嘧啶分子中有 4 个碳原子、 2 个氢原子、2 个氮原子、 4 个用原子个
原子, 一共有 12 个原子.
第 14 页(共 14 页)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
