6.2溶液组成的表示同步练习沪教版化学九年级下册(含答案)
文档属性
| 名称 | 6.2溶液组成的表示同步练习沪教版化学九年级下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 266.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 11:43:36 | ||
图片预览



文档简介
6.2溶液组成的表示 同步练习
一、多选题
1.水是生命之源,是人类生产、生活中不可缺少的物质。初中化学实验中经常用到水。下列实验有关水的用途叙述正确的是
实验①燃烧的条件 实验②收集气体 实验③ 实验④溶解固体NaCl 实验⑤制取蒸馏水
A.实验①中热水对铜片起到了加热的作用
B.实验②中主要利用了气体密度比水小
C.实验③④中水只是一种溶剂,没有参加反应
D.实验⑤中水起到冷凝的作用
2.下列说法正确的是
A.等质量的H2O和H2O2中,所含氧元素质量比为1:2
B.20g氢气和氧气的混合气体,点燃后充分反应生成18g水,则原混合气体中氢气和氧气的质量比可能为1:4
C.某硫酸镁和硫酸的混合溶液中,硫元素的质量分数为4.8%,取100g该溶液向其中加入100g氢氧化钠溶液,恰好完全反应,则氢氧化钠溶液中溶质的质量分数为12%
D.由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体不可能是CO和C2H4
3.下列有关“溶质质量分数为20%的NaOH溶液”的说法中,明显错误的是
A.100克水中溶解有20克NaOH
B.在该溶液中,溶质和溶剂的质量比为1:5
C.将该溶液倒出一半,剩余溶液中溶质的质量分数为10%
D.氢氧化钠固体溶解于水时,溶液温度升高
4.取15.6gCaO和CaCO3的固体混合物放于烧杯中,向烧杯中加入200g稀盐酸,恰好完全反应,得到一定温度下的不饱和溶液211.2g。则下列说法中,符合事实的是
A.反应生成二氧化碳的质量是4.4 g B.所取固体混合物中CaO的质量为5.6g
C.参加反应的稀盐酸的溶质质量分数为3.65% D.原固体混合物中钙元素的质量为8.0 g
5.某种蔬菜的无土栽培营养液中含有溶质质量分数为4%的KNO3溶液。下列方法能够得到溶质质量分数为4%的KNO3溶液的是
A.从1000g3%的KNO3溶液蒸发出250g水
B.从1000mL8%的KNO3溶液中倒出500mL溶液
C.向1000g2%的KNO3溶液中加入20g KNO3固体
D.将400g2%的KNO3溶液与400g6%的KNO3溶液混合
二、选择题
6.下列关于溶液的说法错误的是( )
A.一定温度下向甲物质的饱和溶液中加入乙,则甲的质量分数会减小
B.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
C.NH4NO3溶解过程中吸热,溶液温度降低
D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量不一定相等
7.下列理解正确的是
A.钻石恒久远,一颗永流传:是指金刚石是天然物质中最硬的 B.0.9%的生理盐水:是指 100g 水中溶解了 0.9g 的氯化钠
C.真金不怕火炼:金的熔点很高 D.古代的“五金”:是指金、银、铜、铁、锡
8.下列各组物质中,前者属于混合物,后者属于纯净物的是
A.食醋、啤酒 B.牛奶、冰水混合物
C.液氧、蒸馏水 D.澄清的石灰水、食盐水
9.下列选项不属于溶液的是
A.蔗糖水 B.生理盐水 C.碘酒 D.蒸馏水
10.下列关于配制25g 10%的氯化钠溶液的相关说法不正确的是
A.操作步骤主要有:计算、称量、量取、溶解、装瓶
B.量取蒸馏水时,需使用100 mL的量筒
C.用该溶液配制5%的氯化钠溶液,需加水的质量为25g
D.配制好的溶液装瓶时有少许液体洒出,溶液的溶质质量分数不变
11.下列关于溶液的叙述,正确的是
A.溶剂一定为水 B.溶液中只能有一种溶质
C.无色透明的液体一定是溶液 D.溶液中各部分的性质均相同
12.实验室制取氧气所用的氯酸钾通常含一定量的杂质。小明同学称取6.00g样品与少量二氧化锰(不溶于水)混合,加热使其完全反应,冷却至室温,将剩余固体与18.0g水充分溶解,过滤,得到的不饱和溶液中溶质的质量分数为10.0%,若不考虑实验中药品的损耗,氯酸钾样品中的杂质不参与反应,也不溶于水,其他物质均可溶于水,则样品中氯酸钾的质量约为
A.2.0g B.3.5g C.3.29g D.5.12g
13.下列有关水的说法,错误的是
A.澄清石灰水、稀盐酸中的溶剂是水
B.通过活性炭可以将硬水转变为软水
C.通过加热煮沸的方法降低水的硬度
D.蒸馏水是由大量水分子聚集而成的
14.下列溶液中,不是以水作溶剂的是( )
A.10g硝酸铵跟8g水组成的溶液
B.10g水跟8g硝酸铵组成的溶液
C.1g水跟9g酒精组成的溶液
D.100g酒精跟5g碘组成的溶液
15.对说法中涉及的“数量”理解正确的是( )
A.“He﹣3原子”中的3表示氦原子核外有三个电子
B.“20℃时NaCl溶解度为36g”中的36g表示在20℃时100g NaCl饱和溶液中含有36g NaCl
C.“H2O”中的2表示水中含有二个氢原子
D.“10%的蔗糖溶液”中的10%表示100份质量的这种蔗糖溶液中含有90份质量的水
三、综合应用题
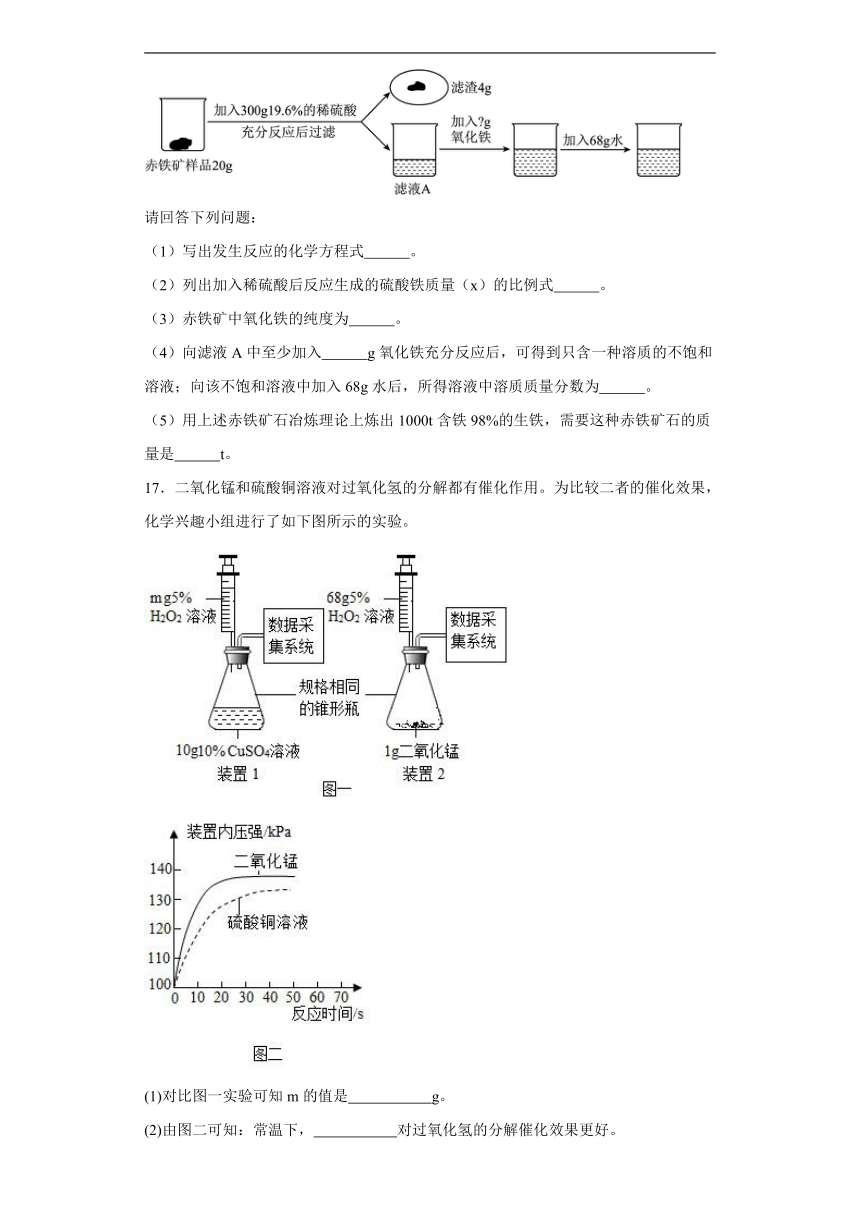
16.欲测定某赤铁矿中(杂质不溶于水,也不与酸反应)氧化铁的纯度,并配制一种溶液,同学们进行了如下图所示的实验:
请回答下列问题:
(1)写出发生反应的化学方程式 。
(2)列出加入稀硫酸后反应生成的硫酸铁质量(x)的比例式 。
(3)赤铁矿中氧化铁的纯度为 。
(4)向滤液A中至少加入 g氧化铁充分反应后,可得到只含一种溶质的不饱和溶液;向该不饱和溶液中加入68g水后,所得溶液中溶质质量分数为 。
(5)用上述赤铁矿石冶炼理论上炼出1000t含铁98%的生铁,需要这种赤铁矿石的质量是 t。
17.二氧化锰和硫酸铜溶液对过氧化氢的分解都有催化作用。为比较二者的催化效果,化学兴趣小组进行了如下图所示的实验。
(1)对比图一实验可知m的值是 g。
(2)由图二可知:常温下, 对过氧化氢的分解催化效果更好。
(3)68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是多少?(写出计算过程)。
(4)有同学认为上述实验还不够严密,其理由是 。
(5)请画出装置1中加入对应的H2O2溶液完全反应后所得溶液的坐标图。(请标出有关的数据)
18.防范新冠疫情依然重要,需要我们“戴口罩,勤洗手,勤消毒,勤通风”
(1)请从微观角度解释:随身携带的酒精湿巾或酒精喷雾用时室内充满酒精气味的原因
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是
(3)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 kg
(4)84消毒液因诞生于1984年而得名,在抗击新冠肺炎疫情期间,它频频进入公众视野 当时在1984年,北京第一传染病医院(今地坛医院)研制出了一种消毒液,经过多次研究,3000多次实验,上百次的配方的调整,这种消毒液能够快灭活肝炎病毒,起初它名字叫‘84肝炎洗消液’后来才更名为‘84消毒液’.下面是“84”消毒液主要成分次氯酸钠的生产流程图以及次氯酸钠的相关性质
①标出次氯酸钠中氯元素的化合价 。
②操作(1)的名称为 。
③反应(2)的化学方程式为 。
④84消毒液如何保存
参考答案:
1.AD
2.BC
3.ABC
4.ABD
5.AD
6.B
7.D
8.B
9.D
10.B
11.D
12.C
13.B
14.D
15.D
16. 80% 16 20% 1750
17.(1)68
(2)二氧化锰
(3)设68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是x
x=1. 6g
答:68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是1. 6g
(4)硫酸铜溶液和二氧化锰的质量不同(或二氧化锰是固体,硫酸铜是溶液)
(5)
18. 酒精分子在不断的运动 乳化作用 2 过滤 避光密闭
一、多选题
1.水是生命之源,是人类生产、生活中不可缺少的物质。初中化学实验中经常用到水。下列实验有关水的用途叙述正确的是
实验①燃烧的条件 实验②收集气体 实验③ 实验④溶解固体NaCl 实验⑤制取蒸馏水
A.实验①中热水对铜片起到了加热的作用
B.实验②中主要利用了气体密度比水小
C.实验③④中水只是一种溶剂,没有参加反应
D.实验⑤中水起到冷凝的作用
2.下列说法正确的是
A.等质量的H2O和H2O2中,所含氧元素质量比为1:2
B.20g氢气和氧气的混合气体,点燃后充分反应生成18g水,则原混合气体中氢气和氧气的质量比可能为1:4
C.某硫酸镁和硫酸的混合溶液中,硫元素的质量分数为4.8%,取100g该溶液向其中加入100g氢氧化钠溶液,恰好完全反应,则氢氧化钠溶液中溶质的质量分数为12%
D.由甲烷和另两种气体组成的混合物中,碳元素的质量分数为80%,则另两种气体不可能是CO和C2H4
3.下列有关“溶质质量分数为20%的NaOH溶液”的说法中,明显错误的是
A.100克水中溶解有20克NaOH
B.在该溶液中,溶质和溶剂的质量比为1:5
C.将该溶液倒出一半,剩余溶液中溶质的质量分数为10%
D.氢氧化钠固体溶解于水时,溶液温度升高
4.取15.6gCaO和CaCO3的固体混合物放于烧杯中,向烧杯中加入200g稀盐酸,恰好完全反应,得到一定温度下的不饱和溶液211.2g。则下列说法中,符合事实的是
A.反应生成二氧化碳的质量是4.4 g B.所取固体混合物中CaO的质量为5.6g
C.参加反应的稀盐酸的溶质质量分数为3.65% D.原固体混合物中钙元素的质量为8.0 g
5.某种蔬菜的无土栽培营养液中含有溶质质量分数为4%的KNO3溶液。下列方法能够得到溶质质量分数为4%的KNO3溶液的是
A.从1000g3%的KNO3溶液蒸发出250g水
B.从1000mL8%的KNO3溶液中倒出500mL溶液
C.向1000g2%的KNO3溶液中加入20g KNO3固体
D.将400g2%的KNO3溶液与400g6%的KNO3溶液混合
二、选择题
6.下列关于溶液的说法错误的是( )
A.一定温度下向甲物质的饱和溶液中加入乙,则甲的质量分数会减小
B.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
C.NH4NO3溶解过程中吸热,溶液温度降低
D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量不一定相等
7.下列理解正确的是
A.钻石恒久远,一颗永流传:是指金刚石是天然物质中最硬的 B.0.9%的生理盐水:是指 100g 水中溶解了 0.9g 的氯化钠
C.真金不怕火炼:金的熔点很高 D.古代的“五金”:是指金、银、铜、铁、锡
8.下列各组物质中,前者属于混合物,后者属于纯净物的是
A.食醋、啤酒 B.牛奶、冰水混合物
C.液氧、蒸馏水 D.澄清的石灰水、食盐水
9.下列选项不属于溶液的是
A.蔗糖水 B.生理盐水 C.碘酒 D.蒸馏水
10.下列关于配制25g 10%的氯化钠溶液的相关说法不正确的是
A.操作步骤主要有:计算、称量、量取、溶解、装瓶
B.量取蒸馏水时,需使用100 mL的量筒
C.用该溶液配制5%的氯化钠溶液,需加水的质量为25g
D.配制好的溶液装瓶时有少许液体洒出,溶液的溶质质量分数不变
11.下列关于溶液的叙述,正确的是
A.溶剂一定为水 B.溶液中只能有一种溶质
C.无色透明的液体一定是溶液 D.溶液中各部分的性质均相同
12.实验室制取氧气所用的氯酸钾通常含一定量的杂质。小明同学称取6.00g样品与少量二氧化锰(不溶于水)混合,加热使其完全反应,冷却至室温,将剩余固体与18.0g水充分溶解,过滤,得到的不饱和溶液中溶质的质量分数为10.0%,若不考虑实验中药品的损耗,氯酸钾样品中的杂质不参与反应,也不溶于水,其他物质均可溶于水,则样品中氯酸钾的质量约为
A.2.0g B.3.5g C.3.29g D.5.12g
13.下列有关水的说法,错误的是
A.澄清石灰水、稀盐酸中的溶剂是水
B.通过活性炭可以将硬水转变为软水
C.通过加热煮沸的方法降低水的硬度
D.蒸馏水是由大量水分子聚集而成的
14.下列溶液中,不是以水作溶剂的是( )
A.10g硝酸铵跟8g水组成的溶液
B.10g水跟8g硝酸铵组成的溶液
C.1g水跟9g酒精组成的溶液
D.100g酒精跟5g碘组成的溶液
15.对说法中涉及的“数量”理解正确的是( )
A.“He﹣3原子”中的3表示氦原子核外有三个电子
B.“20℃时NaCl溶解度为36g”中的36g表示在20℃时100g NaCl饱和溶液中含有36g NaCl
C.“H2O”中的2表示水中含有二个氢原子
D.“10%的蔗糖溶液”中的10%表示100份质量的这种蔗糖溶液中含有90份质量的水
三、综合应用题
16.欲测定某赤铁矿中(杂质不溶于水,也不与酸反应)氧化铁的纯度,并配制一种溶液,同学们进行了如下图所示的实验:
请回答下列问题:
(1)写出发生反应的化学方程式 。
(2)列出加入稀硫酸后反应生成的硫酸铁质量(x)的比例式 。
(3)赤铁矿中氧化铁的纯度为 。
(4)向滤液A中至少加入 g氧化铁充分反应后,可得到只含一种溶质的不饱和溶液;向该不饱和溶液中加入68g水后,所得溶液中溶质质量分数为 。
(5)用上述赤铁矿石冶炼理论上炼出1000t含铁98%的生铁,需要这种赤铁矿石的质量是 t。
17.二氧化锰和硫酸铜溶液对过氧化氢的分解都有催化作用。为比较二者的催化效果,化学兴趣小组进行了如下图所示的实验。
(1)对比图一实验可知m的值是 g。
(2)由图二可知:常温下, 对过氧化氢的分解催化效果更好。
(3)68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是多少?(写出计算过程)。
(4)有同学认为上述实验还不够严密,其理由是 。
(5)请画出装置1中加入对应的H2O2溶液完全反应后所得溶液的坐标图。(请标出有关的数据)
18.防范新冠疫情依然重要,需要我们“戴口罩,勤洗手,勤消毒,勤通风”
(1)请从微观角度解释:随身携带的酒精湿巾或酒精喷雾用时室内充满酒精气味的原因
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是
(3)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 kg
(4)84消毒液因诞生于1984年而得名,在抗击新冠肺炎疫情期间,它频频进入公众视野 当时在1984年,北京第一传染病医院(今地坛医院)研制出了一种消毒液,经过多次研究,3000多次实验,上百次的配方的调整,这种消毒液能够快灭活肝炎病毒,起初它名字叫‘84肝炎洗消液’后来才更名为‘84消毒液’.下面是“84”消毒液主要成分次氯酸钠的生产流程图以及次氯酸钠的相关性质
①标出次氯酸钠中氯元素的化合价 。
②操作(1)的名称为 。
③反应(2)的化学方程式为 。
④84消毒液如何保存
参考答案:
1.AD
2.BC
3.ABC
4.ABD
5.AD
6.B
7.D
8.B
9.D
10.B
11.D
12.C
13.B
14.D
15.D
16. 80% 16 20% 1750
17.(1)68
(2)二氧化锰
(3)设68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是x
x=1. 6g
答:68g5%的H2O2溶液在MnO2的催化下完全分解生成氧气的质量是1. 6g
(4)硫酸铜溶液和二氧化锰的质量不同(或二氧化锰是固体,硫酸铜是溶液)
(5)
18. 酒精分子在不断的运动 乳化作用 2 过滤 避光密闭
