6.3物质的溶解性同步练习沪教版化学九年级下册(含答案)
文档属性
| 名称 | 6.3物质的溶解性同步练习沪教版化学九年级下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 768.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 11:45:45 | ||
图片预览


文档简介
6.3物质的溶解性 同步练习
一、多选题
1.分类观是重要的化学学科思想之一,下列有关分类符合如图所示关系的是
A B C D
X 化合反应 天然气 饱和溶液 空气
Y 氧化反应 化石燃料 浓溶液 稀有气体
A.A B.B C.C D.D
2.下列说法正确的是
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.升高温度或增大压强均可以增大气体在水中的溶解度
C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水200g
D.在溶液中加入KNO3晶体和蒸发溶液中的水分这两种方法,都能把8%的KNO3溶液变成15%的KNO3溶液
3.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的饱和溶液
B.将c的饱和溶液变为不饱和溶液,可采用降温的方法
C.P点表示t1℃时,a、c两种物质的溶解度相等
D.t2℃时a、b、c三种物质的饱和溶液降温到t1℃时所得溶液溶质质量分数由大到小的顺序是b>a≥c
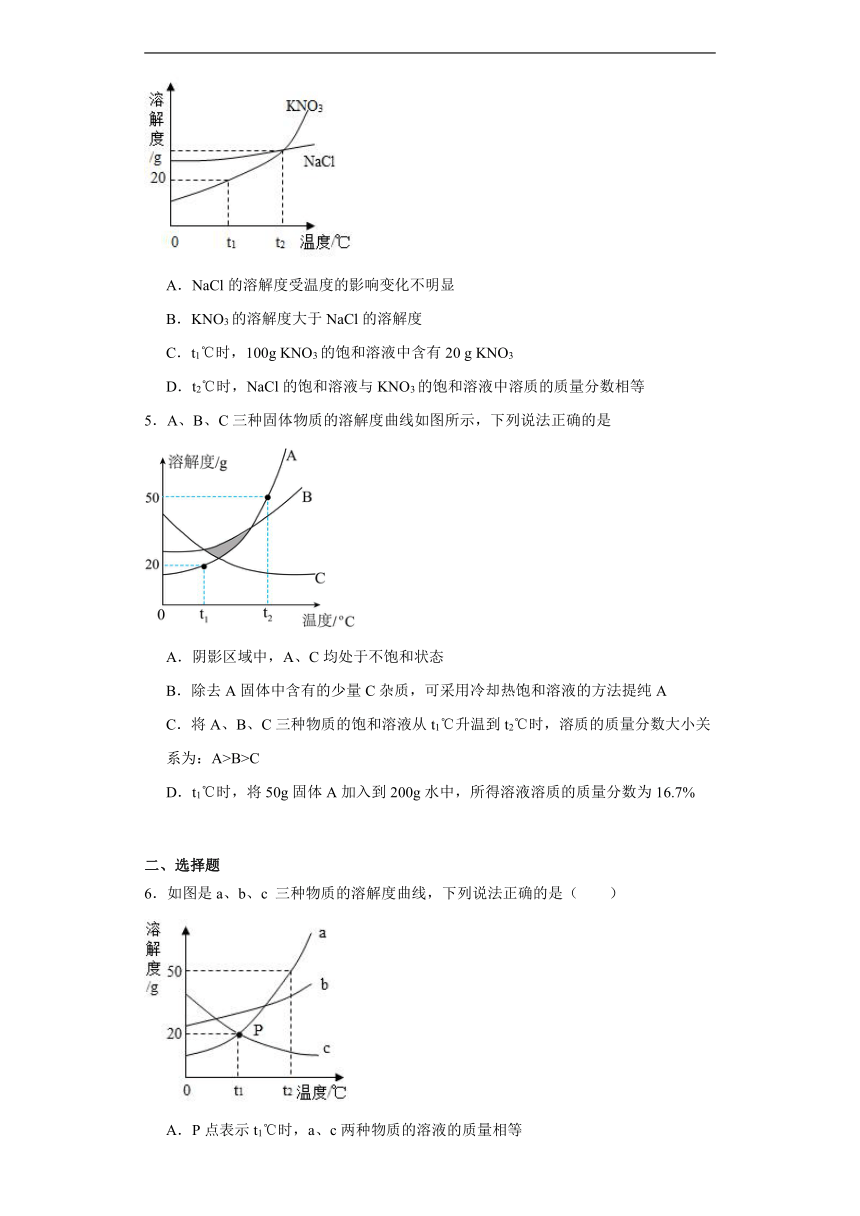
4.右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度受温度的影响变化不明显
B.KNO3的溶解度大于NaCl的溶解度
C.t1℃时,100g KNO3的饱和溶液中含有20 g KNO3
D.t2℃时,NaCl的饱和溶液与KNO3的饱和溶液中溶质的质量分数相等
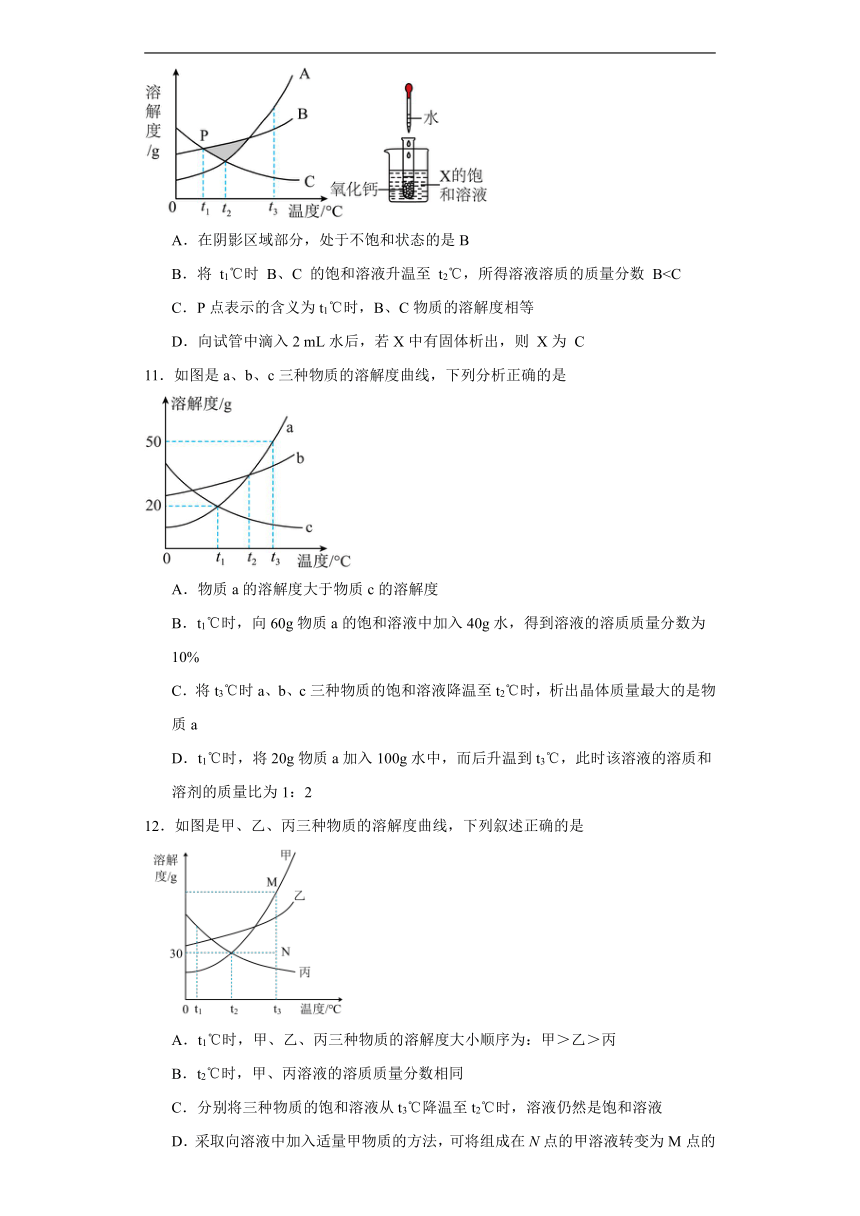
5.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.阴影区域中,A、C均处于不饱和状态
B.除去A固体中含有的少量C杂质,可采用冷却热饱和溶液的方法提纯A
C.将A、B、C三种物质的饱和溶液从t1℃升温到t2℃时,溶质的质量分数大小关系为:A>B>C
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数为16.7%
二、选择题
6.如图是a、b、c 三种物质的溶解度曲线,下列说法正确的是( )
A.P点表示t1℃时,a、c两种物质的溶液的质量相等
B.由图可知,a、b两种物质的溶解度不可能相等
C.t2℃时,将等质量的a、b、c三种物质配制成饱和溶液,所需水的质量最少的为a
D.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,变为不饱和溶液的是a
7.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.20℃时,甲、乙都属于易溶物
B.40℃时,甲、乙饱和溶液所含溶质质量相等
C.50℃时,等质量的甲和乙饱和溶液中所含溶剂的质量甲>乙
D.将40℃时甲、乙饱和溶液降温到20℃,溶液的溶质质量分数甲>乙
8.化学实验常需要溶液,下列有关溶液的说法正确的是( )
A.汽油除去油污是利用了乳化原理
B.饱和溶液一定是浓溶液
C.氢氧化钠固体溶于水温度会降低
D.其它条件不变时,气体物质的溶解度随温度升高而降低
9.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.从乙溶液中获得乙晶体,常用蒸发结晶的方法
B.35℃时,30g甲加入50g水中,得到80g甲溶液
C.15℃时,甲和乙的饱和溶液中溶质质量相等
D.降低温度,甲溶液中溶质的质量分数一定减小
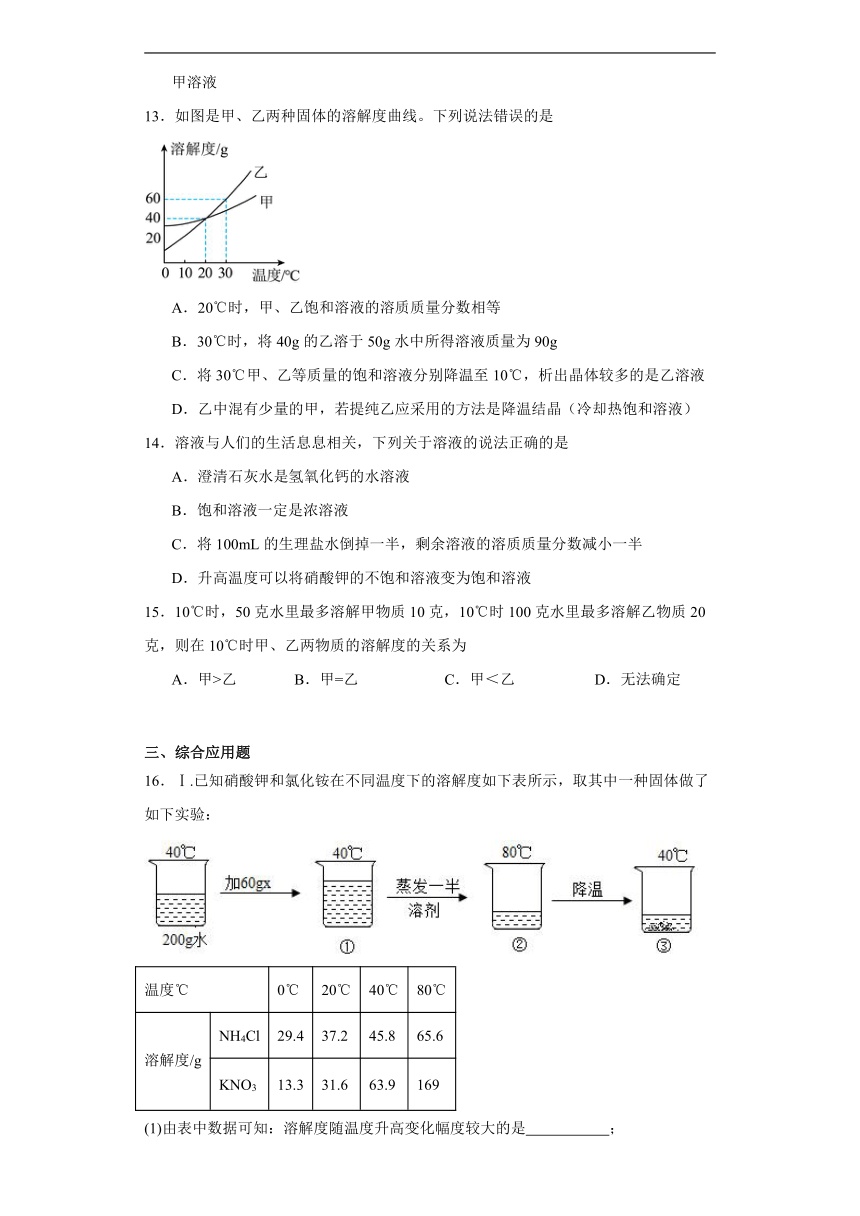
10.已知 A、B、C三种物质的溶解度曲线如图所示,下列说法错误的是
A.在阴影区域部分,处于不饱和状态的是B
B.将 t1℃时 B、C 的饱和溶液升温至 t2℃,所得溶液溶质的质量分数 BC.P点表示的含义为t1℃时,B、C物质的溶解度相等
D.向试管中滴入2 mL水后,若X中有固体析出,则 X为 C
11.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.物质a的溶解度大于物质c的溶解度
B.t1℃时,向60g物质a的饱和溶液中加入40g水,得到溶液的溶质质量分数为10%
C.将t3℃时a、b、c三种物质的饱和溶液降温至t2℃时,析出晶体质量最大的是物质a
D.t1℃时,将20g物质a加入100g水中,而后升温到t3℃,此时该溶液的溶质和溶剂的质量比为1:2
12.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1℃时,甲、乙、丙三种物质的溶解度大小顺序为:甲>乙>丙
B.t2℃时,甲、丙溶液的溶质质量分数相同
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,溶液仍然是饱和溶液
D.采取向溶液中加入适量甲物质的方法,可将组成在N点的甲溶液转变为M点的甲溶液
13.如图是甲、乙两种固体的溶解度曲线。下列说法错误的是
A.20℃时,甲、乙饱和溶液的溶质质量分数相等
B.30℃时,将40g的乙溶于50g水中所得溶液质量为90g
C.将30℃甲、乙等质量的饱和溶液分别降温至10℃,析出晶体较多的是乙溶液
D.乙中混有少量的甲,若提纯乙应采用的方法是降温结晶(冷却热饱和溶液)
14.溶液与人们的生活息息相关,下列关于溶液的说法正确的是
A.澄清石灰水是氢氧化钙的水溶液
B.饱和溶液一定是浓溶液
C.将100mL的生理盐水倒掉一半,剩余溶液的溶质质量分数减小一半
D.升高温度可以将硝酸钾的不饱和溶液变为饱和溶液
15.10℃时,50克水里最多溶解甲物质10克,10℃时100克水里最多溶解乙物质20克,则在10℃时甲、乙两物质的溶解度的关系为
A.甲>乙 B.甲=乙 C.甲<乙 D.无法确定
三、综合应用题
16.Ⅰ.已知硝酸钾和氯化铵在不同温度下的溶解度如下表所示,取其中一种固体做了如下实验:
温度℃ 0℃ 20℃ 40℃ 80℃
溶解度/g NH4Cl 29.4 37.2 45.8 65.6
KNO3 13.3 31.6 63.9 169
(1)由表中数据可知:溶解度随温度升高变化幅度较大的是 ;
(2)由②到③获得固体的的方法是 、过滤、洗涤、干燥;
(3)过滤要用到的玻璃仪器有: 、漏斗、烧杯;
(4)上图中的x是哪种固体 (填化学式);②是否是饱和溶液 (填“是”或“否”)。
Ⅱ.下图表示各物质之间的转化关系(部分反应物、生成物及反应条件已略)。已知A、B是常见黑色固体;D、F为金属;x是磁铁矿的主要成分,y是蓝色溶液。
(1)A、F分别为 、 (填化学式)。
(2)写出反应②的化学方程式 。
(3)反应⑤能发生的原因是 。
(4)上述反应中属于化合反应的有 (填序号)。
(5)列举E在生产生活中的用途 (任写一点)。
17.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 。该反应的方程式为 。
Ⅱ.电解水实验证明了水由 组成。
电解水过程中保持不变的微粒是 (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
18.高氯酸钠广泛用于火箭和火药工业。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含、两种杂质),以“精盐”为原料制备高氯酸铵()、高氯酸钠晶体()和相关副产品的生产流程如图19-7所示(资料:高氯酸钠在较高温度下容易分解;相关物质的溶解度曲线如图所示)
(1)步骤①中的X是步骤②的副产品经加工再利用的物质,其化学式是 ,步骤①中的副产品的一种用途是 ;步骤②的目的是 ;步骤③的目的是 .
(2)步骤⑥通入是为了除去溶液中少量的,并制得副产品新型自来水消毒剂,该反应的化学方程式为 。
(3)高氯酸铵()是复合火箭推进剂的重要成分,实验室可通过溶液和溶液在90℃条件下反应制取。若用浓氨水和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是 。
(4)步骤⑦分离出副产品芒硝()的实验操作依次为(填操作名称) ,干燥。
(5)步骤⑧反应得到的混合溶液中和的质量分数分别为0.30和0.15。从混合溶液中获得较多晶体的实验操作与步骤⑦相似,不同的是在干燥前要用冰水洗涤,其原因是 。
(6)获取时,“气流干燥”的温度应控制在75~95℃,其原因是 。
(7)根据绿色化学的理念,可以在该生产流程中再利用的物质有、、 (填化学式),该生产流程的优点除了有的物质可以再利用外,还有 。
参考答案:
1.AC
2.CD
3.AD
4.AD
5.BD
6.C
7.A
8.D
9.A
10.B
11.B
12.D
13.B
14.A
15.B
16. 硝酸钾(或KNO3) 降温结晶 玻璃棒 NH4Cl 否 C Fe C + 2CuO2Cu + CO2↑ 较活泼金属能把较不活泼的金属从它们化合物的溶液里置换出来(或者Fe的金属活动性强于Cu,可从硫酸铜溶液中将铜置换出来) ①③(完全正确才给分) 作燃料(或冶炼金属)
17. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
18. (或) 解除胃酸过多(或作阻燃剂) 除去和 除去和 浓氨水与浓盐酸反应放出热量 蒸发浓缩,冷却结晶,过滤,洗涤 0℃时的溶解度比的溶解度小很多,用冰水洗涤既可以洗去晶体表面的又能减小的溶解损失 温度过高,高氯酸钠晶体会失去结晶水或分解,温度过低,干燥不充分(或75~95℃,干燥充分且高氯酸钠晶体不会失去结晶水或分解) 原料便宜易得,副产品都是有用物质(或没有废物产生)
一、多选题
1.分类观是重要的化学学科思想之一,下列有关分类符合如图所示关系的是
A B C D
X 化合反应 天然气 饱和溶液 空气
Y 氧化反应 化石燃料 浓溶液 稀有气体
A.A B.B C.C D.D
2.下列说法正确的是
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.升高温度或增大压强均可以增大气体在水中的溶解度
C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水200g
D.在溶液中加入KNO3晶体和蒸发溶液中的水分这两种方法,都能把8%的KNO3溶液变成15%的KNO3溶液
3.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的饱和溶液
B.将c的饱和溶液变为不饱和溶液,可采用降温的方法
C.P点表示t1℃时,a、c两种物质的溶解度相等
D.t2℃时a、b、c三种物质的饱和溶液降温到t1℃时所得溶液溶质质量分数由大到小的顺序是b>a≥c
4.右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度受温度的影响变化不明显
B.KNO3的溶解度大于NaCl的溶解度
C.t1℃时,100g KNO3的饱和溶液中含有20 g KNO3
D.t2℃时,NaCl的饱和溶液与KNO3的饱和溶液中溶质的质量分数相等
5.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.阴影区域中,A、C均处于不饱和状态
B.除去A固体中含有的少量C杂质,可采用冷却热饱和溶液的方法提纯A
C.将A、B、C三种物质的饱和溶液从t1℃升温到t2℃时,溶质的质量分数大小关系为:A>B>C
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数为16.7%
二、选择题
6.如图是a、b、c 三种物质的溶解度曲线,下列说法正确的是( )
A.P点表示t1℃时,a、c两种物质的溶液的质量相等
B.由图可知,a、b两种物质的溶解度不可能相等
C.t2℃时,将等质量的a、b、c三种物质配制成饱和溶液,所需水的质量最少的为a
D.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,变为不饱和溶液的是a
7.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.20℃时,甲、乙都属于易溶物
B.40℃时,甲、乙饱和溶液所含溶质质量相等
C.50℃时,等质量的甲和乙饱和溶液中所含溶剂的质量甲>乙
D.将40℃时甲、乙饱和溶液降温到20℃,溶液的溶质质量分数甲>乙
8.化学实验常需要溶液,下列有关溶液的说法正确的是( )
A.汽油除去油污是利用了乳化原理
B.饱和溶液一定是浓溶液
C.氢氧化钠固体溶于水温度会降低
D.其它条件不变时,气体物质的溶解度随温度升高而降低
9.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.从乙溶液中获得乙晶体,常用蒸发结晶的方法
B.35℃时,30g甲加入50g水中,得到80g甲溶液
C.15℃时,甲和乙的饱和溶液中溶质质量相等
D.降低温度,甲溶液中溶质的质量分数一定减小
10.已知 A、B、C三种物质的溶解度曲线如图所示,下列说法错误的是
A.在阴影区域部分,处于不饱和状态的是B
B.将 t1℃时 B、C 的饱和溶液升温至 t2℃,所得溶液溶质的质量分数 B
D.向试管中滴入2 mL水后,若X中有固体析出,则 X为 C
11.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.物质a的溶解度大于物质c的溶解度
B.t1℃时,向60g物质a的饱和溶液中加入40g水,得到溶液的溶质质量分数为10%
C.将t3℃时a、b、c三种物质的饱和溶液降温至t2℃时,析出晶体质量最大的是物质a
D.t1℃时,将20g物质a加入100g水中,而后升温到t3℃,此时该溶液的溶质和溶剂的质量比为1:2
12.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1℃时,甲、乙、丙三种物质的溶解度大小顺序为:甲>乙>丙
B.t2℃时,甲、丙溶液的溶质质量分数相同
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,溶液仍然是饱和溶液
D.采取向溶液中加入适量甲物质的方法,可将组成在N点的甲溶液转变为M点的甲溶液
13.如图是甲、乙两种固体的溶解度曲线。下列说法错误的是
A.20℃时,甲、乙饱和溶液的溶质质量分数相等
B.30℃时,将40g的乙溶于50g水中所得溶液质量为90g
C.将30℃甲、乙等质量的饱和溶液分别降温至10℃,析出晶体较多的是乙溶液
D.乙中混有少量的甲,若提纯乙应采用的方法是降温结晶(冷却热饱和溶液)
14.溶液与人们的生活息息相关,下列关于溶液的说法正确的是
A.澄清石灰水是氢氧化钙的水溶液
B.饱和溶液一定是浓溶液
C.将100mL的生理盐水倒掉一半,剩余溶液的溶质质量分数减小一半
D.升高温度可以将硝酸钾的不饱和溶液变为饱和溶液
15.10℃时,50克水里最多溶解甲物质10克,10℃时100克水里最多溶解乙物质20克,则在10℃时甲、乙两物质的溶解度的关系为
A.甲>乙 B.甲=乙 C.甲<乙 D.无法确定
三、综合应用题
16.Ⅰ.已知硝酸钾和氯化铵在不同温度下的溶解度如下表所示,取其中一种固体做了如下实验:
温度℃ 0℃ 20℃ 40℃ 80℃
溶解度/g NH4Cl 29.4 37.2 45.8 65.6
KNO3 13.3 31.6 63.9 169
(1)由表中数据可知:溶解度随温度升高变化幅度较大的是 ;
(2)由②到③获得固体的的方法是 、过滤、洗涤、干燥;
(3)过滤要用到的玻璃仪器有: 、漏斗、烧杯;
(4)上图中的x是哪种固体 (填化学式);②是否是饱和溶液 (填“是”或“否”)。
Ⅱ.下图表示各物质之间的转化关系(部分反应物、生成物及反应条件已略)。已知A、B是常见黑色固体;D、F为金属;x是磁铁矿的主要成分,y是蓝色溶液。
(1)A、F分别为 、 (填化学式)。
(2)写出反应②的化学方程式 。
(3)反应⑤能发生的原因是 。
(4)上述反应中属于化合反应的有 (填序号)。
(5)列举E在生产生活中的用途 (任写一点)。
17.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 。该反应的方程式为 。
Ⅱ.电解水实验证明了水由 组成。
电解水过程中保持不变的微粒是 (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
18.高氯酸钠广泛用于火箭和火药工业。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含、两种杂质),以“精盐”为原料制备高氯酸铵()、高氯酸钠晶体()和相关副产品的生产流程如图19-7所示(资料:高氯酸钠在较高温度下容易分解;相关物质的溶解度曲线如图所示)
(1)步骤①中的X是步骤②的副产品经加工再利用的物质,其化学式是 ,步骤①中的副产品的一种用途是 ;步骤②的目的是 ;步骤③的目的是 .
(2)步骤⑥通入是为了除去溶液中少量的,并制得副产品新型自来水消毒剂,该反应的化学方程式为 。
(3)高氯酸铵()是复合火箭推进剂的重要成分,实验室可通过溶液和溶液在90℃条件下反应制取。若用浓氨水和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是 。
(4)步骤⑦分离出副产品芒硝()的实验操作依次为(填操作名称) ,干燥。
(5)步骤⑧反应得到的混合溶液中和的质量分数分别为0.30和0.15。从混合溶液中获得较多晶体的实验操作与步骤⑦相似,不同的是在干燥前要用冰水洗涤,其原因是 。
(6)获取时,“气流干燥”的温度应控制在75~95℃,其原因是 。
(7)根据绿色化学的理念,可以在该生产流程中再利用的物质有、、 (填化学式),该生产流程的优点除了有的物质可以再利用外,还有 。
参考答案:
1.AC
2.CD
3.AD
4.AD
5.BD
6.C
7.A
8.D
9.A
10.B
11.B
12.D
13.B
14.A
15.B
16. 硝酸钾(或KNO3) 降温结晶 玻璃棒 NH4Cl 否 C Fe C + 2CuO2Cu + CO2↑ 较活泼金属能把较不活泼的金属从它们化合物的溶液里置换出来(或者Fe的金属活动性强于Cu,可从硫酸铜溶液中将铜置换出来) ①③(完全正确才给分) 作燃料(或冶炼金属)
17. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
18. (或) 解除胃酸过多(或作阻燃剂) 除去和 除去和 浓氨水与浓盐酸反应放出热量 蒸发浓缩,冷却结晶,过滤,洗涤 0℃时的溶解度比的溶解度小很多,用冰水洗涤既可以洗去晶体表面的又能减小的溶解损失 温度过高,高氯酸钠晶体会失去结晶水或分解,温度过低,干燥不充分(或75~95℃,干燥充分且高氯酸钠晶体不会失去结晶水或分解) 原料便宜易得,副产品都是有用物质(或没有废物产生)
