2023—2024学年沪教版(全国)化学九年级下册第7章 应用广泛的酸、碱、盐 分层题(含答案)
文档属性
| 名称 | 2023—2024学年沪教版(全国)化学九年级下册第7章 应用广泛的酸、碱、盐 分层题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 285.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-18 15:17:25 | ||
图片预览

文档简介
2023—2024学年沪教版(全国)化学九年级下册第7章 应用广泛的酸、碱、盐 分层题附答案
一、选择题。
1、(双选)某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
2、将下列几种物质分别投入稀盐酸中,能发生化学反应但无气泡产生的是( )
A.Cu B.Al C.Fe D.Fe2O3
3、下列物质敞口放置在空中质量增大且变质的是( )
A.浓盐酸 B.浓硫酸 C.烧碱 D.食盐水
4、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
5、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
6、下列常见物质显碱性的是( )
A.食醋 B.食盐水 C.肥皂水 D.柠檬水
7、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
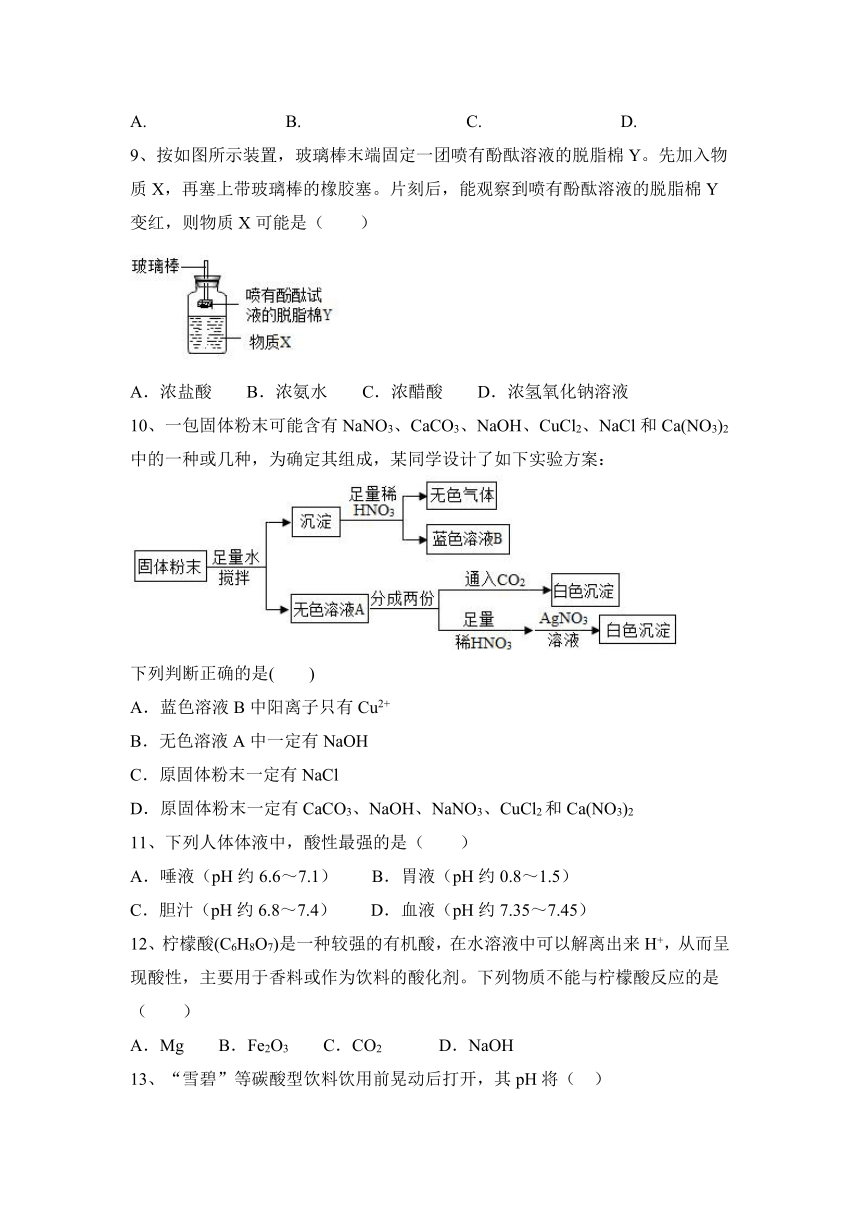
8、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
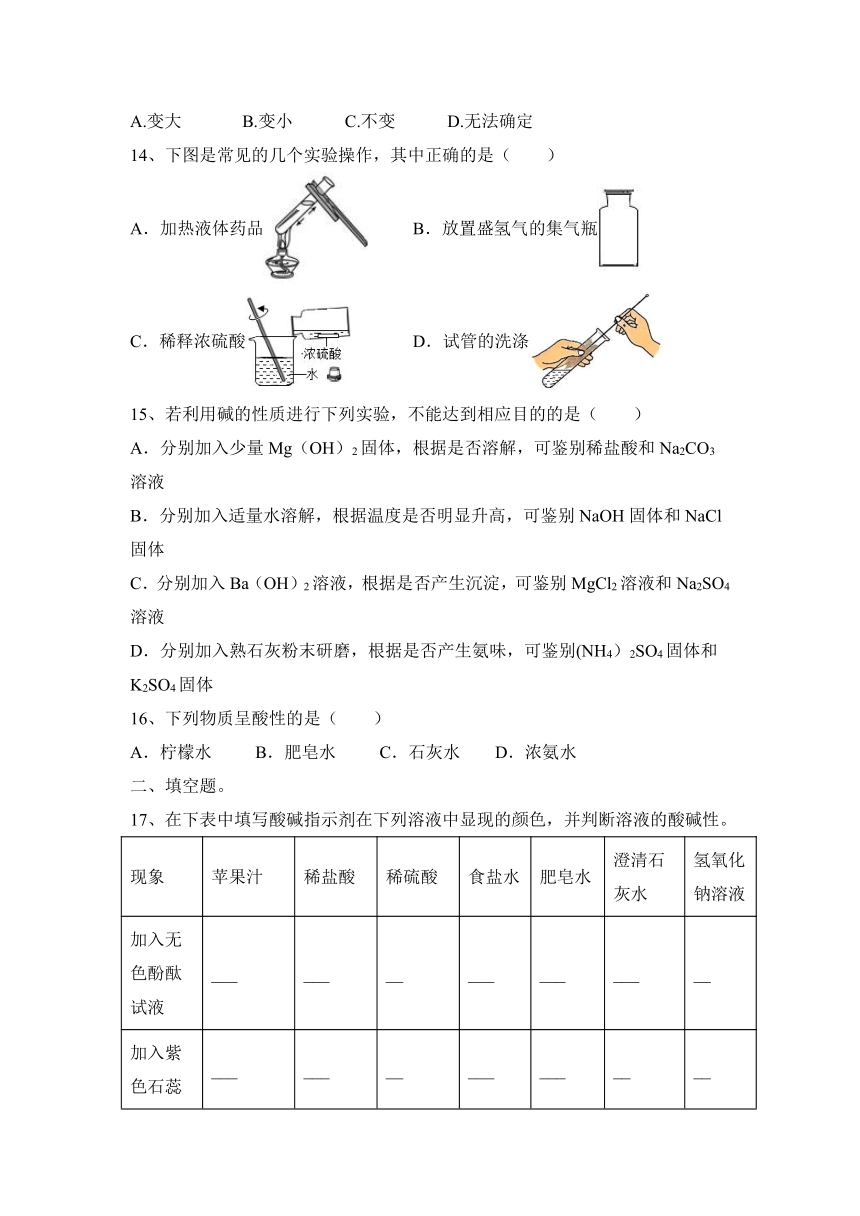
9、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
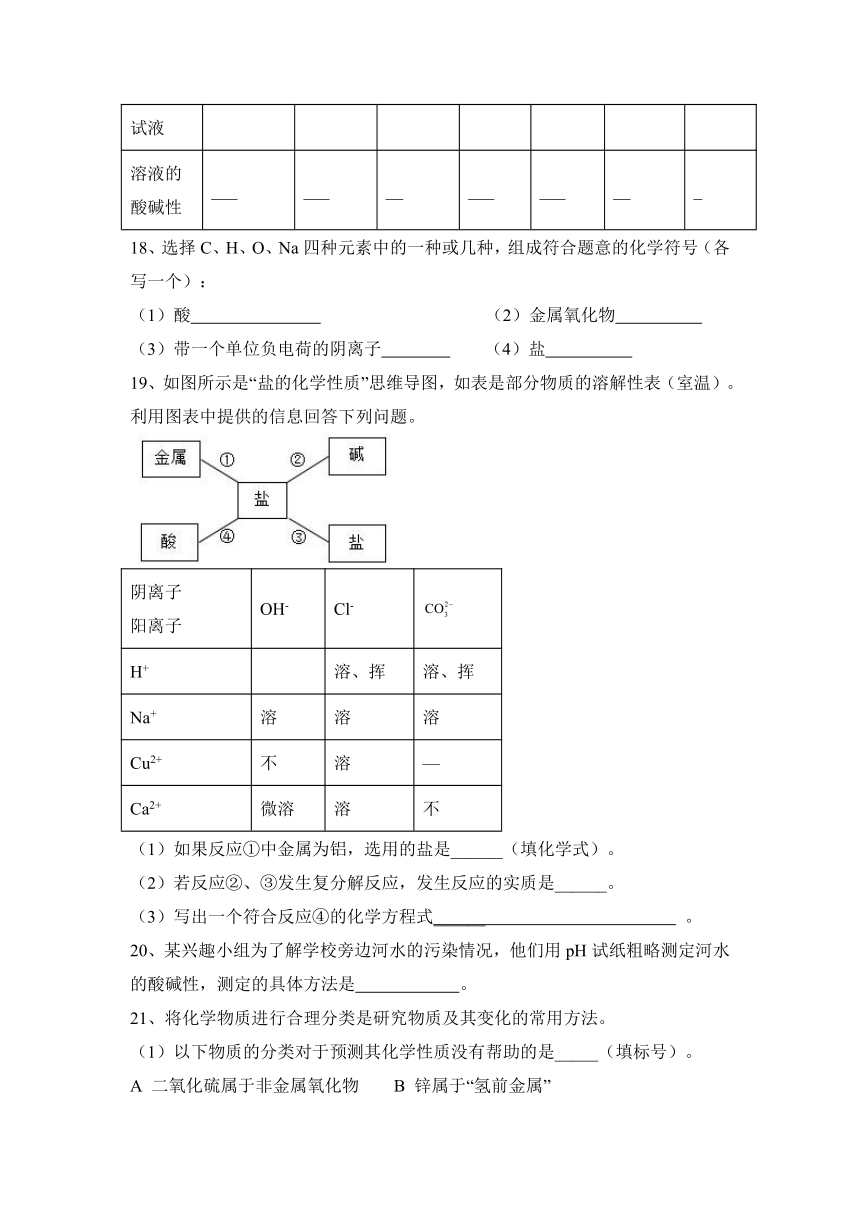
10、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
11、下列人体体液中,酸性最强的是( )
A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4) D.血液(pH约7.35~7.45)
12、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
13、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
14、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
15、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
16、下列物质呈酸性的是( )
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
二、填空题。
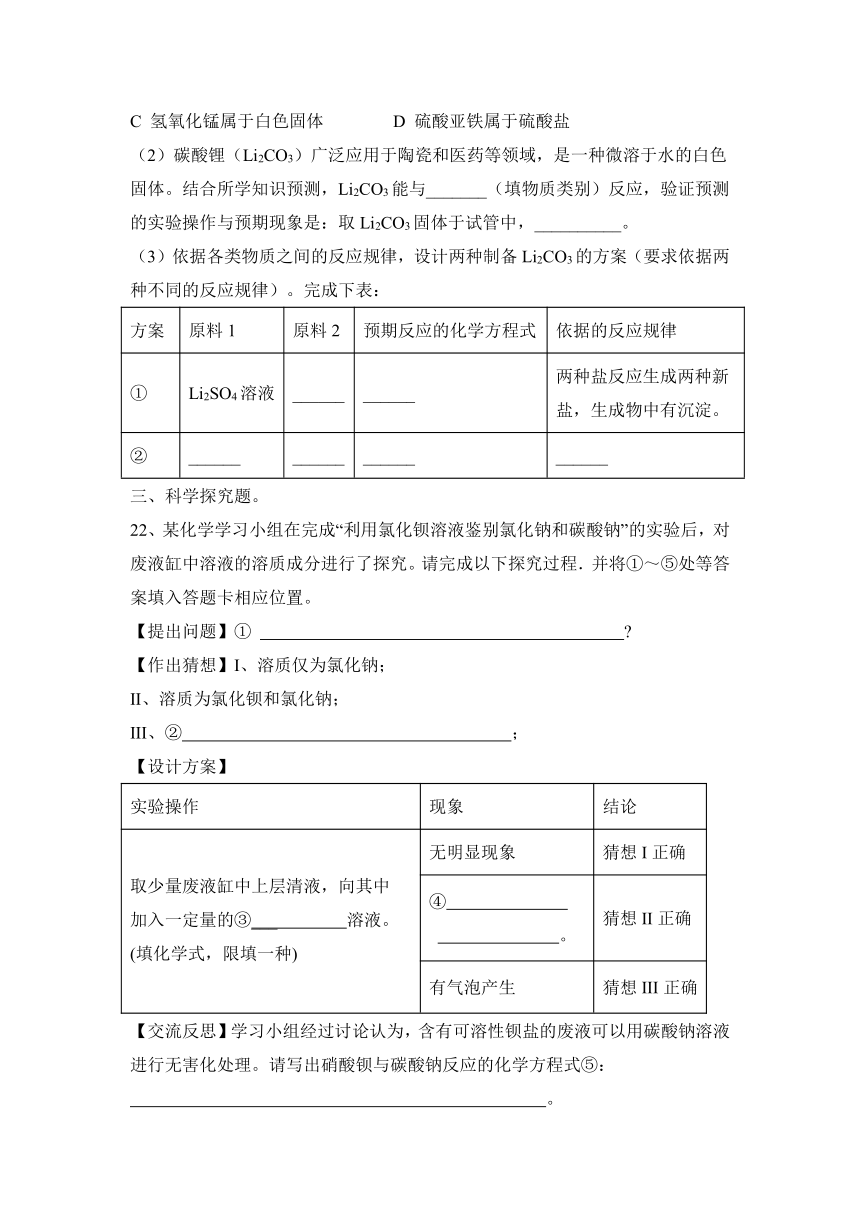
17、在下表中填写酸碱指示剂在下列溶液中显现的颜色,并判断溶液的酸碱性。
现象 苹果汁 稀盐酸 稀硫酸 食盐水 肥皂水 澄清石灰水 氢氧化钠溶液
加入无色酚酞试液 ___ ___ __ ___ ___ ___ __
加入紫色石蕊试液 ___ ___ __ ___ ___ __ __
溶液的酸碱性 ___ ___ __ ___ ___ __ _
18、选择C、H、O、Na四种元素中的一种或几种,组成符合题意的化学符号(各写一个):
(1)酸 (2)金属氧化物
(3)带一个单位负电荷的阴离子 (4)盐
19、如图所示是“盐的化学性质”思维导图,如表是部分物质的溶解性表(室温)。利用图表中提供的信息回答下列问题。
阴离子阳离子 OH- Cl-
H+ 溶、挥 溶、挥
Na+ 溶 溶 溶
Cu2+ 不 溶 —
Ca2+ 微溶 溶 不
(1)如果反应①中金属为铝,选用的盐是______(填化学式)。
(2)若反应②、③发生复分解反应,发生反应的实质是______。
(3)写出一个符合反应④的化学方程式______ 。
20、某兴趣小组为了解学校旁边河水的污染情况,他们用pH试纸粗略测定河水的酸碱性,测定的具体方法是 。
21、将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____(填标号)。
A 二氧化硫属于非金属氧化物 B 锌属于“氢前金属”
C 氢氧化锰属于白色固体 D 硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与_______(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,__________。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 ______ ______ 两种盐反应生成两种新盐,生成物中有沉淀。
② ______ ______ ______ ______
三、科学探究题。
22、某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程.并将①~⑤处等答案填入答题卡相应位置。
【提出问题】①
【作出猜想】I、溶质仅为氯化钠;
II、溶质为氯化钡和氯化钠;
III、② ;
【设计方案】
实验操作 现象 结论
取少量废液缸中上层清液,向其中加入一定量的③___ 溶液。(填化学式,限填一种) 无明显现象 猜想I正确
④ 。 猜想II正确
有气泡产生 猜想III正确
【交流反思】学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式⑤:
。
四、综合应用题。
23、氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
五、计算题。
24、某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
2023—2024学年沪教版(全国)化学九年级下册第7章 应用广泛的酸、碱、盐 分层题附答案
一、选择题。
1、(双选)某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
【答案】B D
2、将下列几种物质分别投入稀盐酸中,能发生化学反应但无气泡产生的是( )
A.Cu B.Al C.Fe D.Fe2O3
【答案】D
3、下列物质敞口放置在空中质量增大且变质的是( )
A.浓盐酸 B.浓硫酸 C.烧碱 D.食盐水
【答案】C
4、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
【答案】B
5、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
【答案】C
6、下列常见物质显碱性的是( )
A.食醋 B.食盐水 C.肥皂水 D.柠檬水
【答案】C
7、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
8、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
【答案】D
9、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
【答案】B
10、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
11、下列人体体液中,酸性最强的是( )
A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4) D.血液(pH约7.35~7.45)
【答案】B
12、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
13、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
【答案】A
14、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
【答案】D
15、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
【答案】C
16、下列物质呈酸性的是( )
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
【答案】A
二、填空题。
17、在下表中填写酸碱指示剂在下列溶液中显现的颜色,并判断溶液的酸碱性。
现象 苹果汁 稀盐酸 稀硫酸 食盐水 肥皂水 澄清石灰水 氢氧化钠溶液
加入无色酚酞试液 ___ ___ __ ___ ___ ___ __
加入紫色石蕊试液 ___ ___ __ ___ ___ __ __
溶液的酸碱性 ___ ___ __ ___ ___ __ _
【答案】(1)无色 无色 无色 无色 红色 红色 红色
(2) 红色 红色 红色 紫色 蓝色 蓝色 蓝色 酸性
(3)酸性 酸性 中性 碱性 碱性 碱性
18、选择C、H、O、Na四种元素中的一种或几种,组成符合题意的化学符号(各写一个):
(1)酸 (2)金属氧化物
(3)带一个单位负电荷的阴离子 (4)盐
【答案】(1)H2CO3 (2)Na2O (3)OH- (4)Na2CO3
19、如图所示是“盐的化学性质”思维导图,如表是部分物质的溶解性表(室温)。利用图表中提供的信息回答下列问题。
阴离子阳离子 OH- Cl-
H+ 溶、挥 溶、挥
Na+ 溶 溶 溶
Cu2+ 不 溶 —
Ca2+ 微溶 溶 不
(1)如果反应①中金属为铝,选用的盐是______(填化学式)。
(2)若反应②、③发生复分解反应,发生反应的实质是______。
(3)写出一个符合反应④的化学方程式______ 。
【答案】(1) CuCl2 (2) 两种物质相互交换成分,有沉淀生成
(3)
20、某兴趣小组为了解学校旁边河水的污染情况,他们用pH试纸粗略测定河水的酸碱性,测定的具体方法是 。
【答案】在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取河水滴在pH试纸上,将显示的颜色与标准比色卡对照,读出数值
21、将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____(填标号)。
A 二氧化硫属于非金属氧化物 B 锌属于“氢前金属”
C 氢氧化锰属于白色固体 D 硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与_______(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,__________。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 ______ ______ 两种盐反应生成两种新盐,生成物中有沉淀。
② ______ ______ ______ ______
【答案】 (1)C
(2)酸 加入足量的稀盐酸,固体逐渐消失,产生气泡(合理即可)
(3)Na2CO3溶液 Li2SO4+ Na2CO3= Li2CO3↓+ Na2SO4
LiOH溶液 CO2 2LiOH + CO2= Li2CO3↓+ H2O
非金属氧化物能与碱溶液反应生成盐和水(最后四空,答案合理即可)
三、科学探究题。
22、某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程.并将①~⑤处等答案填入答题卡相应位置。
【提出问题】①
【作出猜想】I、溶质仅为氯化钠;
II、溶质为氯化钡和氯化钠;
III、② ;
【设计方案】
实验操作 现象 结论
取少量废液缸中上层清液,向其中加入一定量的③___ 溶液。(填化学式,限填一种) 无明显现象 猜想I正确
④ 。 猜想II正确
有气泡产生 猜想III正确
【交流反思】学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式⑤:
。
【答案】废液缸中溶液的溶质是什么? 溶质为氯化钠和碳酸钠
H2SO4 有白色沉淀产生 Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
四、综合应用题。
23、氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
【答案】(1)分解 (2)A
(3) NaCl、CuCl2 生成蓝色沉淀 设反应生成NaCl的质量为x,Cu(OH)2的质量为y。
解得: x=11.7g
解得: y=9.8g
则此时所得不饱和溶液中溶质的质量分数为:。
五、计算题。
24、某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
【答案】16%
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
一、选择题。
1、(双选)某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
2、将下列几种物质分别投入稀盐酸中,能发生化学反应但无气泡产生的是( )
A.Cu B.Al C.Fe D.Fe2O3
3、下列物质敞口放置在空中质量增大且变质的是( )
A.浓盐酸 B.浓硫酸 C.烧碱 D.食盐水
4、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
5、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
6、下列常见物质显碱性的是( )
A.食醋 B.食盐水 C.肥皂水 D.柠檬水
7、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
8、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
9、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
10、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
11、下列人体体液中,酸性最强的是( )
A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4) D.血液(pH约7.35~7.45)
12、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
13、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
14、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
15、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
16、下列物质呈酸性的是( )
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
二、填空题。
17、在下表中填写酸碱指示剂在下列溶液中显现的颜色,并判断溶液的酸碱性。
现象 苹果汁 稀盐酸 稀硫酸 食盐水 肥皂水 澄清石灰水 氢氧化钠溶液
加入无色酚酞试液 ___ ___ __ ___ ___ ___ __
加入紫色石蕊试液 ___ ___ __ ___ ___ __ __
溶液的酸碱性 ___ ___ __ ___ ___ __ _
18、选择C、H、O、Na四种元素中的一种或几种,组成符合题意的化学符号(各写一个):
(1)酸 (2)金属氧化物
(3)带一个单位负电荷的阴离子 (4)盐
19、如图所示是“盐的化学性质”思维导图,如表是部分物质的溶解性表(室温)。利用图表中提供的信息回答下列问题。
阴离子阳离子 OH- Cl-
H+ 溶、挥 溶、挥
Na+ 溶 溶 溶
Cu2+ 不 溶 —
Ca2+ 微溶 溶 不
(1)如果反应①中金属为铝,选用的盐是______(填化学式)。
(2)若反应②、③发生复分解反应,发生反应的实质是______。
(3)写出一个符合反应④的化学方程式______ 。
20、某兴趣小组为了解学校旁边河水的污染情况,他们用pH试纸粗略测定河水的酸碱性,测定的具体方法是 。
21、将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____(填标号)。
A 二氧化硫属于非金属氧化物 B 锌属于“氢前金属”
C 氢氧化锰属于白色固体 D 硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与_______(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,__________。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 ______ ______ 两种盐反应生成两种新盐,生成物中有沉淀。
② ______ ______ ______ ______
三、科学探究题。
22、某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程.并将①~⑤处等答案填入答题卡相应位置。
【提出问题】①
【作出猜想】I、溶质仅为氯化钠;
II、溶质为氯化钡和氯化钠;
III、② ;
【设计方案】
实验操作 现象 结论
取少量废液缸中上层清液,向其中加入一定量的③___ 溶液。(填化学式,限填一种) 无明显现象 猜想I正确
④ 。 猜想II正确
有气泡产生 猜想III正确
【交流反思】学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式⑤:
。
四、综合应用题。
23、氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
五、计算题。
24、某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
2023—2024学年沪教版(全国)化学九年级下册第7章 应用广泛的酸、碱、盐 分层题附答案
一、选择题。
1、(双选)某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
【答案】B D
2、将下列几种物质分别投入稀盐酸中,能发生化学反应但无气泡产生的是( )
A.Cu B.Al C.Fe D.Fe2O3
【答案】D
3、下列物质敞口放置在空中质量增大且变质的是( )
A.浓盐酸 B.浓硫酸 C.烧碱 D.食盐水
【答案】C
4、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
【答案】B
5、下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
【答案】C
6、下列常见物质显碱性的是( )
A.食醋 B.食盐水 C.肥皂水 D.柠檬水
【答案】C
7、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
8、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
【答案】D
9、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
【答案】B
10、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
11、下列人体体液中,酸性最强的是( )
A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4) D.血液(pH约7.35~7.45)
【答案】B
12、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
13、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
【答案】A
14、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
【答案】D
15、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
【答案】C
16、下列物质呈酸性的是( )
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
【答案】A
二、填空题。
17、在下表中填写酸碱指示剂在下列溶液中显现的颜色,并判断溶液的酸碱性。
现象 苹果汁 稀盐酸 稀硫酸 食盐水 肥皂水 澄清石灰水 氢氧化钠溶液
加入无色酚酞试液 ___ ___ __ ___ ___ ___ __
加入紫色石蕊试液 ___ ___ __ ___ ___ __ __
溶液的酸碱性 ___ ___ __ ___ ___ __ _
【答案】(1)无色 无色 无色 无色 红色 红色 红色
(2) 红色 红色 红色 紫色 蓝色 蓝色 蓝色 酸性
(3)酸性 酸性 中性 碱性 碱性 碱性
18、选择C、H、O、Na四种元素中的一种或几种,组成符合题意的化学符号(各写一个):
(1)酸 (2)金属氧化物
(3)带一个单位负电荷的阴离子 (4)盐
【答案】(1)H2CO3 (2)Na2O (3)OH- (4)Na2CO3
19、如图所示是“盐的化学性质”思维导图,如表是部分物质的溶解性表(室温)。利用图表中提供的信息回答下列问题。
阴离子阳离子 OH- Cl-
H+ 溶、挥 溶、挥
Na+ 溶 溶 溶
Cu2+ 不 溶 —
Ca2+ 微溶 溶 不
(1)如果反应①中金属为铝,选用的盐是______(填化学式)。
(2)若反应②、③发生复分解反应,发生反应的实质是______。
(3)写出一个符合反应④的化学方程式______ 。
【答案】(1) CuCl2 (2) 两种物质相互交换成分,有沉淀生成
(3)
20、某兴趣小组为了解学校旁边河水的污染情况,他们用pH试纸粗略测定河水的酸碱性,测定的具体方法是 。
【答案】在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取河水滴在pH试纸上,将显示的颜色与标准比色卡对照,读出数值
21、将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是_____(填标号)。
A 二氧化硫属于非金属氧化物 B 锌属于“氢前金属”
C 氢氧化锰属于白色固体 D 硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与_______(填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中,__________。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成下表:
方案 原料1 原料2 预期反应的化学方程式 依据的反应规律
① Li2SO4溶液 ______ ______ 两种盐反应生成两种新盐,生成物中有沉淀。
② ______ ______ ______ ______
【答案】 (1)C
(2)酸 加入足量的稀盐酸,固体逐渐消失,产生气泡(合理即可)
(3)Na2CO3溶液 Li2SO4+ Na2CO3= Li2CO3↓+ Na2SO4
LiOH溶液 CO2 2LiOH + CO2= Li2CO3↓+ H2O
非金属氧化物能与碱溶液反应生成盐和水(最后四空,答案合理即可)
三、科学探究题。
22、某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程.并将①~⑤处等答案填入答题卡相应位置。
【提出问题】①
【作出猜想】I、溶质仅为氯化钠;
II、溶质为氯化钡和氯化钠;
III、② ;
【设计方案】
实验操作 现象 结论
取少量废液缸中上层清液,向其中加入一定量的③___ 溶液。(填化学式,限填一种) 无明显现象 猜想I正确
④ 。 猜想II正确
有气泡产生 猜想III正确
【交流反思】学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式⑤:
。
【答案】废液缸中溶液的溶质是什么? 溶质为氯化钠和碳酸钠
H2SO4 有白色沉淀产生 Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
四、综合应用题。
23、氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
【答案】(1)分解 (2)A
(3) NaCl、CuCl2 生成蓝色沉淀 设反应生成NaCl的质量为x,Cu(OH)2的质量为y。
解得: x=11.7g
解得: y=9.8g
则此时所得不饱和溶液中溶质的质量分数为:。
五、计算题。
24、某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
【答案】16%
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
