第六章 溶解现象 达标检测卷 (含解析)沪教版九年级化学下册
文档属性
| 名称 | 第六章 溶解现象 达标检测卷 (含解析)沪教版九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 202.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-19 16:22:24 | ||
图片预览


文档简介
第六章 溶解现象 达标检测卷 沪教版九年级化学下册
一、单选题
1.下列固体物质加入适量水中,溶液的温度明显降低的是( )
A. B. C. D.
2.下列物质放入水中,能形成溶液的是( )
A.蔗糖 B.植物油 C.泥土 D.面粉
3.全面推进乡村振兴,大力发展农业生产,农业上常用溶质质量分数为16%的氯化钠溶液来选种。下列有关溶液的说法正确的是( )
A.溶液是混合物 B.溶液一定是无色的
C.均一、稳定的液体一定是溶液 D.植物油和水可以形成溶液
4.关于生活中的化学,下列说法正确的是( )
A.室内起火时立即打开所有门窗
B.用水灭火时降低了可燃物的着火点
C.喝汽水打嗝时因为压强增大气体溶解度减小
D.硝酸铵溶于水制成的冰袋可用于给高烧病人降温
5.向盛有等量水的三个烧杯中分别加入某固体物质10g、25g、25g,如图甲所示是充分溶解后的现象,如图乙所示是该固体物质和另一种固体物质的溶解度曲线。
下列有关说法正确的是( )
A.三个烧杯中形成的溶液都是饱和溶液
B.t1℃时,X、Y溶液中溶质的质量分数相等
C.Y代表该固体物质,X代表另一种固体物质
D.分别将100gX、Y的饱和溶液从t2℃降温到t1℃,所得到的溶液质量:Y>X
6.下列关于溶液的说法正确的是( )
A.降低温度一定可以使不饱和溶液变为饱和溶液
B.硫酸铜溶液中,溶质是硫酸铜,溶剂是水
C.洗洁精去除油污的原理是将油污溶解
D.饱和溶液不能再溶解任何物质
7.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示,甲乙对应的溶解度曲线如图二所示。下列说法错误的( )
A.图一烧杯中的溶液一定属于饱和溶液的是B
B.在图二中,能表示NaNO3溶解度曲线的是甲
C.将甲的饱和溶液从t2℃降温到t1℃,乙的饱和溶液从t1℃升温到t2℃,两溶液析出晶体质量可能相等
D.依据图二的分析判断,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的溶质的质量分数:甲=乙
8.下列生活中常见的物质属于溶液的是( )
A.碘酒 B.冰水混合物
C.刚刚配置的波尔多液 D.液氧
9.如图是 MgCl2、KCl、MgSO4的溶解度曲线,下列说法中正确的是( )
A.P 点表示 KCl 与 MgSO4溶解度相等
B.在 t2℃时,向 40g 的 MgCl2中加入 50g 水,充分溶解后,所得溶液的质量为 90g
C.将 t2℃时 KCl 和 MgSO4的饱和溶液升温至 t3℃时,所得溶液中溶质质量分数由大到小的关系是 KCl>MgSO4
D.只能通过降温结晶的方法,获得 MgCl2晶体
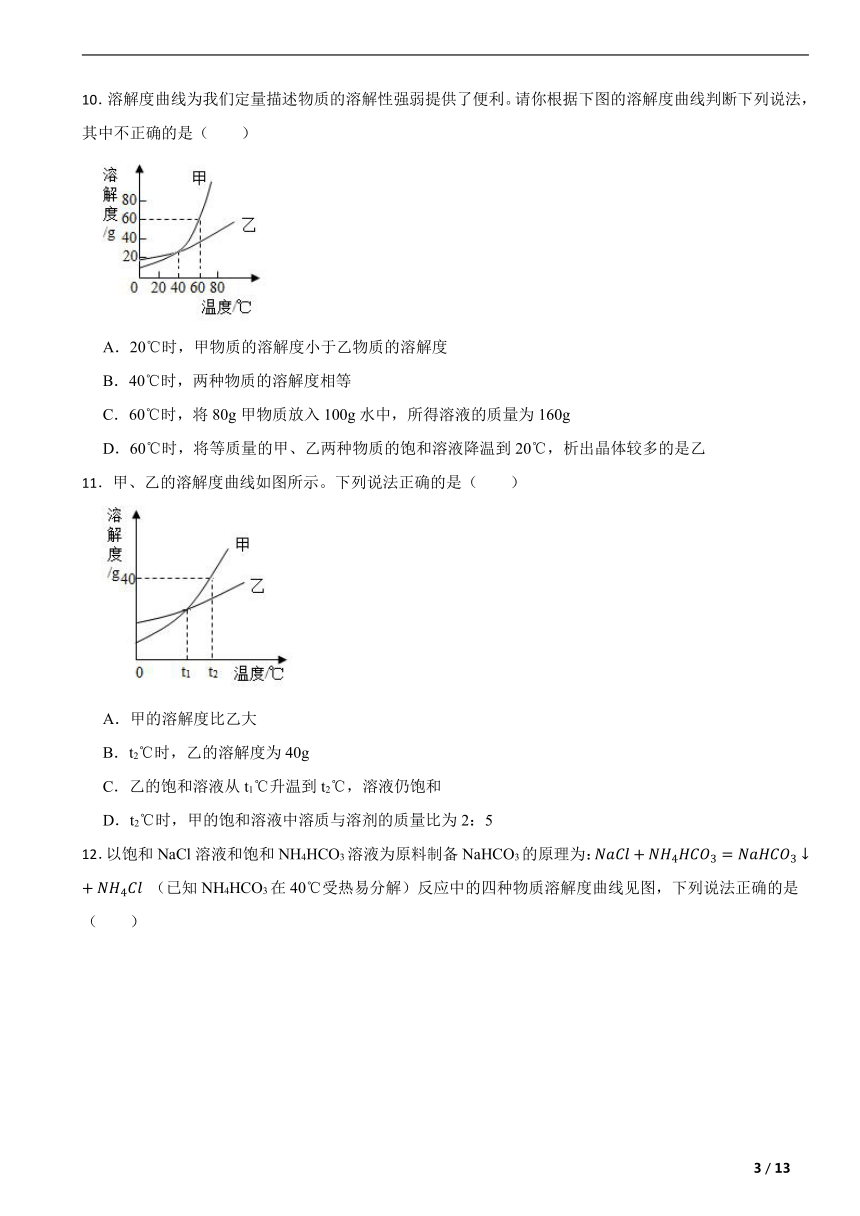
10.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线判断下列说法,其中不正确的是( )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
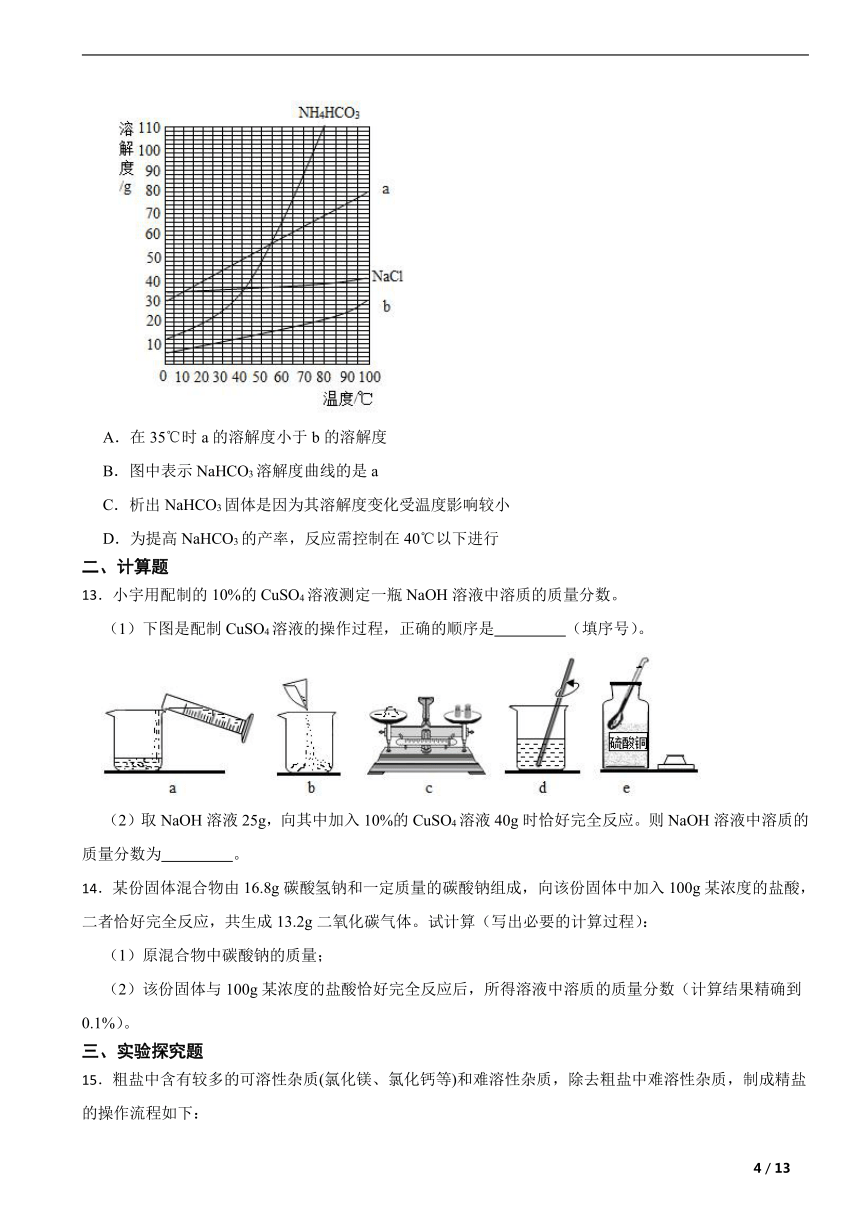
11.甲、乙的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.t2℃时,乙的溶解度为40g
C.乙的饱和溶液从t1℃升温到t2℃,溶液仍饱和
D.t2℃时,甲的饱和溶液中溶质与溶剂的质量比为2:5
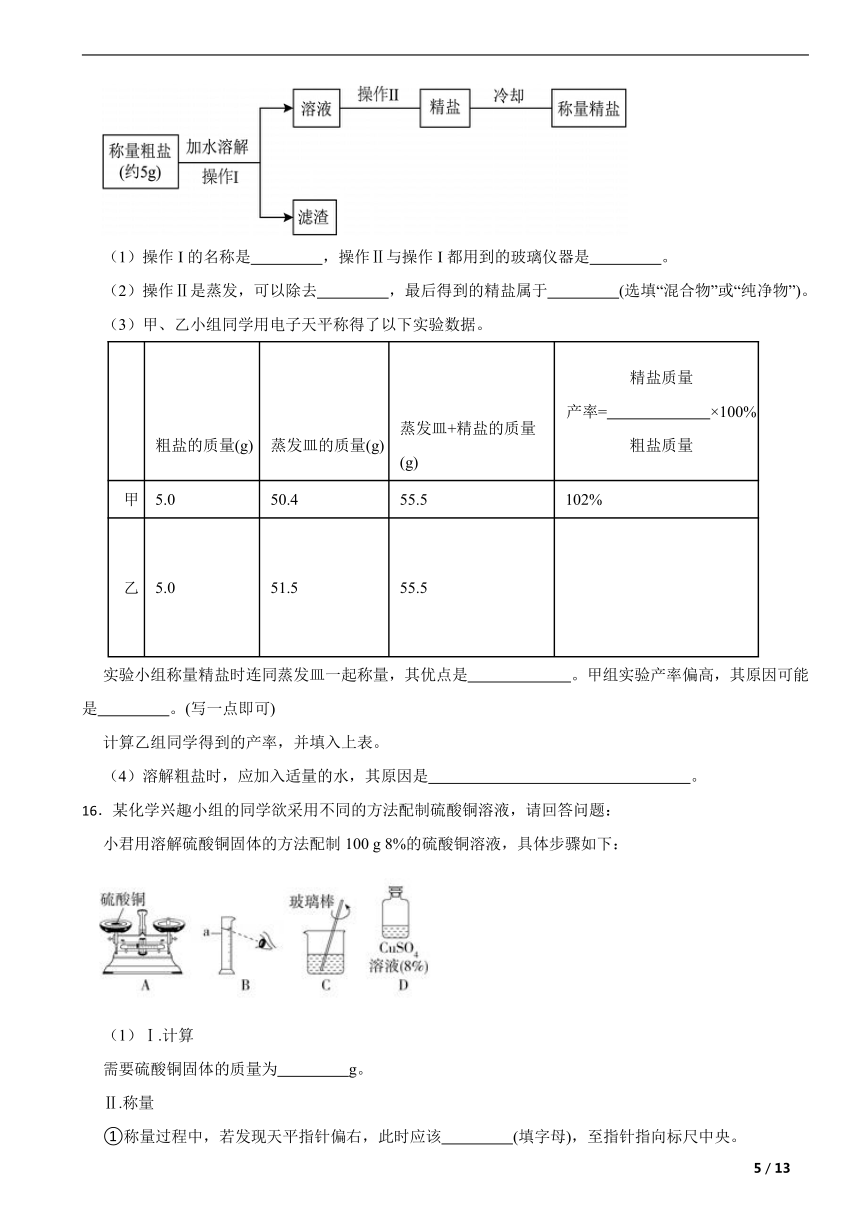
12.以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为: (已知NH4HCO3在40℃受热易分解)反应中的四种物质溶解度曲线见图,下列说法正确的是( )
A.在35℃时a的溶解度小于b的溶解度
B.图中表示NaHCO3溶解度曲线的是a
C.析出NaHCO3固体是因为其溶解度变化受温度影响较小
D.为提高NaHCO3的产率,反应需控制在40℃以下进行
二、计算题
13.小宇用配制的10%的CuSO4溶液测定一瓶NaOH溶液中溶质的质量分数。
(1)下图是配制CuSO4溶液的操作过程,正确的顺序是 (填序号)。
(2)取NaOH溶液25g,向其中加入10%的CuSO4溶液40g时恰好完全反应。则NaOH溶液中溶质的质量分数为 。
14.某份固体混合物由16.8g碳酸氢钠和一定质量的碳酸钠组成,向该份固体中加入100g某浓度的盐酸,二者恰好完全反应,共生成13.2g二氧化碳气体。试计算(写出必要的计算过程):
(1)原混合物中碳酸钠的质量;
(2)该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数(计算结果精确到0.1%)。
三、实验探究题
15.粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和难溶性杂质,除去粗盐中难溶性杂质,制成精盐的操作流程如下:
(1)操作I的名称是 ,操作Ⅱ与操作I都用到的玻璃仪器是 。
(2)操作Ⅱ是蒸发,可以除去 ,最后得到的精盐属于 (选填“混合物”或“纯净物”)。
(3)甲、乙小组同学用电子天平称得了以下实验数据。
粗盐的质量(g)
蒸发皿的质量(g)
蒸发皿+精盐的质量(g) 精盐质量 产率= ×100% 粗盐质量
甲 5.0 50.4 55.5 102%
乙 5.0 51.5 55.5
实验小组称量精盐时连同蒸发皿一起称量,其优点是 。甲组实验产率偏高,其原因可能是 。(写一点即可)
计算乙组同学得到的产率,并填入上表。
(4)溶解粗盐时,应加入适量的水,其原因是 。
16.某化学兴趣小组的同学欲采用不同的方法配制硫酸铜溶液,请回答问题:
小君用溶解硫酸铜固体的方法配制100 g 8%的硫酸铜溶液,具体步骤如下:
(1)Ⅰ.计算
需要硫酸铜固体的质量为 g。
Ⅱ.称量
①称量过程中,若发现天平指针偏右,此时应该 (填字母),至指针指向标尺中央。
A.调节游码和砝码
B.调节平衡螺母
C.减少硫酸铜固体
D.增加硫酸铜固体
②量取水时,如果按照B的方式读数,会使配制的溶液的溶质质量分数 (填“偏大”或“偏小”)。
Ⅲ.溶解
Ⅳ.装瓶,贴标签
(2)小东用溶液稀释的方法配制100 g 8%的硫酸铜溶液,需要 20%的硫酸铜溶液(密度为1.16 g/mL)的体积为 (列出计算式即可),需要加入水的体积为 mL。
答案解析部分
1.【答案】A
【解析】【解答】A、硝酸铵溶解吸热,溶于水后溶液温度明显降低,符合题意;
B、氧化钙放入水中会与水反应生成氢氧化钙,同时放热,不符合题意;
C、氯化钠放入水中溶液温度无明显变化,不符合题意;
D、氢氧化钠溶解放热,放入水中溶液温度明显升高,不符合题意;
故答案选:A。
【分析】A、根据硝酸铵溶解吸热分析;
B、根据氧化钙与水反应放热分析;
C、根据氯化钠溶解温度无明显变化分析;
D、根据氢氧化钠溶解放热分析。
2.【答案】A
【解析】【解答】A、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故符合题意;
B、植物油不溶于水,与水混合形成的是乳浊液,不是溶液,故不符合题意;
C、泥沙不溶于水,与水混合形成的是悬浊液,不是溶液,故不符合题意;
D、面粉不溶于水,与水混合形成的是悬浊液,不是溶液,故不符合题意;
故答案为:A。
【分析】溶液是指在一定条件下溶质分散到溶剂中形成的均一稳定的混合物。
3.【答案】A
【解析】【解答】A.溶液是均一、稳定的混合物,符合题意。
B.溶液不一定是无色的,比如硫酸铜溶液为蓝色,选项不符合题意。
C.均一、稳定的液体不一定是溶液,比如水,选项不符合题意。
D.植物油和水不可以形成溶液,只能形成乳浊液,选项不符合题意。
故答案为:A。
【分析】A.溶液中含有溶质和溶剂,最少含有两种物质,属于混合物;
B.溶液可以有颜色;
C.均一、稳定的混合物才是溶液;
D.植物油不溶于水。
4.【答案】D
【解析】【解答】A. 室内着火时打开门窗,能形成空气对流,增加氧气,加剧燃烧,故不符合题意;
B. 可燃物的着火点一般不会改变,用水灭火时将可燃物的温度降到着火点以下,故不符合题意;
C. 喝了汽水会打嗝,是因为温度升高,气体的溶解度减小的缘故,故不符合题意;
D. 硝酸铵溶于水时吸热,使温度降低,制成的冰袋可用于给发烧病人降温,故符合题意。
故答案为:D。
【分析】A、室内着火时打开门窗,增加氧气,会加剧燃烧。
B、可燃物的着火点一般不会改变,是物质的固有属性。
C、温度升高,气体的溶解度会减小。
D、硝酸铵溶于水时会吸热。
5.【答案】D
【解析】【解答】A、由于①③烧杯中没有未溶解的固体存在,不能确定能否再溶解该物质,所以不能确定是否是饱和溶液,②有固体剩余,是饱和溶液,不符合题意;
B、未指明X、Y溶液是否饱和,所以t1℃时,X、Y溶液中溶质的质量分数不一定相等,不符合题意;
C、由题意可知,30℃的水中溶解的该物质的量比20℃时多,说明该物质的溶解度随温度的升高而增大,故X表示的是该物质,不符合题意;
D、由溶解度曲线可知,X的溶解度随温度的升高而增大,Y的溶解度随温度的升高而减小,所以,分别将100gX、Y的饱和溶液从t2℃降温到t1℃,X的溶解度减小,有溶质析出,Y的溶解度增加,变为不饱和溶液,溶液质量不变,故所得到的溶液质量:Y>X,符合题意。
故答案为:D。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
6.【答案】B
【解析】【解答】A. 降低温度不一定可以使不饱和溶液变为饱和溶液,如氢氧化钙的溶解度随温度升高反而减小,氢氧化钙的不饱和溶液的温度降低后,氢氧化钙的溶解度增大,溶液将变得更不饱和,故不符合题意;
B. 硫酸铜溶液中,溶质是硫酸铜,溶剂是水,故符合题意;
C. 洗洁精具有乳化作用,能够乳化油污,即洗洁精去除油污的原理是乳化作用,故不符合题意;
D. 饱和溶液不能再溶解作溶质的物质,但还可以溶解其它物质,故不符合题意,
故答案为:B。
【分析】A、根据物质的溶解度,进行分析。
B、一般情况,溶剂是水。
C、洗洁精具有乳化作用。
D、一种溶质的饱和溶液还可以溶解其它物质。
7.【答案】D
【解析】【解答】A、根据图可以看出,A、B、C三个烧杯中的溶液,B中含有未溶解的固体,故B一定属于饱和溶液,故不符合题意;
B、根据烧杯中物质的溶解性可以看出,甲的溶解度随温度的升高而增大,故图二中能表示NaNO3溶解度曲线的是甲,故不符合题意;
C、甲的溶解度随温度的升高而增大明显,而乙的溶解度随温度的升高而降低,所以甲的饱和溶液降温会有晶体析出,而乙升高温度也会有晶体析出,这两溶液析出晶体质量有可能相等,故不符合题意;
D、由图可知在t2℃时甲溶液的溶质质量分数大于乙溶液中溶质的质量分数,现分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,甲溶液中会结晶析出溶质,t1℃时仍为饱和溶液,而乙降温后溶解度变大,成为不饱和溶液,但是溶液中溶质的质量分数没有改变,所以所得溶液的溶质的质量分数:甲>乙,故符合题意。
故答案为:D。
【分析】根据有固体剩余的溶液一定是饱和溶液,没有固体剩余的溶液可能饱和可能不饱和,硝酸钠的溶解度随温度升高而增大,饱和溶液的溶质质量分数=溶解度/100+溶解度分析。
8.【答案】A
【解析】【解答】A、碘酒是碘溶于酒精形成的溶液,符合题意;
B、冰水混合物是水的不同形态组成,属于纯净物,不是溶液,不符合题意;
C、波尔多液是由石灰乳和硫酸铜混合发生反应而得来,含有沉淀物,属于悬浊液,不符合题意;
D、液氧只含氧分子,是纯净物,不是溶液,不符合题意。
故答案为:A
【分析】根据溶液是均一稳定的混合物分析。
9.【答案】C
【解析】【解答】A、 P 点表示在 t2℃时 KCl 与 MgSO4溶解度相等,故A的说法错误,不符合题意;
B、在 t2℃时,MgCl2的溶解度是40 g 的意思是100g水中最多溶解40g该物质达到饱和溶液,故50g水中最多能溶解氯化钾20g达到饱和状态,故t2℃时, 向 40g 的 MgCl2中加入 50g 水,充分溶解后,所得溶液的质量为 70g,B说法错误,不符合题意;
C、 将 t2℃时 KCl 和 MgSO4的饱和溶液升温至 t3℃时,所得溶液中溶质质量分数由大到小的关系是 KCl>MgSO4 的说法正确,符合题意;
D、 既可以通过恒温蒸发溶剂,也可以通过降温结晶的方法,获得 MgCl2晶体,故D说法错误,不符合题意。
故答案为:C.
【分析】A、根据P点表示在 t2℃时 KCl 与 MgSO4溶解度相等来解答;
B、根据在t2℃时,MgCl2的溶解度是40 g 的含义来解释进行解答;
C、根据 t2℃时 KCl 和 MgSO4的溶解度和t3℃时的溶解度的大小来判断饱和溶液的质量分数来解答;
D、根据氯化镁的溶解度曲线图可知,氯化镁的溶解随温度增大而增大,可以冷却热饱和溶液或恒温蒸发溶剂来结晶来解答。
10.【答案】D
【解析】【解答】A、由图可知,20℃时,甲物质的溶解度小于乙物质的溶解度,故说法不符合题意;
B、40℃时,两种物质的溶解度曲线交于一点,故两种物质的溶解度相等,故说法不符合题意;
C、60℃时,甲物质的溶解度为60g,故将80g甲物质放入100g水中,充分搅拌后只能溶解60g,将得到溶液的质量为160g,故说法不符合题意;
D、甲物质的溶解度受温度的影响变化较大,故60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是甲,故说法符合题意。
故答案为:D。
【分析】根据溶解度曲线知识进行分析。
11.【答案】D
【解析】【解答】A、没有确定的温度,不确定甲的溶解度是否比乙大,不符合题意;
B、由图可知,t2℃时,甲的溶解度为40g,不符合题意;
C、由图可知,甲、乙溶解度随温度升高而变大,乙的饱和溶液从t1℃升温到t2℃,溶液变为不饱和,不符合题意;
D、t2℃时,甲的溶解度为40g,甲的饱和溶液中溶质与溶剂的质量比为40g:100g=2:5,符合题意。
故答案为:D。
【分析】A、比较不同物质溶解大大小时,先确定温度;
B、根据溶解度曲线即可得出答案;
C、对于甲乙升温,溶解度增大,溶液变为不饱和;
D、根据溶液的质量=溶质的质量+溶剂的质量,结合图象计算。
12.【答案】D
【解析】【解答】A、由图可知,在35℃时a的溶解度大于b的溶解度,故A不符合题意;
B、根据题干信息:饱和NaCl溶液和饱和NH4HCO3溶液得到碳酸氢钠固体和氯化铵溶液,可知同一温度下碳酸氢钠的溶解度最小,所以图中表示NaHCO3溶解度曲线的是b,故B不符合题意;
C、根据题干信息:饱和NaCl溶液和饱和NH4HCO3溶液得到碳酸氢钠固体和氯化铵溶液,是因为同一温度下碳酸氢钠的溶解度最小,故C不符合题意;
D、根据题干信息:NH4HCO3在40℃受热易分解,所以为提高NaHCO3的产率,反应需控制在40℃以下进行,故D符合题意。
故答案为:D。
【分析】根据溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质的溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析。
13.【答案】(1)ecbad
(2)8%
【解析】【解答】(1)配制硫酸铜溶液时,计算完后,进行称量,称量时先称固体盐,后量取水,最后是溶解,故步骤为:称量、量取、溶解。结合图示正确的操作顺序是e c b a d。
(2)CuSO4溶液中所含CuSO4质量为:40g×10%=4g
设氢氧化钠溶液中氢氧化钠的质量为x
x=2g
则NaOH溶液中溶质的质量分数为:
【分析】(1)根据配制溶液的步骤为:称量、量取、溶解分析。
(2)先设未知数,正确写出氢氧化钠与硫酸铜反应的化学方程式;再找准有关物质,已知量是六是TV的质量,未知量是氢氧化钠的质量;列比例式计算。
根据溶液中溶质的质量分数计算公式分析。
14.【答案】(1)解:设与碳酸氢钠反应生成的二氧化碳的质量为,氯化钠的质量为;
由题意可知,共生成13.2g二氧化碳气体,因为碳酸氢钠生成的气体为8.8g,所以碳酸钠完全反应生成的气体为。设碳酸钠的质量为
答:原混合物中碳酸钠的质量为10.6g;
(2)解:设与碳酸钠反应生成的氯化钠的质量为
该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数是
答:该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数为。
【解析】【分析】(1)根据 和 计算 ;
(2)根据化学方程式计算两部分反应生成氯化钠的质量,进而计算溶质质量分数。
15.【答案】(1)过滤;玻璃棒
(2)水分;混合物
(3)减少误差;没有蒸干;80%
(4)为了减少过滤和蒸发所需的时间
【解析】【解答】(1)过滤可以将不溶性固体从溶液中分离出来,所以操作Ⅰ的名称是过滤;
过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒,蒸发需要的玻璃仪器有玻璃棒,所以操作Ⅱ与操作Ⅰ都用到的玻璃仪器是玻璃棒。
(2)操作Ⅱ是蒸发,可以除去水分,最后得到的精盐中仍含有氯化镁、氯化钙等物质,属于混合物。
(3)实验小组称量精盐时连同蒸发皿一起称量,其优点是减少误差。
甲组实验产率偏高,其原因可能是没有蒸干。
乙组同学得到的产率=×100%=80%。
(4)水的量偏多,会造成过滤和蒸发所需的时间增加,溶解粗盐时应加适量水,加适量水是为了减少过滤和蒸发所需的时间。
【分析】(1)根据过滤的原理,过滤、溶解操作需要的玻璃仪器分析。
(2)根据过滤只能除去不溶性杂质,蒸发可以除去水分分析。
(3)根据产率=×100%进行计算。
(4)根据水的量偏多,会造成过滤和蒸发所需的时间增加分析。
16.【答案】(1)8;D;偏小
(2);60
【解析】【解答】(1)Ⅰ.配制100g 8%硫酸铜溶液需要硫酸铜的质量=100g×8%=8g。
Ⅱ.①称量过程中,若发现天平指针偏右,说明药品的质量不足,此时应该增加硫酸铜固体至指针指向标尺中央。
②量取水时,仰视读数会导致量取的水偏多,造成配制的溶液溶质质量分数偏小。
(2)设需要 20%的硫酸铜溶液(密度为1.16g/mL)的体积为x,则:
100g×8%=x×1.16g/mL×20%
则x=;
需要加入的水的质量为:100g-=60g
则所需水的体积为:60g÷1g/mL=60mL。
【分析】(1)溶质的质量=溶液的质量×溶质的质量分数。
根据托盘天平的使用方法、量筒的读数方法分析。
(2)根据溶液加水稀释过程中,溶质的质量不变分析。
1 / 1
一、单选题
1.下列固体物质加入适量水中,溶液的温度明显降低的是( )
A. B. C. D.
2.下列物质放入水中,能形成溶液的是( )
A.蔗糖 B.植物油 C.泥土 D.面粉
3.全面推进乡村振兴,大力发展农业生产,农业上常用溶质质量分数为16%的氯化钠溶液来选种。下列有关溶液的说法正确的是( )
A.溶液是混合物 B.溶液一定是无色的
C.均一、稳定的液体一定是溶液 D.植物油和水可以形成溶液
4.关于生活中的化学,下列说法正确的是( )
A.室内起火时立即打开所有门窗
B.用水灭火时降低了可燃物的着火点
C.喝汽水打嗝时因为压强增大气体溶解度减小
D.硝酸铵溶于水制成的冰袋可用于给高烧病人降温
5.向盛有等量水的三个烧杯中分别加入某固体物质10g、25g、25g,如图甲所示是充分溶解后的现象,如图乙所示是该固体物质和另一种固体物质的溶解度曲线。
下列有关说法正确的是( )
A.三个烧杯中形成的溶液都是饱和溶液
B.t1℃时,X、Y溶液中溶质的质量分数相等
C.Y代表该固体物质,X代表另一种固体物质
D.分别将100gX、Y的饱和溶液从t2℃降温到t1℃,所得到的溶液质量:Y>X
6.下列关于溶液的说法正确的是( )
A.降低温度一定可以使不饱和溶液变为饱和溶液
B.硫酸铜溶液中,溶质是硫酸铜,溶剂是水
C.洗洁精去除油污的原理是将油污溶解
D.饱和溶液不能再溶解任何物质
7.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示,甲乙对应的溶解度曲线如图二所示。下列说法错误的( )
A.图一烧杯中的溶液一定属于饱和溶液的是B
B.在图二中,能表示NaNO3溶解度曲线的是甲
C.将甲的饱和溶液从t2℃降温到t1℃,乙的饱和溶液从t1℃升温到t2℃,两溶液析出晶体质量可能相等
D.依据图二的分析判断,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的溶质的质量分数:甲=乙
8.下列生活中常见的物质属于溶液的是( )
A.碘酒 B.冰水混合物
C.刚刚配置的波尔多液 D.液氧
9.如图是 MgCl2、KCl、MgSO4的溶解度曲线,下列说法中正确的是( )
A.P 点表示 KCl 与 MgSO4溶解度相等
B.在 t2℃时,向 40g 的 MgCl2中加入 50g 水,充分溶解后,所得溶液的质量为 90g
C.将 t2℃时 KCl 和 MgSO4的饱和溶液升温至 t3℃时,所得溶液中溶质质量分数由大到小的关系是 KCl>MgSO4
D.只能通过降温结晶的方法,获得 MgCl2晶体
10.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线判断下列说法,其中不正确的是( )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
11.甲、乙的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度比乙大
B.t2℃时,乙的溶解度为40g
C.乙的饱和溶液从t1℃升温到t2℃,溶液仍饱和
D.t2℃时,甲的饱和溶液中溶质与溶剂的质量比为2:5
12.以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为: (已知NH4HCO3在40℃受热易分解)反应中的四种物质溶解度曲线见图,下列说法正确的是( )
A.在35℃时a的溶解度小于b的溶解度
B.图中表示NaHCO3溶解度曲线的是a
C.析出NaHCO3固体是因为其溶解度变化受温度影响较小
D.为提高NaHCO3的产率,反应需控制在40℃以下进行
二、计算题
13.小宇用配制的10%的CuSO4溶液测定一瓶NaOH溶液中溶质的质量分数。
(1)下图是配制CuSO4溶液的操作过程,正确的顺序是 (填序号)。
(2)取NaOH溶液25g,向其中加入10%的CuSO4溶液40g时恰好完全反应。则NaOH溶液中溶质的质量分数为 。
14.某份固体混合物由16.8g碳酸氢钠和一定质量的碳酸钠组成,向该份固体中加入100g某浓度的盐酸,二者恰好完全反应,共生成13.2g二氧化碳气体。试计算(写出必要的计算过程):
(1)原混合物中碳酸钠的质量;
(2)该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数(计算结果精确到0.1%)。
三、实验探究题
15.粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和难溶性杂质,除去粗盐中难溶性杂质,制成精盐的操作流程如下:
(1)操作I的名称是 ,操作Ⅱ与操作I都用到的玻璃仪器是 。
(2)操作Ⅱ是蒸发,可以除去 ,最后得到的精盐属于 (选填“混合物”或“纯净物”)。
(3)甲、乙小组同学用电子天平称得了以下实验数据。
粗盐的质量(g)
蒸发皿的质量(g)
蒸发皿+精盐的质量(g) 精盐质量 产率= ×100% 粗盐质量
甲 5.0 50.4 55.5 102%
乙 5.0 51.5 55.5
实验小组称量精盐时连同蒸发皿一起称量,其优点是 。甲组实验产率偏高,其原因可能是 。(写一点即可)
计算乙组同学得到的产率,并填入上表。
(4)溶解粗盐时,应加入适量的水,其原因是 。
16.某化学兴趣小组的同学欲采用不同的方法配制硫酸铜溶液,请回答问题:
小君用溶解硫酸铜固体的方法配制100 g 8%的硫酸铜溶液,具体步骤如下:
(1)Ⅰ.计算
需要硫酸铜固体的质量为 g。
Ⅱ.称量
①称量过程中,若发现天平指针偏右,此时应该 (填字母),至指针指向标尺中央。
A.调节游码和砝码
B.调节平衡螺母
C.减少硫酸铜固体
D.增加硫酸铜固体
②量取水时,如果按照B的方式读数,会使配制的溶液的溶质质量分数 (填“偏大”或“偏小”)。
Ⅲ.溶解
Ⅳ.装瓶,贴标签
(2)小东用溶液稀释的方法配制100 g 8%的硫酸铜溶液,需要 20%的硫酸铜溶液(密度为1.16 g/mL)的体积为 (列出计算式即可),需要加入水的体积为 mL。
答案解析部分
1.【答案】A
【解析】【解答】A、硝酸铵溶解吸热,溶于水后溶液温度明显降低,符合题意;
B、氧化钙放入水中会与水反应生成氢氧化钙,同时放热,不符合题意;
C、氯化钠放入水中溶液温度无明显变化,不符合题意;
D、氢氧化钠溶解放热,放入水中溶液温度明显升高,不符合题意;
故答案选:A。
【分析】A、根据硝酸铵溶解吸热分析;
B、根据氧化钙与水反应放热分析;
C、根据氯化钠溶解温度无明显变化分析;
D、根据氢氧化钠溶解放热分析。
2.【答案】A
【解析】【解答】A、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故符合题意;
B、植物油不溶于水,与水混合形成的是乳浊液,不是溶液,故不符合题意;
C、泥沙不溶于水,与水混合形成的是悬浊液,不是溶液,故不符合题意;
D、面粉不溶于水,与水混合形成的是悬浊液,不是溶液,故不符合题意;
故答案为:A。
【分析】溶液是指在一定条件下溶质分散到溶剂中形成的均一稳定的混合物。
3.【答案】A
【解析】【解答】A.溶液是均一、稳定的混合物,符合题意。
B.溶液不一定是无色的,比如硫酸铜溶液为蓝色,选项不符合题意。
C.均一、稳定的液体不一定是溶液,比如水,选项不符合题意。
D.植物油和水不可以形成溶液,只能形成乳浊液,选项不符合题意。
故答案为:A。
【分析】A.溶液中含有溶质和溶剂,最少含有两种物质,属于混合物;
B.溶液可以有颜色;
C.均一、稳定的混合物才是溶液;
D.植物油不溶于水。
4.【答案】D
【解析】【解答】A. 室内着火时打开门窗,能形成空气对流,增加氧气,加剧燃烧,故不符合题意;
B. 可燃物的着火点一般不会改变,用水灭火时将可燃物的温度降到着火点以下,故不符合题意;
C. 喝了汽水会打嗝,是因为温度升高,气体的溶解度减小的缘故,故不符合题意;
D. 硝酸铵溶于水时吸热,使温度降低,制成的冰袋可用于给发烧病人降温,故符合题意。
故答案为:D。
【分析】A、室内着火时打开门窗,增加氧气,会加剧燃烧。
B、可燃物的着火点一般不会改变,是物质的固有属性。
C、温度升高,气体的溶解度会减小。
D、硝酸铵溶于水时会吸热。
5.【答案】D
【解析】【解答】A、由于①③烧杯中没有未溶解的固体存在,不能确定能否再溶解该物质,所以不能确定是否是饱和溶液,②有固体剩余,是饱和溶液,不符合题意;
B、未指明X、Y溶液是否饱和,所以t1℃时,X、Y溶液中溶质的质量分数不一定相等,不符合题意;
C、由题意可知,30℃的水中溶解的该物质的量比20℃时多,说明该物质的溶解度随温度的升高而增大,故X表示的是该物质,不符合题意;
D、由溶解度曲线可知,X的溶解度随温度的升高而增大,Y的溶解度随温度的升高而减小,所以,分别将100gX、Y的饱和溶液从t2℃降温到t1℃,X的溶解度减小,有溶质析出,Y的溶解度增加,变为不饱和溶液,溶液质量不变,故所得到的溶液质量:Y>X,符合题意。
故答案为:D。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
6.【答案】B
【解析】【解答】A. 降低温度不一定可以使不饱和溶液变为饱和溶液,如氢氧化钙的溶解度随温度升高反而减小,氢氧化钙的不饱和溶液的温度降低后,氢氧化钙的溶解度增大,溶液将变得更不饱和,故不符合题意;
B. 硫酸铜溶液中,溶质是硫酸铜,溶剂是水,故符合题意;
C. 洗洁精具有乳化作用,能够乳化油污,即洗洁精去除油污的原理是乳化作用,故不符合题意;
D. 饱和溶液不能再溶解作溶质的物质,但还可以溶解其它物质,故不符合题意,
故答案为:B。
【分析】A、根据物质的溶解度,进行分析。
B、一般情况,溶剂是水。
C、洗洁精具有乳化作用。
D、一种溶质的饱和溶液还可以溶解其它物质。
7.【答案】D
【解析】【解答】A、根据图可以看出,A、B、C三个烧杯中的溶液,B中含有未溶解的固体,故B一定属于饱和溶液,故不符合题意;
B、根据烧杯中物质的溶解性可以看出,甲的溶解度随温度的升高而增大,故图二中能表示NaNO3溶解度曲线的是甲,故不符合题意;
C、甲的溶解度随温度的升高而增大明显,而乙的溶解度随温度的升高而降低,所以甲的饱和溶液降温会有晶体析出,而乙升高温度也会有晶体析出,这两溶液析出晶体质量有可能相等,故不符合题意;
D、由图可知在t2℃时甲溶液的溶质质量分数大于乙溶液中溶质的质量分数,现分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,甲溶液中会结晶析出溶质,t1℃时仍为饱和溶液,而乙降温后溶解度变大,成为不饱和溶液,但是溶液中溶质的质量分数没有改变,所以所得溶液的溶质的质量分数:甲>乙,故符合题意。
故答案为:D。
【分析】根据有固体剩余的溶液一定是饱和溶液,没有固体剩余的溶液可能饱和可能不饱和,硝酸钠的溶解度随温度升高而增大,饱和溶液的溶质质量分数=溶解度/100+溶解度分析。
8.【答案】A
【解析】【解答】A、碘酒是碘溶于酒精形成的溶液,符合题意;
B、冰水混合物是水的不同形态组成,属于纯净物,不是溶液,不符合题意;
C、波尔多液是由石灰乳和硫酸铜混合发生反应而得来,含有沉淀物,属于悬浊液,不符合题意;
D、液氧只含氧分子,是纯净物,不是溶液,不符合题意。
故答案为:A
【分析】根据溶液是均一稳定的混合物分析。
9.【答案】C
【解析】【解答】A、 P 点表示在 t2℃时 KCl 与 MgSO4溶解度相等,故A的说法错误,不符合题意;
B、在 t2℃时,MgCl2的溶解度是40 g 的意思是100g水中最多溶解40g该物质达到饱和溶液,故50g水中最多能溶解氯化钾20g达到饱和状态,故t2℃时, 向 40g 的 MgCl2中加入 50g 水,充分溶解后,所得溶液的质量为 70g,B说法错误,不符合题意;
C、 将 t2℃时 KCl 和 MgSO4的饱和溶液升温至 t3℃时,所得溶液中溶质质量分数由大到小的关系是 KCl>MgSO4 的说法正确,符合题意;
D、 既可以通过恒温蒸发溶剂,也可以通过降温结晶的方法,获得 MgCl2晶体,故D说法错误,不符合题意。
故答案为:C.
【分析】A、根据P点表示在 t2℃时 KCl 与 MgSO4溶解度相等来解答;
B、根据在t2℃时,MgCl2的溶解度是40 g 的含义来解释进行解答;
C、根据 t2℃时 KCl 和 MgSO4的溶解度和t3℃时的溶解度的大小来判断饱和溶液的质量分数来解答;
D、根据氯化镁的溶解度曲线图可知,氯化镁的溶解随温度增大而增大,可以冷却热饱和溶液或恒温蒸发溶剂来结晶来解答。
10.【答案】D
【解析】【解答】A、由图可知,20℃时,甲物质的溶解度小于乙物质的溶解度,故说法不符合题意;
B、40℃时,两种物质的溶解度曲线交于一点,故两种物质的溶解度相等,故说法不符合题意;
C、60℃时,甲物质的溶解度为60g,故将80g甲物质放入100g水中,充分搅拌后只能溶解60g,将得到溶液的质量为160g,故说法不符合题意;
D、甲物质的溶解度受温度的影响变化较大,故60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是甲,故说法符合题意。
故答案为:D。
【分析】根据溶解度曲线知识进行分析。
11.【答案】D
【解析】【解答】A、没有确定的温度,不确定甲的溶解度是否比乙大,不符合题意;
B、由图可知,t2℃时,甲的溶解度为40g,不符合题意;
C、由图可知,甲、乙溶解度随温度升高而变大,乙的饱和溶液从t1℃升温到t2℃,溶液变为不饱和,不符合题意;
D、t2℃时,甲的溶解度为40g,甲的饱和溶液中溶质与溶剂的质量比为40g:100g=2:5,符合题意。
故答案为:D。
【分析】A、比较不同物质溶解大大小时,先确定温度;
B、根据溶解度曲线即可得出答案;
C、对于甲乙升温,溶解度增大,溶液变为不饱和;
D、根据溶液的质量=溶质的质量+溶剂的质量,结合图象计算。
12.【答案】D
【解析】【解答】A、由图可知,在35℃时a的溶解度大于b的溶解度,故A不符合题意;
B、根据题干信息:饱和NaCl溶液和饱和NH4HCO3溶液得到碳酸氢钠固体和氯化铵溶液,可知同一温度下碳酸氢钠的溶解度最小,所以图中表示NaHCO3溶解度曲线的是b,故B不符合题意;
C、根据题干信息:饱和NaCl溶液和饱和NH4HCO3溶液得到碳酸氢钠固体和氯化铵溶液,是因为同一温度下碳酸氢钠的溶解度最小,故C不符合题意;
D、根据题干信息:NH4HCO3在40℃受热易分解,所以为提高NaHCO3的产率,反应需控制在40℃以下进行,故D符合题意。
故答案为:D。
【分析】根据溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质的溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析。
13.【答案】(1)ecbad
(2)8%
【解析】【解答】(1)配制硫酸铜溶液时,计算完后,进行称量,称量时先称固体盐,后量取水,最后是溶解,故步骤为:称量、量取、溶解。结合图示正确的操作顺序是e c b a d。
(2)CuSO4溶液中所含CuSO4质量为:40g×10%=4g
设氢氧化钠溶液中氢氧化钠的质量为x
x=2g
则NaOH溶液中溶质的质量分数为:
【分析】(1)根据配制溶液的步骤为:称量、量取、溶解分析。
(2)先设未知数,正确写出氢氧化钠与硫酸铜反应的化学方程式;再找准有关物质,已知量是六是TV的质量,未知量是氢氧化钠的质量;列比例式计算。
根据溶液中溶质的质量分数计算公式分析。
14.【答案】(1)解:设与碳酸氢钠反应生成的二氧化碳的质量为,氯化钠的质量为;
由题意可知,共生成13.2g二氧化碳气体,因为碳酸氢钠生成的气体为8.8g,所以碳酸钠完全反应生成的气体为。设碳酸钠的质量为
答:原混合物中碳酸钠的质量为10.6g;
(2)解:设与碳酸钠反应生成的氯化钠的质量为
该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数是
答:该份固体与100g某浓度的盐酸恰好完全反应后,所得溶液中溶质的质量分数为。
【解析】【分析】(1)根据 和 计算 ;
(2)根据化学方程式计算两部分反应生成氯化钠的质量,进而计算溶质质量分数。
15.【答案】(1)过滤;玻璃棒
(2)水分;混合物
(3)减少误差;没有蒸干;80%
(4)为了减少过滤和蒸发所需的时间
【解析】【解答】(1)过滤可以将不溶性固体从溶液中分离出来,所以操作Ⅰ的名称是过滤;
过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒,蒸发需要的玻璃仪器有玻璃棒,所以操作Ⅱ与操作Ⅰ都用到的玻璃仪器是玻璃棒。
(2)操作Ⅱ是蒸发,可以除去水分,最后得到的精盐中仍含有氯化镁、氯化钙等物质,属于混合物。
(3)实验小组称量精盐时连同蒸发皿一起称量,其优点是减少误差。
甲组实验产率偏高,其原因可能是没有蒸干。
乙组同学得到的产率=×100%=80%。
(4)水的量偏多,会造成过滤和蒸发所需的时间增加,溶解粗盐时应加适量水,加适量水是为了减少过滤和蒸发所需的时间。
【分析】(1)根据过滤的原理,过滤、溶解操作需要的玻璃仪器分析。
(2)根据过滤只能除去不溶性杂质,蒸发可以除去水分分析。
(3)根据产率=×100%进行计算。
(4)根据水的量偏多,会造成过滤和蒸发所需的时间增加分析。
16.【答案】(1)8;D;偏小
(2);60
【解析】【解答】(1)Ⅰ.配制100g 8%硫酸铜溶液需要硫酸铜的质量=100g×8%=8g。
Ⅱ.①称量过程中,若发现天平指针偏右,说明药品的质量不足,此时应该增加硫酸铜固体至指针指向标尺中央。
②量取水时,仰视读数会导致量取的水偏多,造成配制的溶液溶质质量分数偏小。
(2)设需要 20%的硫酸铜溶液(密度为1.16g/mL)的体积为x,则:
100g×8%=x×1.16g/mL×20%
则x=;
需要加入的水的质量为:100g-=60g
则所需水的体积为:60g÷1g/mL=60mL。
【分析】(1)溶质的质量=溶液的质量×溶质的质量分数。
根据托盘天平的使用方法、量筒的读数方法分析。
(2)根据溶液加水稀释过程中,溶质的质量不变分析。
1 / 1
