第7章应用广泛的酸、碱、盐练习题(含解析) 2023-2024学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐练习题(含解析) 2023-2024学年九年级化学沪教版(全国)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 313.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-20 21:51:55 | ||
图片预览




文档简介
第7章应用广泛的酸、碱、盐 练习题
一、选择题
1.证据推理是化学学科核心素养之一。下列推理得出的结论合理的是
A.洗洁精去油污利用的是乳化作用,因此汽油去油污利用的也是乳化作用
B.可燃物燃烧温度要达到着火点,因此温度达到着火点时可燃物一定能燃烧
C.中和反应生成盐和水,因此生成盐和水的反应一定是中和反应
D.同种元素原子的质子数相同,因此质子数相同的原子一定是同种元素
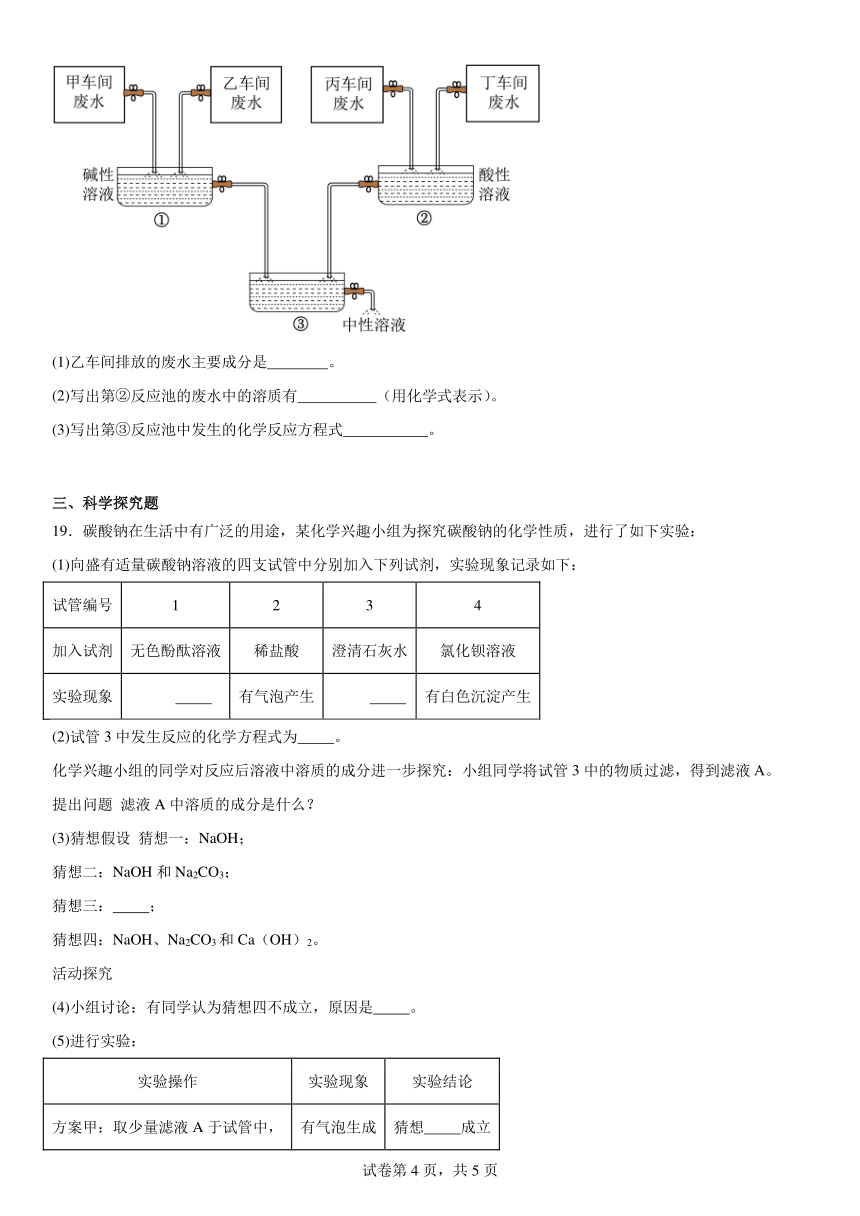
2.物质的用途主要由性质决定,下列物质用途的描述主要利用的是化学性质的是
A.洗涤剂去油污 B.石墨做电极
C.稀盐酸除铁锈 D.食盐做调味品
3.下列说法中错误的是
A.水银不是银 B.干冰不是冰 C.纯碱不是碱 D.食盐不是盐
4.下列各组离子在pH=1的溶液中能大量共存的是
A. Na+ Cl﹣ B. K+ Na+
C.Cu2+ OH﹣ Cl﹣ Ba2+ D.Ag+ Cl﹣ Na+
5.关于硫酸和盐酸的说法不正确的是
A.都属于酸类 B.两者的溶液都具有导电性
C.都可用于除铁锈 D.两者的pH一定相等
6.下列几种作物适宜生长的pH范围如下:水稻6.0~70、茶树5.0~5.5、马铃薯4.8~5.5、大豆6.5~7.5、棉花6.0~6.8。下列说法不正确的是
A.pH越小,溶液的酸性越强
B.用盐酸除去铁锈
C.胃酸过多的病人在空腹时最好多喝一些柠檬汁
D.某地土壤的浸出液加入石蕊溶液,溶液略显蓝色,则该土壤最适宜种植的是大豆
7.下列做法不能达到实验目的的是
A.鉴别铁粉和氧化铜粉末一滴加稀硫酸
B.除去二氧化碳中的一氧化碳一点燃气体
C.比较黄铜片和铜片的硬度一将两种金属片相互刻画
D.除去氧气中的水蒸气一将气体通过浓硫酸
8.逻辑推理是化学学习中常用的思维方法。下列说法错误的是
A.点燃可燃性气体前都要检验纯度,则点燃氢气前需要检验纯度
B.溶液是均一的、稳定的混合物,则均一的、稳定的混合物一定是溶液
C.单质是由一种元素组成的纯净物。则由一种元素组成的纯净物一定是单质
D.碱溶液能使酚酞溶液变红色,则能使酚酞溶液变红色的溶液一定是碱溶液
9.下列反应的化学方程式及其应用都正确的是
A. 工业上用磁铁矿冶炼铁
B. 用于制取透视检查胃肠的钡餐
C. 用铁粉除去硫酸亚铁中的硫酸铜
D. 镁用于制作烟花爆竹
10.推理是一种重要的学习方法。下列推理中正确的是( )
A.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
B.在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定都显负价
C.碱中都含有氢氧根离子,所以含有氢氧根离子的化合物一定是碱
D.许多物质都可以与氧气发生化学反应,这类反应属于氧化反应,所以氧化反应定有O2参与
11.推理是化学学习中常用的思维方法,下列推理错误的是
A.生成盐和水的反应一定是中和反应
B.含有铵根离子的氮肥与熟石灰混合研磨后,一定会生成氨气
C.化合物是由不同种元素组成的物质,所以由同种元素组成的物质一定不是化合物
D.中和反应一定是复分解反应,复分解反应不一定是中和反应
二、填空与简答
12.氢氧燃料电池以氢气作燃料,空气作助燃剂,使用的空气必须要除去二氧化碳,否则将对导电介质氢氧化钠造成影响,原因是 (用化学方程式表示)。
13.某实验小组做如图实验。实验开始时,天平 甲、乙处于平衡状态,放置一段时间后,天平指针向右偏转。请回答下列问题。
甲瓶中的现象为 ;乙瓶中发生反应的化学方程式为 。
14.根据下列现象说明空气中存在的气体,请将该气体的名称填在横线上:
(1)澄清石灰水在空气中液面形成一层白色薄膜,原因是空气中含有 ;
(2)以空气为原料可以生产氮肥,这说明空气中有 ;
15.在日常生活中我们经常会听到一些物质的俗名,比如小苏打、碱石灰等请用正确的化学用语完成下面各题
(1)苏打溶液中的阳离子 ;
(2)请标出干冰中碳元素的化合价 ;
(3)苛性钠 ;
(4)生石灰加水后所得溶液的溶质 ;
16.联合制碱法(又称侯氏制碱法),它是我国化学工程专家 于1943年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法,碳酸钠俗称纯碱,其化学式为 ;氯化铵中阳离子的符号是 。
17.有某固体混合物,已知其中可能含有Na2CO3、CaCO3、CuSO4、FeCl3四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)
试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体A水溶液的pH 7(填“大于”“小于”“等于”之一)。
(2)该固体混合物中,一定不存在的物质是(写化学式) ,理由是: 。
(3)在滤液E中,一定大量存在的阴离子是(写离子符号) 。
(4)写出过程③中一定发生反应的化学方程式 。
(5)写出过程①中发生反应的一个化学方程式 。
18.“五水共治”的首要任务是“治废水”,合理处理废水是当前防治废水污染的重要举措。某化工厂有甲、乙、丙、丁四个车间,排放的废水中分别含有FeCl3、HCl、Na2CO3、NaOH的一种,甲车间的废水呈黄色。通过调节废水流量,使乙、丁两个车间废水相对过量,通过如图方式处理,最终可使排出的废水呈中性。处理时第①反应池中出现大量的红褐色沉淀,第②反应池中出现大量的气泡,请回答:
(1)乙车间排放的废水主要成分是 。
(2)写出第②反应池的废水中的溶质有 (用化学式表示)。
(3)写出第③反应池中发生的化学反应方程式 。
三、科学探究题
19.碳酸钠在生活中有广泛的用途,某化学兴趣小组为探究碳酸钠的化学性质,进行了如下实验:
(1)向盛有适量碳酸钠溶液的四支试管中分别加入下列试剂,实验现象记录如下:
试管编号 1 2 3 4
加入试剂 无色酚酞溶液 稀盐酸 澄清石灰水 氯化钡溶液
实验现象 有气泡产生 有白色沉淀产生
(2)试管3中发生反应的化学方程式为 。
化学兴趣小组的同学对反应后溶液中溶质的成分进一步探究:小组同学将试管3中的物质过滤,得到滤液A。
提出问题 滤液A中溶质的成分是什么?
(3)猜想假设 猜想一:NaOH;
猜想二:NaOH和Na2CO3;
猜想三: ;
猜想四:NaOH、Na2CO3和Ca(OH)2。
活动探究
(4)小组讨论:有同学认为猜想四不成立,原因是 。
(5)进行实验:
实验操作 实验现象 实验结论
方案甲:取少量滤液A于试管中, 加入过量的稀盐酸 有气泡生成 猜想 成立
方案乙:取少量滤液A于试管中, 加入适量的Ba(NO3)2溶液
反思与评价
(6)碳酸钠溶液呈 性,可以和盐酸、氢氧化钙、氯化钡等物质发生反应。
(7)要验证反应后物质的成分,既要考虑生成物,还应考虑 。
四、计算题
20.小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。
第一次 第二次 第三次 第四次
所取生铁的质量∕g 10 10 10 10
所加稀硫酸的质量∕g 25 50 75 100
生成氢气的质量∕g 0.10 0.20 0.30 0.35
根据她的实验数据,完成下列问题:
(1)第 次生铁完全反应?
(2)计算生铁中铁的质量分数是多少? (要有详细过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、洗洁精去油污,是因为洗洁精中含有乳化剂,具有乳化作用,能将油污乳化为细小油滴,随水冲走,汽油去油污,是因为汽油能溶解油污,不符合题意;
B、燃烧的条件:可燃物、温度达到着火点,与空气(或氧气)接触,故温度达到着火点时,可燃物不一定燃烧,还需与氧气(或空气)接触,不符合题意;
C、中和反应是酸与碱作用生成盐和水的反应,故中和反应生成盐和水,生成盐和水的反应不一定是中和反应,如二氧化碳和氢氧化钠反应生成碳酸钠和水,不符合题意;
D、元素是质子数相同的一类原子的总称,同种元素原子的质子数相同,因此质子数相同的原子一定是同种元素,符合题意。
故选D。
2.C
【分析】化学性质是物质在化学变化中表现出来的性质,如可燃性、氧化性、酸性、碱性等。
【详解】A、洗涤剂去油污是洗涤剂有乳化作用,它能将大的油污分散成细小的液滴,随水流走。发生的是物理变化,利用的是洗涤剂的物理性质。A不符合题意;
B、石墨做电极利用石墨的导电性,是石墨的物理性质。B不符合题意;
C、稀盐酸除铁锈是利用稀盐酸与铁锈反应生成氯化铁和水这一化学性质。C符合题意;
D、食盐做调味品是利用食盐有咸味这一物理性质。D不符合题意。
综上所述:选择C。
3.D
【详解】A、水银是金属汞,不是银,故A正确,不符合题意;
B、干冰是固态二氧化碳,冰是固态的水,故干冰不是冰,故B正确,不符合题意;
C、纯碱为碳酸钠,是由金属离子和酸根离子构成,为盐,故纯碱不是碱,故C正确,不符合题意;
D、食盐主要成分为氯化钠,是由金属离子和酸根离子构成,为盐,故D错误,符合题意。
故选:D。
4.A
【详解】离子能大量共存,它们之间不能结合产生水、气体或沉淀。
A、离子之间不会结合成水、沉淀或气体,该组离子能大量共存;正确;
B、 pH =1的溶液为强酸性溶液,含有氢离子,和氢离子不能共存;错误;
C、OH-不能在强酸性溶液中存在,氢离子和氢氧根离子反应产生水;错误;
D、Ag+与Cl-不能共存,反应产生氯化银沉淀;错误。
故选A。
5.D
【详解】解:A、盐酸和硫酸都是酸,该选项说法正确;
B、盐酸和硫酸中都有自由移动的离子,两者的溶液都具有导电性,该选项说法正确;
C、铁锈主要成分是氧化铁,氧化铁和盐酸反应生成氯化铁和水,和稀硫酸反应生成硫酸铁和水,该选项说法正确;
D、两者的pH不一定相等,该选项说法不正确。
故选D。
6.C
【详解】A、pH越小,溶液的酸性越强,正确;
B、铁锈的主要成分是氧化铁,盐酸可以和氧化铁反应,故用盐酸除去铁锈,正确;
C、柠檬汁显酸性,胃酸过多的病人在空腹时不能多喝柠檬汁,错误;
D、大豆适合在弱碱性土壤中生长,某地土壤的浸出液加入石蕊溶液,溶液略显蓝色,说明该土壤呈碱性,则该土壤最适宜种植的是大豆,正确;
故选C。
7.B
【详解】A、鉴别铁粉和氧化铜粉末,滴加稀硫酸,有气泡生成的是铁粉,没有气泡生成的氧化铜,做法能达到实验目的;
B、除去二氧化碳中的一氧化碳,二氧化碳浓度大,一氧化碳不能被点燃,做法不能达到实验目的;
C、比较黄铜片和铜片的硬度,将两种金属片相互刻画,有划痕的是铜片,没有划痕的是黄铜片,做法能达到实验目的;
D、除去氧气中的水蒸气,将气体通过浓硫酸,浓硫酸具有吸水性,可以吸收混合气体中的水蒸气,做法能达到实验目的;
答案:B。
8.D
【详解】A.点燃可燃性气体前均需要检验纯度,以免发生爆炸,所以点燃氢气前需要检验纯度,正确;
B.溶液具有均一性、稳定性,所以均一的、稳定的混合物一定是溶液,正确;
C.由同种元素组成的纯净物是单质,所以由一种元素组成的纯净物一定是单质,正确;
D.能使酚酞溶液变红色的溶液不一定是碱溶液,如碳酸钠属于盐,其水溶液呈碱性,也能使酚酞溶液变红色,错误。
故选:D。
9.A
【详解】A、工业上用磁铁矿冶炼铁,是一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:,符合题意;
B、氯化钡和二氧化碳、水不反应,且碳酸钡能与稀盐酸反应生成可溶性的氯化钡,不能用碳酸钡做钡餐,不符合题意;
C、铁能与硫酸铜反应生成硫酸亚铁和铜,故可用铁粉除去硫酸亚铁中的硫酸铜,该反应的化学方程式为:,不符合题意;
D、镁能在空气中燃烧生成氧化镁,发出耀眼白光,故镁可用于制作烟花爆竹,该反应的化学方程式为:,不符合题意。
故选A。
10.A
【详解】A、单质是由同种元素组成的纯净物,故由一种元素组成的纯净物一定是单质,说法正确,符合题意;
B、在化合物里,正负化合价的代数和为零,但是在同一化合物中金属元素显正价,非金属元素不一定都显负价,如碳酸钙中,钙元素显+2价,氧元素显-2价,碳元素属于非金属元素,但是显+4价,不符合题意;
C、碱中都含有氢氧根离子,但是含有氢氧根离子的化合物不一定是碱,如碱式碳酸铜中含氢氧根,但是属于盐,不符合题意;
D、许多物质都可以与氧气发生化学反应,这类反应属于氧化反应,但是氧化反应不一定有O2参与,如氢气在氯气中燃烧生成氯化氢,属于氧化反应,但是无氧气参与,不符合题意。
故选A。
11.A
【详解】A.酸和碱反应生成盐和水的反应是中和反应,但生成盐和水的反应不一定是中和反应,如:,反应生成盐和水,但不是中和反应,故选项推理错误,符合题意;
B.铵态氮肥能与碱性物质混合研磨产生有刺激性气味的气体,反应的原理是铵根离子与氢氧根离子反应生成氨气和水,故选项推理正确,不符合题意;
C.化合物是由不同种元素组成的纯净物,由同种元素组成的物质可能是单质、纯净物、混合物,但是一定不是化合物,因为化合物最少也有两种元素组成的,故选项推理正确,不符合题意;
D.中和反应是酸与碱之间的反应,属于复分解反应,复分解反应是指两种化合物相互交换成分生成另外两种化合物的反应,不一定是酸和碱之间的反应,则复分解反应不一定是中和反应,故选项推理正确,不符合题意;
故选:A。
12.2NaOH+CO2=== Na2CO3+H2O
【详解】二氧化碳能与氢氧化钠反应生成碳酸钠和水,反应的化学方程式是:2NaOH+CO2=== Na2CO3+H2O。
13. 有固体析出 CaO+H2O=Ca(OH)2
【详解】甲瓶中饱和食盐水中水分蒸发溶剂减少、溶质析出,故有固体析出,水蒸气移动至乙瓶中,水与氧化钙反应生成氢氧化钙,化学方程式为。
14. 二氧化碳 氮气
【详解】(1)澄清石灰水中的氢氧化钙易与空气中的二氧化碳反应形成一层白色薄膜,故含有二氧化碳;
(2)氮气中含有氮元素,空气中的氮气可以制造氮肥,故含有氮气。
15. Na+ NaOH Ca(OH)2
【详解】(1)苏打是碳酸钠的俗称,碳酸钠溶液中的阳离子是钠离子,故填:Na+;
(2)干冰是固体二氧化碳,氧元素通常为-2价,设二氧化碳中碳元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(-2)×2+x=0,x=+4,元素化合价的表示方法是在化学式该元素的上方用正负号和数字表示,正负号标在数字前面,故二氧化碳中碳元素的化合价表示为:;
(3)苛性钠是氢氧化钠的俗称,化学式为:NaOH;
(4)生石灰是氧化钙的俗称,氧化钙与水反应生成氢氧化钙,故所得溶液的溶质是氢氧化钙,化学式为:Ca(OH)2。
16. 侯德榜 Na2CO3
【详解】联合制碱法(又称侯氏制碱法),它是我国化学工程专家侯德榜于1943年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法;
碳酸钠俗称纯碱,碳酸钠是由钠离子和碳酸根离子构成的化合物,其中钠离子显示+1价,碳酸根离子显示-2价,其化学式为Na2CO3;
氯化铵是由铵根离子和氯离子构成的化合物,其中阳离子为铵根离子,根据离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字。铵根离子的符号是。
17.(1)小于
(2) CuSO4 沉淀D加入稀盐酸,得到的是黄色溶液,没有得到蓝色溶液
(3)Cl-
(4)
(5)或
【分析】有某固体混合物,已知其中可能含有Na2CO3、CaCO3、CuSO4、FeCl3四种物质中的两种或多种。加入适量稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,故得到气体A,说明含碳酸钠和碳酸钙中至少一种,气体A为二氧化碳,向溶液B中加入适量氢氧化钠溶液,得到沉淀D和滤液E,向沉淀D中加入适量稀盐酸,得到黄色溶液,氯化铁和氢氧化钠反应生成氢氧化铁沉淀,氢氧化铁和稀盐酸反应生成氯化铁黄色溶液,硫酸铜和氢氧化钠反应生成氢氧化铜,氢氧化铜和稀盐酸反应生成氯化铜,氯化铜溶液是蓝色的,故固体混合物中一定含氯化铁,一定不含硫酸铜。
【详解】(1)由分析可知,气体A为二氧化碳,二氧化碳和水反应生成碳酸,碳酸显酸性,pH小于7;
(2)由分析可知,该固体混合物中,一定不存在的物质是CuSO4;因为向沉淀D中加入稀盐酸得到的是黄色溶液,不是蓝色溶液;
(3)向固体混合物中加入稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,向溶液B中加入适量氢氧化钠溶液,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,故滤液E中一定含氯化钠,可能含氯化钙,故一定大量存在的阴离子是氯离子,故填:Cl-;
(4)过程③中一定发生反应为氢氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:;
(5)过程①中发生反应为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:。
18.(1)氢氧化钠/NaOH
(2)NaCl、HCl
(3)
【详解】(1)甲车间的废水呈黄色,则甲排放的废水中含有FeCl3,处理时第①反应池中出现大量的红褐色沉淀,说明有氢氧化铁生成,则乙车间排放的废水主要成分是氢氧化钠(NaOH)。
(2)第②反应池中是盐酸和碳酸钠,故出现大量的气泡,且第②反应池中溶液是酸性,说明盐酸过量,所以第②反应池废水中的溶质有氯化钠和盐酸,故填NaCl、HCl。
(3)第③反应池中是氢氧化钠和盐酸的反应,化学反应方程式为:。
19.(1) 溶液变为红色 产生白色沉淀
(2)
(3)NaOH和Ca(OH)2
(4)Na2CO3和Ca(OH)2在溶液中会继续反应,不能共存
(5) 二 产生白色沉淀
(6)碱
(7)反应物是否过量
【详解】(1)1、碳酸钠溶液显碱性,能使无色酚酞试液变红,故现象为:溶液变红;
3、氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,故现象为:产生白色沉淀;
(2)试管3中发生反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:;
(3)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,如果恰好完全反应,则溶质为氢氧化钠,如果碳酸钠过量,则溶质为碳酸钠、氢氧化钠,如果氢氧化钙过量,则溶质为氢氧化钙、氢氧化钠,故猜想三:NaOH和Ca(OH)2;
(4)碳酸钠能与氢氧化钙反应生成碳酸钙和氢氧化钠,不能共存,故猜想四不成立;
(5)方案甲:取少量滤液A于试管中,加入过量的稀盐酸,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,产生气泡,说明含碳酸钠,则猜想二成立;
方案乙:取少量滤液A于试管中,加入适量硝酸钡溶液,硝酸钡能与碳酸钠反应生成碳酸钡和硝酸钠,故现象为:产生白色沉淀;
(6)由以上实验可知,碳酸钠溶液显碱性,能与盐酸、氢氧化钙、氯化钡等反应;
(7)由以上分析可知,要验证反应后物质的成分,既要考虑生成物,还应考虑反应物是否过量。
20.(1)四
(2)设参加反应的铁的质量为x
x=9.8g
则生铁中铁的质量分数为。
【详解】(1)通过表中第一、二、三次数据可以看出,随着硫酸质量的增加,氢气的质量成比例增加,但是第四次没有增加到0.4g,所以第四次生铁完全反应。
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.证据推理是化学学科核心素养之一。下列推理得出的结论合理的是
A.洗洁精去油污利用的是乳化作用,因此汽油去油污利用的也是乳化作用
B.可燃物燃烧温度要达到着火点,因此温度达到着火点时可燃物一定能燃烧
C.中和反应生成盐和水,因此生成盐和水的反应一定是中和反应
D.同种元素原子的质子数相同,因此质子数相同的原子一定是同种元素
2.物质的用途主要由性质决定,下列物质用途的描述主要利用的是化学性质的是
A.洗涤剂去油污 B.石墨做电极
C.稀盐酸除铁锈 D.食盐做调味品
3.下列说法中错误的是
A.水银不是银 B.干冰不是冰 C.纯碱不是碱 D.食盐不是盐
4.下列各组离子在pH=1的溶液中能大量共存的是
A. Na+ Cl﹣ B. K+ Na+
C.Cu2+ OH﹣ Cl﹣ Ba2+ D.Ag+ Cl﹣ Na+
5.关于硫酸和盐酸的说法不正确的是
A.都属于酸类 B.两者的溶液都具有导电性
C.都可用于除铁锈 D.两者的pH一定相等
6.下列几种作物适宜生长的pH范围如下:水稻6.0~70、茶树5.0~5.5、马铃薯4.8~5.5、大豆6.5~7.5、棉花6.0~6.8。下列说法不正确的是
A.pH越小,溶液的酸性越强
B.用盐酸除去铁锈
C.胃酸过多的病人在空腹时最好多喝一些柠檬汁
D.某地土壤的浸出液加入石蕊溶液,溶液略显蓝色,则该土壤最适宜种植的是大豆
7.下列做法不能达到实验目的的是
A.鉴别铁粉和氧化铜粉末一滴加稀硫酸
B.除去二氧化碳中的一氧化碳一点燃气体
C.比较黄铜片和铜片的硬度一将两种金属片相互刻画
D.除去氧气中的水蒸气一将气体通过浓硫酸
8.逻辑推理是化学学习中常用的思维方法。下列说法错误的是
A.点燃可燃性气体前都要检验纯度,则点燃氢气前需要检验纯度
B.溶液是均一的、稳定的混合物,则均一的、稳定的混合物一定是溶液
C.单质是由一种元素组成的纯净物。则由一种元素组成的纯净物一定是单质
D.碱溶液能使酚酞溶液变红色,则能使酚酞溶液变红色的溶液一定是碱溶液
9.下列反应的化学方程式及其应用都正确的是
A. 工业上用磁铁矿冶炼铁
B. 用于制取透视检查胃肠的钡餐
C. 用铁粉除去硫酸亚铁中的硫酸铜
D. 镁用于制作烟花爆竹
10.推理是一种重要的学习方法。下列推理中正确的是( )
A.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
B.在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定都显负价
C.碱中都含有氢氧根离子,所以含有氢氧根离子的化合物一定是碱
D.许多物质都可以与氧气发生化学反应,这类反应属于氧化反应,所以氧化反应定有O2参与
11.推理是化学学习中常用的思维方法,下列推理错误的是
A.生成盐和水的反应一定是中和反应
B.含有铵根离子的氮肥与熟石灰混合研磨后,一定会生成氨气
C.化合物是由不同种元素组成的物质,所以由同种元素组成的物质一定不是化合物
D.中和反应一定是复分解反应,复分解反应不一定是中和反应
二、填空与简答
12.氢氧燃料电池以氢气作燃料,空气作助燃剂,使用的空气必须要除去二氧化碳,否则将对导电介质氢氧化钠造成影响,原因是 (用化学方程式表示)。
13.某实验小组做如图实验。实验开始时,天平 甲、乙处于平衡状态,放置一段时间后,天平指针向右偏转。请回答下列问题。
甲瓶中的现象为 ;乙瓶中发生反应的化学方程式为 。
14.根据下列现象说明空气中存在的气体,请将该气体的名称填在横线上:
(1)澄清石灰水在空气中液面形成一层白色薄膜,原因是空气中含有 ;
(2)以空气为原料可以生产氮肥,这说明空气中有 ;
15.在日常生活中我们经常会听到一些物质的俗名,比如小苏打、碱石灰等请用正确的化学用语完成下面各题
(1)苏打溶液中的阳离子 ;
(2)请标出干冰中碳元素的化合价 ;
(3)苛性钠 ;
(4)生石灰加水后所得溶液的溶质 ;
16.联合制碱法(又称侯氏制碱法),它是我国化学工程专家 于1943年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法,碳酸钠俗称纯碱,其化学式为 ;氯化铵中阳离子的符号是 。
17.有某固体混合物,已知其中可能含有Na2CO3、CaCO3、CuSO4、FeCl3四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)
试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体A水溶液的pH 7(填“大于”“小于”“等于”之一)。
(2)该固体混合物中,一定不存在的物质是(写化学式) ,理由是: 。
(3)在滤液E中,一定大量存在的阴离子是(写离子符号) 。
(4)写出过程③中一定发生反应的化学方程式 。
(5)写出过程①中发生反应的一个化学方程式 。
18.“五水共治”的首要任务是“治废水”,合理处理废水是当前防治废水污染的重要举措。某化工厂有甲、乙、丙、丁四个车间,排放的废水中分别含有FeCl3、HCl、Na2CO3、NaOH的一种,甲车间的废水呈黄色。通过调节废水流量,使乙、丁两个车间废水相对过量,通过如图方式处理,最终可使排出的废水呈中性。处理时第①反应池中出现大量的红褐色沉淀,第②反应池中出现大量的气泡,请回答:
(1)乙车间排放的废水主要成分是 。
(2)写出第②反应池的废水中的溶质有 (用化学式表示)。
(3)写出第③反应池中发生的化学反应方程式 。
三、科学探究题
19.碳酸钠在生活中有广泛的用途,某化学兴趣小组为探究碳酸钠的化学性质,进行了如下实验:
(1)向盛有适量碳酸钠溶液的四支试管中分别加入下列试剂,实验现象记录如下:
试管编号 1 2 3 4
加入试剂 无色酚酞溶液 稀盐酸 澄清石灰水 氯化钡溶液
实验现象 有气泡产生 有白色沉淀产生
(2)试管3中发生反应的化学方程式为 。
化学兴趣小组的同学对反应后溶液中溶质的成分进一步探究:小组同学将试管3中的物质过滤,得到滤液A。
提出问题 滤液A中溶质的成分是什么?
(3)猜想假设 猜想一:NaOH;
猜想二:NaOH和Na2CO3;
猜想三: ;
猜想四:NaOH、Na2CO3和Ca(OH)2。
活动探究
(4)小组讨论:有同学认为猜想四不成立,原因是 。
(5)进行实验:
实验操作 实验现象 实验结论
方案甲:取少量滤液A于试管中, 加入过量的稀盐酸 有气泡生成 猜想 成立
方案乙:取少量滤液A于试管中, 加入适量的Ba(NO3)2溶液
反思与评价
(6)碳酸钠溶液呈 性,可以和盐酸、氢氧化钙、氯化钡等物质发生反应。
(7)要验证反应后物质的成分,既要考虑生成物,还应考虑 。
四、计算题
20.小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。
第一次 第二次 第三次 第四次
所取生铁的质量∕g 10 10 10 10
所加稀硫酸的质量∕g 25 50 75 100
生成氢气的质量∕g 0.10 0.20 0.30 0.35
根据她的实验数据,完成下列问题:
(1)第 次生铁完全反应?
(2)计算生铁中铁的质量分数是多少? (要有详细过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、洗洁精去油污,是因为洗洁精中含有乳化剂,具有乳化作用,能将油污乳化为细小油滴,随水冲走,汽油去油污,是因为汽油能溶解油污,不符合题意;
B、燃烧的条件:可燃物、温度达到着火点,与空气(或氧气)接触,故温度达到着火点时,可燃物不一定燃烧,还需与氧气(或空气)接触,不符合题意;
C、中和反应是酸与碱作用生成盐和水的反应,故中和反应生成盐和水,生成盐和水的反应不一定是中和反应,如二氧化碳和氢氧化钠反应生成碳酸钠和水,不符合题意;
D、元素是质子数相同的一类原子的总称,同种元素原子的质子数相同,因此质子数相同的原子一定是同种元素,符合题意。
故选D。
2.C
【分析】化学性质是物质在化学变化中表现出来的性质,如可燃性、氧化性、酸性、碱性等。
【详解】A、洗涤剂去油污是洗涤剂有乳化作用,它能将大的油污分散成细小的液滴,随水流走。发生的是物理变化,利用的是洗涤剂的物理性质。A不符合题意;
B、石墨做电极利用石墨的导电性,是石墨的物理性质。B不符合题意;
C、稀盐酸除铁锈是利用稀盐酸与铁锈反应生成氯化铁和水这一化学性质。C符合题意;
D、食盐做调味品是利用食盐有咸味这一物理性质。D不符合题意。
综上所述:选择C。
3.D
【详解】A、水银是金属汞,不是银,故A正确,不符合题意;
B、干冰是固态二氧化碳,冰是固态的水,故干冰不是冰,故B正确,不符合题意;
C、纯碱为碳酸钠,是由金属离子和酸根离子构成,为盐,故纯碱不是碱,故C正确,不符合题意;
D、食盐主要成分为氯化钠,是由金属离子和酸根离子构成,为盐,故D错误,符合题意。
故选:D。
4.A
【详解】离子能大量共存,它们之间不能结合产生水、气体或沉淀。
A、离子之间不会结合成水、沉淀或气体,该组离子能大量共存;正确;
B、 pH =1的溶液为强酸性溶液,含有氢离子,和氢离子不能共存;错误;
C、OH-不能在强酸性溶液中存在,氢离子和氢氧根离子反应产生水;错误;
D、Ag+与Cl-不能共存,反应产生氯化银沉淀;错误。
故选A。
5.D
【详解】解:A、盐酸和硫酸都是酸,该选项说法正确;
B、盐酸和硫酸中都有自由移动的离子,两者的溶液都具有导电性,该选项说法正确;
C、铁锈主要成分是氧化铁,氧化铁和盐酸反应生成氯化铁和水,和稀硫酸反应生成硫酸铁和水,该选项说法正确;
D、两者的pH不一定相等,该选项说法不正确。
故选D。
6.C
【详解】A、pH越小,溶液的酸性越强,正确;
B、铁锈的主要成分是氧化铁,盐酸可以和氧化铁反应,故用盐酸除去铁锈,正确;
C、柠檬汁显酸性,胃酸过多的病人在空腹时不能多喝柠檬汁,错误;
D、大豆适合在弱碱性土壤中生长,某地土壤的浸出液加入石蕊溶液,溶液略显蓝色,说明该土壤呈碱性,则该土壤最适宜种植的是大豆,正确;
故选C。
7.B
【详解】A、鉴别铁粉和氧化铜粉末,滴加稀硫酸,有气泡生成的是铁粉,没有气泡生成的氧化铜,做法能达到实验目的;
B、除去二氧化碳中的一氧化碳,二氧化碳浓度大,一氧化碳不能被点燃,做法不能达到实验目的;
C、比较黄铜片和铜片的硬度,将两种金属片相互刻画,有划痕的是铜片,没有划痕的是黄铜片,做法能达到实验目的;
D、除去氧气中的水蒸气,将气体通过浓硫酸,浓硫酸具有吸水性,可以吸收混合气体中的水蒸气,做法能达到实验目的;
答案:B。
8.D
【详解】A.点燃可燃性气体前均需要检验纯度,以免发生爆炸,所以点燃氢气前需要检验纯度,正确;
B.溶液具有均一性、稳定性,所以均一的、稳定的混合物一定是溶液,正确;
C.由同种元素组成的纯净物是单质,所以由一种元素组成的纯净物一定是单质,正确;
D.能使酚酞溶液变红色的溶液不一定是碱溶液,如碳酸钠属于盐,其水溶液呈碱性,也能使酚酞溶液变红色,错误。
故选:D。
9.A
【详解】A、工业上用磁铁矿冶炼铁,是一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:,符合题意;
B、氯化钡和二氧化碳、水不反应,且碳酸钡能与稀盐酸反应生成可溶性的氯化钡,不能用碳酸钡做钡餐,不符合题意;
C、铁能与硫酸铜反应生成硫酸亚铁和铜,故可用铁粉除去硫酸亚铁中的硫酸铜,该反应的化学方程式为:,不符合题意;
D、镁能在空气中燃烧生成氧化镁,发出耀眼白光,故镁可用于制作烟花爆竹,该反应的化学方程式为:,不符合题意。
故选A。
10.A
【详解】A、单质是由同种元素组成的纯净物,故由一种元素组成的纯净物一定是单质,说法正确,符合题意;
B、在化合物里,正负化合价的代数和为零,但是在同一化合物中金属元素显正价,非金属元素不一定都显负价,如碳酸钙中,钙元素显+2价,氧元素显-2价,碳元素属于非金属元素,但是显+4价,不符合题意;
C、碱中都含有氢氧根离子,但是含有氢氧根离子的化合物不一定是碱,如碱式碳酸铜中含氢氧根,但是属于盐,不符合题意;
D、许多物质都可以与氧气发生化学反应,这类反应属于氧化反应,但是氧化反应不一定有O2参与,如氢气在氯气中燃烧生成氯化氢,属于氧化反应,但是无氧气参与,不符合题意。
故选A。
11.A
【详解】A.酸和碱反应生成盐和水的反应是中和反应,但生成盐和水的反应不一定是中和反应,如:,反应生成盐和水,但不是中和反应,故选项推理错误,符合题意;
B.铵态氮肥能与碱性物质混合研磨产生有刺激性气味的气体,反应的原理是铵根离子与氢氧根离子反应生成氨气和水,故选项推理正确,不符合题意;
C.化合物是由不同种元素组成的纯净物,由同种元素组成的物质可能是单质、纯净物、混合物,但是一定不是化合物,因为化合物最少也有两种元素组成的,故选项推理正确,不符合题意;
D.中和反应是酸与碱之间的反应,属于复分解反应,复分解反应是指两种化合物相互交换成分生成另外两种化合物的反应,不一定是酸和碱之间的反应,则复分解反应不一定是中和反应,故选项推理正确,不符合题意;
故选:A。
12.2NaOH+CO2=== Na2CO3+H2O
【详解】二氧化碳能与氢氧化钠反应生成碳酸钠和水,反应的化学方程式是:2NaOH+CO2=== Na2CO3+H2O。
13. 有固体析出 CaO+H2O=Ca(OH)2
【详解】甲瓶中饱和食盐水中水分蒸发溶剂减少、溶质析出,故有固体析出,水蒸气移动至乙瓶中,水与氧化钙反应生成氢氧化钙,化学方程式为。
14. 二氧化碳 氮气
【详解】(1)澄清石灰水中的氢氧化钙易与空气中的二氧化碳反应形成一层白色薄膜,故含有二氧化碳;
(2)氮气中含有氮元素,空气中的氮气可以制造氮肥,故含有氮气。
15. Na+ NaOH Ca(OH)2
【详解】(1)苏打是碳酸钠的俗称,碳酸钠溶液中的阳离子是钠离子,故填:Na+;
(2)干冰是固体二氧化碳,氧元素通常为-2价,设二氧化碳中碳元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(-2)×2+x=0,x=+4,元素化合价的表示方法是在化学式该元素的上方用正负号和数字表示,正负号标在数字前面,故二氧化碳中碳元素的化合价表示为:;
(3)苛性钠是氢氧化钠的俗称,化学式为:NaOH;
(4)生石灰是氧化钙的俗称,氧化钙与水反应生成氢氧化钙,故所得溶液的溶质是氢氧化钙,化学式为:Ca(OH)2。
16. 侯德榜 Na2CO3
【详解】联合制碱法(又称侯氏制碱法),它是我国化学工程专家侯德榜于1943年创立的,是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法;
碳酸钠俗称纯碱,碳酸钠是由钠离子和碳酸根离子构成的化合物,其中钠离子显示+1价,碳酸根离子显示-2价,其化学式为Na2CO3;
氯化铵是由铵根离子和氯离子构成的化合物,其中阳离子为铵根离子,根据离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字。铵根离子的符号是。
17.(1)小于
(2) CuSO4 沉淀D加入稀盐酸,得到的是黄色溶液,没有得到蓝色溶液
(3)Cl-
(4)
(5)或
【分析】有某固体混合物,已知其中可能含有Na2CO3、CaCO3、CuSO4、FeCl3四种物质中的两种或多种。加入适量稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,故得到气体A,说明含碳酸钠和碳酸钙中至少一种,气体A为二氧化碳,向溶液B中加入适量氢氧化钠溶液,得到沉淀D和滤液E,向沉淀D中加入适量稀盐酸,得到黄色溶液,氯化铁和氢氧化钠反应生成氢氧化铁沉淀,氢氧化铁和稀盐酸反应生成氯化铁黄色溶液,硫酸铜和氢氧化钠反应生成氢氧化铜,氢氧化铜和稀盐酸反应生成氯化铜,氯化铜溶液是蓝色的,故固体混合物中一定含氯化铁,一定不含硫酸铜。
【详解】(1)由分析可知,气体A为二氧化碳,二氧化碳和水反应生成碳酸,碳酸显酸性,pH小于7;
(2)由分析可知,该固体混合物中,一定不存在的物质是CuSO4;因为向沉淀D中加入稀盐酸得到的是黄色溶液,不是蓝色溶液;
(3)向固体混合物中加入稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,向溶液B中加入适量氢氧化钠溶液,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,故滤液E中一定含氯化钠,可能含氯化钙,故一定大量存在的阴离子是氯离子,故填:Cl-;
(4)过程③中一定发生反应为氢氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:;
(5)过程①中发生反应为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:,碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:。
18.(1)氢氧化钠/NaOH
(2)NaCl、HCl
(3)
【详解】(1)甲车间的废水呈黄色,则甲排放的废水中含有FeCl3,处理时第①反应池中出现大量的红褐色沉淀,说明有氢氧化铁生成,则乙车间排放的废水主要成分是氢氧化钠(NaOH)。
(2)第②反应池中是盐酸和碳酸钠,故出现大量的气泡,且第②反应池中溶液是酸性,说明盐酸过量,所以第②反应池废水中的溶质有氯化钠和盐酸,故填NaCl、HCl。
(3)第③反应池中是氢氧化钠和盐酸的反应,化学反应方程式为:。
19.(1) 溶液变为红色 产生白色沉淀
(2)
(3)NaOH和Ca(OH)2
(4)Na2CO3和Ca(OH)2在溶液中会继续反应,不能共存
(5) 二 产生白色沉淀
(6)碱
(7)反应物是否过量
【详解】(1)1、碳酸钠溶液显碱性,能使无色酚酞试液变红,故现象为:溶液变红;
3、氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,故现象为:产生白色沉淀;
(2)试管3中发生反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:;
(3)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,如果恰好完全反应,则溶质为氢氧化钠,如果碳酸钠过量,则溶质为碳酸钠、氢氧化钠,如果氢氧化钙过量,则溶质为氢氧化钙、氢氧化钠,故猜想三:NaOH和Ca(OH)2;
(4)碳酸钠能与氢氧化钙反应生成碳酸钙和氢氧化钠,不能共存,故猜想四不成立;
(5)方案甲:取少量滤液A于试管中,加入过量的稀盐酸,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,产生气泡,说明含碳酸钠,则猜想二成立;
方案乙:取少量滤液A于试管中,加入适量硝酸钡溶液,硝酸钡能与碳酸钠反应生成碳酸钡和硝酸钠,故现象为:产生白色沉淀;
(6)由以上实验可知,碳酸钠溶液显碱性,能与盐酸、氢氧化钙、氯化钡等反应;
(7)由以上分析可知,要验证反应后物质的成分,既要考虑生成物,还应考虑反应物是否过量。
20.(1)四
(2)设参加反应的铁的质量为x
x=9.8g
则生铁中铁的质量分数为。
【详解】(1)通过表中第一、二、三次数据可以看出,随着硫酸质量的增加,氢气的质量成比例增加,但是第四次没有增加到0.4g,所以第四次生铁完全反应。
(2)见答案。
答案第1页,共2页
答案第1页,共2页
