【浙教版】2024年春初二科学讲义4粒子模型与原子结构-答案附后
文档属性
| 名称 | 【浙教版】2024年春初二科学讲义4粒子模型与原子结构-答案附后 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-22 14:55:53 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
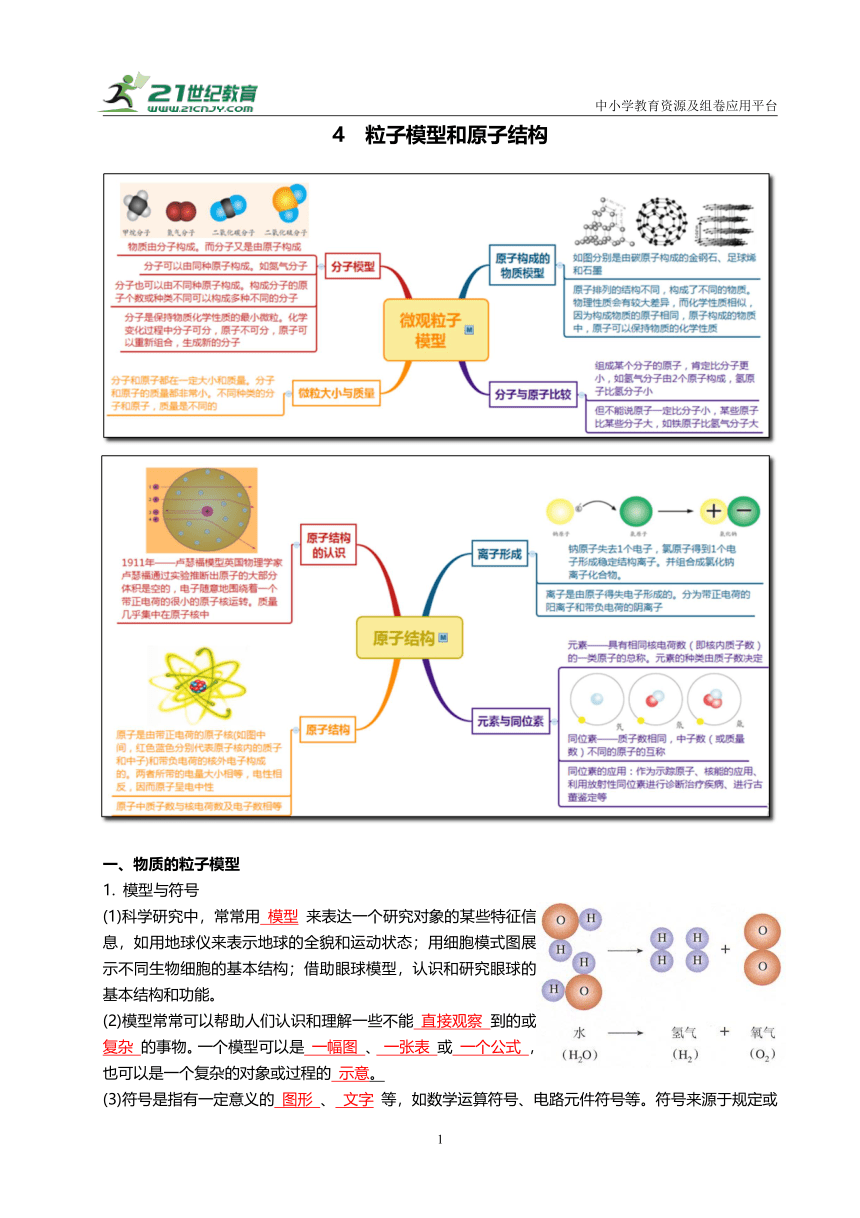
4 粒子模型和原子结构
一、物质的粒子模型
1. 模型与符号
(1)科学研究中,常常用 模型 来表达一个研究对象的某些特征信息,如用地球仪来表示地球的全貌和运动状态;用细胞模式图展示不同生物细胞的基本结构;借助眼球模型,认识和研究眼球的基本结构和功能。
(2)模型常常可以帮助人们认识和理解一些不能 直接观察 到的或 复杂 的事物。一个模型可以是 一幅图 、 一张表 或 一个公式 ,也可以是一个复杂的对象或过程的 示意。
(3)符号是指有一定意义的 图形 、 文字 等,如数学运算符号、电路元件符号等。符号来源于规定或者约定俗成,其形式简单,种类繁多,用途广泛,具有很强的实用性。
用 符号 能简单明了地表示事物,还可避免由于事物 外形 不同和表达的 文字语言 不同而引起的混乱。
模型与符号的区别与联系
符号 模型
表示方法 字母数字等 较简单 物体、图、表、表达式等 相对复杂
作用 使事物简单化 更好认识和理解事物 具体、直观
例子 Kg、H2O 地球仪、细胞模式图、公式
关系 模型中可能含有符号
2. 分子由原子构成
(1)通过水电解微观示意图可知:
①分子是由原子构成的。
②化学变化中,分子的种类发生变化,变成了新物质的分子,分子的性质也就发生了变化。
因此,对于由分子构成的物质而言,分子是保持物质化学性质的最小微粒。
③原子的种类和数量没有发生变化,即化学变化中,原子不可分。因此,原子是化学变化中的最小微粒。
(2)分子和原子都能构成物质
分子和原子都是构成物质的微粒。有的物质由分子构成,如水、氢气、氧气、二氧化碳、甲烷等物质都是由分子构成的;有的物质是直接由原子构成的,由原子构成的物质主要有三类:金属、稀有气体和某些固态非金属(如碳、硅、硫、磷等)。
3.分子的种类
(1)分子可以由同种原子构成,也可以由不同种原子构成。如氢气分子、氧气分子、臭氧分子都是由同种原子构成的,二氧化碳分子、甲烷分子等都是由不同种原子构成的。
(2)不同数量的同种原子可以结合成不同的分子。如一个氧气分子由两个氧原子构成,一个臭氧分子由三个氧原子构成。
(3)不同种原子以不同的原子数量可以结合成不同的分子。如水分子和过氧化氢分子都是由氢原子和氧原子构成的,一个水分子由两个氢原子和一个氧原子构成,一个过氧化氢分子由两个氢原子和两个氧原子构成,一氧化碳分子和二氧化碳分子也是这种情况。
由此我们可以得出,分子的种类由原子的种类和数量决定。
(4)由原子直接构成物质时,原子种类不同,物质不同;同种原子以不同结构构成物质,物质种类也不同。
金刚石 石墨
金刚石、石墨都是由碳原子构成的,由于碳原子的排列方式不同,造成它们的内部结构不同,它们的物理性质和用途也不同,金刚石坚硬无比,可做钻头和刻刀,而石墨质软且有滑腻感,可用于制作铅笔芯和高温润滑剂。由此我们可知,同种原子可以以不同的结构构成不同的物质。
4.分子和原子的区别与联系
分子 原子
不同点 在由分子构成的物质中,分子是保持物质化学性质的最小粒子,分子在化学变化中可以再分 原子是化学变化中的最小粒子,原子在化学变化中不能再分
相同点 ①质量和体积都很小; ②都在不停地做无规则运动; ③微粒间都有空隙; ④同种微粒性质相同,不同种微粒性质不同; ⑤都能直接构成物质
联系 分子 原子
用分子的观点解释物质的变化
①物理变化:分子本身不变,只是构成物质的分子间的空隙发生变化
②化学变化:分子本身发生变化,变成更小的微粒-原子,而原子又结合成新的分子。
5.粒子的大小与质量
分子和原子都有一定的质量和体积。
(1)分子和原子的体积都很小,原子半径一般在10-10米数量级。如碳原子半径为0.6x10-10米。
(2)分子和原子的质量也非常小。1个碳原子的质量约为1.9939x10-26千克。
(3)不同种类的分子和原子质量不同,体积也不同。
(4)一个分子的质量等于该分子中各原子的质量之和。
二、原子结构模型
1. 原子结构模型的建立
时间 模型类型 科学家 模型说明 建立模型的依据
1803 实心球模型 道尔顿(英国) 认为原子是一个实心球体 猜测
1897 枣糕模型(又叫西瓜模型) 汤姆生(英国) 原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌其中 汤姆生发现电子,且测得电子带负电,而原子显电中性
1911 核式结构模型(又叫行星模型) 卢瑟福(英国) ①原子的大部分体积是空的 ②在原子的中心有一个很小的原子核 ③原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间绕核运动 a粒子轰击金属箔实验
1913 分层模型 玻尔 (丹麦) 电子在原子核外空间的一定轨道上分层绕核做高速的运动 带负电的电子只能在原子内的一些特定稳定轨道上运动
建立模型往往需要有一个不断完善 、不断修正的过程,以使模型更接近事物的本质,现在原子结构模型已经修正到电子云模型。
2. 原子的构成
原子是由带正电荷的原子核和带负电荷的核外电子构成的。电子在原子核外空间做高速绕核运动,一个电子带一个单位负电荷,原子核所带的正电荷与核外电子所带的负电荷总数相等,电性相反,因此原子呈电中性。
3. 原子核与原子大小的比较
原子很小,原子核更小。原子核的半径大约是原子半径的十万分之一,原子核的体积虽然很小,但它几乎集中了原子的全部质量。原子核对于原子,就好比足球场内的一只蚂蚁
原子核的构成
(1)原子核是由更小的两种粒子一质子和中子构成的(氢原子除外)
(2)原子核带正电,原子核中一个质子带一个单位正电荷,中子不带电;核外电子带负电,一个电子带一个单位负电荷。而原子呈电中性,因此质子数 = 核外电子数。
(3)科学上把原子核所带的电荷数称为核电荷数。核电荷数 = 质子数。
5. 构成原子的各种粒子之间的关系
(1)原子中,核电荷数=质子数=核外电子数。如氧原子核内有8个质子,则氧原子核带8个单位正电荷(即+8), 即核电荷数为8,而核外电子数也为8。
(2)中子数不一定等于质子数。如钠原子的质子数为11,中子数为12,两者并不相等。
(3)原子核内一定有质子, 但不一定有中子。如普通氢原子核内只有1个质子而没有中子。
6. 带电的原子-离子
(1)概念:带电的原子或原子团。原子团是由两种或两种以上元素的原子结合而成的原子集团,在许多化学反应中作为一个整体参加反应。
(2)离子的分类:
阳离子:带正电荷的原子或原子团,如钠离子,铵根离子。
阴离子:带负电荷的原子或原子团,如氯离子,硫酸根离子。
离子的形成:
一般来说,金属原子容易失去最外层电子变成阳离子,非金属原子容易得到电子变成阴离子。
(4)原子与离子的比较
项目 原子 离子
阳离子 阴离子
结构关系 质子数 = 电子数 质子数 > 电子数 质子数 < 电子数
电性 呈电中性 带正电 带负电
相互转化 同种元素的原子和离子的原子核相同,原子得、失电子后形成阴、阳离子
(6)氯化钠的形成
钠在氯气中燃烧时,钠原子失去1个电子形成带正电荷的钠离子,氯原子得到1个电子形成带负电荷的氯离子。带相反电荷的钠离子和氯离子之间相互吸引,构成了呈电中性的氯化钠。
7. 元素
具有相同核电荷数(即质子数)的一类原子总称为元素。如氧元素就是所有核电荷数为8的氧原子的总称,氢元素就是所有核电荷数为1的氢原子的总称。
8. 同位素
(1)定义:原子核内的质子数相同、中子数不相同的同类原子互为同位素原子。
(2)同位素原子是一种元素的不同种原子。如三种氧原子:氧-16、氧-17、氧-18的质子数均为8,中子数分别为8、9、10,因此它们都属于氧元素,不同的是其核内的中子数。
(3)同位素原子的表示方法
为了区分元素的同位素原子,常用原子符号(AzX)表示,其中X表示原子种类,Z表示质子数,A表示质子数和中子数之和。如氢有氕(11H)、氚(21H )氚(31H)三种同位素。
(4)同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。如质谱分析中,用稳定同位素原子作为示踪原子;核潜艇利用铀的同位素裂变释放的能量作为动力;利用放射性同位素对一些脏器进行扫描,诊断肿瘤等疾病;根据放射性同位素的半衰期,进行古董鉴定。
四、典型例题
(一)考点:粒子模型
【例1】(2024建功单元)2022年2月4日,第24届冬季奥林匹克运动会在北京开幕,下列有关冬奥会的信息属于模型的是( )
A、冬奥会会徽 B、冬奥会冰球项目标志
C、冬奥会场馆沙盘 D、场馆内禁止吸烟标识
【例2】(2023浙江专题)有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质,其中由原子直接构成的是( )
A.②③⑤ B.③⑤⑧ C.②⑤⑦ D.①④⑥
【例3】(2023杭州期中)下列各图中●和〇分别表示氢原子和氧原子,其中能表示保持H2O化学性质的微粒是( )
B.
C.D.
【例4】(2022杭州期中)下列有关分子、原子的叙述错误的是( )
A.分子一定比原子质量大
B.对于分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子、原子都是构成物质的粒子
D.在化学变化中,原子是不能再分的一种粒子
【例5】(2021浙江专题)下列对一些事实的微观解释错误的是( )
选项 事实 解释
A 固体碘和碘蒸气都能使淀粉溶液变为蓝色 构成物质的原子相同,化学性质相同
B 金刚石的硬度远大于石墨 原子排列方式不同
C 水通直流电产生氢气和氧气 化学变化中分子是可以再分的
D 炎热的夏天自行车车胎容易爆裂 分子间间隔变大
A.A B.B C.C D.D
(二)考点:原子结构
【例1】(2024建功单元)推理是初中科学常用的思维方法。下列推理正确的是( )
①离子是带电荷的微粒,所以带电荷的微粒一定是离子;
②同种元素质子数相同,所以质子数相同的微粒一定是同一种元素:
③单质中只含一种元素,所以由一种元素组成的物质一定是单质
只有① B.只有② C.只有③ D.①②③都不正确
【例2】(2024建功单元)用“”“ ”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A、甲、乙互为同位素 B、乙、丁为同一种元素
C、甲、丙的核电荷数不同 D、丙、丁为同一种原子
【例3】(2024建功单元)1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象.由实验得出的结论合理的是( )
A 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D. 该实验说明α粒子无法穿透原子与原子间的空隙
【例4】(2023湖州中考)金属钠可以在氯气中燃烧,生成氯化钠。从微观角度分析,下列说法错误的是( )
A.燃烧过程中钠原子失去电子形成钠离子
B.氯离子中质子数大于电子数
C.钠离子与氯离子之间相互吸引,构成电中性的氯化钠
D.氯原子转变为氯离子的过程中,核内质子数不变
【例5】(2023·浙江·一模)月球土壤中含有较丰富的氦-3,而在地球上,氦元素主要以氦-4的形式存在。图是氦-3和氦-4的原子结构示意图,图中“o”代表( )
A.质子 B.中子 C.电子 D.原子核
【例6】(2024建功单元)理解分子、原子、离子、元素等概念,会运用这些概念正确描述物质的组成和构成是学好化学的关键。下面请用“分子”“原子”“离子”“元素”“质子”、“中子”、“电子”、“原子核”填空:
(1)水是由氢和氧______________组成的。 (2)酒精是由______________构成的。
(3)汞是由汞______________构成的.(4)氯化钠是由______________构成的。
(5)能保持水银化学性质的微粒是______________。(6)显示电中性的微粒有______________。
(7)带正电的微粒有______________。 (8)质量最小的微粒是______________。(9)在同一原子里数目相等的是______________
四、学力训练
A组 夯实基础
1.(2023浙江专题)用模型和符号表现事物是两种常见的科学方法,下列选项中属于符号的是( )
A.原子结构B.眼球结构 C.密度公式D.节约用水
2.(2021浙江专题)下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
3.(2023浙江期中)人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )
A.发现电子的科学家是汤姆生,他认为原子是一个球体,不可分
B.卢瑟福提出原子的全部正电荷和几乎全部的质量都集中在原子核里
C.通过实验,科学家们发现原子核一般是由质子和中子构成的
D.质子和中子都是由更微小的基本粒子——夸克构成的
4.(2023宁波期末)不同种元素最本质的区别是( )
A.中子数不同 B.质子数不同
C.原子质量不同 D.核外电子数不同
5.(2023宁波期末)反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
B组 强化提高
1.(2023浙江期中)下列选项不属于模型的是( )
A.足球烯B.电路图C.钠元素D.欧姆定律
2.(2024浙江开学)模型法指通过模型来揭示原型的形态、特征和本质。下列属于模型法的是( )
A.用放大镜观察蜗牛的身体 B.测量科学书本中一张纸的厚度
C.用三色橡皮泥制作地球结构 D.参照动物分类方法对植物分类
3.(2023浙江一模)如图是卢瑟福将带正电的α粒子流轰击金箔后的运动轨迹示意图,其中能说明原子质量几乎全部集中在原子核内的轨迹是( )
A.a B.b C.c D.d
4.(2023浙江一模)如图所示通过对黑箱“输入”“输出”的信息,推理出黑箱内部情况的方法称为黑箱法。下列操作主要运用了黑箱法的是( )
A.用磁感线描述磁场分布 B.用压强计研究液体内部的压强
C.通过a粒子轰击金箔研究原子内部结构 D.用金属丝研究电阻大小的影响因素
5.(2023浙江一模)氯化钠溶液中的一个钠离子与金属钠中的一个钠原子之间不同的是( )
A.质子数 B.电子数 C.中子数 D.核电荷数
6.(2023杭州中考)华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子()中含有的质子个数为( )
A.3 B.10 C.12 D.20
7.(2023浙江期中)我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示。下列有关说法正确的是( )
A.中子的质量相对于带电的质子和电子,可以忽略
B.原子核内质子带正电,核外电子带负电
C.所有原子中,质子数=中子数
D.质子和中子由更小的、不能再分的夸克构成
8.(2023浙江期中)下列有关分子和原子的说法中,正确的是( )
A.分子可直接构成物质,而原子要先构成分子后才能构成物质
B.在化学变化中,分子可以再分,原子不能再分
C.分子能保持物质的化学性质,原子不能保持物质的化学性质
D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小
9. (2024建功单元)人类对微观世界的探究永无止境。请根据所学知识回答:
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,1897年汤姆生发现电子并提出类似西瓜”的原子模型,认为电子就像西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,如今这些观点均是______________(填“正确”或“错误”)的。
(2)卢瑟福进行a粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的原子核和核外电子构成。如图甲是卢瑟福用a 粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个______________。
A、建立模型的过程 B、得出结论的过程
C、提出问题的过程 D、验证证据的过程
(3)卢瑟福在α散射实验中(a粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是______________
10.(2024建功单元)“用微观的钥匙开启宏观问题之门”是化学学科研究物质的一般方法,而构建模型又常常是我们认识微观世界的重要手段。下列各组微观模型图回答问题:
(1) 水电解的过程可用如图表示,微粒运动变化的先后顺序是______________。
(2) 如图为某化学反应的微观过程。从图中选出应该添加在“ ”处的微观模型示意图______________。(填写选项编号) , 参加反应的反应物分子个数比为______________
C组 瞄准中考
1.(2023浙江期中)思维模型是依据事物发展内在规律所建立的解决问题的基本框架。海水淡化是将海水中的盐与水分开,常用加热蒸馏法将海水加热形成水蒸气。该方法属于下列模型中的( )
A.性质差异 B.分离转移 C.反应转化 D.恢复原态
2.(2021衢州期中)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
3.(2023鹿城期中)小实学习了氧气相关知识后,将其梳理成如下思维导图,请完成问题。
根据氧原子的微观结构图可知,氧原子的质子数为( )
A.2 B.6 C.8 D.16
4.(2023浙江期中)从微观的角度来认识物质的构成和物质的变化,是学习科学的重要方法。
(1)下列物质中,由原子直接构成的是 。
A.甲烷 B.金刚石 C.水银 D.氮气
(2)如图分别是物质发生变化的微观示意图。
请回答:
①图1表示的变化,从微观角度看改变的是 ;
②图2表示的变化,从微观角度看,在变化前后,一定改变的是 。
5. (2023仙居期末)为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;
现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以O、●和分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是 。
参考答案
四、典型例题
(一)考点:粒子模型
【例1】(2024建功单元)2022年2月4日,第24届冬季奥林匹克运动会在北京开幕,下列有关冬奥会的信息属于模型的是( )
A、冬奥会会徽 B、冬奥会冰球项目标志
C、冬奥会场馆沙盘 D、场馆内禁止吸烟标识
【答案】C
【例2】(2023浙江专题)有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质,其中由原子直接构成的是( )
A.②③⑤ B.③⑤⑧ C.②⑤⑦ D.①④⑥
【答案】B
【例3】(2023杭州期中)下列各图中●和〇分别表示氢原子和氧原子,其中能表示保持H2O化学性质的微粒是( )
B.
C.D.
【答案】A
【例4】(2022杭州期中)下列有关分子、原子的叙述错误的是( )
A.分子一定比原子质量大
B.对于分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子、原子都是构成物质的粒子
D.在化学变化中,原子是不能再分的一种粒子
【答案】A
【例5】(2021浙江专题)下列对一些事实的微观解释错误的是( )
选项 事实 解释
A 固体碘和碘蒸气都能使淀粉溶液变为蓝色 构成物质的原子相同,化学性质相同
B 金刚石的硬度远大于石墨 原子排列方式不同
C 水通直流电产生氢气和氧气 化学变化中分子是可以再分的
D 炎热的夏天自行车车胎容易爆裂 分子间间隔变大
A.A B.B C.C D.D
【答案】A
(二)考点:原子结构
【例1】(2024建功单元)推理是初中科学常用的思维方法。下列推理正确的是( )
①离子是带电荷的微粒,所以带电荷的微粒一定是离子;
②同种元素质子数相同,所以质子数相同的微粒一定是同一种元素:
③单质中只含一种元素,所以由一种元素组成的物质一定是单质
只有① B.只有② C.只有③ D.①②③都不正确
【答案】D
【例2】(2024建功单元)用“”“ ”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A、甲、乙互为同位素 B、乙、丁为同一种元素
C、甲、丙的核电荷数不同 D、丙、丁为同一种原子
【答案】B
【例3】(2024建功单元)1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象.由实验得出的结论合理的是( )
A 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D. 该实验说明α粒子无法穿透原子与原子间的空隙
【答案】C
【例4】(2023湖州中考)金属钠可以在氯气中燃烧,生成氯化钠。从微观角度分析,下列说法错误的是( )
A.燃烧过程中钠原子失去电子形成钠离子
B.氯离子中质子数大于电子数
C.钠离子与氯离子之间相互吸引,构成电中性的氯化钠
D.氯原子转变为氯离子的过程中,核内质子数不变
【答案】B
【例5】(2023·浙江·一模)月球土壤中含有较丰富的氦-3,而在地球上,氦元素主要以氦-4的形式存在。图是氦-3和氦-4的原子结构示意图,图中“o”代表( )
A.质子 B.中子 C.电子 D.原子核
【答案】B
【例6】(2024建功单元)理解分子、原子、离子、元素等概念,会运用这些概念正确描述物质的组成和构成是学好化学的关键。下面请用“分子”“原子”“离子”“元素”“质子”、“中子”、“电子”、“原子核”填空:
(1)水是由氢和氧______________组成的。 (2)酒精是由______________构成的。
(3)汞是由汞______________构成的.(4)氯化钠是由______________构成的。
(5)能保持水银化学性质的微粒是______________。(6)显示电中性的微粒有______________。
(7)带正电的微粒有______________。 (8)质量最小的微粒是______________。(9)在同一原子里数目相等的是______________
【答案】元素 分子 原子 离子 原子 分子,原子,中子 质子,原子核 电子 质子与电子
四、学力训练
A组 夯实基础
1.(2023浙江专题)用模型和符号表现事物是两种常见的科学方法,下列选项中属于符号的是( )
A.原子结构B.眼球结构 C.密度公式D.节约用水
【答案】D
2.(2021浙江专题)下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
【答案】C
3.(2023浙江期中)人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )
A.发现电子的科学家是汤姆生,他认为原子是一个球体,不可分
B.卢瑟福提出原子的全部正电荷和几乎全部的质量都集中在原子核里
C.通过实验,科学家们发现原子核一般是由质子和中子构成的
D.质子和中子都是由更微小的基本粒子——夸克构成的
【答案】A
4.(2023宁波期末)不同种元素最本质的区别是( )
A.中子数不同 B.质子数不同
C.原子质量不同 D.核外电子数不同
【答案】B
5.(2023宁波期末)反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
【答案】B
B组 强化提高
1.(2023浙江期中)下列选项不属于模型的是( )
A.足球烯B.电路图C.钠元素D.欧姆定律
【答案】C
2.(2024浙江开学)模型法指通过模型来揭示原型的形态、特征和本质。下列属于模型法的是( )
A.用放大镜观察蜗牛的身体 B.测量科学书本中一张纸的厚度
C.用三色橡皮泥制作地球结构 D.参照动物分类方法对植物分类
【答案】C
3.(2023浙江一模)如图是卢瑟福将带正电的α粒子流轰击金箔后的运动轨迹示意图,其中能说明原子质量几乎全部集中在原子核内的轨迹是( )
A.a B.b C.c D.d
【答案】C
4.(2023浙江一模)如图所示通过对黑箱“输入”“输出”的信息,推理出黑箱内部情况的方法称为黑箱法。下列操作主要运用了黑箱法的是( )
A.用磁感线描述磁场分布 B.用压强计研究液体内部的压强
C.通过a粒子轰击金箔研究原子内部结构 D.用金属丝研究电阻大小的影响因素
【答案】C
5.(2023浙江一模)氯化钠溶液中的一个钠离子与金属钠中的一个钠原子之间不同的是( )
A.质子数 B.电子数 C.中子数 D.核电荷数
【答案】B
6.(2023杭州中考)华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子()中含有的质子个数为( )
A.3 B.10 C.12 D.20
【答案】B
7.(2023浙江期中)我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示。下列有关说法正确的是( )
A.中子的质量相对于带电的质子和电子,可以忽略
B.原子核内质子带正电,核外电子带负电
C.所有原子中,质子数=中子数
D.质子和中子由更小的、不能再分的夸克构成
【答案】B
8.(2023浙江期中)下列有关分子和原子的说法中,正确的是( )
A.分子可直接构成物质,而原子要先构成分子后才能构成物质
B.在化学变化中,分子可以再分,原子不能再分
C.分子能保持物质的化学性质,原子不能保持物质的化学性质
D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小
【答案】B
9. (2024建功单元)人类对微观世界的探究永无止境。请根据所学知识回答:
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,1897年汤姆生发现电子并提出类似西瓜”的原子模型,认为电子就像西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,如今这些观点均是______________(填“正确”或“错误”)的。
(2)卢瑟福进行a粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的原子核和核外电子构成。如图甲是卢瑟福用a 粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个______________。
A、建立模型的过程 B、得出结论的过程
C、提出问题的过程 D、验证证据的过程
(3)卢瑟福在α散射实验中(a粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是______________
【答案】错误 A 大部分a粒子都没有改变方向,直接穿过原子
10.(2024建功单元)“用微观的钥匙开启宏观问题之门”是化学学科研究物质的一般方法,而构建模型又常常是我们认识微观世界的重要手段。下列各组微观模型图回答问题:
(1) 水电解的过程可用如图表示,微粒运动变化的先后顺序是______________。
(2) 如图为某化学反应的微观过程。从图中选出应该添加在“ ”处的微观模型示意图______________。(填写选项编号) , 参加反应的反应物分子个数比为______________
【答案】①②③④ ③ 2:1
C组 瞄准中考
1.(2023浙江期中)思维模型是依据事物发展内在规律所建立的解决问题的基本框架。海水淡化是将海水中的盐与水分开,常用加热蒸馏法将海水加热形成水蒸气。该方法属于下列模型中的( )
A.性质差异 B.分离转移 C.反应转化 D.恢复原态
【答案】B
2.(2021衢州期中)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【答案】B
3.(2023鹿城期中)小实学习了氧气相关知识后,将其梳理成如下思维导图,请完成问题。
根据氧原子的微观结构图可知,氧原子的质子数为( )
A.2 B.6 C.8 D.16
【答案】C
4.(2023浙江期中)从微观的角度来认识物质的构成和物质的变化,是学习科学的重要方法。
(1)下列物质中,由原子直接构成的是 。
A.甲烷 B.金刚石 C.水银 D.氮气
(2)如图分别是物质发生变化的微观示意图。
请回答:
①图1表示的变化,从微观角度看改变的是 ;
②图2表示的变化,从微观角度看,在变化前后,一定改变的是 。
【答案】BC 水分子本身没有改变,只是分子间隔变小 分子种类
5. (2023仙居期末)为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;
现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以O、●和分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是 。
【答案】 (1)原子核很小且质量很大;(2)A;(3)D。
4 粒子模型和原子结构
一、物质的粒子模型
1. 模型与符号
(1)科学研究中,常常用 模型 来表达一个研究对象的某些特征信息,如用地球仪来表示地球的全貌和运动状态;用细胞模式图展示不同生物细胞的基本结构;借助眼球模型,认识和研究眼球的基本结构和功能。
(2)模型常常可以帮助人们认识和理解一些不能 直接观察 到的或 复杂 的事物。一个模型可以是 一幅图 、 一张表 或 一个公式 ,也可以是一个复杂的对象或过程的 示意。
(3)符号是指有一定意义的 图形 、 文字 等,如数学运算符号、电路元件符号等。符号来源于规定或者约定俗成,其形式简单,种类繁多,用途广泛,具有很强的实用性。
用 符号 能简单明了地表示事物,还可避免由于事物 外形 不同和表达的 文字语言 不同而引起的混乱。
模型与符号的区别与联系
符号 模型
表示方法 字母数字等 较简单 物体、图、表、表达式等 相对复杂
作用 使事物简单化 更好认识和理解事物 具体、直观
例子 Kg、H2O 地球仪、细胞模式图、公式
关系 模型中可能含有符号
2. 分子由原子构成
(1)通过水电解微观示意图可知:
①分子是由原子构成的。
②化学变化中,分子的种类发生变化,变成了新物质的分子,分子的性质也就发生了变化。
因此,对于由分子构成的物质而言,分子是保持物质化学性质的最小微粒。
③原子的种类和数量没有发生变化,即化学变化中,原子不可分。因此,原子是化学变化中的最小微粒。
(2)分子和原子都能构成物质
分子和原子都是构成物质的微粒。有的物质由分子构成,如水、氢气、氧气、二氧化碳、甲烷等物质都是由分子构成的;有的物质是直接由原子构成的,由原子构成的物质主要有三类:金属、稀有气体和某些固态非金属(如碳、硅、硫、磷等)。
3.分子的种类
(1)分子可以由同种原子构成,也可以由不同种原子构成。如氢气分子、氧气分子、臭氧分子都是由同种原子构成的,二氧化碳分子、甲烷分子等都是由不同种原子构成的。
(2)不同数量的同种原子可以结合成不同的分子。如一个氧气分子由两个氧原子构成,一个臭氧分子由三个氧原子构成。
(3)不同种原子以不同的原子数量可以结合成不同的分子。如水分子和过氧化氢分子都是由氢原子和氧原子构成的,一个水分子由两个氢原子和一个氧原子构成,一个过氧化氢分子由两个氢原子和两个氧原子构成,一氧化碳分子和二氧化碳分子也是这种情况。
由此我们可以得出,分子的种类由原子的种类和数量决定。
(4)由原子直接构成物质时,原子种类不同,物质不同;同种原子以不同结构构成物质,物质种类也不同。
金刚石 石墨
金刚石、石墨都是由碳原子构成的,由于碳原子的排列方式不同,造成它们的内部结构不同,它们的物理性质和用途也不同,金刚石坚硬无比,可做钻头和刻刀,而石墨质软且有滑腻感,可用于制作铅笔芯和高温润滑剂。由此我们可知,同种原子可以以不同的结构构成不同的物质。
4.分子和原子的区别与联系
分子 原子
不同点 在由分子构成的物质中,分子是保持物质化学性质的最小粒子,分子在化学变化中可以再分 原子是化学变化中的最小粒子,原子在化学变化中不能再分
相同点 ①质量和体积都很小; ②都在不停地做无规则运动; ③微粒间都有空隙; ④同种微粒性质相同,不同种微粒性质不同; ⑤都能直接构成物质
联系 分子 原子
用分子的观点解释物质的变化
①物理变化:分子本身不变,只是构成物质的分子间的空隙发生变化
②化学变化:分子本身发生变化,变成更小的微粒-原子,而原子又结合成新的分子。
5.粒子的大小与质量
分子和原子都有一定的质量和体积。
(1)分子和原子的体积都很小,原子半径一般在10-10米数量级。如碳原子半径为0.6x10-10米。
(2)分子和原子的质量也非常小。1个碳原子的质量约为1.9939x10-26千克。
(3)不同种类的分子和原子质量不同,体积也不同。
(4)一个分子的质量等于该分子中各原子的质量之和。
二、原子结构模型
1. 原子结构模型的建立
时间 模型类型 科学家 模型说明 建立模型的依据
1803 实心球模型 道尔顿(英国) 认为原子是一个实心球体 猜测
1897 枣糕模型(又叫西瓜模型) 汤姆生(英国) 原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌其中 汤姆生发现电子,且测得电子带负电,而原子显电中性
1911 核式结构模型(又叫行星模型) 卢瑟福(英国) ①原子的大部分体积是空的 ②在原子的中心有一个很小的原子核 ③原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间绕核运动 a粒子轰击金属箔实验
1913 分层模型 玻尔 (丹麦) 电子在原子核外空间的一定轨道上分层绕核做高速的运动 带负电的电子只能在原子内的一些特定稳定轨道上运动
建立模型往往需要有一个不断完善 、不断修正的过程,以使模型更接近事物的本质,现在原子结构模型已经修正到电子云模型。
2. 原子的构成
原子是由带正电荷的原子核和带负电荷的核外电子构成的。电子在原子核外空间做高速绕核运动,一个电子带一个单位负电荷,原子核所带的正电荷与核外电子所带的负电荷总数相等,电性相反,因此原子呈电中性。
3. 原子核与原子大小的比较
原子很小,原子核更小。原子核的半径大约是原子半径的十万分之一,原子核的体积虽然很小,但它几乎集中了原子的全部质量。原子核对于原子,就好比足球场内的一只蚂蚁
原子核的构成
(1)原子核是由更小的两种粒子一质子和中子构成的(氢原子除外)
(2)原子核带正电,原子核中一个质子带一个单位正电荷,中子不带电;核外电子带负电,一个电子带一个单位负电荷。而原子呈电中性,因此质子数 = 核外电子数。
(3)科学上把原子核所带的电荷数称为核电荷数。核电荷数 = 质子数。
5. 构成原子的各种粒子之间的关系
(1)原子中,核电荷数=质子数=核外电子数。如氧原子核内有8个质子,则氧原子核带8个单位正电荷(即+8), 即核电荷数为8,而核外电子数也为8。
(2)中子数不一定等于质子数。如钠原子的质子数为11,中子数为12,两者并不相等。
(3)原子核内一定有质子, 但不一定有中子。如普通氢原子核内只有1个质子而没有中子。
6. 带电的原子-离子
(1)概念:带电的原子或原子团。原子团是由两种或两种以上元素的原子结合而成的原子集团,在许多化学反应中作为一个整体参加反应。
(2)离子的分类:
阳离子:带正电荷的原子或原子团,如钠离子,铵根离子。
阴离子:带负电荷的原子或原子团,如氯离子,硫酸根离子。
离子的形成:
一般来说,金属原子容易失去最外层电子变成阳离子,非金属原子容易得到电子变成阴离子。
(4)原子与离子的比较
项目 原子 离子
阳离子 阴离子
结构关系 质子数 = 电子数 质子数 > 电子数 质子数 < 电子数
电性 呈电中性 带正电 带负电
相互转化 同种元素的原子和离子的原子核相同,原子得、失电子后形成阴、阳离子
(6)氯化钠的形成
钠在氯气中燃烧时,钠原子失去1个电子形成带正电荷的钠离子,氯原子得到1个电子形成带负电荷的氯离子。带相反电荷的钠离子和氯离子之间相互吸引,构成了呈电中性的氯化钠。
7. 元素
具有相同核电荷数(即质子数)的一类原子总称为元素。如氧元素就是所有核电荷数为8的氧原子的总称,氢元素就是所有核电荷数为1的氢原子的总称。
8. 同位素
(1)定义:原子核内的质子数相同、中子数不相同的同类原子互为同位素原子。
(2)同位素原子是一种元素的不同种原子。如三种氧原子:氧-16、氧-17、氧-18的质子数均为8,中子数分别为8、9、10,因此它们都属于氧元素,不同的是其核内的中子数。
(3)同位素原子的表示方法
为了区分元素的同位素原子,常用原子符号(AzX)表示,其中X表示原子种类,Z表示质子数,A表示质子数和中子数之和。如氢有氕(11H)、氚(21H )氚(31H)三种同位素。
(4)同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。如质谱分析中,用稳定同位素原子作为示踪原子;核潜艇利用铀的同位素裂变释放的能量作为动力;利用放射性同位素对一些脏器进行扫描,诊断肿瘤等疾病;根据放射性同位素的半衰期,进行古董鉴定。
四、典型例题
(一)考点:粒子模型
【例1】(2024建功单元)2022年2月4日,第24届冬季奥林匹克运动会在北京开幕,下列有关冬奥会的信息属于模型的是( )
A、冬奥会会徽 B、冬奥会冰球项目标志
C、冬奥会场馆沙盘 D、场馆内禁止吸烟标识
【例2】(2023浙江专题)有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质,其中由原子直接构成的是( )
A.②③⑤ B.③⑤⑧ C.②⑤⑦ D.①④⑥
【例3】(2023杭州期中)下列各图中●和〇分别表示氢原子和氧原子,其中能表示保持H2O化学性质的微粒是( )
B.
C.D.
【例4】(2022杭州期中)下列有关分子、原子的叙述错误的是( )
A.分子一定比原子质量大
B.对于分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子、原子都是构成物质的粒子
D.在化学变化中,原子是不能再分的一种粒子
【例5】(2021浙江专题)下列对一些事实的微观解释错误的是( )
选项 事实 解释
A 固体碘和碘蒸气都能使淀粉溶液变为蓝色 构成物质的原子相同,化学性质相同
B 金刚石的硬度远大于石墨 原子排列方式不同
C 水通直流电产生氢气和氧气 化学变化中分子是可以再分的
D 炎热的夏天自行车车胎容易爆裂 分子间间隔变大
A.A B.B C.C D.D
(二)考点:原子结构
【例1】(2024建功单元)推理是初中科学常用的思维方法。下列推理正确的是( )
①离子是带电荷的微粒,所以带电荷的微粒一定是离子;
②同种元素质子数相同,所以质子数相同的微粒一定是同一种元素:
③单质中只含一种元素,所以由一种元素组成的物质一定是单质
只有① B.只有② C.只有③ D.①②③都不正确
【例2】(2024建功单元)用“”“ ”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A、甲、乙互为同位素 B、乙、丁为同一种元素
C、甲、丙的核电荷数不同 D、丙、丁为同一种原子
【例3】(2024建功单元)1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象.由实验得出的结论合理的是( )
A 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D. 该实验说明α粒子无法穿透原子与原子间的空隙
【例4】(2023湖州中考)金属钠可以在氯气中燃烧,生成氯化钠。从微观角度分析,下列说法错误的是( )
A.燃烧过程中钠原子失去电子形成钠离子
B.氯离子中质子数大于电子数
C.钠离子与氯离子之间相互吸引,构成电中性的氯化钠
D.氯原子转变为氯离子的过程中,核内质子数不变
【例5】(2023·浙江·一模)月球土壤中含有较丰富的氦-3,而在地球上,氦元素主要以氦-4的形式存在。图是氦-3和氦-4的原子结构示意图,图中“o”代表( )
A.质子 B.中子 C.电子 D.原子核
【例6】(2024建功单元)理解分子、原子、离子、元素等概念,会运用这些概念正确描述物质的组成和构成是学好化学的关键。下面请用“分子”“原子”“离子”“元素”“质子”、“中子”、“电子”、“原子核”填空:
(1)水是由氢和氧______________组成的。 (2)酒精是由______________构成的。
(3)汞是由汞______________构成的.(4)氯化钠是由______________构成的。
(5)能保持水银化学性质的微粒是______________。(6)显示电中性的微粒有______________。
(7)带正电的微粒有______________。 (8)质量最小的微粒是______________。(9)在同一原子里数目相等的是______________
四、学力训练
A组 夯实基础
1.(2023浙江专题)用模型和符号表现事物是两种常见的科学方法,下列选项中属于符号的是( )
A.原子结构B.眼球结构 C.密度公式D.节约用水
2.(2021浙江专题)下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
3.(2023浙江期中)人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )
A.发现电子的科学家是汤姆生,他认为原子是一个球体,不可分
B.卢瑟福提出原子的全部正电荷和几乎全部的质量都集中在原子核里
C.通过实验,科学家们发现原子核一般是由质子和中子构成的
D.质子和中子都是由更微小的基本粒子——夸克构成的
4.(2023宁波期末)不同种元素最本质的区别是( )
A.中子数不同 B.质子数不同
C.原子质量不同 D.核外电子数不同
5.(2023宁波期末)反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
B组 强化提高
1.(2023浙江期中)下列选项不属于模型的是( )
A.足球烯B.电路图C.钠元素D.欧姆定律
2.(2024浙江开学)模型法指通过模型来揭示原型的形态、特征和本质。下列属于模型法的是( )
A.用放大镜观察蜗牛的身体 B.测量科学书本中一张纸的厚度
C.用三色橡皮泥制作地球结构 D.参照动物分类方法对植物分类
3.(2023浙江一模)如图是卢瑟福将带正电的α粒子流轰击金箔后的运动轨迹示意图,其中能说明原子质量几乎全部集中在原子核内的轨迹是( )
A.a B.b C.c D.d
4.(2023浙江一模)如图所示通过对黑箱“输入”“输出”的信息,推理出黑箱内部情况的方法称为黑箱法。下列操作主要运用了黑箱法的是( )
A.用磁感线描述磁场分布 B.用压强计研究液体内部的压强
C.通过a粒子轰击金箔研究原子内部结构 D.用金属丝研究电阻大小的影响因素
5.(2023浙江一模)氯化钠溶液中的一个钠离子与金属钠中的一个钠原子之间不同的是( )
A.质子数 B.电子数 C.中子数 D.核电荷数
6.(2023杭州中考)华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子()中含有的质子个数为( )
A.3 B.10 C.12 D.20
7.(2023浙江期中)我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示。下列有关说法正确的是( )
A.中子的质量相对于带电的质子和电子,可以忽略
B.原子核内质子带正电,核外电子带负电
C.所有原子中,质子数=中子数
D.质子和中子由更小的、不能再分的夸克构成
8.(2023浙江期中)下列有关分子和原子的说法中,正确的是( )
A.分子可直接构成物质,而原子要先构成分子后才能构成物质
B.在化学变化中,分子可以再分,原子不能再分
C.分子能保持物质的化学性质,原子不能保持物质的化学性质
D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小
9. (2024建功单元)人类对微观世界的探究永无止境。请根据所学知识回答:
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,1897年汤姆生发现电子并提出类似西瓜”的原子模型,认为电子就像西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,如今这些观点均是______________(填“正确”或“错误”)的。
(2)卢瑟福进行a粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的原子核和核外电子构成。如图甲是卢瑟福用a 粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个______________。
A、建立模型的过程 B、得出结论的过程
C、提出问题的过程 D、验证证据的过程
(3)卢瑟福在α散射实验中(a粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是______________
10.(2024建功单元)“用微观的钥匙开启宏观问题之门”是化学学科研究物质的一般方法,而构建模型又常常是我们认识微观世界的重要手段。下列各组微观模型图回答问题:
(1) 水电解的过程可用如图表示,微粒运动变化的先后顺序是______________。
(2) 如图为某化学反应的微观过程。从图中选出应该添加在“ ”处的微观模型示意图______________。(填写选项编号) , 参加反应的反应物分子个数比为______________
C组 瞄准中考
1.(2023浙江期中)思维模型是依据事物发展内在规律所建立的解决问题的基本框架。海水淡化是将海水中的盐与水分开,常用加热蒸馏法将海水加热形成水蒸气。该方法属于下列模型中的( )
A.性质差异 B.分离转移 C.反应转化 D.恢复原态
2.(2021衢州期中)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
3.(2023鹿城期中)小实学习了氧气相关知识后,将其梳理成如下思维导图,请完成问题。
根据氧原子的微观结构图可知,氧原子的质子数为( )
A.2 B.6 C.8 D.16
4.(2023浙江期中)从微观的角度来认识物质的构成和物质的变化,是学习科学的重要方法。
(1)下列物质中,由原子直接构成的是 。
A.甲烷 B.金刚石 C.水银 D.氮气
(2)如图分别是物质发生变化的微观示意图。
请回答:
①图1表示的变化,从微观角度看改变的是 ;
②图2表示的变化,从微观角度看,在变化前后,一定改变的是 。
5. (2023仙居期末)为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;
现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以O、●和分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是 。
参考答案
四、典型例题
(一)考点:粒子模型
【例1】(2024建功单元)2022年2月4日,第24届冬季奥林匹克运动会在北京开幕,下列有关冬奥会的信息属于模型的是( )
A、冬奥会会徽 B、冬奥会冰球项目标志
C、冬奥会场馆沙盘 D、场馆内禁止吸烟标识
【答案】C
【例2】(2023浙江专题)有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质,其中由原子直接构成的是( )
A.②③⑤ B.③⑤⑧ C.②⑤⑦ D.①④⑥
【答案】B
【例3】(2023杭州期中)下列各图中●和〇分别表示氢原子和氧原子,其中能表示保持H2O化学性质的微粒是( )
B.
C.D.
【答案】A
【例4】(2022杭州期中)下列有关分子、原子的叙述错误的是( )
A.分子一定比原子质量大
B.对于分子构成的物质,分子是保持物质化学性质的最小粒子
C.分子、原子都是构成物质的粒子
D.在化学变化中,原子是不能再分的一种粒子
【答案】A
【例5】(2021浙江专题)下列对一些事实的微观解释错误的是( )
选项 事实 解释
A 固体碘和碘蒸气都能使淀粉溶液变为蓝色 构成物质的原子相同,化学性质相同
B 金刚石的硬度远大于石墨 原子排列方式不同
C 水通直流电产生氢气和氧气 化学变化中分子是可以再分的
D 炎热的夏天自行车车胎容易爆裂 分子间间隔变大
A.A B.B C.C D.D
【答案】A
(二)考点:原子结构
【例1】(2024建功单元)推理是初中科学常用的思维方法。下列推理正确的是( )
①离子是带电荷的微粒,所以带电荷的微粒一定是离子;
②同种元素质子数相同,所以质子数相同的微粒一定是同一种元素:
③单质中只含一种元素,所以由一种元素组成的物质一定是单质
只有① B.只有② C.只有③ D.①②③都不正确
【答案】D
【例2】(2024建功单元)用“”“ ”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A、甲、乙互为同位素 B、乙、丁为同一种元素
C、甲、丙的核电荷数不同 D、丙、丁为同一种原子
【答案】B
【例3】(2024建功单元)1909年卢瑟福领导的团队用一束α粒子(带正电荷)轰击金箔时发现了如图所示的实验现象.由实验得出的结论合理的是( )
A 多数α粒子直接穿过,说明原子核外是空的,不存在其他粒子
B.少数α粒子发生偏移,说明原子核外电子质量较大且带负电
C.极少数α粒子被反弹,说明原子核体积很小、质量较大
D. 该实验说明α粒子无法穿透原子与原子间的空隙
【答案】C
【例4】(2023湖州中考)金属钠可以在氯气中燃烧,生成氯化钠。从微观角度分析,下列说法错误的是( )
A.燃烧过程中钠原子失去电子形成钠离子
B.氯离子中质子数大于电子数
C.钠离子与氯离子之间相互吸引,构成电中性的氯化钠
D.氯原子转变为氯离子的过程中,核内质子数不变
【答案】B
【例5】(2023·浙江·一模)月球土壤中含有较丰富的氦-3,而在地球上,氦元素主要以氦-4的形式存在。图是氦-3和氦-4的原子结构示意图,图中“o”代表( )
A.质子 B.中子 C.电子 D.原子核
【答案】B
【例6】(2024建功单元)理解分子、原子、离子、元素等概念,会运用这些概念正确描述物质的组成和构成是学好化学的关键。下面请用“分子”“原子”“离子”“元素”“质子”、“中子”、“电子”、“原子核”填空:
(1)水是由氢和氧______________组成的。 (2)酒精是由______________构成的。
(3)汞是由汞______________构成的.(4)氯化钠是由______________构成的。
(5)能保持水银化学性质的微粒是______________。(6)显示电中性的微粒有______________。
(7)带正电的微粒有______________。 (8)质量最小的微粒是______________。(9)在同一原子里数目相等的是______________
【答案】元素 分子 原子 离子 原子 分子,原子,中子 质子,原子核 电子 质子与电子
四、学力训练
A组 夯实基础
1.(2023浙江专题)用模型和符号表现事物是两种常见的科学方法,下列选项中属于符号的是( )
A.原子结构B.眼球结构 C.密度公式D.节约用水
【答案】D
2.(2021浙江专题)下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
【答案】C
3.(2023浙江期中)人们为了解释原子结构的奥秘,经历了漫长的探究过程。下列有关说法错误的是( )
A.发现电子的科学家是汤姆生,他认为原子是一个球体,不可分
B.卢瑟福提出原子的全部正电荷和几乎全部的质量都集中在原子核里
C.通过实验,科学家们发现原子核一般是由质子和中子构成的
D.质子和中子都是由更微小的基本粒子——夸克构成的
【答案】A
4.(2023宁波期末)不同种元素最本质的区别是( )
A.中子数不同 B.质子数不同
C.原子质量不同 D.核外电子数不同
【答案】B
5.(2023宁波期末)反电子、反质子跟普通电子、质子的质量、电量均相等,电性相反。反氢原子是由反质子和反电子构成。1997年年初和年底,欧洲和美洲的研究机构分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。请推测反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
【答案】B
B组 强化提高
1.(2023浙江期中)下列选项不属于模型的是( )
A.足球烯B.电路图C.钠元素D.欧姆定律
【答案】C
2.(2024浙江开学)模型法指通过模型来揭示原型的形态、特征和本质。下列属于模型法的是( )
A.用放大镜观察蜗牛的身体 B.测量科学书本中一张纸的厚度
C.用三色橡皮泥制作地球结构 D.参照动物分类方法对植物分类
【答案】C
3.(2023浙江一模)如图是卢瑟福将带正电的α粒子流轰击金箔后的运动轨迹示意图,其中能说明原子质量几乎全部集中在原子核内的轨迹是( )
A.a B.b C.c D.d
【答案】C
4.(2023浙江一模)如图所示通过对黑箱“输入”“输出”的信息,推理出黑箱内部情况的方法称为黑箱法。下列操作主要运用了黑箱法的是( )
A.用磁感线描述磁场分布 B.用压强计研究液体内部的压强
C.通过a粒子轰击金箔研究原子内部结构 D.用金属丝研究电阻大小的影响因素
【答案】C
5.(2023浙江一模)氯化钠溶液中的一个钠离子与金属钠中的一个钠原子之间不同的是( )
A.质子数 B.电子数 C.中子数 D.核电荷数
【答案】B
6.(2023杭州中考)华南理工大学研究团队利用动态“局域柔性”框架材料,实现了在室温下对重水和普通水的有效分离。一个重水分子()中含有的质子个数为( )
A.3 B.10 C.12 D.20
【答案】B
7.(2023浙江期中)我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示。下列有关说法正确的是( )
A.中子的质量相对于带电的质子和电子,可以忽略
B.原子核内质子带正电,核外电子带负电
C.所有原子中,质子数=中子数
D.质子和中子由更小的、不能再分的夸克构成
【答案】B
8.(2023浙江期中)下列有关分子和原子的说法中,正确的是( )
A.分子可直接构成物质,而原子要先构成分子后才能构成物质
B.在化学变化中,分子可以再分,原子不能再分
C.分子能保持物质的化学性质,原子不能保持物质的化学性质
D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小
【答案】B
9. (2024建功单元)人类对微观世界的探究永无止境。请根据所学知识回答:
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,1897年汤姆生发现电子并提出类似西瓜”的原子模型,认为电子就像西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,如今这些观点均是______________(填“正确”或“错误”)的。
(2)卢瑟福进行a粒子散射实验后,认为原子是“行星模型”,即原子是由带正电荷的原子核和核外电子构成。如图甲是卢瑟福用a 粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个______________。
A、建立模型的过程 B、得出结论的过程
C、提出问题的过程 D、验证证据的过程
(3)卢瑟福在α散射实验中(a粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是______________
【答案】错误 A 大部分a粒子都没有改变方向,直接穿过原子
10.(2024建功单元)“用微观的钥匙开启宏观问题之门”是化学学科研究物质的一般方法,而构建模型又常常是我们认识微观世界的重要手段。下列各组微观模型图回答问题:
(1) 水电解的过程可用如图表示,微粒运动变化的先后顺序是______________。
(2) 如图为某化学反应的微观过程。从图中选出应该添加在“ ”处的微观模型示意图______________。(填写选项编号) , 参加反应的反应物分子个数比为______________
【答案】①②③④ ③ 2:1
C组 瞄准中考
1.(2023浙江期中)思维模型是依据事物发展内在规律所建立的解决问题的基本框架。海水淡化是将海水中的盐与水分开,常用加热蒸馏法将海水加热形成水蒸气。该方法属于下列模型中的( )
A.性质差异 B.分离转移 C.反应转化 D.恢复原态
【答案】B
2.(2021衢州期中)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【答案】B
3.(2023鹿城期中)小实学习了氧气相关知识后,将其梳理成如下思维导图,请完成问题。
根据氧原子的微观结构图可知,氧原子的质子数为( )
A.2 B.6 C.8 D.16
【答案】C
4.(2023浙江期中)从微观的角度来认识物质的构成和物质的变化,是学习科学的重要方法。
(1)下列物质中,由原子直接构成的是 。
A.甲烷 B.金刚石 C.水银 D.氮气
(2)如图分别是物质发生变化的微观示意图。
请回答:
①图1表示的变化,从微观角度看改变的是 ;
②图2表示的变化,从微观角度看,在变化前后,一定改变的是 。
【答案】BC 水分子本身没有改变,只是分子间隔变小 分子种类
5. (2023仙居期末)为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;
现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以O、●和分别代表电子、质子与中子,则下列各示意图所描述的微粒不属于同一类原子的是 。
【答案】 (1)原子核很小且质量很大;(2)A;(3)D。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
