沪教版九年级化学下册第7章应用广泛的酸 碱 盐单元复习题(含解析)
文档属性
| 名称 | 沪教版九年级化学下册第7章应用广泛的酸 碱 盐单元复习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 145.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-28 19:51:41 | ||
图片预览



文档简介
沪教版九年级化学下册第7章应用广泛的酸 碱 盐单元复习题
一、单选题
1.合理使用化肥可提高农作物产量,下列化肥属于氮肥的是( )
A. B. C. D.
2.下列物质的变化属于物理变化的是( )
A.石灰浆抹墙后,墙壁变硬 B.用稀硫酸除去铁锈
C.用烧碱干燥氮气、氧气 D.酚酞试液遇碱性溶液变为红色
3.下列属于复合肥料的是()
A.硫酸铵 B.硝酸钾 C.过磷酸钙 D.尿素
4.一些食物的pH如下,其中酸性最强的是( )
A.柠檬汁(2.9) B.橘子汁(3.8)
C.西瓜汁(6.4) D.苏打水(8.6)
5.正确的实验操作对实验结果和人身安全都非常重要。下列实验操作错误的是( )
A.添加锌粒 B.检查气密性
C.稀释浓硫酸 D.测定溶液的pH
6.下列化肥中属于复合肥料的是( )
A.CO(NH2)2 B.NH4NO3 C.KH2PO4 D.K2SO4
7.下列图象不能正确反映实验事实的是( )
A.向氢氧化钠溶液中滴加过量的稀盐酸
B.相同质量的锌粉和镁粉与等质量相同溶质质量分数的稀盐酸(足量)反应
C.加热氯酸钾和二氧化锰的混合物
D.向硫酸铜溶液中滴加氢氧化钠溶液
8.把金属X和Y分别放入CuSO4溶液中,在X表面有红色物质析出、Y表面无明显现象。则三种金属活动性由强到弱排列的是( )
A.Y、X、Cu B.Cu、X、Y C.X、Cu、Y D.X、Y、Cu
9.化学兴趣小组为了鉴别某黄色金属是黄金还是黄铜(铜锌合金),如下方案不合理的是()
A.在空气中加热 B.加入硝酸银溶液
C.加入氢氧化钾溶液 D.加入稀盐酸
10.通常条件下,下列金属不能和盐酸反应的是( )
A.Zn B.Mg C.Cu D.Al
11.逻辑推理是一种重要的化学思维方法。以下推理合理的是( )
A.NaNO2和NaNO3的组成元素相同,所以它们的化学性质相同
B.中和反应生成盐和水,生成盐和水的反应一定是中和变化
C.铁生锈需要铁与氧气、水充分接触,所以防锈要同时隔绝氧气和水
D.浓硫酸有吸水性,所以浓硫酸常被用作为气体的干燥剂
12.下列实验操作正确的是( )
A. B.
C. D.
二、非选择题
13.在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图1所示。图2为2018年我国某省份人均每日食盐摄入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。
事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
表1平遥县某超市中常见的深井岩盐和低钠岩盐成分配料表
种类 NaCl(g/100g) KCl(g/100g) KIO3(以I计)(mg/kg) K4Fe(CN)6(以[Fe(CN)6]4-计)(mg/kg)
深井岩盐 ≥98.5 0 18~33 ≤10
低钠岩盐 65~80 20~35 18~33 ≤10
依据文章内容回答下列问题。
(1)由图1可知,人们获得钠元素的主要来源是 。
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由 种元素组成的。
(3)由图2可知,下列说法错误的是____(填字母序号)。A.该省份人均每日摄入食盐的量超过了国家推荐的标准
A.我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准
B.无论是城市居民还是农村居民,都是年龄越大,人均每日摄入食盐越少
C.在图示的每个年龄段中,农村居民的人均每日食盐摄入量都比城市居民多
(4)依据表1,你建议外卖小哥在炎热的夏天选用的盐是 。
(5)初中化学中鉴别氯化钠所发生反应的方程式是 。
14.在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生.则反应后所得溶液中含有的金属离子有 ;反应后溶液的质量比原混合溶液的质量 (填“大”或“小”);有关反应的化学方程式为 (写出一个即可).
15.兴趣小组为判断某些酸、碱、盐之间是否发生反应,进行了如下探究。
(1)任务一:判断稀硫酸与下列四种化合物溶液是否发生反应。
(实验1)分别取少量四种化合物溶液1~2mL于试管中(如图1所示),分别滴加几滴稀硫酸。
(交流总结)
B试管中发生了反应,产生的现象是 。
(2)C试管中也发生了反应,发生反应的化学方程式是 。
(3)任务二:探究无明显现象的反应是否发生。
(实验2)A试管中没有现象,为了验证发生了反应,同学们又进行了实验(如图2所示)。由此现象可得到的结论稀硫酸和氢氧化钠发生了反应。判断依据是 。
(4)(能力提升)
①A试管中发生中和反应,其实质是 。
②D试管中没有发生反应的原因是 。
(5)任务三:探究图2所得溶液中溶质成分。
(猜想与假设)小红认为图2恰好反应。小明认为稀硫酸有剩余,理由是 。
(6)(反思交流)针对上述猜想,同学们分享交流了不同实验都能证明稀硫酸有剩余,请你写出其中一种方法对应反应的化学方程式: 。
16.如图为小致同学用数字传感器测得的一定溶质质量分数的盐酸与氢氧化钡溶液反应过程中溶液pH的变化图像,回答问题。
(1)由图可知,该反应是将 (选填 “氢氧化钡溶液”或“稀盐酸”)加入另一种溶液中;
(2)两种溶液反应的化学方程式为 ;
(3)为证明b点处加入的溶液过量,下列操作可行的是 ;
A.取样,加入适量氯化铵溶液并微热 B.取样,滴加酚酞溶液
C.取样,加入少量碳酸钠溶液 D.取样,加入少量 氯化铜溶液
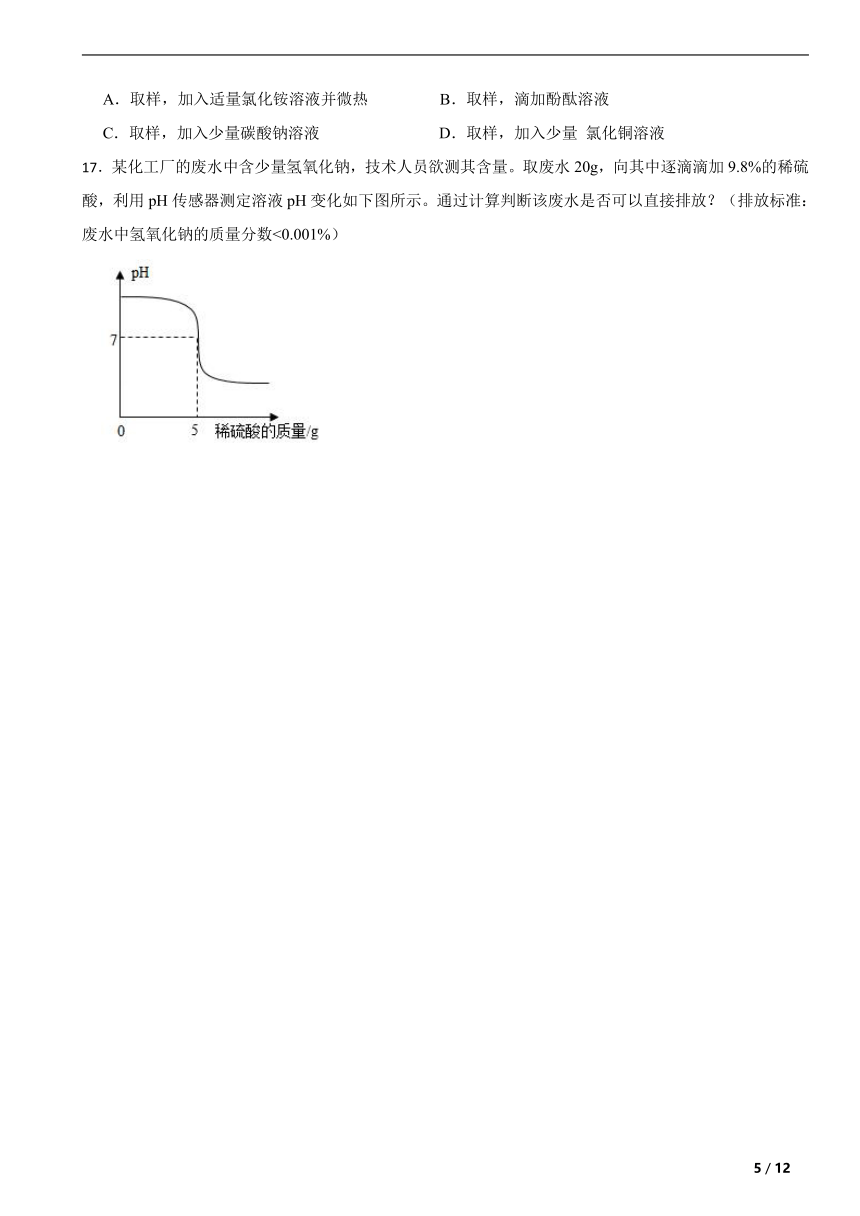
17.某化工厂的废水中含少量氢氧化钠,技术人员欲测其含量。取废水20g,向其中逐滴滴加9.8%的稀硫酸,利用pH传感器测定溶液pH变化如下图所示。通过计算判断该废水是否可以直接排放?(排放标准:废水中氢氧化钠的质量分数<0.001%)
答案解析部分
1.【答案】B
【解析】【解答】A. 碳酸钾中含有钾元素,属于钾肥,故不符合题意;
B. 氯化铵中含有氮元素,属于氮肥,故符合题意;
C. 磷酸钙中含有磷元素,属于磷肥,故不符合题意;
D. 硝酸钾中含有钾、氮两种元素,属于复合肥,故不符合题意;
故答案为:B。
【分析】含有氮元素的肥料称为氮肥。
含有磷元素的肥料称为磷肥。
含有钾元素的肥料称为钾肥。
同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
2.【答案】C
【解析】【解答】物理变化是指没有生成其他物质的变化,化学变化是指生成了其他物质的变化。
A.石灰浆抹墙后,墙壁变硬,生成了碳酸钙,属于化学变化;
B.用稀硫酸除去铁锈,生成氯化铁和水,属于化学变化;
C.用烧碱干燥氮气、氧气,没有生成其他物质,属于物理变化;
D.酚酞试液遇碱性溶液变为红色,生成了其他物质,属于化学变化。
【分析】根据是否生成新物质进行判断。
3.【答案】B
【解析】【解答】A、硫酸铵中含有氮元素,属于氮肥。故A不符合题意;
B、硝酸钾中含有钾元素和氮元素,属于复合肥。故B符合题意;
C、过磷酸钙中含有磷元素,属于磷肥。故C不符合题意。
D、尿素中含有氮元素,属于氮肥。故D不符合题意。
故答案为:B。
【分析】根据化肥的分类分析,植物所需氮、磷、钾三种营养元素,含氮元素的化肥为氮肥,含磷元素的化肥为磷肥,含钾元素的化肥为钾肥,含两种或以上营养元素的为复合肥。
4.【答案】A
【解析】【解答】A. 柠檬汁的pH值2.9<7,显酸性;
B. 橘子汁的pH值3.8<7,显酸性;
C. 西瓜汁的pH值6.4<7,显酸性;
D. 苏打水的pH值8.6>7,显碱性,
其中2.9数据最小, 柠檬汁酸性最强,故答案为:A。
【分析】溶液的pH值<7,显酸性,pH越小,酸性越强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,pH越大,碱性越强。
5.【答案】A
【解析】【解答】A. 应先加固体,再加液体;向试管中装锌粒时,先将试管横放,用镊子把锌粒放在试管口,再慢慢将试管竖立起来,故操作错误,符合题意;
B. 将导管的一端放入水中,用手捂住试管一会儿,若导管口有连续的气泡冒出时,则气密性好,故操作正确,不符合题意;
C. 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;故操作正确,不符合题意;
D. 用pH试纸测定溶液的pH时,正确的操作方法为在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH,故操作正确,不符合题意;
故答案为:A。
【分析】取用粉末、颗粒状药品应使用药匙或纸槽,步骤:“一横、二送、三直立”。
6.【答案】C
【解析】【解答】A. CO(NH2)2 只含植物所需氮元素,属于氮肥,不符合题意;
B. NH4NO3 只含植物所需氮元素,属于氮肥,不符合题意;
C. KH2PO4 含有植物所需钾、磷元素,属于复合肥,符合题意;
D. K2SO4 只含植物所需钾元素,属于钾肥,不符合题意;
故答案为:C
【分析】根据化肥的分类分析,植物所需氮、磷、钾三种营养元素,含氮元素的化肥为氮肥,含磷元素的化肥为磷肥,含钾元素的化肥为钾肥,含两种或以上营养元素的为复合肥。
7.【答案】B
【解析】【解答】解:A、氢氧化钠溶液显碱性,pH大于7,盐酸显酸性,pH小于7,向NaOH溶液中加入稀盐酸时,溶液的pH逐渐减小,当盐酸过量时,溶液的pH小于7,故图象能反映客观事实;
B、首先由于镁比锌活泼,和稀盐酸反应速度快,图象的斜率镁应比锌大,即应该陡一点;其次根据化学方程式可知等质量的镁生成的氢气要比锌生成的氢气多,图象的终点应该镁比锌高,故图象不能反映客观事实;
C、加热氯酸钾和二氧化锰的混合固体制取O2,二氧化锰是催化剂,质量不变,故图象能反映客观事实;
D、向硫酸铜溶液中滴加氢氧化钠溶液,氢氧化钠和硫酸铜发生反应形成氢氧化铜沉淀,直到沉淀量达到最大为一定值,故图象能反映客观事实.
故选B.
【分析】A、氢氧化钠溶液和盐酸反应生成氯化钠和水,氢氧化钠的pH大于7,盐酸pH小于7;
B、镁比锌活泼,和盐酸反应速度镁大于锌,等质量的镁生成的氢气要比锌生成的氢气多;
C、加热氯酸钾和二氧化锰的混合固体制取O2,二氧化锰是催化剂,质量不变;
D、向硫酸铜溶液中滴加氢氧化钠溶液,氢氧化钠和硫酸铜发生反应形成氢氧化铜沉淀.
8.【答案】C
【解析】【分析】根据题干信息(红色物质)可知,红色物质是铜,说明X和硫酸铜发生置换反应,即X把铜置换出来,然后即可得出前后顺序.
【解答】根据题干信息(金属X和Y分别放入CuSO4溶液中,在X表面有红色物质析出、Y表面无明显现象)可知,说明X和硫酸铜发生置换反应,即X把铜置换出来.根据置换反应的特点:排在前面的金属能把后面的金属置换出来.说明X排在铜的前面;
Y表面没有明显现象,说明Y和硫酸铜不会反应.即Y排在铜的后面.
故答案为:X、Cu、Y,
故选:C.
【点评】通过这个题使学生掌握利用置换反应判断金属活动性顺序的方法,原理就是排在前面的金属能把后面的金属置换出来
9.【答案】C
【解析】【解答】A、在空气中加热,铜在加热条件下生成黑色的氧化铜,黄金不能,可以鉴别,不符合题意。
B、加入硝酸银溶液,铜锌均能与硝酸银溶液反应置换出银,黄金不能,可以鉴别,不符合题意。
C、加入氢氧化钾溶液,氢氧化钾溶液与黄金、铜锌均不反应,不能鉴别,符合题意。
D、加入稀盐酸,锌能与稀盐酸反应生成氢气,黄金不能,可以鉴别,不符合题意。
故答案为:C。
【分析】黄金的成分是Au,黄铜的成分是Cu和Zn,因此因根据Au和Cu、Zn的不同的化学性质来进行鉴别。
10.【答案】C
【解析】【解答】在金属活动性顺序里,位于氢之前的金属能置换出盐酸中的氢,金属活动性由强到弱顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;Zn、 Mg 、Cu、 Al四种金属中,Cu不能与盐酸反应;
故答案为:C;
【分析】根据金属活动性顺序回答。
11.【答案】D
【解析】【解答】A、NaNO2和NaNO3的组成元素相同,但构成物质的离子不同,它们的化学性质不同,不符合题意;
B、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如:CO2+2NaOH═Na2CO3+H2O,不符合题意;
C、铁生锈需要铁与氧气、水充分接触,防锈只需隔绝氧气或水即可,不符合题意;
D、浓硫酸有吸水性,则浓硫酸常被用作为气体的干燥剂,但是氨气不能用它干燥,符合题意。
故答案为:D。
【分析】A、根据物质的结构决定物质的性质分析
B、根据中和反应的概念分析
C、根据铁生锈的条件分析
D、根据浓硫酸的吸水性分析
12.【答案】A
【解析】【解答】解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
B、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的 ,图中液体超过试管容积的 ,图中所示操作错误.
C、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另一酒精灯,图中所示操作错误.
D、托盘天平的使用要遵循“左物右码”的原则,且氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,图中所示操作错误.
故选:A.
【分析】A、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
B、根据给试管中的液体加热的方法进行分析判断.
C、使用酒精灯时要注意“两查、两禁、一不可”.
D、根据托盘天平的使用要遵循“左物右码”的原则、氢氧化钠具有腐蚀性,进行分析判断.
13.【答案】(1)食盐
(2)4或四
(3)B
(4)深井岩盐
(5)AgNO3+NaCl=AgCl↓+NaNO3
【解析】【解答】(1)从我国居民膳食中每日通过食品或调料获得钠元素的主要来源图可知,87.20%来源于食盐,7.33%来源于酱油,3.58%来源于酱类、腌菜、乳制品等,1.89%来源于鸡精,因此钠元素的主要来源是食盐,故填:食盐;
(2)K4Fe(CN)6由钾元素、铁元素、碳元素、氮元素共四种元素组成,故填:四;
(3)A、从该省份人均每日食盐摄入量与国家推荐标准和世界卫生组织推荐的国际标准的比对图可以看出全省人均每日食盐摄入量是9.1g,超过国家推荐的标准6.0g,选项A不正确;
B、从图中可知我国推荐的标准是人均每日食盐摄入量6.0g,世界卫生组织推荐的国际标准是人均每日食盐摄入量是5.0g,因此我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准,选项B不正确;
C、从图中可知,农村居民45-49岁阶段人均每日摄入量大于18-44岁阶段,因此不是年龄越大摄入量越少,选项C正确;
D、从图中可看出图示的每个年龄段中,农村居民的人均每日食盐摄入量都高于城市居民,选项D不正确。
故答案为:C。
(4)外卖小哥在炎热的夏天工作,属于高温作业者,汗液流失会带走大量钠离子,需要补充钠离子,因此应选用深井岩盐,故填:深井岩盐。
(5)鉴别氯化钠可用硝酸银溶液,反应生成氯化银沉淀和硝酸钠,化学方程式为,故填:。
【分析】(1)根据题干信息分析;
(2)根据化学判断物质的元素组成;
(3)根据题中所给信息综合分析解答;
(4)高温流汗需要补充钠离子,据此分析;
(5)氯离子与银离子反应生成氯化银白色沉淀。
14.【答案】Al3+;和Fe2+小;Fe十2AgNO3=Fe(NO3) 2+2Ag[Fe+Cu(NO3) 2=Fe(NO3) 2+Cu]
【解析】【解答】解:混合溶液中的Cu(NO3)2、AgNO3与铁发生置换反应,得到Cu、Ag,铁粉过量,所以滤出固体中含Fe;反应后的溶液中即滤液不再含的Cu(NO3)2、AgNO3,而是含有生成的Fe(NO3)2;由于Al(NO3)3不与Fe发生反应,所以滤液中还含有Al(NO3)3;
依据该置换反应的过程是Fe十2AgNO3=Fe(NO3) 2+2Ag;Fe+Cu(NO3) 2=Fe(NO3) 2+Cu反应的铁与铜银的原子量关系可知:该两个反应发生时铁置换银与铜时反应的铁都小于生成的铜和银,故溶液质量减小;该过程中共发现两个反应:铁和硝酸铜的置换反应,铁和硝酸银的置换反应;
故答:Al3+ 和Fe2+;小;Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag).
【分析】依据活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,所以铁可以置换出铜与银但不能置换出铝,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生,此现象说明Fe过量没有反应完,所以原混合溶液中的Cu(NO3)2、AgNO3全部被置换生成Cu、Ag和Fe(NO3)2溶液,Al(NO3)3不反应,再利用反应时金属的原子量可对溶液质量的改变进行分析,确定溶液质量的变化.
15.【答案】(1)有气泡冒出
(2)
(3)向反应后的A的溶液中滴加无色酚酞溶液后,溶液没有变色
(4)氢离子和氢氧根离子反应生成水分子;没有生成沉淀、气体或水
(5)稀硫酸有剩余溶液显酸性,溶液也是无色
(6) (合理即可)
【解析】【解答】[交流总结](1)碳酸盐和酸反应会生成二氧化碳,所以硫酸和碳酸钾反应有气泡冒出;
(2)C试管中是硫酸和硝酸钡反应生成硫酸钡沉淀和硝酸,反应的化学方程式: ;
[实验2]氢氧化钠溶液显碱性,能使酚酞溶液变红,向反应后的A的溶液中滴加无色酚酞溶液后,溶液没有变色,说明稀硫酸和氢氧化钠发生了反应;
[能力提升]①A试管中发生中和反应,实质是氢离子和氢氧根离子反应生成水分子的反应;
②稀硫酸和氯化钠交换后没有生成沉淀、气体或水,所以没有发生反应;
[猜想假设]酸性溶液不能使酚酞试液变红色,若稀硫酸有剩余,溶液显酸性,溶液也是无色;
[反思交流]活泼金属能和硫酸反应生成氢气,有气泡,故可加入铁片进行验证,铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式: 。
【分析】(1)根据碳酸钾与硫酸反应会产生二氧化碳气体分析;
(2)根据硫酸和硝酸钡反应生成硫酸钡沉淀和硝酸分析;
(3)根据氢氧化钠溶液能使酚酞变红分析;
(4)根据中和反应是氢离子和氢氧根离子反应生成水分子及复分解反应条件分析;
(5)根据酚酞在中性或酸性溶液中都呈无色分析;
(6)根据硫酸的化学性质分析。
16.【答案】(1)Ba(OH)2
(2)Ba(OH)2+2HCl=BaCl2+2H2O
(3)A;B;D
【解析】【解答】(1)由图像可知,未加入溶液时,烧杯中原有溶液的pH<7,显酸性,说明原始溶液为盐酸溶液,则该反应是将氢氧化钡加入盐酸溶液中;
(2)氢氧化钡与盐酸发生复分解反应生成氯化钡和水, Ba(OH)2+2HCl=BaCl2+2H2O ;
(3) b点处pH大于7,显碱性,加入的氢氧化钡溶液过量。
A.氢氧化钡与氯化铵在微热的条件下发生反应生成刺激性气味的氨气,A正确;
B.滴加酚酞试液,溶液变红,说明溶液呈碱性,说明氢氧化钡溶液过量,B正确;
C.溶液中含有氯化钡,也会与加入的碳酸钠反应生成白色沉淀,C错误;
D.氯化铜能与氢氧化钡反应生成蓝色的氢氧化铜沉淀,D正确;
故答案为ABD。
【分析】(1)根据初始溶液的pH判断溶液的滴加方法; (2)根据复分解反应的特点书写方程式; (3)根据氢氧化钡的性质及相关反应进行解答。
17.【答案】解:由图像可知pH=7时,消耗的稀硫酸的质量为5g稀硫酸中硫酸的质量为 设含氢氧化钠的质量为x
x=0.4g
2%>0.001%,所以不能直接排放。
【解析】【分析】根据溶质质量等于溶液质量乘以溶质质量分数,利用硫酸的质量结合反应的方程式计算氢氧化钠的质量,进而计算质量分数
1 / 1
一、单选题
1.合理使用化肥可提高农作物产量,下列化肥属于氮肥的是( )
A. B. C. D.
2.下列物质的变化属于物理变化的是( )
A.石灰浆抹墙后,墙壁变硬 B.用稀硫酸除去铁锈
C.用烧碱干燥氮气、氧气 D.酚酞试液遇碱性溶液变为红色
3.下列属于复合肥料的是()
A.硫酸铵 B.硝酸钾 C.过磷酸钙 D.尿素
4.一些食物的pH如下,其中酸性最强的是( )
A.柠檬汁(2.9) B.橘子汁(3.8)
C.西瓜汁(6.4) D.苏打水(8.6)
5.正确的实验操作对实验结果和人身安全都非常重要。下列实验操作错误的是( )
A.添加锌粒 B.检查气密性
C.稀释浓硫酸 D.测定溶液的pH
6.下列化肥中属于复合肥料的是( )
A.CO(NH2)2 B.NH4NO3 C.KH2PO4 D.K2SO4
7.下列图象不能正确反映实验事实的是( )
A.向氢氧化钠溶液中滴加过量的稀盐酸
B.相同质量的锌粉和镁粉与等质量相同溶质质量分数的稀盐酸(足量)反应
C.加热氯酸钾和二氧化锰的混合物
D.向硫酸铜溶液中滴加氢氧化钠溶液
8.把金属X和Y分别放入CuSO4溶液中,在X表面有红色物质析出、Y表面无明显现象。则三种金属活动性由强到弱排列的是( )
A.Y、X、Cu B.Cu、X、Y C.X、Cu、Y D.X、Y、Cu
9.化学兴趣小组为了鉴别某黄色金属是黄金还是黄铜(铜锌合金),如下方案不合理的是()
A.在空气中加热 B.加入硝酸银溶液
C.加入氢氧化钾溶液 D.加入稀盐酸
10.通常条件下,下列金属不能和盐酸反应的是( )
A.Zn B.Mg C.Cu D.Al
11.逻辑推理是一种重要的化学思维方法。以下推理合理的是( )
A.NaNO2和NaNO3的组成元素相同,所以它们的化学性质相同
B.中和反应生成盐和水,生成盐和水的反应一定是中和变化
C.铁生锈需要铁与氧气、水充分接触,所以防锈要同时隔绝氧气和水
D.浓硫酸有吸水性,所以浓硫酸常被用作为气体的干燥剂
12.下列实验操作正确的是( )
A. B.
C. D.
二、非选择题
13.在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图1所示。图2为2018年我国某省份人均每日食盐摄入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。
事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
表1平遥县某超市中常见的深井岩盐和低钠岩盐成分配料表
种类 NaCl(g/100g) KCl(g/100g) KIO3(以I计)(mg/kg) K4Fe(CN)6(以[Fe(CN)6]4-计)(mg/kg)
深井岩盐 ≥98.5 0 18~33 ≤10
低钠岩盐 65~80 20~35 18~33 ≤10
依据文章内容回答下列问题。
(1)由图1可知,人们获得钠元素的主要来源是 。
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由 种元素组成的。
(3)由图2可知,下列说法错误的是____(填字母序号)。A.该省份人均每日摄入食盐的量超过了国家推荐的标准
A.我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准
B.无论是城市居民还是农村居民,都是年龄越大,人均每日摄入食盐越少
C.在图示的每个年龄段中,农村居民的人均每日食盐摄入量都比城市居民多
(4)依据表1,你建议外卖小哥在炎热的夏天选用的盐是 。
(5)初中化学中鉴别氯化钠所发生反应的方程式是 。
14.在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生.则反应后所得溶液中含有的金属离子有 ;反应后溶液的质量比原混合溶液的质量 (填“大”或“小”);有关反应的化学方程式为 (写出一个即可).
15.兴趣小组为判断某些酸、碱、盐之间是否发生反应,进行了如下探究。
(1)任务一:判断稀硫酸与下列四种化合物溶液是否发生反应。
(实验1)分别取少量四种化合物溶液1~2mL于试管中(如图1所示),分别滴加几滴稀硫酸。
(交流总结)
B试管中发生了反应,产生的现象是 。
(2)C试管中也发生了反应,发生反应的化学方程式是 。
(3)任务二:探究无明显现象的反应是否发生。
(实验2)A试管中没有现象,为了验证发生了反应,同学们又进行了实验(如图2所示)。由此现象可得到的结论稀硫酸和氢氧化钠发生了反应。判断依据是 。
(4)(能力提升)
①A试管中发生中和反应,其实质是 。
②D试管中没有发生反应的原因是 。
(5)任务三:探究图2所得溶液中溶质成分。
(猜想与假设)小红认为图2恰好反应。小明认为稀硫酸有剩余,理由是 。
(6)(反思交流)针对上述猜想,同学们分享交流了不同实验都能证明稀硫酸有剩余,请你写出其中一种方法对应反应的化学方程式: 。
16.如图为小致同学用数字传感器测得的一定溶质质量分数的盐酸与氢氧化钡溶液反应过程中溶液pH的变化图像,回答问题。
(1)由图可知,该反应是将 (选填 “氢氧化钡溶液”或“稀盐酸”)加入另一种溶液中;
(2)两种溶液反应的化学方程式为 ;
(3)为证明b点处加入的溶液过量,下列操作可行的是 ;
A.取样,加入适量氯化铵溶液并微热 B.取样,滴加酚酞溶液
C.取样,加入少量碳酸钠溶液 D.取样,加入少量 氯化铜溶液
17.某化工厂的废水中含少量氢氧化钠,技术人员欲测其含量。取废水20g,向其中逐滴滴加9.8%的稀硫酸,利用pH传感器测定溶液pH变化如下图所示。通过计算判断该废水是否可以直接排放?(排放标准:废水中氢氧化钠的质量分数<0.001%)
答案解析部分
1.【答案】B
【解析】【解答】A. 碳酸钾中含有钾元素,属于钾肥,故不符合题意;
B. 氯化铵中含有氮元素,属于氮肥,故符合题意;
C. 磷酸钙中含有磷元素,属于磷肥,故不符合题意;
D. 硝酸钾中含有钾、氮两种元素,属于复合肥,故不符合题意;
故答案为:B。
【分析】含有氮元素的肥料称为氮肥。
含有磷元素的肥料称为磷肥。
含有钾元素的肥料称为钾肥。
同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
2.【答案】C
【解析】【解答】物理变化是指没有生成其他物质的变化,化学变化是指生成了其他物质的变化。
A.石灰浆抹墙后,墙壁变硬,生成了碳酸钙,属于化学变化;
B.用稀硫酸除去铁锈,生成氯化铁和水,属于化学变化;
C.用烧碱干燥氮气、氧气,没有生成其他物质,属于物理变化;
D.酚酞试液遇碱性溶液变为红色,生成了其他物质,属于化学变化。
【分析】根据是否生成新物质进行判断。
3.【答案】B
【解析】【解答】A、硫酸铵中含有氮元素,属于氮肥。故A不符合题意;
B、硝酸钾中含有钾元素和氮元素,属于复合肥。故B符合题意;
C、过磷酸钙中含有磷元素,属于磷肥。故C不符合题意。
D、尿素中含有氮元素,属于氮肥。故D不符合题意。
故答案为:B。
【分析】根据化肥的分类分析,植物所需氮、磷、钾三种营养元素,含氮元素的化肥为氮肥,含磷元素的化肥为磷肥,含钾元素的化肥为钾肥,含两种或以上营养元素的为复合肥。
4.【答案】A
【解析】【解答】A. 柠檬汁的pH值2.9<7,显酸性;
B. 橘子汁的pH值3.8<7,显酸性;
C. 西瓜汁的pH值6.4<7,显酸性;
D. 苏打水的pH值8.6>7,显碱性,
其中2.9数据最小, 柠檬汁酸性最强,故答案为:A。
【分析】溶液的pH值<7,显酸性,pH越小,酸性越强;
溶液的pH值=7,显中性;
溶液的pH值>7,显碱性,pH越大,碱性越强。
5.【答案】A
【解析】【解答】A. 应先加固体,再加液体;向试管中装锌粒时,先将试管横放,用镊子把锌粒放在试管口,再慢慢将试管竖立起来,故操作错误,符合题意;
B. 将导管的一端放入水中,用手捂住试管一会儿,若导管口有连续的气泡冒出时,则气密性好,故操作正确,不符合题意;
C. 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;故操作正确,不符合题意;
D. 用pH试纸测定溶液的pH时,正确的操作方法为在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH,故操作正确,不符合题意;
故答案为:A。
【分析】取用粉末、颗粒状药品应使用药匙或纸槽,步骤:“一横、二送、三直立”。
6.【答案】C
【解析】【解答】A. CO(NH2)2 只含植物所需氮元素,属于氮肥,不符合题意;
B. NH4NO3 只含植物所需氮元素,属于氮肥,不符合题意;
C. KH2PO4 含有植物所需钾、磷元素,属于复合肥,符合题意;
D. K2SO4 只含植物所需钾元素,属于钾肥,不符合题意;
故答案为:C
【分析】根据化肥的分类分析,植物所需氮、磷、钾三种营养元素,含氮元素的化肥为氮肥,含磷元素的化肥为磷肥,含钾元素的化肥为钾肥,含两种或以上营养元素的为复合肥。
7.【答案】B
【解析】【解答】解:A、氢氧化钠溶液显碱性,pH大于7,盐酸显酸性,pH小于7,向NaOH溶液中加入稀盐酸时,溶液的pH逐渐减小,当盐酸过量时,溶液的pH小于7,故图象能反映客观事实;
B、首先由于镁比锌活泼,和稀盐酸反应速度快,图象的斜率镁应比锌大,即应该陡一点;其次根据化学方程式可知等质量的镁生成的氢气要比锌生成的氢气多,图象的终点应该镁比锌高,故图象不能反映客观事实;
C、加热氯酸钾和二氧化锰的混合固体制取O2,二氧化锰是催化剂,质量不变,故图象能反映客观事实;
D、向硫酸铜溶液中滴加氢氧化钠溶液,氢氧化钠和硫酸铜发生反应形成氢氧化铜沉淀,直到沉淀量达到最大为一定值,故图象能反映客观事实.
故选B.
【分析】A、氢氧化钠溶液和盐酸反应生成氯化钠和水,氢氧化钠的pH大于7,盐酸pH小于7;
B、镁比锌活泼,和盐酸反应速度镁大于锌,等质量的镁生成的氢气要比锌生成的氢气多;
C、加热氯酸钾和二氧化锰的混合固体制取O2,二氧化锰是催化剂,质量不变;
D、向硫酸铜溶液中滴加氢氧化钠溶液,氢氧化钠和硫酸铜发生反应形成氢氧化铜沉淀.
8.【答案】C
【解析】【分析】根据题干信息(红色物质)可知,红色物质是铜,说明X和硫酸铜发生置换反应,即X把铜置换出来,然后即可得出前后顺序.
【解答】根据题干信息(金属X和Y分别放入CuSO4溶液中,在X表面有红色物质析出、Y表面无明显现象)可知,说明X和硫酸铜发生置换反应,即X把铜置换出来.根据置换反应的特点:排在前面的金属能把后面的金属置换出来.说明X排在铜的前面;
Y表面没有明显现象,说明Y和硫酸铜不会反应.即Y排在铜的后面.
故答案为:X、Cu、Y,
故选:C.
【点评】通过这个题使学生掌握利用置换反应判断金属活动性顺序的方法,原理就是排在前面的金属能把后面的金属置换出来
9.【答案】C
【解析】【解答】A、在空气中加热,铜在加热条件下生成黑色的氧化铜,黄金不能,可以鉴别,不符合题意。
B、加入硝酸银溶液,铜锌均能与硝酸银溶液反应置换出银,黄金不能,可以鉴别,不符合题意。
C、加入氢氧化钾溶液,氢氧化钾溶液与黄金、铜锌均不反应,不能鉴别,符合题意。
D、加入稀盐酸,锌能与稀盐酸反应生成氢气,黄金不能,可以鉴别,不符合题意。
故答案为:C。
【分析】黄金的成分是Au,黄铜的成分是Cu和Zn,因此因根据Au和Cu、Zn的不同的化学性质来进行鉴别。
10.【答案】C
【解析】【解答】在金属活动性顺序里,位于氢之前的金属能置换出盐酸中的氢,金属活动性由强到弱顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;Zn、 Mg 、Cu、 Al四种金属中,Cu不能与盐酸反应;
故答案为:C;
【分析】根据金属活动性顺序回答。
11.【答案】D
【解析】【解答】A、NaNO2和NaNO3的组成元素相同,但构成物质的离子不同,它们的化学性质不同,不符合题意;
B、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如:CO2+2NaOH═Na2CO3+H2O,不符合题意;
C、铁生锈需要铁与氧气、水充分接触,防锈只需隔绝氧气或水即可,不符合题意;
D、浓硫酸有吸水性,则浓硫酸常被用作为气体的干燥剂,但是氨气不能用它干燥,符合题意。
故答案为:D。
【分析】A、根据物质的结构决定物质的性质分析
B、根据中和反应的概念分析
C、根据铁生锈的条件分析
D、根据浓硫酸的吸水性分析
12.【答案】A
【解析】【解答】解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
B、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的 ,图中液体超过试管容积的 ,图中所示操作错误.
C、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另一酒精灯,图中所示操作错误.
D、托盘天平的使用要遵循“左物右码”的原则,且氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,图中所示操作错误.
故选:A.
【分析】A、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
B、根据给试管中的液体加热的方法进行分析判断.
C、使用酒精灯时要注意“两查、两禁、一不可”.
D、根据托盘天平的使用要遵循“左物右码”的原则、氢氧化钠具有腐蚀性,进行分析判断.
13.【答案】(1)食盐
(2)4或四
(3)B
(4)深井岩盐
(5)AgNO3+NaCl=AgCl↓+NaNO3
【解析】【解答】(1)从我国居民膳食中每日通过食品或调料获得钠元素的主要来源图可知,87.20%来源于食盐,7.33%来源于酱油,3.58%来源于酱类、腌菜、乳制品等,1.89%来源于鸡精,因此钠元素的主要来源是食盐,故填:食盐;
(2)K4Fe(CN)6由钾元素、铁元素、碳元素、氮元素共四种元素组成,故填:四;
(3)A、从该省份人均每日食盐摄入量与国家推荐标准和世界卫生组织推荐的国际标准的比对图可以看出全省人均每日食盐摄入量是9.1g,超过国家推荐的标准6.0g,选项A不正确;
B、从图中可知我国推荐的标准是人均每日食盐摄入量6.0g,世界卫生组织推荐的国际标准是人均每日食盐摄入量是5.0g,因此我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准,选项B不正确;
C、从图中可知,农村居民45-49岁阶段人均每日摄入量大于18-44岁阶段,因此不是年龄越大摄入量越少,选项C正确;
D、从图中可看出图示的每个年龄段中,农村居民的人均每日食盐摄入量都高于城市居民,选项D不正确。
故答案为:C。
(4)外卖小哥在炎热的夏天工作,属于高温作业者,汗液流失会带走大量钠离子,需要补充钠离子,因此应选用深井岩盐,故填:深井岩盐。
(5)鉴别氯化钠可用硝酸银溶液,反应生成氯化银沉淀和硝酸钠,化学方程式为,故填:。
【分析】(1)根据题干信息分析;
(2)根据化学判断物质的元素组成;
(3)根据题中所给信息综合分析解答;
(4)高温流汗需要补充钠离子,据此分析;
(5)氯离子与银离子反应生成氯化银白色沉淀。
14.【答案】Al3+;和Fe2+小;Fe十2AgNO3=Fe(NO3) 2+2Ag[Fe+Cu(NO3) 2=Fe(NO3) 2+Cu]
【解析】【解答】解:混合溶液中的Cu(NO3)2、AgNO3与铁发生置换反应,得到Cu、Ag,铁粉过量,所以滤出固体中含Fe;反应后的溶液中即滤液不再含的Cu(NO3)2、AgNO3,而是含有生成的Fe(NO3)2;由于Al(NO3)3不与Fe发生反应,所以滤液中还含有Al(NO3)3;
依据该置换反应的过程是Fe十2AgNO3=Fe(NO3) 2+2Ag;Fe+Cu(NO3) 2=Fe(NO3) 2+Cu反应的铁与铜银的原子量关系可知:该两个反应发生时铁置换银与铜时反应的铁都小于生成的铜和银,故溶液质量减小;该过程中共发现两个反应:铁和硝酸铜的置换反应,铁和硝酸银的置换反应;
故答:Al3+ 和Fe2+;小;Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag).
【分析】依据活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,所以铁可以置换出铜与银但不能置换出铝,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生,此现象说明Fe过量没有反应完,所以原混合溶液中的Cu(NO3)2、AgNO3全部被置换生成Cu、Ag和Fe(NO3)2溶液,Al(NO3)3不反应,再利用反应时金属的原子量可对溶液质量的改变进行分析,确定溶液质量的变化.
15.【答案】(1)有气泡冒出
(2)
(3)向反应后的A的溶液中滴加无色酚酞溶液后,溶液没有变色
(4)氢离子和氢氧根离子反应生成水分子;没有生成沉淀、气体或水
(5)稀硫酸有剩余溶液显酸性,溶液也是无色
(6) (合理即可)
【解析】【解答】[交流总结](1)碳酸盐和酸反应会生成二氧化碳,所以硫酸和碳酸钾反应有气泡冒出;
(2)C试管中是硫酸和硝酸钡反应生成硫酸钡沉淀和硝酸,反应的化学方程式: ;
[实验2]氢氧化钠溶液显碱性,能使酚酞溶液变红,向反应后的A的溶液中滴加无色酚酞溶液后,溶液没有变色,说明稀硫酸和氢氧化钠发生了反应;
[能力提升]①A试管中发生中和反应,实质是氢离子和氢氧根离子反应生成水分子的反应;
②稀硫酸和氯化钠交换后没有生成沉淀、气体或水,所以没有发生反应;
[猜想假设]酸性溶液不能使酚酞试液变红色,若稀硫酸有剩余,溶液显酸性,溶液也是无色;
[反思交流]活泼金属能和硫酸反应生成氢气,有气泡,故可加入铁片进行验证,铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式: 。
【分析】(1)根据碳酸钾与硫酸反应会产生二氧化碳气体分析;
(2)根据硫酸和硝酸钡反应生成硫酸钡沉淀和硝酸分析;
(3)根据氢氧化钠溶液能使酚酞变红分析;
(4)根据中和反应是氢离子和氢氧根离子反应生成水分子及复分解反应条件分析;
(5)根据酚酞在中性或酸性溶液中都呈无色分析;
(6)根据硫酸的化学性质分析。
16.【答案】(1)Ba(OH)2
(2)Ba(OH)2+2HCl=BaCl2+2H2O
(3)A;B;D
【解析】【解答】(1)由图像可知,未加入溶液时,烧杯中原有溶液的pH<7,显酸性,说明原始溶液为盐酸溶液,则该反应是将氢氧化钡加入盐酸溶液中;
(2)氢氧化钡与盐酸发生复分解反应生成氯化钡和水, Ba(OH)2+2HCl=BaCl2+2H2O ;
(3) b点处pH大于7,显碱性,加入的氢氧化钡溶液过量。
A.氢氧化钡与氯化铵在微热的条件下发生反应生成刺激性气味的氨气,A正确;
B.滴加酚酞试液,溶液变红,说明溶液呈碱性,说明氢氧化钡溶液过量,B正确;
C.溶液中含有氯化钡,也会与加入的碳酸钠反应生成白色沉淀,C错误;
D.氯化铜能与氢氧化钡反应生成蓝色的氢氧化铜沉淀,D正确;
故答案为ABD。
【分析】(1)根据初始溶液的pH判断溶液的滴加方法; (2)根据复分解反应的特点书写方程式; (3)根据氢氧化钡的性质及相关反应进行解答。
17.【答案】解:由图像可知pH=7时,消耗的稀硫酸的质量为5g稀硫酸中硫酸的质量为 设含氢氧化钠的质量为x
x=0.4g
2%>0.001%,所以不能直接排放。
【解析】【分析】根据溶质质量等于溶液质量乘以溶质质量分数,利用硫酸的质量结合反应的方程式计算氢氧化钠的质量,进而计算质量分数
1 / 1
