沪教版九年级化学全册课件 7.2.2常见的碱教学课件
文档属性
| 名称 | 沪教版九年级化学全册课件 7.2.2常见的碱教学课件 |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-06 09:44:17 | ||
图片预览









文档简介
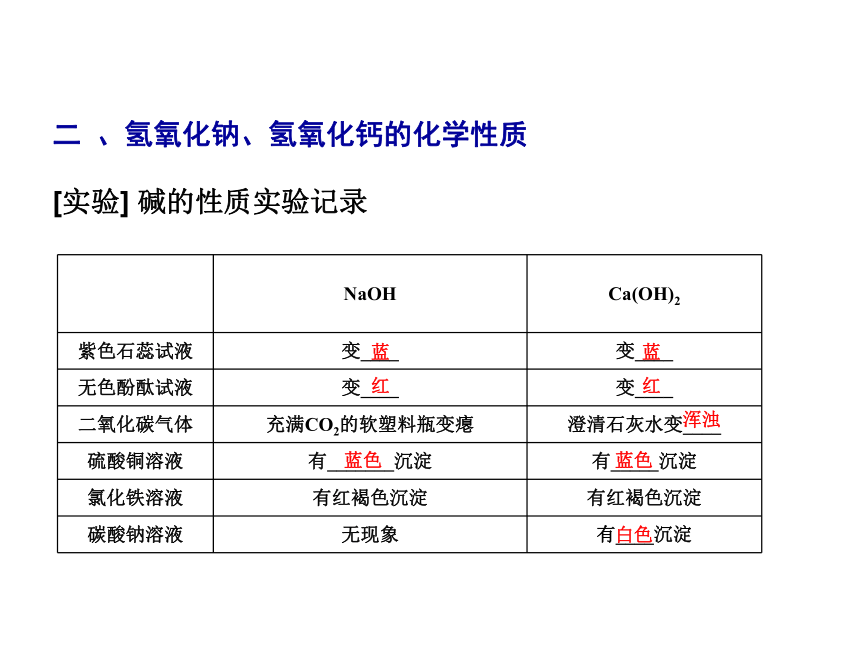
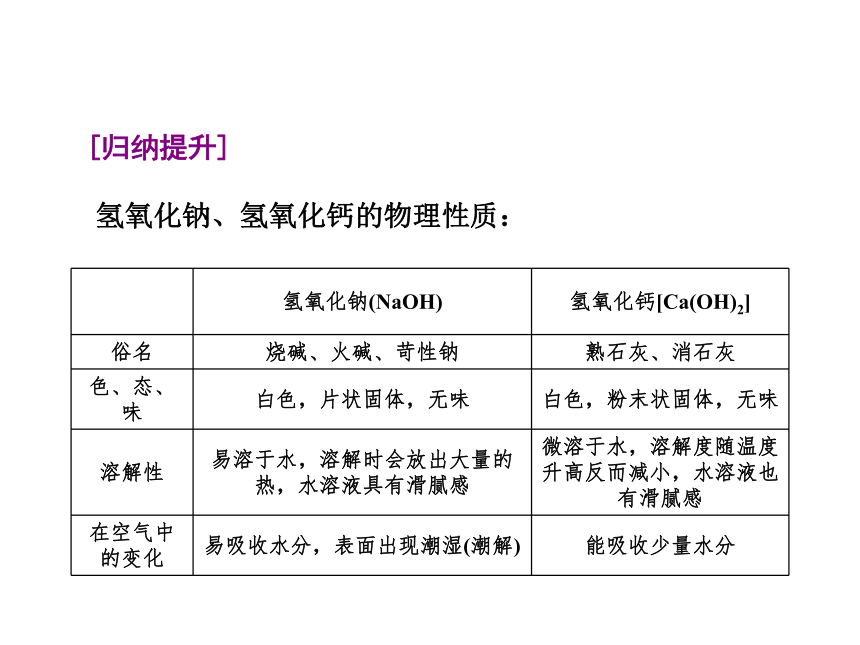
课件30张PPT。第7章 应用广泛的酸、碱、盐第2课时 常见的碱第2节 常见的酸和碱第7章 应用广泛的酸、碱、盐问 题 导 学新 知 预 习一 、氢氧化钠与氢氧化钙的物理性质、用途 第7章 应用广泛的酸、碱、盐白色易白色微烧碱火碱苛性钠熟石灰消石灰石灰水CaO+H2OCa(OH)2第7章 应用广泛的酸、碱、盐二 、氢氧化钠、氢氧化钙的化学性质[实验] 碱的性质实验记录蓝蓝红红浑浊蓝色蓝色白色1.定义:两种化合物相互交换成分,生成另外
两种新的化合物 ,这类反应称为复分解反应。
2.反应规律:AB+CD―→AD+CB
[注意] 碱溶液与非金属氧化物的反应,不是按组成交换规律进行的,不属于复分解反应。第7章 应用广泛的酸、碱、盐三、 复分解反应的定义和规律互 动 探 究探究点一 氢氧化钠与氢氧化钙的物理性质 [情景展示]第7章 应用广泛的酸、碱、盐[问题探究]取片状氢氧化钠固体露置于空气中,一段时间后观察到什么现象?说明氢氧化钠有什么性质?氢氧化钙也会这样吗?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]氢氧化钠、氢氧化钙的物理性质:第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐 氢氧化钙可由氧化钙和水反应制得,反应会放出大量的热。生石灰可用作干燥剂。
氨水(NH3·H2O)也是较为常见的碱。氨水是由氨气(NH3)溶于水形成的,具有挥发性,具有特殊的氨臭味。氨水也有弱碱性,与氢氧化钠和氢氧化钙有相似的性质。[应用示例]例1 有关氢氧化钠的叙述不正确的是( )
A. 露置在空气中易吸收水分而潮解
B.俗称烧碱、火碱、苛性钠
C.溶于水时吸收热量
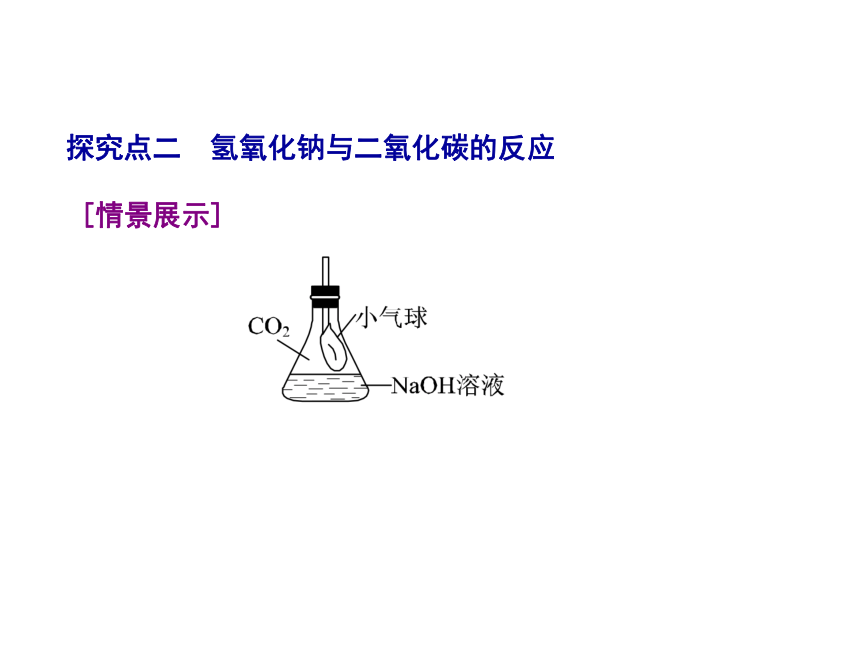
D.其溶液有滑腻感[解析] C 氢氧化钠易溶于水,溶解时放热。第7章 应用广泛的酸、碱、盐 [方法点拨] 由于氢氧化钠易吸收空气中的水分而潮解,又易吸收空气中的二氧化碳而变质(此现象体现的是其化学性质),所以氢氧化钠必须密封保存。利用氢氧化钠易潮解的性质,可利用其作干燥剂。第7章 应用广泛的酸、碱、盐探究点二 氢氧化钠与二氧化碳的反应 [情景展示]第7章 应用广泛的酸、碱、盐[问题探究]氢氧化钠溶液与二氧化碳反应没有明显现象,怎样证明二者发生了反应?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]通过氢氧化钠溶液吸收二氧化碳使装置内外产生压强差,产生明显现象来证明,可用以下装置进行证明。 第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐观察到的现象分别为:A.试管内液面上升;B.烧杯中的水进入导管;C.锥形瓶中气球胀大;D.烧杯中的水进入烧瓶,形成“喷泉”;E.U形管中的水左液面高于右液面;F.软塑料瓶变瘪。
为排除可能是二氧化碳与氢氧化钠溶液中的水发生了反应,还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比试验。[应用示例]例2 有下列四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是( )第7章 应用广泛的酸、碱、盐[解析] B 二氧化碳也能溶于水,使试管中压强减小,应进行对比实验。第7章 应用广泛的酸、碱、盐[方法点拨] NaOH和CO2反应生成Na2CO3和H2O,由于反应中没有出现常见的颜色、状态、气体、沉淀等现象,因此很难判断出发生了反应。CO2到底是与H2O反应还是与NaOH反应,需通过对比实验来验证。探究点三 氢氧化钠与氢氧化钙的变质 [情景展示]第7章 应用广泛的酸、碱、盐盛放石灰水的试剂瓶液面出现一层白色薄膜。[问题探究]石灰水表面白色薄膜的成分是什么?如何验证氢氧化钠是否变质及变质程度?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]石灰水表面的白色固体,可能是石灰水吸收二氧化碳后发生变质生成的难溶性的碳酸钙沉淀。根据氢氧化钠的变质程度有三种可能,提出猜想:a. 氢氧化钠未变质;b. 氢氧化钠部分变质;c. 氢氧化钠完全变质。检验方法:取少许固体样品于试管中,加水溶解。先加入足量氯化钙溶液,若有沉淀生成,则说明氢氧化钠变质为碳酸钠,若无现象,则说明猜想a成立;再滴加无色酚酞试液,若溶液变色,则说明猜想b成立;若无现象,则说明猜想c成立。第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐[应用示例]例3 干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质。某研究小组对一个干燥管里的“碱石灰”样品的成分进行实验探究。
[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠。
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠。
[实验探究]第7章 应用广泛的酸、碱、盐第7章 应用广泛的酸、碱、盐第7章 应用广泛的酸、碱、盐 [小结与思考]
(1)从上述实验现象推断:猜想________成立。
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由。[答案] [实验探究] 氧化钙(或氢氧化钠,或氧化钙和氢氧化钠)
CaCO3+2HCl===CaCl2+H2O+CO2↑
[小结与思考] (1)Ⅱ (2)不一定,可能是样品中含有氧化钙与碳酸钠,加水后氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙。第7章 应用广泛的酸、碱、盐 [方法点拨] ①氢氧化钠、氢氧化钙溶液都能与空气中的二氧化碳发生反应而变质,它们分别会生成碳酸钠与碳酸钙,所以我们只需验证碳酸钠、碳酸钙存在即可,通常是取样加稀盐酸,看是否有气泡产生。实验室中通常用氢氧化钙溶液检验二氧化碳,用氢氧化钠溶液吸收二氧化碳。②对物质的变质程度的猜想有三种可能:没有变质;部分变质;完全变质。通过对产物成分的验证可得出变质程度。课 堂 小 结第7章 应用广泛的酸、碱、盐当 堂 检 测知识点? 碱的性质1.掌握物质的分类是学好化学的基础,指出下列物质中属于碱的是( )
A. NaCl B. KOH C. MgO D.Cu第7章 应用广泛的酸、碱、盐[答案] B2.下列物质露置在空气中质量增加且有新物质生成的是( )
A.生石灰 B.浓盐酸 C.浓硫酸 D.硝酸钾第7章 应用广泛的酸、碱、盐[解析] A 生石灰露置在空气中与水蒸气反应,生成氢氧化钙。 3.图7-2-14是小群同学归纳的几种含钙化合物的知识网络图,请根据该图回答:
(1)属于碱的是______________。
(2)可用作食品干燥剂的是__________。
(3)写出图中涉及的任意一个反应的化学方程式:___。 第7章 应用广泛的酸、碱、盐[答案] (1)Ca(OH)2 (2)CaO
(3)CaO+H2O===Ca(OH)2(其他合理答案均可)[解析] 知识网络图反映出氧化物、碱、盐三者之间的转化关系。CaO与H2O可生成Ca(OH)2,Ca(OH)2和CO2可生成CaCO3和H2O,CaCO3高温下煅烧生成CaO和CO2。第7章 应用广泛的酸、碱、盐
两种新的化合物 ,这类反应称为复分解反应。
2.反应规律:AB+CD―→AD+CB
[注意] 碱溶液与非金属氧化物的反应,不是按组成交换规律进行的,不属于复分解反应。第7章 应用广泛的酸、碱、盐三、 复分解反应的定义和规律互 动 探 究探究点一 氢氧化钠与氢氧化钙的物理性质 [情景展示]第7章 应用广泛的酸、碱、盐[问题探究]取片状氢氧化钠固体露置于空气中,一段时间后观察到什么现象?说明氢氧化钠有什么性质?氢氧化钙也会这样吗?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]氢氧化钠、氢氧化钙的物理性质:第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐 氢氧化钙可由氧化钙和水反应制得,反应会放出大量的热。生石灰可用作干燥剂。
氨水(NH3·H2O)也是较为常见的碱。氨水是由氨气(NH3)溶于水形成的,具有挥发性,具有特殊的氨臭味。氨水也有弱碱性,与氢氧化钠和氢氧化钙有相似的性质。[应用示例]例1 有关氢氧化钠的叙述不正确的是( )
A. 露置在空气中易吸收水分而潮解
B.俗称烧碱、火碱、苛性钠
C.溶于水时吸收热量
D.其溶液有滑腻感[解析] C 氢氧化钠易溶于水,溶解时放热。第7章 应用广泛的酸、碱、盐 [方法点拨] 由于氢氧化钠易吸收空气中的水分而潮解,又易吸收空气中的二氧化碳而变质(此现象体现的是其化学性质),所以氢氧化钠必须密封保存。利用氢氧化钠易潮解的性质,可利用其作干燥剂。第7章 应用广泛的酸、碱、盐探究点二 氢氧化钠与二氧化碳的反应 [情景展示]第7章 应用广泛的酸、碱、盐[问题探究]氢氧化钠溶液与二氧化碳反应没有明显现象,怎样证明二者发生了反应?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]通过氢氧化钠溶液吸收二氧化碳使装置内外产生压强差,产生明显现象来证明,可用以下装置进行证明。 第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐观察到的现象分别为:A.试管内液面上升;B.烧杯中的水进入导管;C.锥形瓶中气球胀大;D.烧杯中的水进入烧瓶,形成“喷泉”;E.U形管中的水左液面高于右液面;F.软塑料瓶变瘪。
为排除可能是二氧化碳与氢氧化钠溶液中的水发生了反应,还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比试验。[应用示例]例2 有下列四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是( )第7章 应用广泛的酸、碱、盐[解析] B 二氧化碳也能溶于水,使试管中压强减小,应进行对比实验。第7章 应用广泛的酸、碱、盐[方法点拨] NaOH和CO2反应生成Na2CO3和H2O,由于反应中没有出现常见的颜色、状态、气体、沉淀等现象,因此很难判断出发生了反应。CO2到底是与H2O反应还是与NaOH反应,需通过对比实验来验证。探究点三 氢氧化钠与氢氧化钙的变质 [情景展示]第7章 应用广泛的酸、碱、盐盛放石灰水的试剂瓶液面出现一层白色薄膜。[问题探究]石灰水表面白色薄膜的成分是什么?如何验证氢氧化钠是否变质及变质程度?[思考交流]第7章 应用广泛的酸、碱、盐[归纳提升]石灰水表面的白色固体,可能是石灰水吸收二氧化碳后发生变质生成的难溶性的碳酸钙沉淀。根据氢氧化钠的变质程度有三种可能,提出猜想:a. 氢氧化钠未变质;b. 氢氧化钠部分变质;c. 氢氧化钠完全变质。检验方法:取少许固体样品于试管中,加水溶解。先加入足量氯化钙溶液,若有沉淀生成,则说明氢氧化钠变质为碳酸钠,若无现象,则说明猜想a成立;再滴加无色酚酞试液,若溶液变色,则说明猜想b成立;若无现象,则说明猜想c成立。第7章 应用广泛的酸、碱、盐[课堂速记]第7章 应用广泛的酸、碱、盐[应用示例]例3 干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质。某研究小组对一个干燥管里的“碱石灰”样品的成分进行实验探究。
[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠。
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠。
[实验探究]第7章 应用广泛的酸、碱、盐第7章 应用广泛的酸、碱、盐第7章 应用广泛的酸、碱、盐 [小结与思考]
(1)从上述实验现象推断:猜想________成立。
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由。[答案] [实验探究] 氧化钙(或氢氧化钠,或氧化钙和氢氧化钠)
CaCO3+2HCl===CaCl2+H2O+CO2↑
[小结与思考] (1)Ⅱ (2)不一定,可能是样品中含有氧化钙与碳酸钠,加水后氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙。第7章 应用广泛的酸、碱、盐 [方法点拨] ①氢氧化钠、氢氧化钙溶液都能与空气中的二氧化碳发生反应而变质,它们分别会生成碳酸钠与碳酸钙,所以我们只需验证碳酸钠、碳酸钙存在即可,通常是取样加稀盐酸,看是否有气泡产生。实验室中通常用氢氧化钙溶液检验二氧化碳,用氢氧化钠溶液吸收二氧化碳。②对物质的变质程度的猜想有三种可能:没有变质;部分变质;完全变质。通过对产物成分的验证可得出变质程度。课 堂 小 结第7章 应用广泛的酸、碱、盐当 堂 检 测知识点? 碱的性质1.掌握物质的分类是学好化学的基础,指出下列物质中属于碱的是( )
A. NaCl B. KOH C. MgO D.Cu第7章 应用广泛的酸、碱、盐[答案] B2.下列物质露置在空气中质量增加且有新物质生成的是( )
A.生石灰 B.浓盐酸 C.浓硫酸 D.硝酸钾第7章 应用广泛的酸、碱、盐[解析] A 生石灰露置在空气中与水蒸气反应,生成氢氧化钙。 3.图7-2-14是小群同学归纳的几种含钙化合物的知识网络图,请根据该图回答:
(1)属于碱的是______________。
(2)可用作食品干燥剂的是__________。
(3)写出图中涉及的任意一个反应的化学方程式:___。 第7章 应用广泛的酸、碱、盐[答案] (1)Ca(OH)2 (2)CaO
(3)CaO+H2O===Ca(OH)2(其他合理答案均可)[解析] 知识网络图反映出氧化物、碱、盐三者之间的转化关系。CaO与H2O可生成Ca(OH)2,Ca(OH)2和CO2可生成CaCO3和H2O,CaCO3高温下煅烧生成CaO和CO2。第7章 应用广泛的酸、碱、盐
