【浙教版】2024年春初二科学授课课件6探究相对原子质量
文档属性
| 名称 | 【浙教版】2024年春初二科学授课课件6探究相对原子质量 |  | |
| 格式 | pptx | ||
| 文件大小 | 319.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-03 16:27:35 | ||
图片预览






文档简介
(共18张PPT)
5探究相对原子质量
八年级科学春季复习PPT
1
相对原子质量
1.原子的质量极小,计算极不方便。为此,国际上规定采用 相对原子质量 来表示原子的质量关系。
2.相对原子质量的概念:把一个碳-12原子的质量分为 12 等份,则1份质量为1.993×10-26×1/12=1.661×10-27千克。其他原子的质量与1.661×10-27千克质量相比后得出一定的 比值 ,这个比值就是该原子的 相对原子质量 。
1
相对原子质量
3.相对原子质量的计算式:
某原子的相对原子质量=
原子的质量与相对原子质量的区别和联系如下表所示:
注:相对原子质量≈质子数+中子数
1
气息666
典型例题
气息666
【例1】(2024建功单元)作为相对原子质量标准的碳-12可以写成 C。1个 C的质量为a kg,1个 CO 的质量为bkg,若以 CO 中的1个氧原了质量的1/16作为相对原子质量的标准,则 CO2的相对分子质量是( )
A.24b /(b-a) B.32b /(a-b) C.32b /(b-a) D.16b /(a-b)
【答案】C
1
气息666
典型例题
气息666
【例2】(2023浙江期中)现在已经实现了4680无极耳电池的量产,可以让电动汽车价格更低性能更高。其中一项技术突破是阳极材料用硅代替了石墨,相关信息如图,下列说法中正确的是( )
A.硅是一种金属元素 B.一个硅原子比碳原子多8个质子
C.与其他元素根本区别是中子数不同 D.碳相对原子质量是12.01克
【答案】B
1
气息666
典型例题
【例3】(2022浙江阶段)已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕原子的相对原子质量为152,该铕(Eu)原子的质量为( )
【答案】B
1
气息666
典型例题
【例4】(2023浙江竞赛)已知一个分子的质量为千克,一个分子的质量为千克(假设两种分子中都具有相同氮原子和氧原子)。若以一个氮原子质量的1/14作为标准,可计算出的相对分子质量(用、表示)为( )
【答案】D
2
相对分子质量
1.一个分子中各原子的相对原子质量 总和 就是该分子的相对分子质量。
2.求物质的相对分子质量,首先要写出正确的 化学式 ,再利用相对原子质量表,查出各元素的 相对原子质量 ,最后根据分子中各元素的相对原子质量 总和 求出相对分子质量。
2
相对分子质量
3.相对分子质量计算的注意事项:
(1)元素符号与其右下角数字之间在计算相对分子质量时需用“ × ”,元素符号之间在计算相对分子质量时需用“ + ”
CO2: 12+16×2 =44
(2)原子团括号外右下角的数字表示原子团的个数,应先将原子团内各原子的相对原子质量之和计算出来,再 乘以 其个数
Al2(SO4)3: 27×2+(32+16×4)×3 =342
(3)结晶水合物中的“·”表示结合的含义,在计算相对分子质量时应将“·”前后两部分的相对分子质量 相加 而不是相乘。
CuSO4·5H2O: 64+32+16×4+5×(1×2+16) =250
(4)相对分子质量与相对原子质量一样,也是一个 比值 ,其单位也是“ 1 ”,通常不写。
2
典型例题
【例1】(2023元培期中)丽水百山祖森林公园的空气中富含有被称为“空气维生素”的负氧离子(O2 ),它是空气中的自由电子附着在氧分子上所形成,那么O2 的相对分子质量是( )
A. 16 B. 32 C. 16克 D. 32克
【答案】B
【例2】(2023浙江期中)达菲(分子式也叫奥司他韦)对于治疗甲流有较好的效果,曾一度出现断供的情况。以下关于奥司他韦说法正确的是( )
A.达菲中含有磷酸分子 B.达菲中氮、磷元素的质量比是28∶31
C.达菲分子相对分子质量是400
D.达菲由16个碳原子,31个氢原子,2个氮原子,8个氧原子和1个磷原子构成
【答案】B
3
相关计算
1.计算组成物质的各元素的质量比
(1)计算依据:化合物中各元素的质量比等于各元素 相对原子质量 乘以其 原子个数 的乘积的比值。
NH4NO3
N H O
(14×2)∶(1×4)∶(16×3)= 7∶1∶12
(2)计算注意事项:
①元素只讲种类,不讲个数,因此在计算格式的书写上有严格的规定,如计算硝酸铵(NH4NO3)中各元素的质量比,
不能写成 2N∶4H∶3O,也不能写成N2∶H4∶O3
应该写成
m(N)∶m(H)∶m(O)=(14×2)∶(1×4)∶(16×3)= 7∶1∶12
3
相关计算
(2)计算注意事项:
②检查各原子的原子总数,
硝酸铵(NH4NO3)中氮元素的原子总数是 2 而不是1,不要遗漏。
③不要把原子个数比当作是元素的质量比。
原子个数比是元素符号右下角的 数字 之比,
H2O中,氢元素与氧元素的原子个数比为 2∶1 ,
氢元素与氧元素的质量比为(1×2)∶(16×1)= 1∶8
3
相关计算
2.计算物质中某元素的质量分数或质量
(1)化合物中某元素的质量分数= ×100%。
(2)化合物中某元素的质量
=化合物的质量×化合物中该元素的质量分数
注:
a.根据化学式计算组成物质的各元素的质量比时,计算结果通常为最简整数比。
b.元素的质量分数用百分数表示,计算物质中某元素的质量分数时,不要漏乘100%
CuO Fe2O3 Fe3O4
3
典型例题
【例1】(2024建功单元)乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人对该气味极其敏感。在天然气中添加该物质,可以帮助判断天然气泄露。下列关于乙硫醇的说法正确的是( )
A.从元素质量角度看:乙硫醇中硫元素的质量分数可表达为32/(12+1+32)
B.从元素组成角度看:乙硫醇由碳、氢、硫三个元素组成
C.从微粒构成角度看:乙硫醇由9个原子构成
D.从分子结构角度看:乙硫醇分子中碳、氢、硫原子个数比为2:6:1
【答案】D
3
典型例题
【例2】(2024建功单元)已知X、Y 两元素的相对原子质量之比为2:1,由该两元素形成的化合物中,X、Y 元素的质量比为2:3,其中X 元素的化合价为+a价、则在此化合物中Y 元素的化合价为( )
A.-a/2 B.-a/3 C.-2a/2 D.-2a/3
【答案】B
【例3】(2024建功单元)在FeO、Fe2O 、和CaCO 的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是( )
A.5% B.15% C.25% D.35%
【答案】C
3
典型例题
【例4】(2024浙江专题)由CO和SO2组成的混合气体,则得其中碳元素的质量分数是24%,则该混合气体中氧元素的质量分数是( )
A.56%B.54% C.52% D.50%
【答案】B
【例5】(2023浙江自主)经实验测得某一溶液由Na+、Mg2+、Cl-、SO42-四种离子组成,其中含有4.6克Na+、14.4克SO42-、14.2克Cl-,则Mg2+质量为( )
A.2.4克 B.5克 C.6克 D.4.8克
【答案】C
3
典型例题
【例6】(2023元培期中) 1828年,德国化学家弗里德里希·维勒首次人工合成了尿素,尿素作为中性肥料适用于各种土壤和植物,使用方便,对土壤的破坏作用小,同时尿素是含氮量最高的固体氮肥。因此它在农业领域有广泛的应用。尿素的化学式为CO(NH2) ,分子结构式如图所示,试回答下列问题:
(1)尿素由 种元素组成。
(2)尿素中氮、氧元素的质量比为 。
(3)某块菜地需要施用2.1千克氮元素,则需尿素 千克。
【答案】四 7:4 4.5
3
典型例题
【例7】 (2024建功单元)(1) 某三价金属与氧元素形成的化合物中氧元素质量分数为 30%, 则该金属的相对原子质量为______________。硒的一种化合物是 K2SeO , 已知K2SO 叫硫酸钾,则K2SeO 的名称叫________。
(2)A、B两元素相对原子质量之比为2:1, 仅由这两种元素组成的化合物里, A、B两元素质量比为2:3, 若其中B为-n价,则此化合物中A元素的化合价为______________。
(3)已知某元素 R 与氢元素的化合物的化学式为RH , 含氢为 25%, 求R的相对原子质量是______________
(4) 要使 CO 和CO中含有相同质量的氧元素, 则 CO 和CO的质量比是_________质量相等的CO 和CO中,氧元素的质量比是______________;
(5) 铁元素在化合物中通常显+2价或+3价,因而Fe O 可写成FeO Fe O 。已知Pb在化合物里显+2价或+4价,则Pb O 也可以写成______________。
【答案】56 硒酸钾 +3n 12 11:14 14:11 2PbO·PbO2
5探究相对原子质量
八年级科学春季复习PPT
1
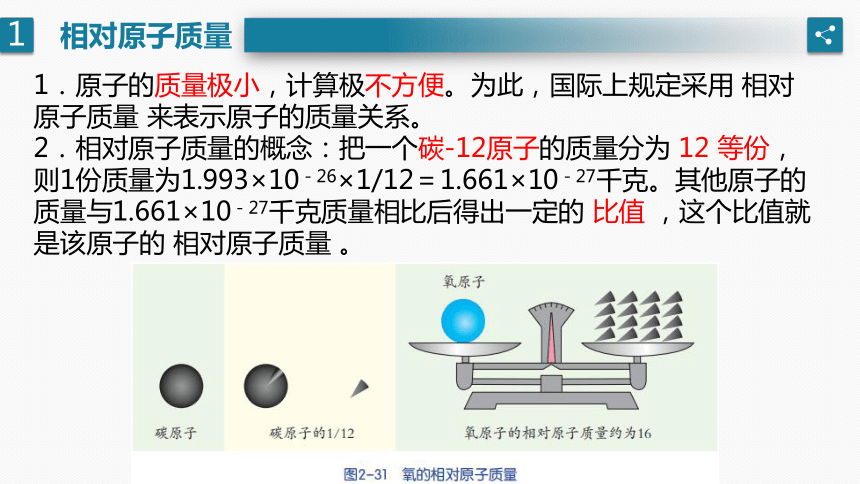
相对原子质量
1.原子的质量极小,计算极不方便。为此,国际上规定采用 相对原子质量 来表示原子的质量关系。
2.相对原子质量的概念:把一个碳-12原子的质量分为 12 等份,则1份质量为1.993×10-26×1/12=1.661×10-27千克。其他原子的质量与1.661×10-27千克质量相比后得出一定的 比值 ,这个比值就是该原子的 相对原子质量 。
1
相对原子质量
3.相对原子质量的计算式:
某原子的相对原子质量=
原子的质量与相对原子质量的区别和联系如下表所示:
注:相对原子质量≈质子数+中子数
1
气息666
典型例题
气息666
【例1】(2024建功单元)作为相对原子质量标准的碳-12可以写成 C。1个 C的质量为a kg,1个 CO 的质量为bkg,若以 CO 中的1个氧原了质量的1/16作为相对原子质量的标准,则 CO2的相对分子质量是( )
A.24b /(b-a) B.32b /(a-b) C.32b /(b-a) D.16b /(a-b)
【答案】C
1
气息666
典型例题
气息666
【例2】(2023浙江期中)现在已经实现了4680无极耳电池的量产,可以让电动汽车价格更低性能更高。其中一项技术突破是阳极材料用硅代替了石墨,相关信息如图,下列说法中正确的是( )
A.硅是一种金属元素 B.一个硅原子比碳原子多8个质子
C.与其他元素根本区别是中子数不同 D.碳相对原子质量是12.01克
【答案】B
1
气息666
典型例题
【例3】(2022浙江阶段)已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕原子的相对原子质量为152,该铕(Eu)原子的质量为( )
【答案】B
1
气息666
典型例题
【例4】(2023浙江竞赛)已知一个分子的质量为千克,一个分子的质量为千克(假设两种分子中都具有相同氮原子和氧原子)。若以一个氮原子质量的1/14作为标准,可计算出的相对分子质量(用、表示)为( )
【答案】D
2
相对分子质量
1.一个分子中各原子的相对原子质量 总和 就是该分子的相对分子质量。
2.求物质的相对分子质量,首先要写出正确的 化学式 ,再利用相对原子质量表,查出各元素的 相对原子质量 ,最后根据分子中各元素的相对原子质量 总和 求出相对分子质量。
2
相对分子质量
3.相对分子质量计算的注意事项:
(1)元素符号与其右下角数字之间在计算相对分子质量时需用“ × ”,元素符号之间在计算相对分子质量时需用“ + ”
CO2: 12+16×2 =44
(2)原子团括号外右下角的数字表示原子团的个数,应先将原子团内各原子的相对原子质量之和计算出来,再 乘以 其个数
Al2(SO4)3: 27×2+(32+16×4)×3 =342
(3)结晶水合物中的“·”表示结合的含义,在计算相对分子质量时应将“·”前后两部分的相对分子质量 相加 而不是相乘。
CuSO4·5H2O: 64+32+16×4+5×(1×2+16) =250
(4)相对分子质量与相对原子质量一样,也是一个 比值 ,其单位也是“ 1 ”,通常不写。
2
典型例题
【例1】(2023元培期中)丽水百山祖森林公园的空气中富含有被称为“空气维生素”的负氧离子(O2 ),它是空气中的自由电子附着在氧分子上所形成,那么O2 的相对分子质量是( )
A. 16 B. 32 C. 16克 D. 32克
【答案】B
【例2】(2023浙江期中)达菲(分子式也叫奥司他韦)对于治疗甲流有较好的效果,曾一度出现断供的情况。以下关于奥司他韦说法正确的是( )
A.达菲中含有磷酸分子 B.达菲中氮、磷元素的质量比是28∶31
C.达菲分子相对分子质量是400
D.达菲由16个碳原子,31个氢原子,2个氮原子,8个氧原子和1个磷原子构成
【答案】B
3
相关计算
1.计算组成物质的各元素的质量比
(1)计算依据:化合物中各元素的质量比等于各元素 相对原子质量 乘以其 原子个数 的乘积的比值。
NH4NO3
N H O
(14×2)∶(1×4)∶(16×3)= 7∶1∶12
(2)计算注意事项:
①元素只讲种类,不讲个数,因此在计算格式的书写上有严格的规定,如计算硝酸铵(NH4NO3)中各元素的质量比,
不能写成 2N∶4H∶3O,也不能写成N2∶H4∶O3
应该写成
m(N)∶m(H)∶m(O)=(14×2)∶(1×4)∶(16×3)= 7∶1∶12
3
相关计算
(2)计算注意事项:
②检查各原子的原子总数,
硝酸铵(NH4NO3)中氮元素的原子总数是 2 而不是1,不要遗漏。
③不要把原子个数比当作是元素的质量比。
原子个数比是元素符号右下角的 数字 之比,
H2O中,氢元素与氧元素的原子个数比为 2∶1 ,
氢元素与氧元素的质量比为(1×2)∶(16×1)= 1∶8
3
相关计算
2.计算物质中某元素的质量分数或质量
(1)化合物中某元素的质量分数= ×100%。
(2)化合物中某元素的质量
=化合物的质量×化合物中该元素的质量分数
注:
a.根据化学式计算组成物质的各元素的质量比时,计算结果通常为最简整数比。
b.元素的质量分数用百分数表示,计算物质中某元素的质量分数时,不要漏乘100%
CuO Fe2O3 Fe3O4
3
典型例题
【例1】(2024建功单元)乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人对该气味极其敏感。在天然气中添加该物质,可以帮助判断天然气泄露。下列关于乙硫醇的说法正确的是( )
A.从元素质量角度看:乙硫醇中硫元素的质量分数可表达为32/(12+1+32)
B.从元素组成角度看:乙硫醇由碳、氢、硫三个元素组成
C.从微粒构成角度看:乙硫醇由9个原子构成
D.从分子结构角度看:乙硫醇分子中碳、氢、硫原子个数比为2:6:1
【答案】D
3
典型例题
【例2】(2024建功单元)已知X、Y 两元素的相对原子质量之比为2:1,由该两元素形成的化合物中,X、Y 元素的质量比为2:3,其中X 元素的化合价为+a价、则在此化合物中Y 元素的化合价为( )
A.-a/2 B.-a/3 C.-2a/2 D.-2a/3
【答案】B
【例3】(2024建功单元)在FeO、Fe2O 、和CaCO 的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是( )
A.5% B.15% C.25% D.35%
【答案】C
3
典型例题
【例4】(2024浙江专题)由CO和SO2组成的混合气体,则得其中碳元素的质量分数是24%,则该混合气体中氧元素的质量分数是( )
A.56%B.54% C.52% D.50%
【答案】B
【例5】(2023浙江自主)经实验测得某一溶液由Na+、Mg2+、Cl-、SO42-四种离子组成,其中含有4.6克Na+、14.4克SO42-、14.2克Cl-,则Mg2+质量为( )
A.2.4克 B.5克 C.6克 D.4.8克
【答案】C
3
典型例题
【例6】(2023元培期中) 1828年,德国化学家弗里德里希·维勒首次人工合成了尿素,尿素作为中性肥料适用于各种土壤和植物,使用方便,对土壤的破坏作用小,同时尿素是含氮量最高的固体氮肥。因此它在农业领域有广泛的应用。尿素的化学式为CO(NH2) ,分子结构式如图所示,试回答下列问题:
(1)尿素由 种元素组成。
(2)尿素中氮、氧元素的质量比为 。
(3)某块菜地需要施用2.1千克氮元素,则需尿素 千克。
【答案】四 7:4 4.5
3
典型例题
【例7】 (2024建功单元)(1) 某三价金属与氧元素形成的化合物中氧元素质量分数为 30%, 则该金属的相对原子质量为______________。硒的一种化合物是 K2SeO , 已知K2SO 叫硫酸钾,则K2SeO 的名称叫________。
(2)A、B两元素相对原子质量之比为2:1, 仅由这两种元素组成的化合物里, A、B两元素质量比为2:3, 若其中B为-n价,则此化合物中A元素的化合价为______________。
(3)已知某元素 R 与氢元素的化合物的化学式为RH , 含氢为 25%, 求R的相对原子质量是______________
(4) 要使 CO 和CO中含有相同质量的氧元素, 则 CO 和CO的质量比是_________质量相等的CO 和CO中,氧元素的质量比是______________;
(5) 铁元素在化合物中通常显+2价或+3价,因而Fe O 可写成FeO Fe O 。已知Pb在化合物里显+2价或+4价,则Pb O 也可以写成______________。
【答案】56 硒酸钾 +3n 12 11:14 14:11 2PbO·PbO2
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
