3.1 空气与氧气 氧气体积分数测量及氧气制取实验专题(含解析)
文档属性
| 名称 | 3.1 空气与氧气 氧气体积分数测量及氧气制取实验专题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 201.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-05-13 16:03:20 | ||
图片预览



文档简介
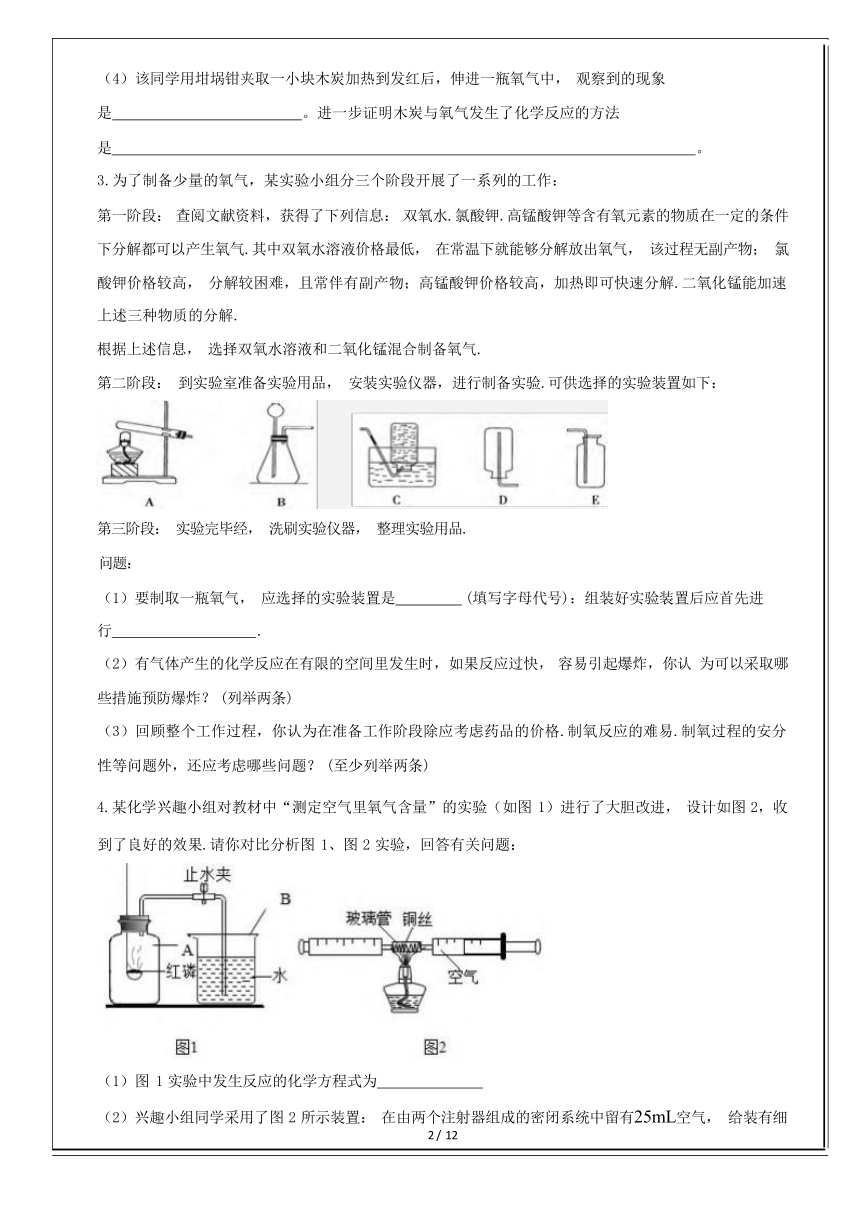
氧气体积分数测量及氧气制取实验专题 一 、实验探究题 1.某校化学兴趣小组利用红磷是燃烧对空气中氧气的含量进行实验探究。 【小组讨论】 (1)小组同学共同设计了如图的两套装置,你认为合理的是 (填序号) (2)写出红磷燃烧的文字表达式 。 (3)【小组实验】在讨论的基础上, 他们分组进行了实验。 【数据分析】实验结束后,整理数据如下:(注: 集气瓶容积为 100 mL) 组别123456进入集气瓶中水的体积/mL202119202219
通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的五分之一。通过实验还可以推断集气瓶 中剩余气体有怎样的物理性质和化学性质? 2.某同学在实验室用以下装置制备氧气并探究氧气的性质。 (1)该同学制备氧气时应选用的药品是 (限选: 过氧化氢溶液、二氧化锰、高锰酸钾),生 成氧气的文字表达式为 。 (2)夏天室温很高的时候,检验该装置气密性的合理方法是: 将导管口放入水面下,然 后 ,若导管口有气泡冒出,说明装置不漏气。 (3)添加药品,连接仪器,加热试管后导管口有气泡冒出,此时导管口还在集气瓶外面,接下来的操作 正确的是 (填字母)。 A.立刻将导管口移入集气瓶 B.等到气泡连续且均匀时,再将导管口移入集气瓶 C.立即熄灭酒精灯,将导管口移入集气瓶后再点燃酒精灯 1 / 12
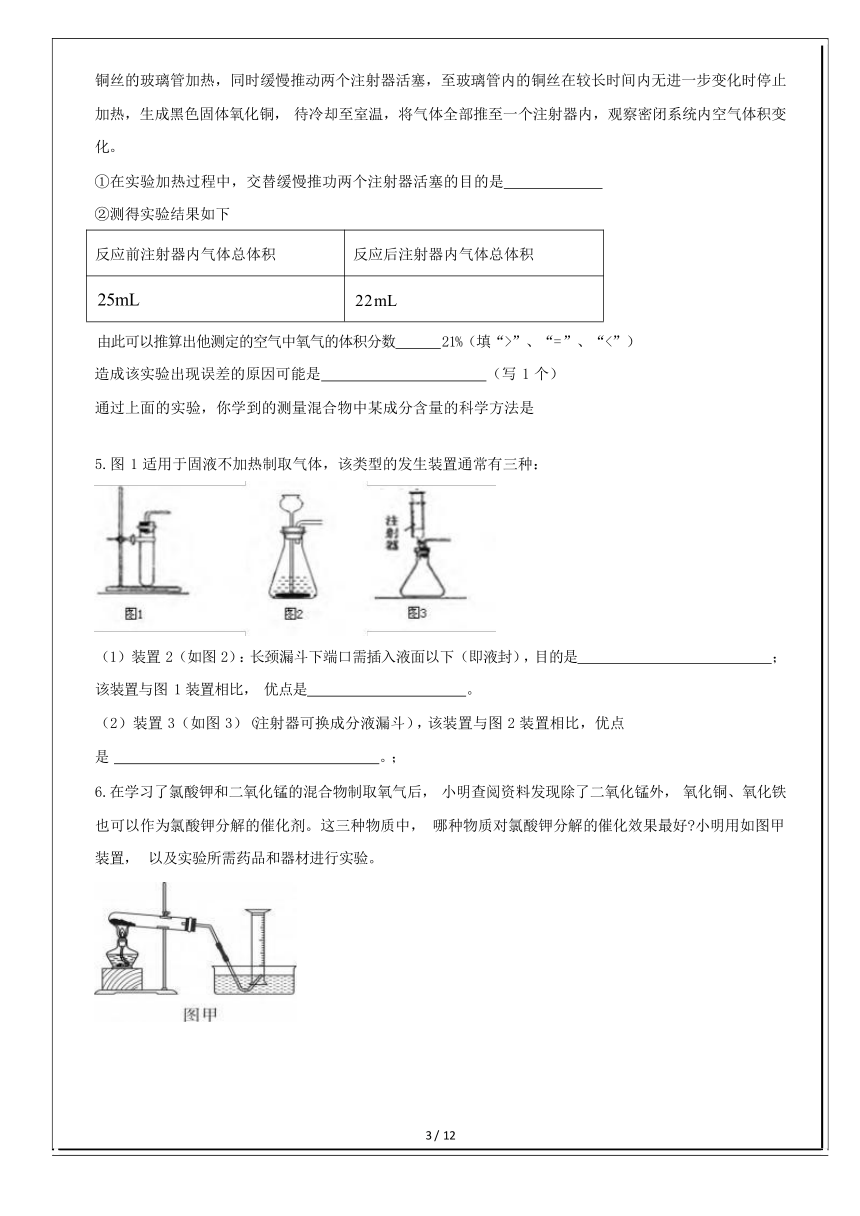
(4)该同学用坩埚钳夹取一小块木炭加热到发红后,伸进一瓶氧气中, 观察到的现象 是 。进一步证明木炭与氧气发生了化学反应的方法 是 。 3.为了制备少量的氧气,某实验小组分三个阶段开展了一系列的工作: 第一阶段: 查阅文献资料,获得了下列信息: 双氧水.氯酸钾.高锰酸钾等含有氧元素的物质在一定的条件 下分解都可以产生氧气.其中双氧水溶液价格最低, 在常温下就能够分解放出氧气, 该过程无副产物; 氯 酸钾价格较高, 分解较困难,且常伴有副产物;高锰酸钾价格较高,加热即可快速分解.二氧化锰能加速 上述三种物质的分解. 根据上述信息, 选择双氧水溶液和二氧化锰混合制备氧气. 第二阶段: 到实验室准备实验用品, 安装实验仪器,进行制备实验.可供选择的实验装置如下: 第三阶段: 实验完毕经, 洗刷实验仪器, 整理实验用品. 问题: (1)要制取一瓶氧气, 应选择的实验装置是 (填写字母代号):组装好实验装置后应首先进 行 . (2)有气体产生的化学反应在有限的空间里发生时,如果反应过快, 容易引起爆炸,你认 为可以采取哪 些措施预防爆炸? (列举两条) (3)回顾整个工作过程,你认为在准备工作阶段除应考虑药品的价格.制氧反应的难易.制氧过程的安分 性等问题外,还应考虑哪些问题? (至少列举两条) 4.某化学兴趣小组对教材中“测定空气里氧气含量”的实验(如图 1)进行了大胆改进, 设计如图 2,收 到了良好的效果.请你对比分析图 1、图 2 实验,回答有关问题: (1)图 1 实验中发生反应的化学方程式为 (2)兴趣小组同学采用了图 2 所示装置: 在由两个注射器组成的密闭系统中留有25mL空气, 给装有细 2 / 12
铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止 加热,生成黑色固体氧化铜, 待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变 化。 ①在实验加热过程中,交替缓慢推功两个注射器活塞的目的是 ②测得实验结果如下 反应前注射器内气体总体积反应后注射器内气体总体积25mL22mL
由此可以推算出他测定的空气中氧气的体积分数 21%(填“>”、“= ”、“<”) 造成该实验出现误差的原因可能是 (写 1 个) 通过上面的实验,你学到的测量混合物中某成分含量的科学方法是 5.图 1 适用于固液不加热制取气体,该类型的发生装置通常有三种: (1)装置 2(如图 2):长颈漏斗下端口需插入液面以下(即液封),目的是 ; 该装置与图 1 装置相比, 优点是 。 (2)装置 3(如图 3)(注射器可换成分液漏斗),该装置与图 2 装置相比,优点 是 。; 6.在学习了氯酸钾和二氧化锰的混合物制取氧气后, 小明查阅资料发现除了二氧化锰外, 氧化铜、氧化铁 也可以作为氯酸钾分解的催化剂。这三种物质中, 哪种物质对氯酸钾分解的催化效果最好 小明用如图甲 装置, 以及实验所需药品和器材进行实验。 3 / 12
(1)请你补充完成以下实验步骤: ①检查装置的气密性; ②取三支相同的试管,各加入相同质量的氯酸钾; ③ ; ④ ; ⑤重复多次实验; ⑥比较数据,得出结论。 (2)实验结果发现二氧化锰对氯酸钾分解的催化效果比氧化铁要好,图乙为氯酸钾和氧化铁混合物制取 氧气时,生成氧气质量随反应时间变化的图像。小妍同学画出下列等质量的氯酸钾和二氧化锰混合物制取 氧气时,生成氧气质量随反应时间变化的图像。你认为正确的是 。 A. B.C. D. 7.如图是实验室的部分仪器或实验装置,回答有关问题. (1)实验室要用 KClO3 和 MnO2 制取氧气,应选用发生装置是(填编号) ,若用排水法收集氧 气,收集完毕后,应先 . (2)装满氧气的集气瓶应盖上玻璃片后 (填正放或倒放)在桌面上,其验满的操作方法 是 . 8.某科学小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。出该小组同 学进行了如下探究。 4 / 12
(1)探究一:蜡烛燃烧产生火焰的原因是什么? 点燃蜡烛,将金属导管一端伸入内焰,导出其中质,在另一端管口点燃,也有火焰产生。由此可知:蜡烛 燃烧产生的火焰是由 (填“固态 ”或“气态”)物质燃烧形成的。 (2)探究二: 物质燃烧产生火焰的根本原因是什么? [查阅资料] 物质熔点/℃沸点/℃燃烧时温度/℃石蜡50~ 70300~ 550约 600铁1 5352 750约 1800钠97.8883约 1400
由上表可知:物质燃烧能否产生火焰与其 (填“熔点 ”或“沸点”)和燃烧时温度有关。由此推 测:钠在燃烧时, (填“有 ”或“没 有”)火焰产生。 (3)木炭在氧气中燃烧没有火焰, 但生活中木炭燃烧时会产生火焰,其原因可能是 (提示:含碳可燃物在氧气浓度低时易产生一氧化碳等可燃性气体)。 9.利用图甲所示的教材装置测量空气中氧气的体积分数,选用红磷作为药品是最佳选择吗? 某兴趣小组设 计并开展了如下实验: ①准备如图乙的玻璃容器,顶部用密封盖密封,并检查该装置的气密性。 ②将氧气传感器(能实时显示容器内氧气的体积分数)固定在容器内壁,并装入足量的红磷。 ③用激光笔点燃红磷,红磷剧烈燃烧,观察并记录氧气传感器所显示的氧气体积分数的变化情况。 ④用白磷替换红磷重复上步骤①~③。 ⑤换用食品脱氧剂(可以直接与氧气反应, 无需点燃的物质)重复上述步骤①~③。 根据实验数据, 分别绘制三种物质氧化时容器内氧气体积分数随时间的变化情况, 如图丙所示。 5 / 12
(1)步骤①中检查气密性时, 将玻璃容器浸没水中,如果观察到 ,则说明气 密性不好。 (2)甲图中白磷(P)燃烧的化学方程式为: 。 (3)装置甲中 150 毫升集气瓶中装入 1/5 的水,量筒内装有 50 毫升水,根据图丙的实验数据,用红磷做 实验, 理论上实验结束后量筒内剩余的水为 毫升。 (4)根据该兴趣小组的实验结果,用图甲装置测量空气中氧气的体积分数, 小明认为选用食品脱氧剂更 好,请说明他选择的理由: 。 10.某兴趣小组对教材中“测定空气里氧气含量 ”的实验(装置 I)进行了大胆改进,设计装置Ⅱ实验方案 进行, 收到了良好的效果。请你对比分析下面装置 I、装置Ⅱ实验,回答下列有关问题: (1)【装置Ⅰ】在实验过程中, 经常出现实验结果偏小的情况,原因可能是 。 A.红磷量不足 B.实验时止水夹未夹紧 C.未等装置冷却就松开止水夹 D.红磷点燃后伸入集气瓶速度太慢 (2)【装置Ⅱ】实验的操作步骤如下:①测定玻璃管容积 V1 为 70mL。②将少量铜粉平装入试管中,将 50mL 的注射器活塞置于 30mL 刻度处, 并按图Ⅱ中所示的连接方式固定好。③点燃酒精灯,缓慢推拉注射器活 塞。④熄灭酒精灯,等装置冷却后读取注射器活塞的数据。按正确操作和有关数据计算,最终得出氧气约 占空气体积的 ,则注射器活塞最终停留在 mL 处. (3)比较装置Ⅰ和装置Ⅱ,你能说出装置Ⅱ的一个优点是 。 6 / 12
氧气体积分数测量及氧气制取实验专题答案解析 一 、实验探究题 1.(1)A (2)红磷+氧气 五氧化二磷 (3)不易溶于水 、不与红磷反应 【解析】要根据红磷与氧气反应的化学方程式、氧气的密度、反应的特点进行分析,注意题目中要求写的 是化学方程式还是文字表达式。 【解答】(1)小组同学所设计的两套装置,A 比较合理, 因为氧气的密度大于空气,使红磷在集气瓶中 下部才能保证氧气能反应完全。 (2)红磷燃烧的文字表达式是: 红磷+氧气 五氧化二磷 。 (3)通过表格中的实验数据发现氧气占空气体积的五分之一,同时也可推断出剩余气体不与红磷反应, 也不易溶于水。 故答案为:(1)A;(2) 红磷+氧气 五氧化二磷;(3)不易溶于水, 不与红磷反应 2.(1)高锰酸钾;高锰酸钾 锰酸钾+二氧化锰+氧气 (2)用酒精灯给试管微热 (3)B (4)木炭剧烈燃烧,发白光;向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发生了 化学变化 【解析】(1)根据制取氧气的反应原理分析; (2)根据检验装置气密性的方法分析; (3)根据制取气体的操作步骤分析; (4)根据木炭燃烧的现象及二氧化碳的检验方法分析。 【解答】(1)由发生装置为加热装置可知,该同学制取氧气选用的是高锰酸钾, 反应的文字表达式为 高 锰酸钾 锰酸钾+二氧化锰+氧气 ; (2) 夏天室温很高的时候, 检验该装置气密性可将导管放入水中,然后用酒精灯给试管微热,观察导管 口是否有气泡冒出; 7 / 12
(3) 添加药品, 连接仪器, 加热试管后导管口有气泡冒出, 开始冒出的气泡中混有大量空气,要待气泡 连续并均匀冒出时, 将导管口移入集气瓶中开始收集气体; (4)木炭在氧气中剧烈燃烧,发生白光, 木炭燃烧生成二氧化碳, 证明该反应是化学反应的方法就是证 明有新物质二氧化碳生成,方法是 向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发 生了化学变化 。 故答案为:(1)高锰酸钾; 高锰酸钾 锰酸钾+二氧化锰+氧气 ;(2) 用酒精灯给试管微热 ; (3)B;(4) 向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发生了化学变化 。 3.(1)B、C;装置气密性检查 (2)①控制反应物间的接触速度,减慢反应的速度;②降低反应物物浓度; ③增大锥形瓶容积; ④在较 低的温度下进行反应;⑤利用催化剂减慢反应的速度; ⑥保证气体的通道畅通(任选两条) (3)反应产生的氧气是否纯净; 反应后是否有有害物质产生等. 【解析】 (1)根据第一阶段中获得的信息, 可知用双氧水制氧气比较好, 收集较为纯净的氧气可以用排水 法;制取气体前要检查装置的气密性,否则漏气. (2)控制反应物间的接触速度,减慢反应的速度;降低 反应物物浓度;增大锥形瓶容积;在较低的温度下进行反应;利用催化剂减慢反应的速度;保证气体的通 道畅通等预防爆炸. (3)制取氧气要考虑是否制得的是纯氧气, 药品的价格是否合理,有没有污染环境的 物质放出, 要遵循绿色化学. (1)制氧气有的药品需加热,有的不需要加热, 根据第一阶段获得的信息,用双氧水制氧气最好; 制取气 体前要检查装置的气密性,否则漏气; (2)反应过快引起爆炸, 只要是能减少反应物的接触面积, 反应的 速度就会降下来; (3)制取氧气要考虑是否制得的是纯氧气,药品的价格是否合理, 有没有污染环境的物 质放出,要遵循绿色化学. 4.4P+5O2 点燃2P2O5 使空气中的氧气充分与铜发生反应 < 装置漏气,空气又进入了注射器 (或药品不足, 没有耗尽氧气等合理答案) 根据质量守恒定律,转化为化合物中元素的质量 【解析】 【分析】 红磷在氧气中点燃生成为五氧化二磷,铜和氧气加热生成氧化铜。 【详解】 (1)图 1 实验中发生反应是红磷在氧气中点燃生成为五氧化二磷, 反应的化学方程式为 点燃 4P+5O2 2P2O5 。 8 / 12
(2)①在实验加热过程中,交替缓慢推功两个注射器活塞的目的是使封闭空间的氧气与铜丝充分接触, 使空气中的氧气与铜丝充分反应。 ②反应前注射器内气体的体积为 25mL,反应后注射器内气体的体积为 22mL,则氧气的体积为 3mL,则空 3mL 气中氧气的体积分数为 根 100%=12%<21% ,造成该实验出现误差的原因可能是:装置漏气, 空气 25mL 又进入了注射器;药品不足,没有耗尽氧气等。 通过上面的实验,学到的测量混合物中某成分含量的科学方法是根据质量守恒定律,转化为化合物中元素 的质量。 5.(1)防止气体从长颈漏斗逸出; 便于随时添加液体 (2)可以通过液体流量来控制反应速率 【解析】固体、液体不需要加热制取气体最简单的装置如图 1,为了便于添加药品,可以加长颈漏斗,为 防止气体从长劲漏斗逸出,下端必须浸没在液面以下。要想控制反应速率, 可以将长颈漏斗换成分液漏斗 或注射器。 本题考查气体发生装置的选择及改进,解答此题时一定要注意分液漏斗只能控制反应速率而不能控制反应 发生与停止。6.(1)分别加入等质量的二氧化锰、氧化铜、氧化铁,组装好仪器; 将导管放入装满水的量筒内, 点燃 酒精灯,记录收集相同体积氧气所需时间(或相同时间所收集的氧气) (2)B 【解析】(1)根据实验目的设计实验步骤; (2)根据题目信息推断图像走势。 (1)为了验证三种不同催化剂的效果,所以在三支装有氯酸钾的试管内分别加入等质量的二氧化锰、氧 化铜、氧化铁, 组装好仪器, 然后将导管放入装满水的量筒内, 点燃酒精灯,记录收集相同体积氧气所需 时间(或相同时间所收集的氧气); (2)二氧化锰催化效果好,说明反应速率快, 相同时间内产生气体多, 质量大,因此在 T 之前就生成了 全部氧气, 所以 B 符合题意;故选 B。 故答案为:(1)③分别加入等质量的二氧化锰、氧化铜、氧化铁,组装好仪器; ④将导管放入装满水的量 筒内,点燃酒精灯, 记录收集相同体积氧气所需时间(或相同时间所收集的氧气);(2)B。7.(1)A;把导管移出水面 (2)正放;将带火星的木条放在集气瓶口,观察木条是否复燃 【解析】(1)实验室要用 KClO3 和 MnO2 制取氧气, 属于固体加热型制取气体, 应选用发生装置是 A,用排 水法收集氧气结束时,先把导管移出水面,再熄灭酒精灯,以防止水槽中的水倒吸入试管,使试管因骤然 冷却而炸裂; 9 / 12
(2)氧气的密度比空气的大,装满氧气的集气瓶应盖上玻璃片后, 应正放在桌面上;检验氧气是否收集 满时, 应将带火星的木条放在集气瓶口, 若木条复燃,证明集满了氧气. 故答案为:(1)A;把导管移出水面;(2)正放;将带火星的木条放在集气瓶口,观察木条是否复燃. (1)实验室要用 KClO3 和 MnO2 制取氧气,属于固体加热型制取气体,据此结合实验室制取氧气的注意事 项,进行分析解答; (2)根据氧气的密度比空气的大,结合氧气验满的方法, 进行分析解答. 8.(1)气态 (2)沸点;有 (3)木炭在氧气中完全燃烧, 生成二氧化碳,在空气中不能完全燃烧,木炭燃烧过程中产生的 CO 等可燃 性气体继续燃烧而产生了火焰 【解析】(1)根据蜡烛燃烧的火焰是由气态物质燃烧形成分析; (2)根据表中所给信息确定当沸点低于燃烧时温度时,燃烧有火焰分析; (3)根据木炭不充分燃烧会生成一氧化碳气体分析。 【解答】(1) 由实验现象可知, 蜡烛燃烧产生的火焰是由气态物质燃料形成的; (2)由表中所给信息可知, 物质燃烧能否产生火焰与其沸点和燃烧时的温度有关, 钠的沸噗低于其燃烧 时的温度, 所以燃烧有火焰产生; (3)因木炭在氧气中完全燃烧,生成二氧化碳, 在空气中不能完全燃烧,木炭燃烧过程中产生的 CO 等可 燃性气体继续燃烧而产生了火焰 , 所以木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰 ; 故答案为:(1)气态;(2)沸点;有;(3) 木炭在氧气中完全燃烧,生成二氧化碳,在空气中不能完全 燃烧, 木炭燃烧过程中产生的 CO 等可燃性气体继续燃烧而产生了火焰 。 9.(1)容器内有水或气泡冒出 (2)4P+5O2 P2O5 (3)33.2 (4)食品脱氧剂能耗尽密闭容器内的氧气且不需要点燃 【解析】(1)根据装置气密性的检验方法解答; (2)确定反应物、反应条件和生成物,据此写出反应的化学方程式; (3)首先用集气瓶的容积减去水的体积得到里面空气的体积, 再乘以 21%计算出其中氧气的体积。根据 丙图确定红磷时燃烧结束后其中氧气的体积分数,从而计算出剩余氧气的体积, 前后氧气的体积之差就是 消耗氧气的体积,也就是量筒内进入集气瓶中水的体积。最后用量筒内水的体积减去消耗氧气的体积得到 剩余水的体积。 10 / 12
(4)当反应结束后,剩余氧气的体积分数越少,说明氧气消耗越充分, 测出的结果越准确, 据此分析解 答。 【解答】(1)步骤①中检查气密性时, 将玻璃容器浸没水中, 如果观察到容器内有水或气泡冒出,则说明 气密性不好。 (2)白磷和氧气在点燃的条件下反应, 生成五氧化二磷,则反应的化学方程式: 4P+5O2 P2O5 。 (3)集气瓶中氧气原来的体积: ; 红磷燃烧结束后氧气的体积: (1-)×150ml×7%=8.4mL; 消耗氧气的体积: 25.2mL-8.4mL=16.8mL; 则量筒内剩余水的体积:50mL-16.8mL=33.2mL。 (4)根据图丙可知,当反应结束后,食品脱氧剂剩余氧气的体积分数最小,即氧气燃烧最充分,则:小 明认为选用食品脱氧剂最好,理由是:食品脱氧剂能耗尽密闭容器内的氧气且不需要点燃。 10.(1)A;C (2)10 (3)使氧气充分反应 【解析】1、检验装置气密性:将装置依次连接,用双手捂热集气瓶壁, 若烧杯内有气泡冒出,且冷却后 有上升一段液柱不下降,说明气密性良好。2.关闭止水夹,点燃足量红磷,红磷燃烧,而后消耗氧气,水 倒吸入集气瓶。实验现象:红磷燃烧, 放热, 发出黄色火焰, 产生大量白烟。烧杯内水倒吸入集气瓶,约 占集气瓶体积五分之一。测出氧气体积小于五分之一:1、红磷量过少(氧气没有完全被消耗),3、导管 漏气, 部分空气进入瓶子。测出氧气体积大于五分之一:1、止水夹没有夹紧,有一部分空气被压出去,2、 点燃红磷伸入瓶内塞进瓶盖过慢(由于里面温度升高,气体压强加大, 使一部分空气被压出去)。 (1)实验结果偏小的原因是里面的气压变小, A 红磷量不足, 会导致氧气没有被耗尽, 会导致实验结果 偏小; B 实验时止水夹未夹紧, 会使得气体受热膨胀跑出去, 导致实验结果偏大; C 未等装置冷却就松开 止水夹, 会使得, 其他差偏小, 使得测得的氧气的体积偏小; D.红磷点燃后伸入集气瓶速度太慢,会使得 集气瓶内的气体受热逸出,使得测量结果偏大;所以答案为: AC; (2)因为里面的空气体积是 100mL,氧气占了 1/5,所以消耗的氧气的体积是 20mL,所以注射器的活塞 最终停留在 10mL 处; (3)比较装置Ⅰ和装置Ⅱ, 你能说出装置Ⅱ的一个优点是可以使氧气充分反应(或者不需要将装置打开, 放入燃烧的红磷,避免气体逸出) 11 / 12
故答案为:(1)AC(2)10(3)使氧气充分反应 12 / 12
通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的五分之一。通过实验还可以推断集气瓶 中剩余气体有怎样的物理性质和化学性质? 2.某同学在实验室用以下装置制备氧气并探究氧气的性质。 (1)该同学制备氧气时应选用的药品是 (限选: 过氧化氢溶液、二氧化锰、高锰酸钾),生 成氧气的文字表达式为 。 (2)夏天室温很高的时候,检验该装置气密性的合理方法是: 将导管口放入水面下,然 后 ,若导管口有气泡冒出,说明装置不漏气。 (3)添加药品,连接仪器,加热试管后导管口有气泡冒出,此时导管口还在集气瓶外面,接下来的操作 正确的是 (填字母)。 A.立刻将导管口移入集气瓶 B.等到气泡连续且均匀时,再将导管口移入集气瓶 C.立即熄灭酒精灯,将导管口移入集气瓶后再点燃酒精灯 1 / 12
(4)该同学用坩埚钳夹取一小块木炭加热到发红后,伸进一瓶氧气中, 观察到的现象 是 。进一步证明木炭与氧气发生了化学反应的方法 是 。 3.为了制备少量的氧气,某实验小组分三个阶段开展了一系列的工作: 第一阶段: 查阅文献资料,获得了下列信息: 双氧水.氯酸钾.高锰酸钾等含有氧元素的物质在一定的条件 下分解都可以产生氧气.其中双氧水溶液价格最低, 在常温下就能够分解放出氧气, 该过程无副产物; 氯 酸钾价格较高, 分解较困难,且常伴有副产物;高锰酸钾价格较高,加热即可快速分解.二氧化锰能加速 上述三种物质的分解. 根据上述信息, 选择双氧水溶液和二氧化锰混合制备氧气. 第二阶段: 到实验室准备实验用品, 安装实验仪器,进行制备实验.可供选择的实验装置如下: 第三阶段: 实验完毕经, 洗刷实验仪器, 整理实验用品. 问题: (1)要制取一瓶氧气, 应选择的实验装置是 (填写字母代号):组装好实验装置后应首先进 行 . (2)有气体产生的化学反应在有限的空间里发生时,如果反应过快, 容易引起爆炸,你认 为可以采取哪 些措施预防爆炸? (列举两条) (3)回顾整个工作过程,你认为在准备工作阶段除应考虑药品的价格.制氧反应的难易.制氧过程的安分 性等问题外,还应考虑哪些问题? (至少列举两条) 4.某化学兴趣小组对教材中“测定空气里氧气含量”的实验(如图 1)进行了大胆改进, 设计如图 2,收 到了良好的效果.请你对比分析图 1、图 2 实验,回答有关问题: (1)图 1 实验中发生反应的化学方程式为 (2)兴趣小组同学采用了图 2 所示装置: 在由两个注射器组成的密闭系统中留有25mL空气, 给装有细 2 / 12
铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止 加热,生成黑色固体氧化铜, 待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变 化。 ①在实验加热过程中,交替缓慢推功两个注射器活塞的目的是 ②测得实验结果如下 反应前注射器内气体总体积反应后注射器内气体总体积25mL22mL
由此可以推算出他测定的空气中氧气的体积分数 21%(填“>”、“= ”、“<”) 造成该实验出现误差的原因可能是 (写 1 个) 通过上面的实验,你学到的测量混合物中某成分含量的科学方法是 5.图 1 适用于固液不加热制取气体,该类型的发生装置通常有三种: (1)装置 2(如图 2):长颈漏斗下端口需插入液面以下(即液封),目的是 ; 该装置与图 1 装置相比, 优点是 。 (2)装置 3(如图 3)(注射器可换成分液漏斗),该装置与图 2 装置相比,优点 是 。; 6.在学习了氯酸钾和二氧化锰的混合物制取氧气后, 小明查阅资料发现除了二氧化锰外, 氧化铜、氧化铁 也可以作为氯酸钾分解的催化剂。这三种物质中, 哪种物质对氯酸钾分解的催化效果最好 小明用如图甲 装置, 以及实验所需药品和器材进行实验。 3 / 12
(1)请你补充完成以下实验步骤: ①检查装置的气密性; ②取三支相同的试管,各加入相同质量的氯酸钾; ③ ; ④ ; ⑤重复多次实验; ⑥比较数据,得出结论。 (2)实验结果发现二氧化锰对氯酸钾分解的催化效果比氧化铁要好,图乙为氯酸钾和氧化铁混合物制取 氧气时,生成氧气质量随反应时间变化的图像。小妍同学画出下列等质量的氯酸钾和二氧化锰混合物制取 氧气时,生成氧气质量随反应时间变化的图像。你认为正确的是 。 A. B.C. D. 7.如图是实验室的部分仪器或实验装置,回答有关问题. (1)实验室要用 KClO3 和 MnO2 制取氧气,应选用发生装置是(填编号) ,若用排水法收集氧 气,收集完毕后,应先 . (2)装满氧气的集气瓶应盖上玻璃片后 (填正放或倒放)在桌面上,其验满的操作方法 是 . 8.某科学小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。出该小组同 学进行了如下探究。 4 / 12
(1)探究一:蜡烛燃烧产生火焰的原因是什么? 点燃蜡烛,将金属导管一端伸入内焰,导出其中质,在另一端管口点燃,也有火焰产生。由此可知:蜡烛 燃烧产生的火焰是由 (填“固态 ”或“气态”)物质燃烧形成的。 (2)探究二: 物质燃烧产生火焰的根本原因是什么? [查阅资料] 物质熔点/℃沸点/℃燃烧时温度/℃石蜡50~ 70300~ 550约 600铁1 5352 750约 1800钠97.8883约 1400
由上表可知:物质燃烧能否产生火焰与其 (填“熔点 ”或“沸点”)和燃烧时温度有关。由此推 测:钠在燃烧时, (填“有 ”或“没 有”)火焰产生。 (3)木炭在氧气中燃烧没有火焰, 但生活中木炭燃烧时会产生火焰,其原因可能是 (提示:含碳可燃物在氧气浓度低时易产生一氧化碳等可燃性气体)。 9.利用图甲所示的教材装置测量空气中氧气的体积分数,选用红磷作为药品是最佳选择吗? 某兴趣小组设 计并开展了如下实验: ①准备如图乙的玻璃容器,顶部用密封盖密封,并检查该装置的气密性。 ②将氧气传感器(能实时显示容器内氧气的体积分数)固定在容器内壁,并装入足量的红磷。 ③用激光笔点燃红磷,红磷剧烈燃烧,观察并记录氧气传感器所显示的氧气体积分数的变化情况。 ④用白磷替换红磷重复上步骤①~③。 ⑤换用食品脱氧剂(可以直接与氧气反应, 无需点燃的物质)重复上述步骤①~③。 根据实验数据, 分别绘制三种物质氧化时容器内氧气体积分数随时间的变化情况, 如图丙所示。 5 / 12
(1)步骤①中检查气密性时, 将玻璃容器浸没水中,如果观察到 ,则说明气 密性不好。 (2)甲图中白磷(P)燃烧的化学方程式为: 。 (3)装置甲中 150 毫升集气瓶中装入 1/5 的水,量筒内装有 50 毫升水,根据图丙的实验数据,用红磷做 实验, 理论上实验结束后量筒内剩余的水为 毫升。 (4)根据该兴趣小组的实验结果,用图甲装置测量空气中氧气的体积分数, 小明认为选用食品脱氧剂更 好,请说明他选择的理由: 。 10.某兴趣小组对教材中“测定空气里氧气含量 ”的实验(装置 I)进行了大胆改进,设计装置Ⅱ实验方案 进行, 收到了良好的效果。请你对比分析下面装置 I、装置Ⅱ实验,回答下列有关问题: (1)【装置Ⅰ】在实验过程中, 经常出现实验结果偏小的情况,原因可能是 。 A.红磷量不足 B.实验时止水夹未夹紧 C.未等装置冷却就松开止水夹 D.红磷点燃后伸入集气瓶速度太慢 (2)【装置Ⅱ】实验的操作步骤如下:①测定玻璃管容积 V1 为 70mL。②将少量铜粉平装入试管中,将 50mL 的注射器活塞置于 30mL 刻度处, 并按图Ⅱ中所示的连接方式固定好。③点燃酒精灯,缓慢推拉注射器活 塞。④熄灭酒精灯,等装置冷却后读取注射器活塞的数据。按正确操作和有关数据计算,最终得出氧气约 占空气体积的 ,则注射器活塞最终停留在 mL 处. (3)比较装置Ⅰ和装置Ⅱ,你能说出装置Ⅱ的一个优点是 。 6 / 12
氧气体积分数测量及氧气制取实验专题答案解析 一 、实验探究题 1.(1)A (2)红磷+氧气 五氧化二磷 (3)不易溶于水 、不与红磷反应 【解析】要根据红磷与氧气反应的化学方程式、氧气的密度、反应的特点进行分析,注意题目中要求写的 是化学方程式还是文字表达式。 【解答】(1)小组同学所设计的两套装置,A 比较合理, 因为氧气的密度大于空气,使红磷在集气瓶中 下部才能保证氧气能反应完全。 (2)红磷燃烧的文字表达式是: 红磷+氧气 五氧化二磷 。 (3)通过表格中的实验数据发现氧气占空气体积的五分之一,同时也可推断出剩余气体不与红磷反应, 也不易溶于水。 故答案为:(1)A;(2) 红磷+氧气 五氧化二磷;(3)不易溶于水, 不与红磷反应 2.(1)高锰酸钾;高锰酸钾 锰酸钾+二氧化锰+氧气 (2)用酒精灯给试管微热 (3)B (4)木炭剧烈燃烧,发白光;向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发生了 化学变化 【解析】(1)根据制取氧气的反应原理分析; (2)根据检验装置气密性的方法分析; (3)根据制取气体的操作步骤分析; (4)根据木炭燃烧的现象及二氧化碳的检验方法分析。 【解答】(1)由发生装置为加热装置可知,该同学制取氧气选用的是高锰酸钾, 反应的文字表达式为 高 锰酸钾 锰酸钾+二氧化锰+氧气 ; (2) 夏天室温很高的时候, 检验该装置气密性可将导管放入水中,然后用酒精灯给试管微热,观察导管 口是否有气泡冒出; 7 / 12
(3) 添加药品, 连接仪器, 加热试管后导管口有气泡冒出, 开始冒出的气泡中混有大量空气,要待气泡 连续并均匀冒出时, 将导管口移入集气瓶中开始收集气体; (4)木炭在氧气中剧烈燃烧,发生白光, 木炭燃烧生成二氧化碳, 证明该反应是化学反应的方法就是证 明有新物质二氧化碳生成,方法是 向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发 生了化学变化 。 故答案为:(1)高锰酸钾; 高锰酸钾 锰酸钾+二氧化锰+氧气 ;(2) 用酒精灯给试管微热 ; (3)B;(4) 向集气瓶中加入澄清石灰水,振荡, 若澄清石灰水变浑浊,则说明发生了化学变化 。 3.(1)B、C;装置气密性检查 (2)①控制反应物间的接触速度,减慢反应的速度;②降低反应物物浓度; ③增大锥形瓶容积; ④在较 低的温度下进行反应;⑤利用催化剂减慢反应的速度; ⑥保证气体的通道畅通(任选两条) (3)反应产生的氧气是否纯净; 反应后是否有有害物质产生等. 【解析】 (1)根据第一阶段中获得的信息, 可知用双氧水制氧气比较好, 收集较为纯净的氧气可以用排水 法;制取气体前要检查装置的气密性,否则漏气. (2)控制反应物间的接触速度,减慢反应的速度;降低 反应物物浓度;增大锥形瓶容积;在较低的温度下进行反应;利用催化剂减慢反应的速度;保证气体的通 道畅通等预防爆炸. (3)制取氧气要考虑是否制得的是纯氧气, 药品的价格是否合理,有没有污染环境的 物质放出, 要遵循绿色化学. (1)制氧气有的药品需加热,有的不需要加热, 根据第一阶段获得的信息,用双氧水制氧气最好; 制取气 体前要检查装置的气密性,否则漏气; (2)反应过快引起爆炸, 只要是能减少反应物的接触面积, 反应的 速度就会降下来; (3)制取氧气要考虑是否制得的是纯氧气,药品的价格是否合理, 有没有污染环境的物 质放出,要遵循绿色化学. 4.4P+5O2 点燃2P2O5 使空气中的氧气充分与铜发生反应 < 装置漏气,空气又进入了注射器 (或药品不足, 没有耗尽氧气等合理答案) 根据质量守恒定律,转化为化合物中元素的质量 【解析】 【分析】 红磷在氧气中点燃生成为五氧化二磷,铜和氧气加热生成氧化铜。 【详解】 (1)图 1 实验中发生反应是红磷在氧气中点燃生成为五氧化二磷, 反应的化学方程式为 点燃 4P+5O2 2P2O5 。 8 / 12
(2)①在实验加热过程中,交替缓慢推功两个注射器活塞的目的是使封闭空间的氧气与铜丝充分接触, 使空气中的氧气与铜丝充分反应。 ②反应前注射器内气体的体积为 25mL,反应后注射器内气体的体积为 22mL,则氧气的体积为 3mL,则空 3mL 气中氧气的体积分数为 根 100%=12%<21% ,造成该实验出现误差的原因可能是:装置漏气, 空气 25mL 又进入了注射器;药品不足,没有耗尽氧气等。 通过上面的实验,学到的测量混合物中某成分含量的科学方法是根据质量守恒定律,转化为化合物中元素 的质量。 5.(1)防止气体从长颈漏斗逸出; 便于随时添加液体 (2)可以通过液体流量来控制反应速率 【解析】固体、液体不需要加热制取气体最简单的装置如图 1,为了便于添加药品,可以加长颈漏斗,为 防止气体从长劲漏斗逸出,下端必须浸没在液面以下。要想控制反应速率, 可以将长颈漏斗换成分液漏斗 或注射器。 本题考查气体发生装置的选择及改进,解答此题时一定要注意分液漏斗只能控制反应速率而不能控制反应 发生与停止。6.(1)分别加入等质量的二氧化锰、氧化铜、氧化铁,组装好仪器; 将导管放入装满水的量筒内, 点燃 酒精灯,记录收集相同体积氧气所需时间(或相同时间所收集的氧气) (2)B 【解析】(1)根据实验目的设计实验步骤; (2)根据题目信息推断图像走势。 (1)为了验证三种不同催化剂的效果,所以在三支装有氯酸钾的试管内分别加入等质量的二氧化锰、氧 化铜、氧化铁, 组装好仪器, 然后将导管放入装满水的量筒内, 点燃酒精灯,记录收集相同体积氧气所需 时间(或相同时间所收集的氧气); (2)二氧化锰催化效果好,说明反应速率快, 相同时间内产生气体多, 质量大,因此在 T 之前就生成了 全部氧气, 所以 B 符合题意;故选 B。 故答案为:(1)③分别加入等质量的二氧化锰、氧化铜、氧化铁,组装好仪器; ④将导管放入装满水的量 筒内,点燃酒精灯, 记录收集相同体积氧气所需时间(或相同时间所收集的氧气);(2)B。7.(1)A;把导管移出水面 (2)正放;将带火星的木条放在集气瓶口,观察木条是否复燃 【解析】(1)实验室要用 KClO3 和 MnO2 制取氧气, 属于固体加热型制取气体, 应选用发生装置是 A,用排 水法收集氧气结束时,先把导管移出水面,再熄灭酒精灯,以防止水槽中的水倒吸入试管,使试管因骤然 冷却而炸裂; 9 / 12
(2)氧气的密度比空气的大,装满氧气的集气瓶应盖上玻璃片后, 应正放在桌面上;检验氧气是否收集 满时, 应将带火星的木条放在集气瓶口, 若木条复燃,证明集满了氧气. 故答案为:(1)A;把导管移出水面;(2)正放;将带火星的木条放在集气瓶口,观察木条是否复燃. (1)实验室要用 KClO3 和 MnO2 制取氧气,属于固体加热型制取气体,据此结合实验室制取氧气的注意事 项,进行分析解答; (2)根据氧气的密度比空气的大,结合氧气验满的方法, 进行分析解答. 8.(1)气态 (2)沸点;有 (3)木炭在氧气中完全燃烧, 生成二氧化碳,在空气中不能完全燃烧,木炭燃烧过程中产生的 CO 等可燃 性气体继续燃烧而产生了火焰 【解析】(1)根据蜡烛燃烧的火焰是由气态物质燃烧形成分析; (2)根据表中所给信息确定当沸点低于燃烧时温度时,燃烧有火焰分析; (3)根据木炭不充分燃烧会生成一氧化碳气体分析。 【解答】(1) 由实验现象可知, 蜡烛燃烧产生的火焰是由气态物质燃料形成的; (2)由表中所给信息可知, 物质燃烧能否产生火焰与其沸点和燃烧时的温度有关, 钠的沸噗低于其燃烧 时的温度, 所以燃烧有火焰产生; (3)因木炭在氧气中完全燃烧,生成二氧化碳, 在空气中不能完全燃烧,木炭燃烧过程中产生的 CO 等可 燃性气体继续燃烧而产生了火焰 , 所以木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰 ; 故答案为:(1)气态;(2)沸点;有;(3) 木炭在氧气中完全燃烧,生成二氧化碳,在空气中不能完全 燃烧, 木炭燃烧过程中产生的 CO 等可燃性气体继续燃烧而产生了火焰 。 9.(1)容器内有水或气泡冒出 (2)4P+5O2 P2O5 (3)33.2 (4)食品脱氧剂能耗尽密闭容器内的氧气且不需要点燃 【解析】(1)根据装置气密性的检验方法解答; (2)确定反应物、反应条件和生成物,据此写出反应的化学方程式; (3)首先用集气瓶的容积减去水的体积得到里面空气的体积, 再乘以 21%计算出其中氧气的体积。根据 丙图确定红磷时燃烧结束后其中氧气的体积分数,从而计算出剩余氧气的体积, 前后氧气的体积之差就是 消耗氧气的体积,也就是量筒内进入集气瓶中水的体积。最后用量筒内水的体积减去消耗氧气的体积得到 剩余水的体积。 10 / 12
(4)当反应结束后,剩余氧气的体积分数越少,说明氧气消耗越充分, 测出的结果越准确, 据此分析解 答。 【解答】(1)步骤①中检查气密性时, 将玻璃容器浸没水中, 如果观察到容器内有水或气泡冒出,则说明 气密性不好。 (2)白磷和氧气在点燃的条件下反应, 生成五氧化二磷,则反应的化学方程式: 4P+5O2 P2O5 。 (3)集气瓶中氧气原来的体积: ; 红磷燃烧结束后氧气的体积: (1-)×150ml×7%=8.4mL; 消耗氧气的体积: 25.2mL-8.4mL=16.8mL; 则量筒内剩余水的体积:50mL-16.8mL=33.2mL。 (4)根据图丙可知,当反应结束后,食品脱氧剂剩余氧气的体积分数最小,即氧气燃烧最充分,则:小 明认为选用食品脱氧剂最好,理由是:食品脱氧剂能耗尽密闭容器内的氧气且不需要点燃。 10.(1)A;C (2)10 (3)使氧气充分反应 【解析】1、检验装置气密性:将装置依次连接,用双手捂热集气瓶壁, 若烧杯内有气泡冒出,且冷却后 有上升一段液柱不下降,说明气密性良好。2.关闭止水夹,点燃足量红磷,红磷燃烧,而后消耗氧气,水 倒吸入集气瓶。实验现象:红磷燃烧, 放热, 发出黄色火焰, 产生大量白烟。烧杯内水倒吸入集气瓶,约 占集气瓶体积五分之一。测出氧气体积小于五分之一:1、红磷量过少(氧气没有完全被消耗),3、导管 漏气, 部分空气进入瓶子。测出氧气体积大于五分之一:1、止水夹没有夹紧,有一部分空气被压出去,2、 点燃红磷伸入瓶内塞进瓶盖过慢(由于里面温度升高,气体压强加大, 使一部分空气被压出去)。 (1)实验结果偏小的原因是里面的气压变小, A 红磷量不足, 会导致氧气没有被耗尽, 会导致实验结果 偏小; B 实验时止水夹未夹紧, 会使得气体受热膨胀跑出去, 导致实验结果偏大; C 未等装置冷却就松开 止水夹, 会使得, 其他差偏小, 使得测得的氧气的体积偏小; D.红磷点燃后伸入集气瓶速度太慢,会使得 集气瓶内的气体受热逸出,使得测量结果偏大;所以答案为: AC; (2)因为里面的空气体积是 100mL,氧气占了 1/5,所以消耗的氧气的体积是 20mL,所以注射器的活塞 最终停留在 10mL 处; (3)比较装置Ⅰ和装置Ⅱ, 你能说出装置Ⅱ的一个优点是可以使氧气充分反应(或者不需要将装置打开, 放入燃烧的红磷,避免气体逸出) 11 / 12
故答案为:(1)AC(2)10(3)使氧气充分反应 12 / 12
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
