第7章应用广泛的酸、碱、盐复习题(含解析) 2023---2024学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐复习题(含解析) 2023---2024学年九年级化学沪教版(全国)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 212.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 00:00:00 | ||
图片预览




文档简介
第7章应用广泛的酸、碱、盐复习题
一、选择题
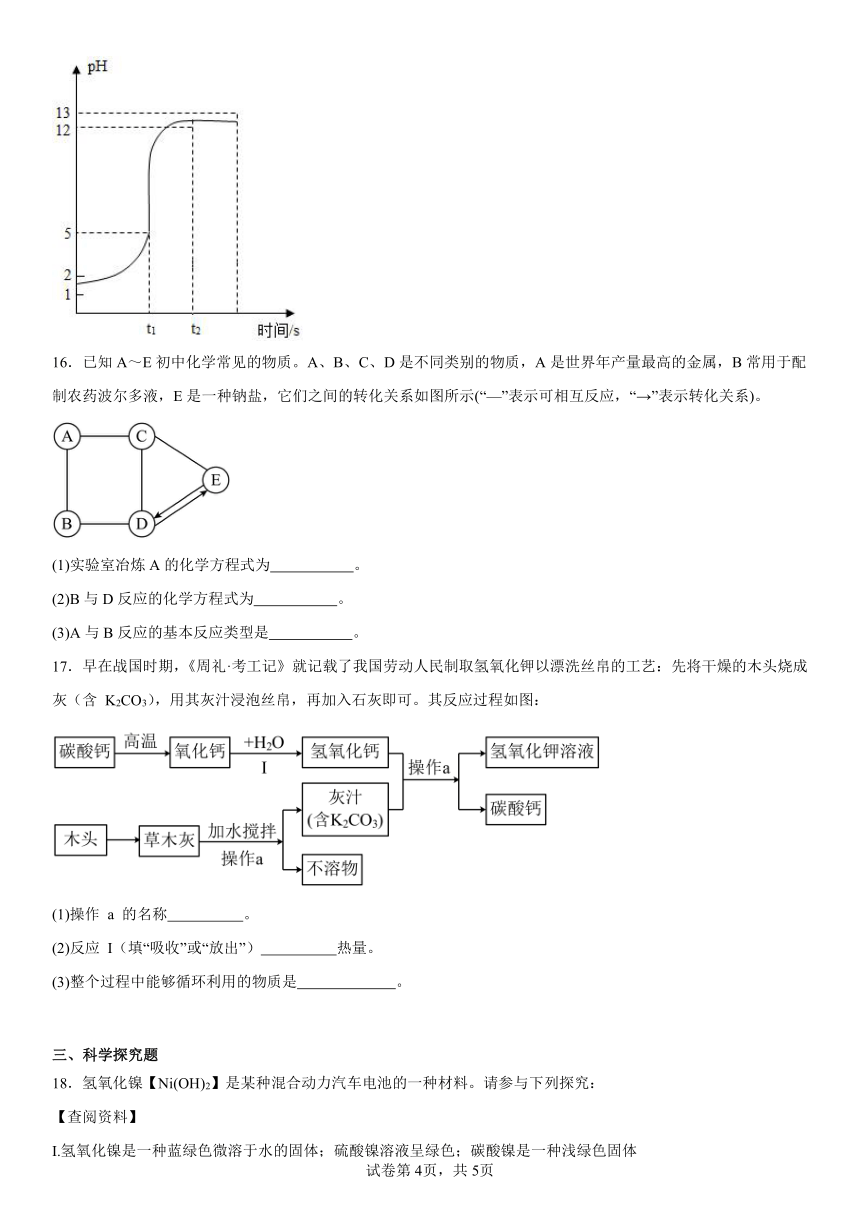
1.天平的两盘上各放一只质量相等的烧杯,在两只烧杯中分别加入等质量、等质量分数的稀硫酸,调节天平至平衡,然后向左盘烧杯中加入一定质量的镁粉,向右盘烧杯中加入和镁粉质量相等的锌粉,充分反应后,下列各种情况中不可能出现的是
A.只有锌粉有剩余 B.天平仍平衡
C.天平偏向放锌粉的一侧 D.天平不平衡
2.小强看到自家的小麦叶色淡黄,并有倒伏现象,则小麦应施用的肥料是
A. B. C. D.
3.某干粉灭火器的填充剂中含有磷酸二氢铵(化学式为NH4H2PO4)。已知23.0g磷酸二氢铵加热完全分解得到固体物质X、5.4g水蒸气和3.4g氨气。固体物质x既不能燃燃烧也不能支持燃烧。下列说法错误的是( )
A.磷酸二氢铵属于复合肥料 B.用磷酸二氢铵灭火既可降低温度,又可隔绝空气
C.固体物质X属于氧化物 D.该反应中固体物质X与氨气的分子个数比为2:1
4.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿在Y的表面有银析出,而Z没变化,则X、Y、Z的金属活动性顺序为
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Y>Z>X
5.向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是
A.滤液中一定含有Cu(NO3)2 B.滤液呈无色
C.滤渣只含有Ag D.向滤渣中滴加稀硫酸有气泡产生
6.已知常温下溶解度为0.17g。向一定量饱和溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:
步骤1:取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2:向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗g。
下列说法正确的是
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗 mL盐酸
C.步骤2中化学反应方程式为
D.该样品中钙元素的质量分数为66.67%
7.下列应用和相应的原理(用化学方程式表示)及基本反应类型均正确的是
A.用木炭还原氧化铜: 置换反应
B.电解水制氧气: 分解反应
C.用盐酸除水垢: 中和反应
D.用氢氧化钠溶液吸收二氧化碳: 复分解反应
8.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4等五种物质,在常温下把它们两两混合,能发生化学反应的有( )
A.4个 B.5个 C.6个 D.7个
9.图中物质的类别均不同,连线两端的物质常温下均能发生反应。下列说法正确的是
A.X与HCl反应可能得到蓝色溶液 B.Y和Z可以是NaNO3和NaOH
C.Z和CO2可能发生复分解反应 D.X、Y、Z分别是碱、盐、酸
10.小明在实验室中找到了三包已经失落标签的白色粉末,已知是CaCO3、Na2CO3、CaO,请从下面的试剂或方法中选择一种来确定该三种物质
A.稀盐酸 B.水 C.加强热 D.CaCl2溶液
二、填空与简答
11.将一个生锈的铁钉放入试管中,然后加入稀盐酸,可以看到 ,反应的化学方程式为 ;过一段时间后,可以看到 ,反应的化学方程式为 。
12.我国近代化学家 发明了联合制碱法,地壳中含量最多的元素与最多的金属元素所形成化合物的化学式为 。
13.按要求用化学式填空。
(1)密度最小的气体是 。
(2)胃液的主要成分是 。
(3)可做食品干燥剂的固体是 。
(4)属于大气污染物,且能形成酸雨的主要气体是 ,吸收该气体可选 溶液,该反应的化学方程式 。
14.回答:
(1)气候变化是人类面临的全球性问题,中国争取2060年前实现碳中和。“碳中和”就是采取各种措施全部抵消掉生产生活中排放的二氧化碳。
①“碳中和”中的“碳”指的是 。
A.碳原子 B.一氧化碳 C.二氧化碳 D.活性炭
②下列措施有利于实现“碳中和”的是 。
A.外出尽量选择公交出行 B.加大化石能源的使用力度
C.国家鼓励购买电动汽车 D.大力推广使用太阳能
(2)袁隆平院士在杂交水稻的培育领域做出巨大贡献,解决了我国人民的温饱问题。水稻丰产离不开化肥,某品牌的化肥中含有氯化铵、硫酸钾等物质。
①该化肥属于 (选“氮肥”或“钾肥”或“复合肥”)。
②该化肥不能与熟石灰混合使用,以免降低肥效。其原理是 。(用化学方程式表示)
15.当稀盐酸与稀氢氧化钠溶液混合后仍为无色溶液,为证明反应确实发生,进行以下实验。
实验一:向装有一定量稀氢氧化钠溶液的试管中滴加几滴酚酞溶液,再滴加稀盐酸,并不断振荡溶液。若观察到 现象,则证明反应发生,写出反应的化学方程式 。
实验二:取一定量的稀盐酸,逐滴匀速滴加稀氢氧化钠溶液,测得反应过程中pH变化 (20℃)如图所示:
①从0→t2时,溶液的酸碱性变化情况是 。
②根据曲线的变化,判断反应恰好完成的依据是 。
③t2时,所得溶液中的溶质是 (写化学式)。
16.已知A~E初中化学常见的物质。A、B、C、D是不同类别的物质,A是世界年产量最高的金属,B常用于配制农药波尔多液,E是一种钠盐,它们之间的转化关系如图所示(“—”表示可相互反应,“→”表示转化关系)。
(1)实验室冶炼A的化学方程式为 。
(2)B与D反应的化学方程式为 。
(3)A与B反应的基本反应类型是 。
17.早在战国时期,《周礼·考工记》就记载了我国劳动人民制取氢氧化钾以漂洗丝帛的工艺:先将干燥的木头烧成灰(含 K2CO3),用其灰汁浸泡丝帛,再加入石灰即可。其反应过程如图:
(1)操作 a 的名称 。
(2)反应 I(填“吸收”或“放出”) 热量。
(3)整个过程中能够循环利用的物质是 。
三、科学探究题
18.氢氧化镍【Ni(OH)2】是某种混合动力汽车电池的一种材料。请参与下列探究:
【查阅资料】
I.氢氧化镍是一种蓝绿色微溶于水的固体;硫酸镍溶液呈绿色;碳酸镍是一种浅绿色固体
Ⅱ.能溶于水的酸、碱、盐溶于水时能电离成离子即以离子的形式存在,如 ;水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
【实验探究】
(1)请完成表格的填写
实验步骤 实验现象 实验结论
①取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡 悬浊液变澄清,溶液呈绿色
②取少量氢氧化镍(新制)悬浊液于试管中,滴加过量Na2CO3溶液 Ni(OH)2能和Na2CO3溶液反应
③向步骤(1)所得的澄清液中,滴加少量NaOH溶液 无明显现象 硫酸镍溶液不能和 NaOH溶液反应
【分析讨论】
(2)Ni(OH)2中Ni的化合价为 。
(3)氢氧化镍和稀硫酸反应的化学方程式 ,属于的基本反应类型为 。
(4)由上述实验可知,氢氧化镍在水中的溶解能力 (填“大于”、“等于”或“小于”)碳酸镍。
(5)小顾认为步骤(3)得出的结论不合理,其理由是 。
四、计算题
19.某活动小组对失去标签的稀硫酸溶液的浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如下图所示。
(1)参加反应的Ba(OH)2溶质质量共有 g。
(2)滴加Ba(OH)2至50g时,烧杯内溶液的pH 7(填“>”、“<”或“=”)。
(3)求该硫酸溶液的溶质质量分数?(写出计算过程,结果精确到0.01%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、镁、锌与稀硫酸反应的化学方程式及其反应物、生成物的质量关系分别为
因为硫酸的质量、金属的质量相等,相等质量的硫酸反应时消耗的锌的质量比镁的质量大,所以当锌粉有剩余时,镁一定有剩余;A不正确.
B、当稀硫酸恰好和金属反应时,生成的氢气的质量相等,氢气逸出后,两边质量相等,天平仍然平衡,所以可能出现天平仍平衡的情况.B正确.
C、当稀硫酸过量时,等质量的镁、锌完全和稀硫酸反应时,镁和稀硫酸反应生成的氢气多,氢气逸出后,左盘烧杯中物质的质量小于右盘烧杯中物质的质量,天平偏向放锌粉的一侧,C正确.
D、当稀硫酸过量时,天平偏向放锌粉的一侧,D正确。
故选:A。
2.A
【详解】小麦叶色淡黄,并有倒伏现象,说明土壤中缺乏钾元素和氮元素;A、KNO3中含有钾元素和氮元素,属于复合肥,正确;B、NH4NO3中含有氮元素,属于氮肥,错误;C、Ca(H2PO4)2中含有磷元素,属于磷肥,错误;D、K2SO4中含有钾元素,属于钾肥,错误。故选A。
点睛:含有氮元素的肥料称为氮肥.含有磷元素的肥料称为磷肥.含有钾元素的肥料称为钾肥;同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
3.D
【详解】A、磷酸二氢铵中含有营养元素磷元素、氮元素,属于复合肥料,该选项说法正确;
B、用磷酸二氢铵灭火时,生成的水蒸发吸热,生成的固体能够隔绝氧气,因此既可降低温度,又可隔绝空气,该选项说法正确;
C、固体物质X既不能燃烧也不能支持燃烧,说明固体物质不是单质磷,因此是五氧化二磷,五氧化二磷是氧化物,该选项说法正确;
D、五氧化二磷质量:23.0g-5.4g-3.4g=14.2g,该反应中固体物质五氧化二磷与氨气的分子个数比为:,该选项说法不正确。
故选D。
4.A
【详解】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明X在氢前,Y在氢后,即X的活动性比Y强;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化,说明Y的活动性比银的强,而Z的活动性比银的弱,即Y的活动性比Z的强,根据以上事实,判断出X、Y和Z的金属活动性顺序为X>Y>Z。故选A。
5.A
【分析】向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液,滤渣中一定含有过量的铜和银(硝酸银和铜反应生成),滤液中一定含有硝酸铜,一定没有硝酸银。
【详解】A、滤液中一定含有Cu(NO3)2,选项正确;
B、滤液中含有硝酸铜,所以呈蓝色,选项错误;
C、滤渣含有Ag和过量的铜,选项错误;
D、向滤渣铜和银中滴加稀硫酸没有气泡产生,因为都是氢后金属,选项错误。
故选:A。
6.D
【详解】A、由题意可知,常温下溶解度为0.17g。取0.60g样品于锥形瓶中,氧化钙和水反应生成氢氧化钙,生成的氢氧化钙的质量>0.6g,向其中加入200mL蒸馏水,200g的水最多溶解0.34g的氢氧化钙,所以生成氢氧化钙不能完全溶解,步骤1中充分振荡后不能得到澄清透明的溶液,故A错误;
B、反应完全时锥形瓶内溶液红色恰好褪去,此时溶液呈中性,pH=7,则消耗 mL盐酸,故B错误;
C、步骤2中是氢氧化钙和稀盐酸反应生成氯化钙和水,化学反应方程式为,故C错误;
D、在该反应过程中,氢氧化钙和稀盐酸反应生成氯化钙和水,根据质量守恒定律可知,钙元素质量不变,则有,该样品中钙元素的质量分数为,故D正确。
故选D。
7.A
【详解】A、化学方程式书写正确,单质和化合物反应生成另一种单质和化合物,属于置换反应,故正确;
B、电解水制氧气:,故错误;
C、化学方程式书写正确,两种化合物互相交换成分生成另外两种化合物的反应,属于复分解反应,故错误;
D、化学方程式书写正确,不属于基本反应类型,故错误;
故选:A。
【点睛】四大基本反应类型
化合反应:由两种或两种以上的物质生成另一种物质的反应;
分解反应:由一种反应物生成两种或两种以上其他物质的反应;
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应。
8.A
【详解】Fe能与稀H2SO4反应:Fe+ H2SO4 == FeSO4 + H2↑,CuO能与稀H2SO4反应: CuO + H2SO4 ==CuSO4 + H2O,MgCl2溶液能与Ca(OH)2溶液反应:MgCl2 + Ca(OH)2 ==Mg(OH)2↓+ CaCl2 ,Ca(OH)2溶液能与稀H2SO4反应:Ca(OH)2 + H2SO4 ==CaSO4 + 2H2O,故选A。
9.A
【分析】根据题意可知:所有物质的类别均不同, Z 能与二氧化碳反应,能与酸反应,能与石蕊溶液作用,应为碱;由酸的化学性质, X 应为金属氧化物; Y 能与盐酸、碱反应,应为盐。
【详解】A、根据分析可知:X应为金属氧化物,X与HCl反应,可以是氧化铜和盐酸的反应,氧化铜与盐酸反应会生成氯化铜和水,溶液变为蓝色,故该项说法正确;
B、根据分析可知:Y是盐,Z应为碱,但Y不可能是NaNO3,因为NaNO3与稀盐酸不反应,故该项说错误;
C、根据分析可知:Z应为碱。金属与酸的反应属于置换反应,酸和碱、盐、金属氧化物的反应均属于复分解反应,碱和盐的反应也是复分解反应,而碱与非金属氧化物的反应不属于基本反应类型中的复分解反应,故该项说错误;
D、根据分析可知:Z应为碱;由酸的化学性质,X应为金属氧化物;Y能与盐酸、碱反应,应为盐,故该项说法错误。
故选A。
10.B
【详解】A、盐酸和碳酸钙,碳酸钠都生成二氧化碳,不能鉴别;错误;
B、碳酸钙不溶与水;碳酸钠溶于水;氧化钙和反应生成氢氧化钙,并放出热量;正确;
C、碳酸钙加强热生成二氧化碳,碳酸钠、氧化钙加热不产生二氧化碳,不能鉴别;错误;
D、氧化钙和氯化钙溶液中的水反应产生氢氧化钙,同时放热,氯化钙和碳酸钠生成沉淀碳酸钙,碳酸钙不溶于氯化钙溶液,不能鉴别;错误;
故选B。
11. 铁锈逐渐消失,溶液由无色变为黄色 Fe2O3+6HCl===2FeCl3+3H2O 有气泡产生 Fe+2HCl===FeCl2+H2↑
【详解】铁锈的成分是氧化铁,能与盐酸生成氯化铁和水,氯化铁的水溶液颜色的为黄色,铁能与盐酸反应生成氯化亚铁和氢气,故会观察到有气泡产生,故填:铁锈逐渐消失,溶液由无色变为黄色;反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;过一段时间后,会产生无色的气泡,反应的化学方程式为Fe+2HCl=FeCl2+H2↑。
12. 侯德榜 Al2O3
【详解】我国近代化学家侯德榜发明了联合制碱法;
地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,氧元素与铝元素形成的化合物为氧化铝,氧化铝中铝元素显+3价,氧元素显-2价,化学式为:Al2O3。
13. H2 HCl CaO SO2 NaOH SO2+2NaOH=Na2SO3+H2O
【详解】(1)密度最小的气体是氢气,氢气由氢分子构成,一个氢分子由两个氢原子构成,所以氢气的化学式写为H2,故填H2。
(2)胃液的主要成分是胃酸,胃酸的主要成分是盐酸,盐酸的化学式为HCl,故填HCl。
(3)可做食品干燥剂的固体是氧化钙,其中钙元素的化合价为+2价,氧元素的化合价为-2价,根据化合物中各元素的化合价的代数和为零,则氧化钙的化学式为CaO,故填CaO。
(4)属于大气污染物,且能形成酸雨的主要气体是煤燃烧后生成的二氧化硫,其中硫元素的化合价为+4价,氧元素的化合价为-2价,根据化合物中各元素的化合价的代数和为零,则二氧化硫的化学式为SO2,故填SO2;
二氧化硫能与氢氧化钠反应生成盐和水,所以吸收二氧化硫可选用NaOH溶液,故填NaOH;
二氧化硫与氢氧化钠反应生成亚硫酸钠和水,故反应的化学方程式写为:SO2+2NaOH=Na2SO3+H2O。
14.(1) C ACD
(2) 复合肥
【详解】(1)(1)①“碳中和”就是采取各种措施全部抵消掉生产生活中排放的二氧化碳,“碳中和”中的“碳”指的是二氧化碳;
故填:C;
②A、外出尽量选择公交出行,减少使用汽车,能减少二氧化碳排放,有利于实现“碳中和”;
B、化石能源燃烧生成大量二氧化碳,加大化石能源的使用力度,不利于实现“碳中和”;
C、国家鼓励购买电动汽车,减少化石燃料使用,减少二氧化碳排放,有利于实现“碳中和”;
D、大力推广使用太阳能,减少化石燃料使用,减少二氧化碳排放,有利于实现“碳中和”;
故填:ACD;
(2)①某品牌的化肥中含有氯化铵、硫酸钾等物质,化肥中含有氮元素、钾元素等营养元素,该化肥属于复合肥。
②该化肥不能与熟石灰混合使用,以免降低肥效,其原理是氯化铵与氢氧化钙反应生成氨气、氯化钙和水,方程式为。
15. 溶液红色褪去 NaOH+HCl=NaCl+H2O 溶液由酸性变为中性,最后变为碱性 溶液pH为7 NaCl NaOH
【详解】实验一:因酚酞滴入到氢氧化钠溶液中变为红色,当向碱性溶液中加稀盐酸时,发生NaOH+HCl=NaCl+H2O,反应使碱减少至消失,则红色逐渐变浅至消失,即可利用溶液颜色的变化来判断发生反应;
实验二:①由图可知pH在不断变大,t1时pH为7,即溶液的酸性不断减弱,t1时变为中性,在t2时pH大于7溶液呈碱性,溶液又逐渐碱性增强;
②判断发生酸和碱发生反应的依据是根据图中pH变化,随着碱的滴加溶液的酸性减弱pH变大,直至恰好反应pH=7,溶液呈中性,说明反应恰好完成;
③在t2时pH大于7溶液呈碱性,此时溶液中氢氧化钠过量,所以溶液中的溶质是氯化钠和氢氧化钠。
16.(1)
(2)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(3)置换反应
【分析】A~E是初中化学中常见的物质,A、B、C、D是不同类别的物质,A是目前世界上年产量最高的金属,所以A是铁,B常用来配制农药波尔多液,B会与铁反应,所以B是硫酸铜,E是一种钠盐,D会与硫酸铜反应,D与E相互转化,所以D是氢氧化钠,E是碳酸钠,C可以是盐酸,经过验证,推导正确。
【详解】(1)A是铁,实验室冶炼铁的原理是一氧化碳在高温条件下还原氧化铁,生成铁和二氧化碳,反应的化学方程式为。
(2)B是硫酸铜,D是氢氧化钠,硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,反应的化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓。
(3)铁与硫酸铜反应生成硫酸亚铁和铜,是单质与化合物反应生成另外的单质和化合物的化学反应,属于置换反应。
17.(1)过滤
(2)放出
(3)碳酸钙/ CaCO3
【详解】(1)操作a是将不溶于液体的固体物质与液体分离的一种方法,操作a的名称是过滤;
(2)氧化钙与水反应生成氢氧化钙,该反应是放热反应;
(3)由流程图可知,碳酸钙既是流程的反应物,又是流程的生成物,碳酸钙能够循环利用。
18. 氢氧化镍能和稀硫酸反应 产生浅绿色沉淀 +2 复分解反应 大于 步骤(3)加入的少量NaOH溶液先与步骤(1)中过量的稀硫酸反应
【详解】[实验探究]
(1)取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡,若观察到悬浊液变澄清,溶液呈绿色,则说明氢氧化镍能和稀硫酸反应;
取少量氢氧化镍(新制)悬浊液于试管中,滴加过量Na2CO3溶液,若观察到产生浅绿色沉淀,则说明Ni(OH)2能和Na2CO3溶液反应;
向步骤(1)所得的澄清液中,滴加少量NaOH溶液,若无明显现象,则说明硫酸镍溶液不能和NaOH溶液反应;
[分析讨论]
(2)Ni(OH)2中氢氧根显负一价,根据化合物中正负化合价的代数和为零,设Ni的化合价为x,;
(3)氢氧化镍和稀硫酸反应生成硫酸镍和水,化学方程式为;由两种化合物互相交换成分,生成另外两种化合物的反应 ,属于复分解反应;
(4)由上述实验可知,氢氧化镍可与碳酸钠反应生成溶解度更小的碳酸镍,故氢氧化镍在水中的溶解能力大于碳酸镍;
(5)小顾认为步骤(3)得出的结论不合理,其理由是步骤(3)加入的少量NaOH溶液先与步骤(1)中过量的稀硫酸反应。
19.(1)3.42
(2)<
(3)设与100g氢氧化钡溶液恰好完全反应时消耗硫酸的质量为
解得
则50g硫酸溶液的溶质质量分数为
答:硫酸溶液的溶质质量分数为3.92%。
【解析】(1)由图像可知,当氢氧化钡溶液的质量为100g时,溶液中溶质质量为零,此时硫酸和氢氧化钡恰好完全反应,此时氢氧化钡质量为 100g×3.42%=3.42g;
(2)由图像可知,加入100g氢氧化钡溶液时硫酸全部恰好完全反应,此时溶液呈中性,所以加入50g氢氧化钡溶液时,硫酸过量,溶液整体呈酸性,pH<7;
(3)见答案。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.天平的两盘上各放一只质量相等的烧杯,在两只烧杯中分别加入等质量、等质量分数的稀硫酸,调节天平至平衡,然后向左盘烧杯中加入一定质量的镁粉,向右盘烧杯中加入和镁粉质量相等的锌粉,充分反应后,下列各种情况中不可能出现的是
A.只有锌粉有剩余 B.天平仍平衡
C.天平偏向放锌粉的一侧 D.天平不平衡
2.小强看到自家的小麦叶色淡黄,并有倒伏现象,则小麦应施用的肥料是
A. B. C. D.
3.某干粉灭火器的填充剂中含有磷酸二氢铵(化学式为NH4H2PO4)。已知23.0g磷酸二氢铵加热完全分解得到固体物质X、5.4g水蒸气和3.4g氨气。固体物质x既不能燃燃烧也不能支持燃烧。下列说法错误的是( )
A.磷酸二氢铵属于复合肥料 B.用磷酸二氢铵灭火既可降低温度,又可隔绝空气
C.固体物质X属于氧化物 D.该反应中固体物质X与氨气的分子个数比为2:1
4.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿在Y的表面有银析出,而Z没变化,则X、Y、Z的金属活动性顺序为
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Y>Z>X
5.向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是
A.滤液中一定含有Cu(NO3)2 B.滤液呈无色
C.滤渣只含有Ag D.向滤渣中滴加稀硫酸有气泡产生
6.已知常温下溶解度为0.17g。向一定量饱和溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:
步骤1:取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2:向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗g。
下列说法正确的是
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗 mL盐酸
C.步骤2中化学反应方程式为
D.该样品中钙元素的质量分数为66.67%
7.下列应用和相应的原理(用化学方程式表示)及基本反应类型均正确的是
A.用木炭还原氧化铜: 置换反应
B.电解水制氧气: 分解反应
C.用盐酸除水垢: 中和反应
D.用氢氧化钠溶液吸收二氧化碳: 复分解反应
8.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4等五种物质,在常温下把它们两两混合,能发生化学反应的有( )
A.4个 B.5个 C.6个 D.7个
9.图中物质的类别均不同,连线两端的物质常温下均能发生反应。下列说法正确的是
A.X与HCl反应可能得到蓝色溶液 B.Y和Z可以是NaNO3和NaOH
C.Z和CO2可能发生复分解反应 D.X、Y、Z分别是碱、盐、酸
10.小明在实验室中找到了三包已经失落标签的白色粉末,已知是CaCO3、Na2CO3、CaO,请从下面的试剂或方法中选择一种来确定该三种物质
A.稀盐酸 B.水 C.加强热 D.CaCl2溶液
二、填空与简答
11.将一个生锈的铁钉放入试管中,然后加入稀盐酸,可以看到 ,反应的化学方程式为 ;过一段时间后,可以看到 ,反应的化学方程式为 。
12.我国近代化学家 发明了联合制碱法,地壳中含量最多的元素与最多的金属元素所形成化合物的化学式为 。
13.按要求用化学式填空。
(1)密度最小的气体是 。
(2)胃液的主要成分是 。
(3)可做食品干燥剂的固体是 。
(4)属于大气污染物,且能形成酸雨的主要气体是 ,吸收该气体可选 溶液,该反应的化学方程式 。
14.回答:
(1)气候变化是人类面临的全球性问题,中国争取2060年前实现碳中和。“碳中和”就是采取各种措施全部抵消掉生产生活中排放的二氧化碳。
①“碳中和”中的“碳”指的是 。
A.碳原子 B.一氧化碳 C.二氧化碳 D.活性炭
②下列措施有利于实现“碳中和”的是 。
A.外出尽量选择公交出行 B.加大化石能源的使用力度
C.国家鼓励购买电动汽车 D.大力推广使用太阳能
(2)袁隆平院士在杂交水稻的培育领域做出巨大贡献,解决了我国人民的温饱问题。水稻丰产离不开化肥,某品牌的化肥中含有氯化铵、硫酸钾等物质。
①该化肥属于 (选“氮肥”或“钾肥”或“复合肥”)。
②该化肥不能与熟石灰混合使用,以免降低肥效。其原理是 。(用化学方程式表示)
15.当稀盐酸与稀氢氧化钠溶液混合后仍为无色溶液,为证明反应确实发生,进行以下实验。
实验一:向装有一定量稀氢氧化钠溶液的试管中滴加几滴酚酞溶液,再滴加稀盐酸,并不断振荡溶液。若观察到 现象,则证明反应发生,写出反应的化学方程式 。
实验二:取一定量的稀盐酸,逐滴匀速滴加稀氢氧化钠溶液,测得反应过程中pH变化 (20℃)如图所示:
①从0→t2时,溶液的酸碱性变化情况是 。
②根据曲线的变化,判断反应恰好完成的依据是 。
③t2时,所得溶液中的溶质是 (写化学式)。
16.已知A~E初中化学常见的物质。A、B、C、D是不同类别的物质,A是世界年产量最高的金属,B常用于配制农药波尔多液,E是一种钠盐,它们之间的转化关系如图所示(“—”表示可相互反应,“→”表示转化关系)。
(1)实验室冶炼A的化学方程式为 。
(2)B与D反应的化学方程式为 。
(3)A与B反应的基本反应类型是 。
17.早在战国时期,《周礼·考工记》就记载了我国劳动人民制取氢氧化钾以漂洗丝帛的工艺:先将干燥的木头烧成灰(含 K2CO3),用其灰汁浸泡丝帛,再加入石灰即可。其反应过程如图:
(1)操作 a 的名称 。
(2)反应 I(填“吸收”或“放出”) 热量。
(3)整个过程中能够循环利用的物质是 。
三、科学探究题
18.氢氧化镍【Ni(OH)2】是某种混合动力汽车电池的一种材料。请参与下列探究:
【查阅资料】
I.氢氧化镍是一种蓝绿色微溶于水的固体;硫酸镍溶液呈绿色;碳酸镍是一种浅绿色固体
Ⅱ.能溶于水的酸、碱、盐溶于水时能电离成离子即以离子的形式存在,如 ;水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
【实验探究】
(1)请完成表格的填写
实验步骤 实验现象 实验结论
①取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡 悬浊液变澄清,溶液呈绿色
②取少量氢氧化镍(新制)悬浊液于试管中,滴加过量Na2CO3溶液 Ni(OH)2能和Na2CO3溶液反应
③向步骤(1)所得的澄清液中,滴加少量NaOH溶液 无明显现象 硫酸镍溶液不能和 NaOH溶液反应
【分析讨论】
(2)Ni(OH)2中Ni的化合价为 。
(3)氢氧化镍和稀硫酸反应的化学方程式 ,属于的基本反应类型为 。
(4)由上述实验可知,氢氧化镍在水中的溶解能力 (填“大于”、“等于”或“小于”)碳酸镍。
(5)小顾认为步骤(3)得出的结论不合理,其理由是 。
四、计算题
19.某活动小组对失去标签的稀硫酸溶液的浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如下图所示。
(1)参加反应的Ba(OH)2溶质质量共有 g。
(2)滴加Ba(OH)2至50g时,烧杯内溶液的pH 7(填“>”、“<”或“=”)。
(3)求该硫酸溶液的溶质质量分数?(写出计算过程,结果精确到0.01%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、镁、锌与稀硫酸反应的化学方程式及其反应物、生成物的质量关系分别为
因为硫酸的质量、金属的质量相等,相等质量的硫酸反应时消耗的锌的质量比镁的质量大,所以当锌粉有剩余时,镁一定有剩余;A不正确.
B、当稀硫酸恰好和金属反应时,生成的氢气的质量相等,氢气逸出后,两边质量相等,天平仍然平衡,所以可能出现天平仍平衡的情况.B正确.
C、当稀硫酸过量时,等质量的镁、锌完全和稀硫酸反应时,镁和稀硫酸反应生成的氢气多,氢气逸出后,左盘烧杯中物质的质量小于右盘烧杯中物质的质量,天平偏向放锌粉的一侧,C正确.
D、当稀硫酸过量时,天平偏向放锌粉的一侧,D正确。
故选:A。
2.A
【详解】小麦叶色淡黄,并有倒伏现象,说明土壤中缺乏钾元素和氮元素;A、KNO3中含有钾元素和氮元素,属于复合肥,正确;B、NH4NO3中含有氮元素,属于氮肥,错误;C、Ca(H2PO4)2中含有磷元素,属于磷肥,错误;D、K2SO4中含有钾元素,属于钾肥,错误。故选A。
点睛:含有氮元素的肥料称为氮肥.含有磷元素的肥料称为磷肥.含有钾元素的肥料称为钾肥;同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
3.D
【详解】A、磷酸二氢铵中含有营养元素磷元素、氮元素,属于复合肥料,该选项说法正确;
B、用磷酸二氢铵灭火时,生成的水蒸发吸热,生成的固体能够隔绝氧气,因此既可降低温度,又可隔绝空气,该选项说法正确;
C、固体物质X既不能燃烧也不能支持燃烧,说明固体物质不是单质磷,因此是五氧化二磷,五氧化二磷是氧化物,该选项说法正确;
D、五氧化二磷质量:23.0g-5.4g-3.4g=14.2g,该反应中固体物质五氧化二磷与氨气的分子个数比为:,该选项说法不正确。
故选D。
4.A
【详解】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明X在氢前,Y在氢后,即X的活动性比Y强;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化,说明Y的活动性比银的强,而Z的活动性比银的弱,即Y的活动性比Z的强,根据以上事实,判断出X、Y和Z的金属活动性顺序为X>Y>Z。故选A。
5.A
【分析】向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液,滤渣中一定含有过量的铜和银(硝酸银和铜反应生成),滤液中一定含有硝酸铜,一定没有硝酸银。
【详解】A、滤液中一定含有Cu(NO3)2,选项正确;
B、滤液中含有硝酸铜,所以呈蓝色,选项错误;
C、滤渣含有Ag和过量的铜,选项错误;
D、向滤渣铜和银中滴加稀硫酸没有气泡产生,因为都是氢后金属,选项错误。
故选:A。
6.D
【详解】A、由题意可知,常温下溶解度为0.17g。取0.60g样品于锥形瓶中,氧化钙和水反应生成氢氧化钙,生成的氢氧化钙的质量>0.6g,向其中加入200mL蒸馏水,200g的水最多溶解0.34g的氢氧化钙,所以生成氢氧化钙不能完全溶解,步骤1中充分振荡后不能得到澄清透明的溶液,故A错误;
B、反应完全时锥形瓶内溶液红色恰好褪去,此时溶液呈中性,pH=7,则消耗 mL盐酸,故B错误;
C、步骤2中是氢氧化钙和稀盐酸反应生成氯化钙和水,化学反应方程式为,故C错误;
D、在该反应过程中,氢氧化钙和稀盐酸反应生成氯化钙和水,根据质量守恒定律可知,钙元素质量不变,则有,该样品中钙元素的质量分数为,故D正确。
故选D。
7.A
【详解】A、化学方程式书写正确,单质和化合物反应生成另一种单质和化合物,属于置换反应,故正确;
B、电解水制氧气:,故错误;
C、化学方程式书写正确,两种化合物互相交换成分生成另外两种化合物的反应,属于复分解反应,故错误;
D、化学方程式书写正确,不属于基本反应类型,故错误;
故选:A。
【点睛】四大基本反应类型
化合反应:由两种或两种以上的物质生成另一种物质的反应;
分解反应:由一种反应物生成两种或两种以上其他物质的反应;
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应。
8.A
【详解】Fe能与稀H2SO4反应:Fe+ H2SO4 == FeSO4 + H2↑,CuO能与稀H2SO4反应: CuO + H2SO4 ==CuSO4 + H2O,MgCl2溶液能与Ca(OH)2溶液反应:MgCl2 + Ca(OH)2 ==Mg(OH)2↓+ CaCl2 ,Ca(OH)2溶液能与稀H2SO4反应:Ca(OH)2 + H2SO4 ==CaSO4 + 2H2O,故选A。
9.A
【分析】根据题意可知:所有物质的类别均不同, Z 能与二氧化碳反应,能与酸反应,能与石蕊溶液作用,应为碱;由酸的化学性质, X 应为金属氧化物; Y 能与盐酸、碱反应,应为盐。
【详解】A、根据分析可知:X应为金属氧化物,X与HCl反应,可以是氧化铜和盐酸的反应,氧化铜与盐酸反应会生成氯化铜和水,溶液变为蓝色,故该项说法正确;
B、根据分析可知:Y是盐,Z应为碱,但Y不可能是NaNO3,因为NaNO3与稀盐酸不反应,故该项说错误;
C、根据分析可知:Z应为碱。金属与酸的反应属于置换反应,酸和碱、盐、金属氧化物的反应均属于复分解反应,碱和盐的反应也是复分解反应,而碱与非金属氧化物的反应不属于基本反应类型中的复分解反应,故该项说错误;
D、根据分析可知:Z应为碱;由酸的化学性质,X应为金属氧化物;Y能与盐酸、碱反应,应为盐,故该项说法错误。
故选A。
10.B
【详解】A、盐酸和碳酸钙,碳酸钠都生成二氧化碳,不能鉴别;错误;
B、碳酸钙不溶与水;碳酸钠溶于水;氧化钙和反应生成氢氧化钙,并放出热量;正确;
C、碳酸钙加强热生成二氧化碳,碳酸钠、氧化钙加热不产生二氧化碳,不能鉴别;错误;
D、氧化钙和氯化钙溶液中的水反应产生氢氧化钙,同时放热,氯化钙和碳酸钠生成沉淀碳酸钙,碳酸钙不溶于氯化钙溶液,不能鉴别;错误;
故选B。
11. 铁锈逐渐消失,溶液由无色变为黄色 Fe2O3+6HCl===2FeCl3+3H2O 有气泡产生 Fe+2HCl===FeCl2+H2↑
【详解】铁锈的成分是氧化铁,能与盐酸生成氯化铁和水,氯化铁的水溶液颜色的为黄色,铁能与盐酸反应生成氯化亚铁和氢气,故会观察到有气泡产生,故填:铁锈逐渐消失,溶液由无色变为黄色;反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;过一段时间后,会产生无色的气泡,反应的化学方程式为Fe+2HCl=FeCl2+H2↑。
12. 侯德榜 Al2O3
【详解】我国近代化学家侯德榜发明了联合制碱法;
地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,氧元素与铝元素形成的化合物为氧化铝,氧化铝中铝元素显+3价,氧元素显-2价,化学式为:Al2O3。
13. H2 HCl CaO SO2 NaOH SO2+2NaOH=Na2SO3+H2O
【详解】(1)密度最小的气体是氢气,氢气由氢分子构成,一个氢分子由两个氢原子构成,所以氢气的化学式写为H2,故填H2。
(2)胃液的主要成分是胃酸,胃酸的主要成分是盐酸,盐酸的化学式为HCl,故填HCl。
(3)可做食品干燥剂的固体是氧化钙,其中钙元素的化合价为+2价,氧元素的化合价为-2价,根据化合物中各元素的化合价的代数和为零,则氧化钙的化学式为CaO,故填CaO。
(4)属于大气污染物,且能形成酸雨的主要气体是煤燃烧后生成的二氧化硫,其中硫元素的化合价为+4价,氧元素的化合价为-2价,根据化合物中各元素的化合价的代数和为零,则二氧化硫的化学式为SO2,故填SO2;
二氧化硫能与氢氧化钠反应生成盐和水,所以吸收二氧化硫可选用NaOH溶液,故填NaOH;
二氧化硫与氢氧化钠反应生成亚硫酸钠和水,故反应的化学方程式写为:SO2+2NaOH=Na2SO3+H2O。
14.(1) C ACD
(2) 复合肥
【详解】(1)(1)①“碳中和”就是采取各种措施全部抵消掉生产生活中排放的二氧化碳,“碳中和”中的“碳”指的是二氧化碳;
故填:C;
②A、外出尽量选择公交出行,减少使用汽车,能减少二氧化碳排放,有利于实现“碳中和”;
B、化石能源燃烧生成大量二氧化碳,加大化石能源的使用力度,不利于实现“碳中和”;
C、国家鼓励购买电动汽车,减少化石燃料使用,减少二氧化碳排放,有利于实现“碳中和”;
D、大力推广使用太阳能,减少化石燃料使用,减少二氧化碳排放,有利于实现“碳中和”;
故填:ACD;
(2)①某品牌的化肥中含有氯化铵、硫酸钾等物质,化肥中含有氮元素、钾元素等营养元素,该化肥属于复合肥。
②该化肥不能与熟石灰混合使用,以免降低肥效,其原理是氯化铵与氢氧化钙反应生成氨气、氯化钙和水,方程式为。
15. 溶液红色褪去 NaOH+HCl=NaCl+H2O 溶液由酸性变为中性,最后变为碱性 溶液pH为7 NaCl NaOH
【详解】实验一:因酚酞滴入到氢氧化钠溶液中变为红色,当向碱性溶液中加稀盐酸时,发生NaOH+HCl=NaCl+H2O,反应使碱减少至消失,则红色逐渐变浅至消失,即可利用溶液颜色的变化来判断发生反应;
实验二:①由图可知pH在不断变大,t1时pH为7,即溶液的酸性不断减弱,t1时变为中性,在t2时pH大于7溶液呈碱性,溶液又逐渐碱性增强;
②判断发生酸和碱发生反应的依据是根据图中pH变化,随着碱的滴加溶液的酸性减弱pH变大,直至恰好反应pH=7,溶液呈中性,说明反应恰好完成;
③在t2时pH大于7溶液呈碱性,此时溶液中氢氧化钠过量,所以溶液中的溶质是氯化钠和氢氧化钠。
16.(1)
(2)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(3)置换反应
【分析】A~E是初中化学中常见的物质,A、B、C、D是不同类别的物质,A是目前世界上年产量最高的金属,所以A是铁,B常用来配制农药波尔多液,B会与铁反应,所以B是硫酸铜,E是一种钠盐,D会与硫酸铜反应,D与E相互转化,所以D是氢氧化钠,E是碳酸钠,C可以是盐酸,经过验证,推导正确。
【详解】(1)A是铁,实验室冶炼铁的原理是一氧化碳在高温条件下还原氧化铁,生成铁和二氧化碳,反应的化学方程式为。
(2)B是硫酸铜,D是氢氧化钠,硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,反应的化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓。
(3)铁与硫酸铜反应生成硫酸亚铁和铜,是单质与化合物反应生成另外的单质和化合物的化学反应,属于置换反应。
17.(1)过滤
(2)放出
(3)碳酸钙/ CaCO3
【详解】(1)操作a是将不溶于液体的固体物质与液体分离的一种方法,操作a的名称是过滤;
(2)氧化钙与水反应生成氢氧化钙,该反应是放热反应;
(3)由流程图可知,碳酸钙既是流程的反应物,又是流程的生成物,碳酸钙能够循环利用。
18. 氢氧化镍能和稀硫酸反应 产生浅绿色沉淀 +2 复分解反应 大于 步骤(3)加入的少量NaOH溶液先与步骤(1)中过量的稀硫酸反应
【详解】[实验探究]
(1)取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡,若观察到悬浊液变澄清,溶液呈绿色,则说明氢氧化镍能和稀硫酸反应;
取少量氢氧化镍(新制)悬浊液于试管中,滴加过量Na2CO3溶液,若观察到产生浅绿色沉淀,则说明Ni(OH)2能和Na2CO3溶液反应;
向步骤(1)所得的澄清液中,滴加少量NaOH溶液,若无明显现象,则说明硫酸镍溶液不能和NaOH溶液反应;
[分析讨论]
(2)Ni(OH)2中氢氧根显负一价,根据化合物中正负化合价的代数和为零,设Ni的化合价为x,;
(3)氢氧化镍和稀硫酸反应生成硫酸镍和水,化学方程式为;由两种化合物互相交换成分,生成另外两种化合物的反应 ,属于复分解反应;
(4)由上述实验可知,氢氧化镍可与碳酸钠反应生成溶解度更小的碳酸镍,故氢氧化镍在水中的溶解能力大于碳酸镍;
(5)小顾认为步骤(3)得出的结论不合理,其理由是步骤(3)加入的少量NaOH溶液先与步骤(1)中过量的稀硫酸反应。
19.(1)3.42
(2)<
(3)设与100g氢氧化钡溶液恰好完全反应时消耗硫酸的质量为
解得
则50g硫酸溶液的溶质质量分数为
答:硫酸溶液的溶质质量分数为3.92%。
【解析】(1)由图像可知,当氢氧化钡溶液的质量为100g时,溶液中溶质质量为零,此时硫酸和氢氧化钡恰好完全反应,此时氢氧化钡质量为 100g×3.42%=3.42g;
(2)由图像可知,加入100g氢氧化钡溶液时硫酸全部恰好完全反应,此时溶液呈中性,所以加入50g氢氧化钡溶液时,硫酸过量,溶液整体呈酸性,pH<7;
(3)见答案。
答案第1页,共2页
答案第1页,共2页
