【浙教版】2024年春初二科学授课课件10氧化与燃烧(20页ppt)
文档属性
| 名称 | 【浙教版】2024年春初二科学授课课件10氧化与燃烧(20页ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-30 09:58:07 | ||
图片预览







文档简介
(共20张PPT)
10氧化与燃烧
八年级科学春季复习PPT
chen
1
氧化与燃烧
1.氧化反应:物质跟氧发生的反应叫作氧化反应。
(1)缓慢氧化:氧化过程进行得非常缓慢,甚至在短期内不易察觉,如钢铁生锈、塑料和橡胶制品的老化等。
1
氧化与燃烧
(2)剧烈氧化:氧化过程进行得很剧烈,如燃烧,爆炸。
1
氧化与燃烧
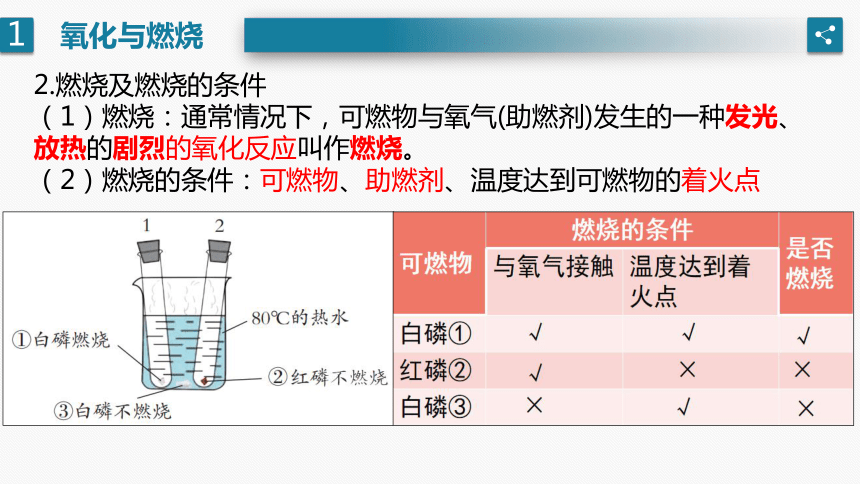
2.燃烧及燃烧的条件
(1)燃烧:通常情况下,可燃物与氧气(助燃剂)发生的一种发光、放热的剧烈的氧化反应叫作燃烧。
(2)燃烧的条件:可燃物、助燃剂、温度达到可燃物的着火点
1
氧化与燃烧
(3)可燃物的着火点:物质燃烧所需达到的最低温度叫着火点
不同物质的着火点是不同的。
(4)可燃物在空气中燃烧和在氧气中燃烧的异同点:
①本质一样,都是与氧气发生反应;
②现象不一样,在氧气中燃烧剧烈一些
原因:反应物接触面越大,浓度越大,反应越剧烈
(5)自燃:由于缓慢氧化产生的热量被积累后,温度
升高达到该可燃物的着火点时,在氧气充足的情况下
,不经点火就自发燃烧起来的现象
1
氧化与燃烧
6)爆炸:如果燃烧以极快的速率在有限的空间里发生,瞬间内累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。
化学变化:鞭炮
(另一种需要分清楚的爆炸:高压锅爆炸,轮胎爆胎属于物理变化)
1
氧化与燃烧
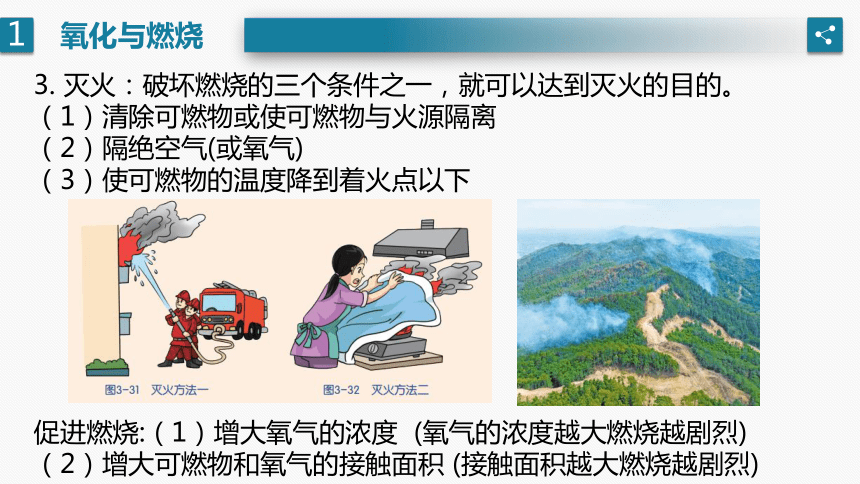
3. 灭火:破坏燃烧的三个条件之一,就可以达到灭火的目的。
(1)清除可燃物或使可燃物与火源隔离
(2)隔绝空气(或氧气)
(3)使可燃物的温度降到着火点以下
促进燃烧:(1)增大氧气的浓度 (氧气的浓度越大燃烧越剧烈)
(2)增大可燃物和氧气的接触面积 (接触面积越大燃烧越剧烈)
1
氧化与燃烧
4. 化学反应中的能量变化
化学反应在生成新物质的同时,伴有能量的变化,而能量的变化通常表现为热量的变化,即有放热现象或吸热现象。
(1)放出热量的反应:如燃料的燃烧,生石灰与水结合成氢氧化钙,镁与盐酸反应等。
(2)吸收热量的反应:
如碳与二氧化碳在高温条件下生成CO,Ba(OH)2与NH4Cl反应。
1
气息666
典型例题
气息666
【例1】(2022杭州期末)下列说法不正确的是( )
A.切开的苹果放一段时间会变黄是因为和空气中的氧气发生了缓慢氧化
B.镁带在空气中剧烈燃烧,发出耀眼的白光,发生的反应属于氧化反应
C.可燃物必须遇到氧气,且温度达到着火点才可以燃烧
D.若炒菜时油锅着火,则可以放入切好的蔬菜或者盖上锅盖来灭火
【答案】C
1
气息666
典型例题
气息666
【例2】(2022浙江专题)分析推理是科学学习过程中的常用方法,下列推理正确的是 ( )
A.自燃是由缓慢氧化引起的,缓慢氧化一定能引起自燃
B.化合物是含有不同种元素的纯净物,含有不同种元素的纯净物一定是化合物
C.物质和氧气发生的反应是氧化反应,氧化反应一定有氧气参加
D.分子、原子可以构成物质,物质一定是由分子、原子构成的
【答案】B
1
气息666
典型例题
【例3】(2023宁波期末)某课外活动小组同学依据如图进行实验(夹持仪器略去)。实验过程:①通入N2,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通O2,a中无明显现象,b中碳燃烧,下列有关该实验的说法不正确的是( )
A.实验过程①中,能说明N2不支持燃烧
B.实验过程①中,将氮气换为二氧化碳也能得出燃烧的有关条件
C.实验过程②中,碳燃烧时发出白光
D.实验过程②中,只能说明可燃物燃烧的条件是与氧气接触
【答案】D
1
气息666
典型例题
【例4】(2024宁波期中)火折子被誉为古代的“打火机”(如图),其制作与使用方法如下:
①将棉花、松香、硫磺等可燃物混合 ②将混合后的可燃物卷起、压实、捆紧
③点燃后装入竹简,竹简盖子上有小孔 ④使用时取下盖子,吹一下就能复燃其中有助于燃烧的是( )
A.②③④ B.①②④ C.①②③ D.①③④
【答案】D
1
气息666
典型例题
【【例5】(2022绍兴期末)小科用研钵将约20克氢氧化钡[Ba(OH)2]晶体磨成粉末,倒入一小烧杯。在玻璃片上洒上少量水,并将小烧杯放在玻璃片上、再向小烧杯中加入约10克氯化铵[NH4Cl]晶体,并用玻璃棒迅速搅拌,烧杯中产生刺激性气味的气体,静止片刻,提起小烧杯,观察到如图所示现象。下列对现象的观察分析中正确的是( )
A.用手触摸烧杯外壁,能感觉到发热
B.化学反应中,不同形式的能之间可以相互转化
C.把氢氧化钡晶体磨成粉末可以增加最终产生气体的质量
D.该反应和燃烧一样,反应物总的化学能高于生成物总的化学能
【答案】B
1
气息666
典型例题
【例6】(2023绍兴期末)成语“釜底抽薪”的本意包含着灭火的原理,下列灭火方法也依据这个原理的是( )
A.砍掉树木形成隔离带 B.用二氧化碳灭火器灭火
C.用锅盖盖灭着火的油锅 D.消防队员用高压水枪灭火
【答案】A
2
质量守恒定律
1.质量守恒定律的概念:在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
2.化学反应的过程就是组成反应物分子的原子重新组合成生成物分子的过程。
3.化学反应前后原子的 种类 和 数目 不变,所以化学反应前后物质的质量总和必然相等。而物质的 分子数和物态可能改变。
2
质量守恒定律
注意:
a.质量守恒定律的适用范围是化学变化,一切化学反应都符合该定律。
b.反应物的质量总和只包括参与部分,不包括反应物过量部分的质量及不参加反应的杂质的质量。
c.验证质量守恒定律时,对于有气体参加或生成的反应,一定要在密闭容器内进行实验。
2
质量守恒定律
d.化学反应前后的变与不变
六个一定 不变 宏观 元素的种类不变
元素的质量不变
反应物和生成物的总质量不变
微观 原子的种类不变
原子的数目不变
原子的质量不变
两个一定 改变 宏观 物质的种类一定改变
微观 分子的种类一定改变
两个可能 改变 宏观 物质的物态(或元素的化合价)可能改变
微观 分子的数目可能改变
2
典型例题
【例1】(2023浙江期中)已知2A+3B=C+3D,用足量的A和49gB恰好完全反应,其生成57gC和1gD,若B的相对分子质量为98,则A的相对分子质量为( )
A.18 B.27 C.46 D.54
【答案】B
【例2】(2024宁波阶段)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
A.乙可能是化合物
B.该反应是分解反应
C.丁可能是该反应的催化剂
D.每消耗100g的甲,能生成22g的丙
【答案】D
2
典型例题
【例3】(2024宁波阶段)将等容积、等质量(含瓶塞、导管和燃烧匙)的两个集气瓶置于天平的左右两端,并调至平衡。然后同时迅速放入点燃的等质量的白磷和木炭(如图所示),使两者充分燃烧后冷却至室温。打开止水夹,此时的天平( )
A.指针偏向右 B.指针偏向左
C.仍处于平衡状态 D.指针先偏向左后向右
【答案】B
2
典型例题
【例4】(2024宁波期中)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,则关于此反应认识正确的是( )
A.反应后x的值为15
B.该反应有两种生成物
C.完全反应后物质P有剩余
D.反应中N、P的质量比为5:4
【答案】D
10氧化与燃烧
八年级科学春季复习PPT
chen
1
氧化与燃烧
1.氧化反应:物质跟氧发生的反应叫作氧化反应。
(1)缓慢氧化:氧化过程进行得非常缓慢,甚至在短期内不易察觉,如钢铁生锈、塑料和橡胶制品的老化等。
1
氧化与燃烧
(2)剧烈氧化:氧化过程进行得很剧烈,如燃烧,爆炸。
1
氧化与燃烧
2.燃烧及燃烧的条件
(1)燃烧:通常情况下,可燃物与氧气(助燃剂)发生的一种发光、放热的剧烈的氧化反应叫作燃烧。
(2)燃烧的条件:可燃物、助燃剂、温度达到可燃物的着火点
1
氧化与燃烧
(3)可燃物的着火点:物质燃烧所需达到的最低温度叫着火点
不同物质的着火点是不同的。
(4)可燃物在空气中燃烧和在氧气中燃烧的异同点:
①本质一样,都是与氧气发生反应;
②现象不一样,在氧气中燃烧剧烈一些
原因:反应物接触面越大,浓度越大,反应越剧烈
(5)自燃:由于缓慢氧化产生的热量被积累后,温度
升高达到该可燃物的着火点时,在氧气充足的情况下
,不经点火就自发燃烧起来的现象
1
氧化与燃烧
6)爆炸:如果燃烧以极快的速率在有限的空间里发生,瞬间内累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。
化学变化:鞭炮
(另一种需要分清楚的爆炸:高压锅爆炸,轮胎爆胎属于物理变化)
1
氧化与燃烧
3. 灭火:破坏燃烧的三个条件之一,就可以达到灭火的目的。
(1)清除可燃物或使可燃物与火源隔离
(2)隔绝空气(或氧气)
(3)使可燃物的温度降到着火点以下
促进燃烧:(1)增大氧气的浓度 (氧气的浓度越大燃烧越剧烈)
(2)增大可燃物和氧气的接触面积 (接触面积越大燃烧越剧烈)
1
氧化与燃烧
4. 化学反应中的能量变化
化学反应在生成新物质的同时,伴有能量的变化,而能量的变化通常表现为热量的变化,即有放热现象或吸热现象。
(1)放出热量的反应:如燃料的燃烧,生石灰与水结合成氢氧化钙,镁与盐酸反应等。
(2)吸收热量的反应:
如碳与二氧化碳在高温条件下生成CO,Ba(OH)2与NH4Cl反应。
1
气息666
典型例题
气息666
【例1】(2022杭州期末)下列说法不正确的是( )
A.切开的苹果放一段时间会变黄是因为和空气中的氧气发生了缓慢氧化
B.镁带在空气中剧烈燃烧,发出耀眼的白光,发生的反应属于氧化反应
C.可燃物必须遇到氧气,且温度达到着火点才可以燃烧
D.若炒菜时油锅着火,则可以放入切好的蔬菜或者盖上锅盖来灭火
【答案】C
1
气息666
典型例题
气息666
【例2】(2022浙江专题)分析推理是科学学习过程中的常用方法,下列推理正确的是 ( )
A.自燃是由缓慢氧化引起的,缓慢氧化一定能引起自燃
B.化合物是含有不同种元素的纯净物,含有不同种元素的纯净物一定是化合物
C.物质和氧气发生的反应是氧化反应,氧化反应一定有氧气参加
D.分子、原子可以构成物质,物质一定是由分子、原子构成的
【答案】B
1
气息666
典型例题
【例3】(2023宁波期末)某课外活动小组同学依据如图进行实验(夹持仪器略去)。实验过程:①通入N2,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通O2,a中无明显现象,b中碳燃烧,下列有关该实验的说法不正确的是( )
A.实验过程①中,能说明N2不支持燃烧
B.实验过程①中,将氮气换为二氧化碳也能得出燃烧的有关条件
C.实验过程②中,碳燃烧时发出白光
D.实验过程②中,只能说明可燃物燃烧的条件是与氧气接触
【答案】D
1
气息666
典型例题
【例4】(2024宁波期中)火折子被誉为古代的“打火机”(如图),其制作与使用方法如下:
①将棉花、松香、硫磺等可燃物混合 ②将混合后的可燃物卷起、压实、捆紧
③点燃后装入竹简,竹简盖子上有小孔 ④使用时取下盖子,吹一下就能复燃其中有助于燃烧的是( )
A.②③④ B.①②④ C.①②③ D.①③④
【答案】D
1
气息666
典型例题
【【例5】(2022绍兴期末)小科用研钵将约20克氢氧化钡[Ba(OH)2]晶体磨成粉末,倒入一小烧杯。在玻璃片上洒上少量水,并将小烧杯放在玻璃片上、再向小烧杯中加入约10克氯化铵[NH4Cl]晶体,并用玻璃棒迅速搅拌,烧杯中产生刺激性气味的气体,静止片刻,提起小烧杯,观察到如图所示现象。下列对现象的观察分析中正确的是( )
A.用手触摸烧杯外壁,能感觉到发热
B.化学反应中,不同形式的能之间可以相互转化
C.把氢氧化钡晶体磨成粉末可以增加最终产生气体的质量
D.该反应和燃烧一样,反应物总的化学能高于生成物总的化学能
【答案】B
1
气息666
典型例题
【例6】(2023绍兴期末)成语“釜底抽薪”的本意包含着灭火的原理,下列灭火方法也依据这个原理的是( )
A.砍掉树木形成隔离带 B.用二氧化碳灭火器灭火
C.用锅盖盖灭着火的油锅 D.消防队员用高压水枪灭火
【答案】A
2
质量守恒定律
1.质量守恒定律的概念:在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
2.化学反应的过程就是组成反应物分子的原子重新组合成生成物分子的过程。
3.化学反应前后原子的 种类 和 数目 不变,所以化学反应前后物质的质量总和必然相等。而物质的 分子数和物态可能改变。
2
质量守恒定律
注意:
a.质量守恒定律的适用范围是化学变化,一切化学反应都符合该定律。
b.反应物的质量总和只包括参与部分,不包括反应物过量部分的质量及不参加反应的杂质的质量。
c.验证质量守恒定律时,对于有气体参加或生成的反应,一定要在密闭容器内进行实验。
2
质量守恒定律
d.化学反应前后的变与不变
六个一定 不变 宏观 元素的种类不变
元素的质量不变
反应物和生成物的总质量不变
微观 原子的种类不变
原子的数目不变
原子的质量不变
两个一定 改变 宏观 物质的种类一定改变
微观 分子的种类一定改变
两个可能 改变 宏观 物质的物态(或元素的化合价)可能改变
微观 分子的数目可能改变
2
典型例题
【例1】(2023浙江期中)已知2A+3B=C+3D,用足量的A和49gB恰好完全反应,其生成57gC和1gD,若B的相对分子质量为98,则A的相对分子质量为( )
A.18 B.27 C.46 D.54
【答案】B
【例2】(2024宁波阶段)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
A.乙可能是化合物
B.该反应是分解反应
C.丁可能是该反应的催化剂
D.每消耗100g的甲,能生成22g的丙
【答案】D
2
典型例题
【例3】(2024宁波阶段)将等容积、等质量(含瓶塞、导管和燃烧匙)的两个集气瓶置于天平的左右两端,并调至平衡。然后同时迅速放入点燃的等质量的白磷和木炭(如图所示),使两者充分燃烧后冷却至室温。打开止水夹,此时的天平( )
A.指针偏向右 B.指针偏向左
C.仍处于平衡状态 D.指针先偏向左后向右
【答案】B
2
典型例题
【例4】(2024宁波期中)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,则关于此反应认识正确的是( )
A.反应后x的值为15
B.该反应有两种生成物
C.完全反应后物质P有剩余
D.反应中N、P的质量比为5:4
【答案】D
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
