浙教版初二科学4.4二氧化碳讲义(含答案)
文档属性
| 名称 | 浙教版初二科学4.4二氧化碳讲义(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 742.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-30 16:20:37 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
浙教版初二科学4.4二氧化碳讲义
一、单选题
1.证明碳酸饮料中含有气体,最合理的做法是( )
A.将燃着的木条伸进碳酸饮料中,观察是否熄灭
B.用手在瓶口轻轻扇动,闻有无刺激性气味
C.振荡碳酸饮料瓶,观察瓶子是否变扁
D.振荡碳酸饮料瓶,将喷出的气体通入澄清石灰水,观察是否变浑浊
2.通常证明集气瓶中气体是二氧化碳的正确方法是( )
A.把带火星的木条放在装满气体的集气瓶中
B.把燃着的木条迅速插入装满气体的集气瓶中
C.通入澄清石灰水中
D.通入石蕊试液中
3.下列操作中只发生物理变化的是( )
A.将二氧化碳通入水中
B.将二氧化碳通入澄清石灰水中
C.将二氧化碳倾倒入盛有燃着蜡烛的烧杯中
D.将二氧化碳加压降温压缩成干冰
4.把干燥的蓝色石蕊试纸放在中,蓝色石蕊试纸不变色。将通入滴有紫色石蕊试液的水中,溶液变红色,将该溶液敞口加热一段时间,发现溶液的红色裉去,冷却到原温度后,再次通入,溶液又变红色。上述实验现象不能说明的是( )
A.能和水发生化学反应
B.的水溶液具有酸性
C.加热能使二氧化碳水溶液的酸性减弱
D.具有酸性
5.节能减排、低碳出行是我们倡导的生活方式.下列有关碳及其氧化物的说法中正确的是()
A.焦炭、一氧化碳、二氧化碳都具有还原性
B.二氧化碳和一氧化碳的组成元素相同,在一定条件下可以互相转化
C.二氧化碳通过紫色石蕊溶液,溶液变为红色,说明二氧化碳具有酸性
D.金刚石、石墨和C60都是由碳元素组成的单质,性质相同
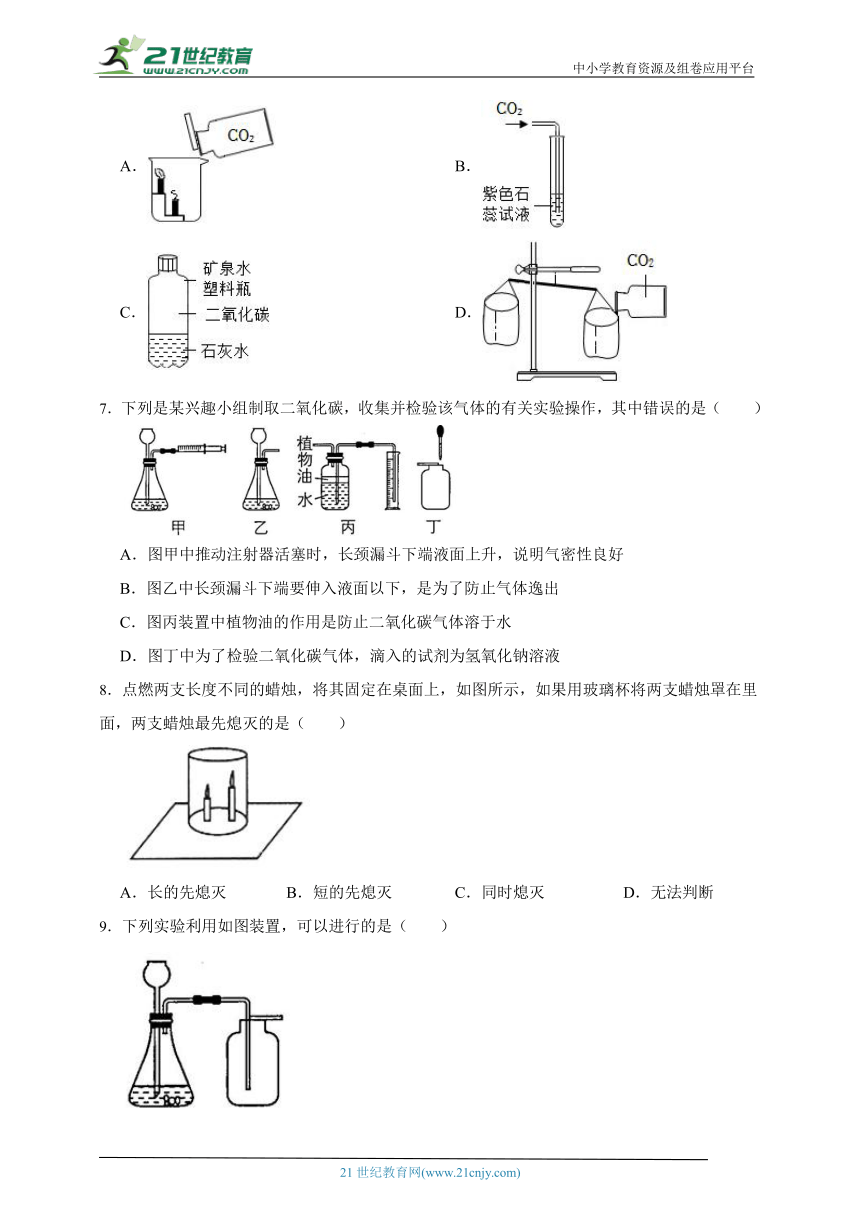
6.下图所示的有关二氧化碳性质的实验中,只能证明二氧化碳的物理性质的是( )
A. B.
C. D.
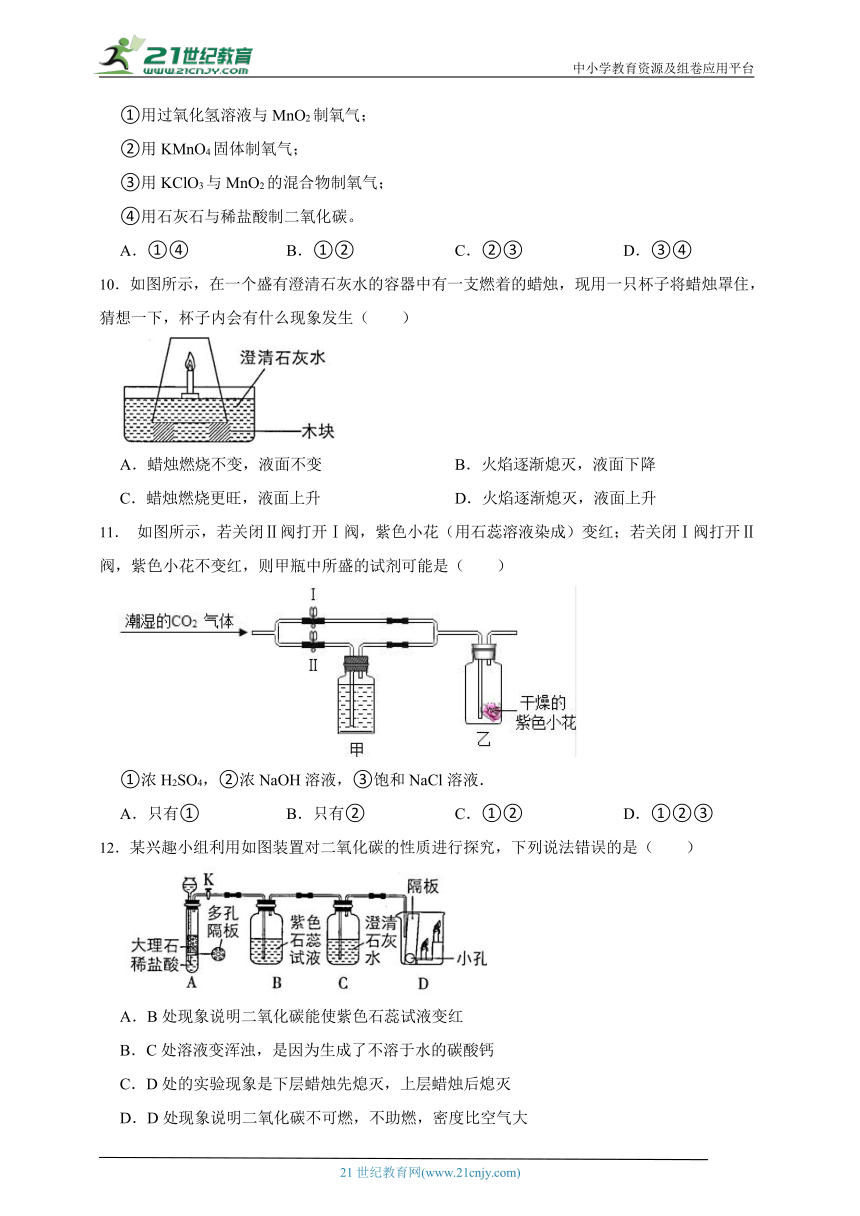
7.下列是某兴趣小组制取二氧化碳,收集并检验该气体的有关实验操作,其中错误的是( )
A.图甲中推动注射器活塞时,长颈漏斗下端液面上升,说明气密性良好
B.图乙中长颈漏斗下端要伸入液面以下,是为了防止气体逸出
C.图丙装置中植物油的作用是防止二氧化碳气体溶于水
D.图丁中为了检验二氧化碳气体,滴入的试剂为氢氧化钠溶液
8.点燃两支长度不同的蜡烛,将其固定在桌面上,如图所示,如果用玻璃杯将两支蜡烛罩在里面,两支蜡烛最先熄灭的是( )
A.长的先熄灭 B.短的先熄灭 C.同时熄灭 D.无法判断
9.下列实验利用如图装置,可以进行的是( )
①用过氧化氢溶液与MnO2制氧气;
②用KMnO4固体制氧气;
③用KClO3与MnO2的混合物制氧气;
④用石灰石与稀盐酸制二氧化碳。
A.①④ B.①② C.②③ D.③④
10.如图所示,在一个盛有澄清石灰水的容器中有一支燃着的蜡烛,现用一只杯子将蜡烛罩住,猜想一下,杯子内会有什么现象发生( )
A.蜡烛燃烧不变,液面不变 B.火焰逐渐熄灭,液面下降
C.蜡烛燃烧更旺,液面上升 D.火焰逐渐熄灭,液面上升
11. 如图所示,若关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀打开Ⅱ阀,紫色小花不变红,则甲瓶中所盛的试剂可能是( )
①浓H2SO4,②浓NaOH溶液,③饱和NaCl溶液.
A.只有① B.只有② C.①② D.①②③
12.某兴趣小组利用如图装置对二氧化碳的性质进行探究,下列说法错误的是( )
A.B处现象说明二氧化碳能使紫色石蕊试液变红
B.C处溶液变浑浊,是因为生成了不溶于水的碳酸钙
C.D处的实验现象是下层蜡烛先熄灭,上层蜡烛后熄灭
D.D处现象说明二氧化碳不可燃,不助燃,密度比空气大
二、填空题
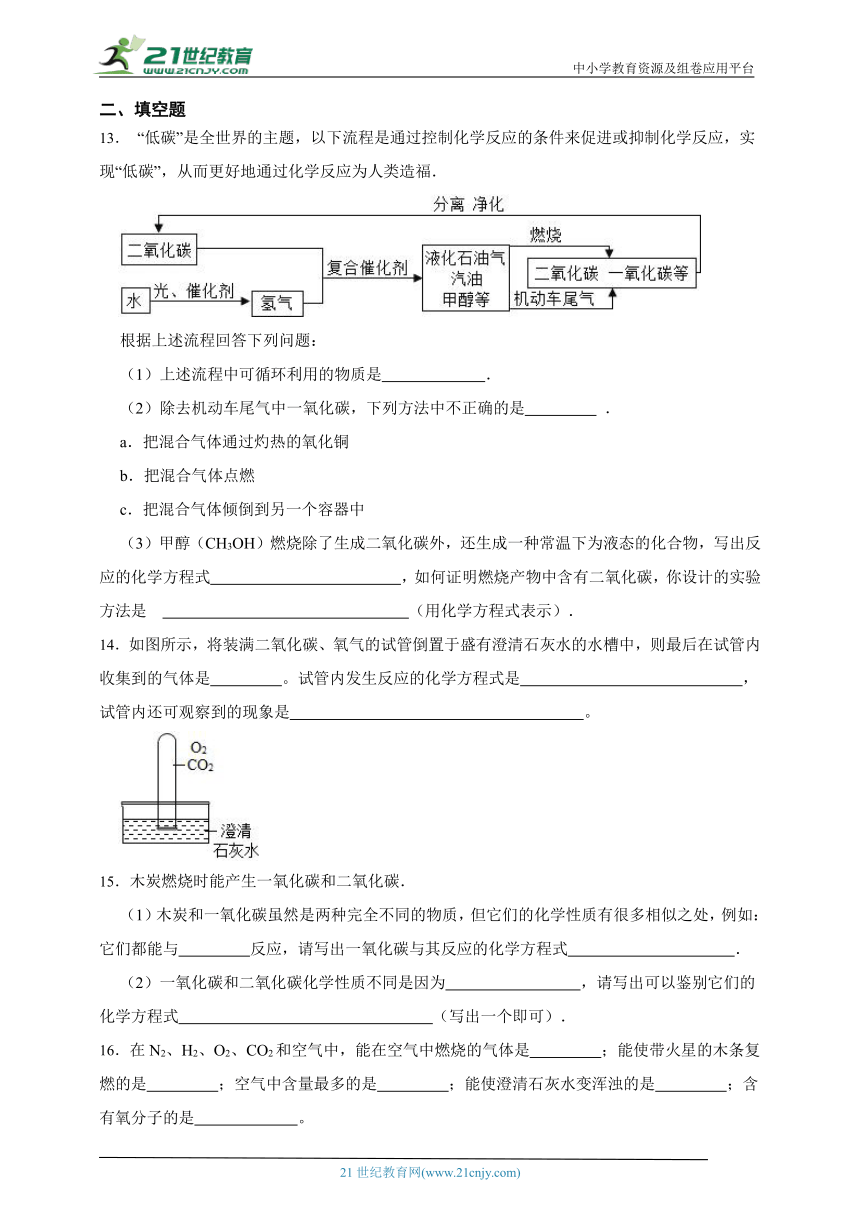
13. “低碳”是全世界的主题,以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福.
根据上述流程回答下列问题:
(1)上述流程中可循环利用的物质是 .
(2)除去机动车尾气中一氧化碳,下列方法中不正确的是 .
a.把混合气体通过灼热的氧化铜
b.把混合气体点燃
c.把混合气体倾倒到另一个容器中
(3)甲醇(CH3OH)燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,写出反应的化学方程式 ,如何证明燃烧产物中含有二氧化碳,你设计的实验方法是 (用化学方程式表示).
14.如图所示,将装满二氧化碳、氧气的试管倒置于盛有澄清石灰水的水槽中,则最后在试管内收集到的气体是 。试管内发生反应的化学方程式是 ,试管内还可观察到的现象是 。
15.木炭燃烧时能产生一氧化碳和二氧化碳.
(1)木炭和一氧化碳虽然是两种完全不同的物质,但它们的化学性质有很多相似之处,例如:它们都能与 反应,请写出一氧化碳与其反应的化学方程式 .
(2)一氧化碳和二氧化碳化学性质不同是因为 ,请写出可以鉴别它们的化学方程式 (写出一个即可).
16.在N2、H2、O2、CO2和空气中,能在空气中燃烧的气体是 ;能使带火星的木条复燃的是 ;空气中含量最多的是 ;能使澄清石灰水变浑浊的是 ;含有氧分子的是 。
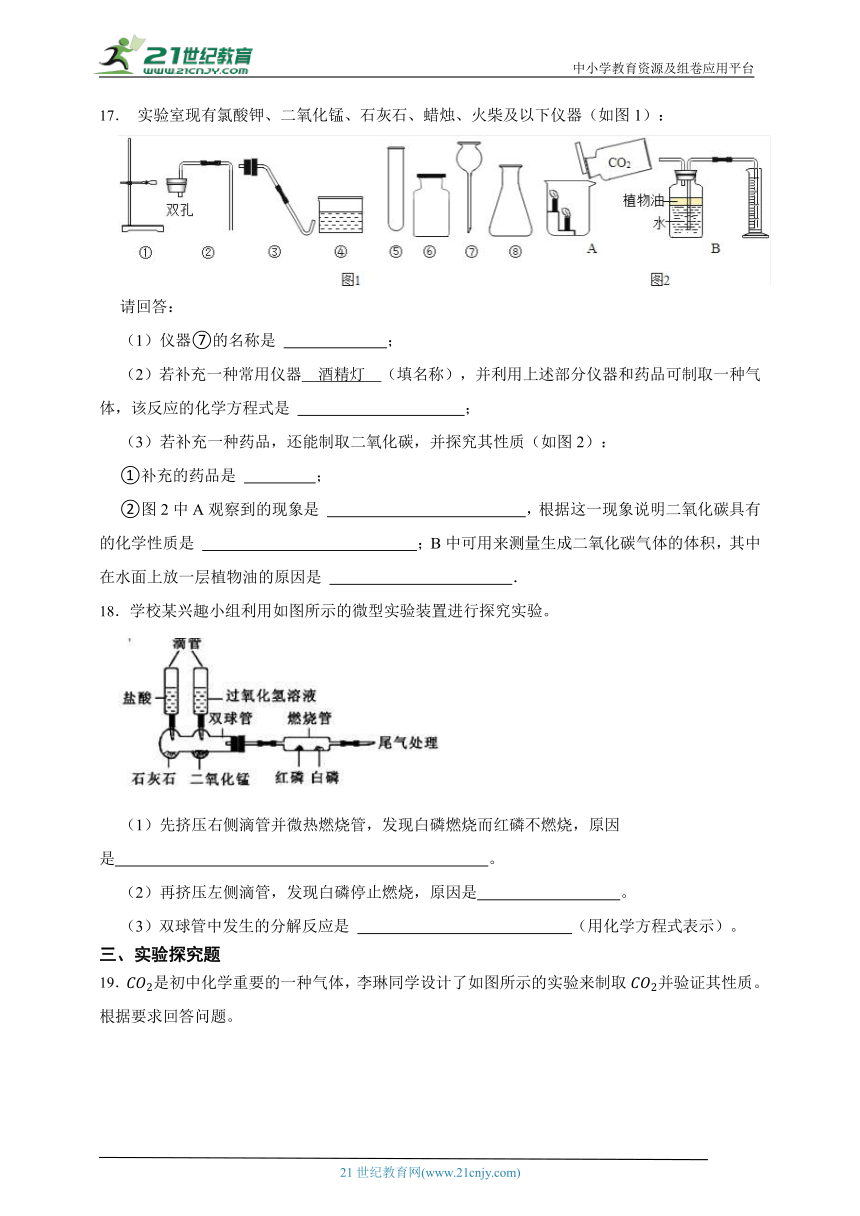
17. 实验室现有氯酸钾、二氧化锰、石灰石、蜡烛、火柴及以下仪器(如图1):
请回答:
(1)仪器⑦的名称是 ;
(2)若补充一种常用仪器 酒精灯 (填名称),并利用上述部分仪器和药品可制取一种气体,该反应的化学方程式是 ;
(3)若补充一种药品,还能制取二氧化碳,并探究其性质(如图2):
①补充的药品是 ;
②图2中A观察到的现象是 ,根据这一现象说明二氧化碳具有的化学性质是 ;B中可用来测量生成二氧化碳气体的体积,其中在水面上放一层植物油的原因是 .
18.学校某兴趣小组利用如图所示的微型实验装置进行探究实验。
(1)先挤压右侧滴管并微热燃烧管,发现白磷燃烧而红磷不燃烧,原因是 。
(2)再挤压左侧滴管,发现白磷停止燃烧,原因是 。
(3)双球管中发生的分解反应是
(用化学方程式表示)。
三、实验探究题
19.是初中化学重要的一种气体,李琳同学设计了如图所示的实验来制取并验证其性质。根据要求回答问题。
(1)指出该装置中一处明显错误是 。
(2)B装置中观察到干石曼纸花变红,分析原因可能是____(填序号)。
A.生成的直接使石蕊纸花变红
B.产生的含有水分,与反应生成了使石蕊纸花变红
(3)已知碳酸钠与少量盐酸可发生如下反应:,甲、乙同学都用溶液来探究反应后装置中剩余溶液的成分。甲同学是一次性全部加入溶液,乙同学是逐滴加入溶液。你觉得 同学操作不合理,其理由是 。
20.如图为实验室制取和收集常见气体的装置示意图。
(1)在装入试剂前如何检查装置①的气密性: 。
(2)做“二氧化碳的制取实验”时在选择装置和药品时有以下考虑,不合理的是____(填序号)。
A.不可选用装置②完成实验,因为装置②中的分液漏斗无法伸入液面以下,无法达到液封的效果
B.若选用装置⑥收集二氧化碳,可得到一瓶干燥的二氧化碳
C.可用稀硫酸与石灰石反应,因为此反应速度适中,且易于收集二氧化碳
(3)最终小金选择装置①和⑤制取二氧化碳气体,检验二氧化碳是否已经收集满的方法是 。
(4)实验室可用装置③加热氯化铵固体和熟石灰[Ca(OH)2]固体混合物的方法制取氨气(NH3),收集氨气的装置只能用④,而不能用⑤或⑥,由此可知氨气的性质是 。
21.实验室常用稀盐酸和石灰石反应制取二氧化碳。
(1)该反应的化学方程式为 。
(2)图甲表示加入药品前的一个操作,其目的是 。
(3)检验生成的气体是二氧化碳的方法是 。
(4)实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,因为生成的微溶物硫酸钙会阻碍反应的进一步进行。某小组经研究,用图乙所示方法成功制得了大量CO2(反应物为稀硫酸和石灰石)。
推测:在稀硫酸中加入氯化铵并对溶液加热的目的都是 。
22.科学课堂上老师演示了如图所示的几个实验:
(1)图甲中蜡烛熄灭的原因是 ;
(2)图乙实验中, (填化学式)使紫色干花(用石落试液浸泡过)变红;
(3)图丙实验中,应观察到的实验现象是____(填序号)。
A.试管内液体上升
B.试管内液体变红
C.试管内的澄清石灰水变浑浊
23.人类发现二氧化碳经历了多个世纪,下列是其过程中的部分资料。
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使燃着的蜡烛熄灭的气体,后来被证实是。
资料二:1754年,布莱克将石灰石煅烧首次制得,并完成了如图甲所示的物质转化研究。
资料三:1766年,卡文迪许通过实验测得,室温下1体积水大约能溶解1体积二氧化碳气体。
(1)根据海尔蒙特的发现,可推测二氧化碳的化学性质是 。
(2)写出布莱克实验中反应③的化学方程式: 。
(3)如图乙,在室温下将容积为的广口瓶注满蒸馏水,通过导管缓慢通入。如果卡文迪许的结论是正确的,则在量筒中收集到的水约为 。
24.研究性学习小组中的小科同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】 在体积相同的盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。 实验装置和现象如图所示。 请你一起参与。
【注:NaOH为氢氧化钠, Ca(OH)2 为氢氧化钙】
【现象结论】 甲装置中产生的实验现象为 ,解释通常用石灰水而不用NaOH 溶液检验CO2的原因是 ;乙装置中的实验现象是 ,吸收CO2较多的装置是 (填“甲”或“乙”)。
【计算验证】 另一位同学小甬通过计算发现,等质量的 Ca(OH)2 和NaOH 吸收CO2的质量, Ca(OH)2 大于 NaOH。因此,他认为通常吸收CO2应该用饱和石灰水。
【思考评价】 请你对小甬同学的结论进行评价: 。
25.如图是研究二氧化碳性质的实验,②③为湿润的紫色石蕊试纸,①为干燥的紫色石蕊试纸,请回答下列问题。
(1)为了防止气体从长颈漏斗逸出,A稀盐酸中加入稀盐酸至 。
(2)B中能说明CO 的密度比空气大的实验现象是 ,可证明CO 与水反应的现象是 。
(3)C中观察到蜡烛自下而上熄灭,说明CO 具有的物理性质是 。
26. 如图是实验室制取气体的常用装置,请回答下列问题:
(1)写出带有标号的仪器名称① ,② .
(2)写出一个实验室制取氧气的化学方程式 ,用该方法制取氧气所选择的发生装置是 .若用排水法收集氧气,判断气瓶内氧气已收集满的依据是 .
(3)实验室制取二氧化碳,可选择发生装置为 .若要收集一瓶纯净、干燥的二氧化碳气体,请按照气流从左到右的方向,用仪器接口字母表示连接顺序.
发生装置端口→ ( )→( )→( )→( )→( ) .
(4)检验二氧化碳气体的方法是 .(用化学方程式表示)
27.CO2可以像倒水那样使阶梯蜡烛自下而上熄灭(如图甲),小明将一个小玻璃罩罩在两支点燃的蜡烛上(如图乙),却发现高处烛焰先熄灭。为了探究玻璃罩中烛焰熄灭顺序不同的原因,小明进行了如图丙、丁的实验。
实验一:将6个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图丙),分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如表。
容器编号 1 2 3 4 5 6
平均时间/秒 3.2 3.8 5.0 7.1 11.1 19.0
实验二:将3支温度计分别挂在小玻璃罩内不同位置(如图丁),点燃蜡烛,一段时间后发现温度计②示数明显增大,温度计①③示数增大不明显。
(1)图甲中CO2可以像倒水那样倒入大烧杯中,是因为二氧化碳密度比空气 (选填“大”或“小”)。
(2)根据实验一的结果,推测小玻璃罩内二氧化碳浓度较高的部位是 (选填“下部”、“中部”或“上部”)。容器内石灰水变浑浊的文字表达式为 。
(3)实验二探究的问题是蜡烛燃烧对小钟罩内不同位置 的影响。
(4)结合本次实验的研究结果,小明对乙实验中高处蜡烛先熄灭的原因做如下解释,合理的排序是 (填字母)。
A.二氧化碳在高处聚集,使高处氧气的浓度下降
B.蜡烛燃烧产生的热量使热的二氧化碳上升
C.蜡烛燃烧产生二氧化碳
D.高处氧气浓度低于低处氧气的浓度
E.高处蜡烛先熄灭
四、解答题
28.某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为20.0g)。
烧杯+盐酸 大理石 充分反应后烧杯+剩余物
甲 75.0g 25.0g 95.6g
乙 75.0g 30.0g 100.6g
丙 95.0g 25.0g 115.6g
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数.
29.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。如图甲是制取并检验CO2的装置,图乙是对图甲实验装置微型化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 (填字母)仪器相同。
(2)实验过程中,乙装置W型玻璃管中产生现象是 。
(3)某同学用图甲装置进行实验,锥形瓶B中石灰石的质量随加入稀盐酸质量的变化情况如图所示。求:
①最多产生CO2气体的质量;
②所加入稀盐酸的溶质质量分数。
30.为确定影响化学反应速度快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品(样品中杂质不与稀盐酸反应)各6克,分别与足量的、溶质质量分数相同的稀盐酸反应,实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量。记录的前18分钟的数据如下表:
时间(分) 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2的质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2的质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察图中哪一现象可判断反应结束? 。
(2)结合表格分析,6克块状大理石与稀盐酸反应最多能生成多少克二氧化碳? ;简要说明判断的理由: 。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】D
4.【答案】D
5.【答案】B
6.【答案】D
7.【答案】D
8.【答案】A
9.【答案】A
10.【答案】D
11.【答案】C
12.【答案】A
13.【答案】二氧化碳;bc;2CH3OH+3O22CO2+4H2O;CO2+Ca(OH)2═CaCO3↓+H2O
14.【答案】O2;CO2+Ca(OH)2=CaCO3↓+H2O;试管内液面上升,澄清石灰水变浑浊
15.【答案】(1)氧气;2CO+O2点燃2CO2;
(2)分子结构不同;CO2+Ca(OH)2=CaCO3↓+H2O.
16.【答案】H2;O2;N2;CO2;O2、空气
17.【答案】长颈漏斗;2KClO32KCl+3O2↑;稀盐酸;蜡烛自下而上依次熄灭;不能燃烧、也不支持燃烧;防止二氧化碳溶于水
18.【答案】(1)温度达到白磷的着火点,没有达到红磷的着火点
(2)CO2不支持燃烧
(3) +
19.【答案】(1)长颈漏斗未伸入液面以下
(2)B
(3)甲;无法验证剩余溶液的成分中是否含有少量
20.【答案】(1)关闭弹簧夹,然后向长颈漏斗内注水,若长颈漏斗内能形成一段稳定的水柱,说明装置的气密性良好
(2)A;B;C
(3)将一根燃着的木条放在集气瓶口,若木条熄灭,则证明二氧化碳已收集满
(4)密度比空气小,易溶于水
21.【答案】(1)
(2)检查装置气密性
(3)将生成的气体通入澄清石灰水中,若溶液变浑浊,则证明是二氧化碳
(4)增大硫酸钙在溶液中的溶解能力
22.【答案】(1))瓶内氧气被耗尽
(2)
(3)A;C
23.【答案】(1)不燃烧也不支持燃烧
(2)
(3)100
24.【答案】气球体积增大,溶液变浑浊;二氧化碳与石灰水作用有明显的实验现象,与氢氧化钠溶液作用无明显现象;气球体积增大;乙;不正确,因为氢氧化钙的溶解度很小,形成的饱和石灰水中溶质的质量分数很小
25.【答案】(1)没过长颈漏斗的下端
(2)②处紫色石蕊试纸比③处先变红;②③处湿润的紫色石蕊试纸变红,①处不变红
(3)密度比空气大
26.【答案】(1)长颈漏斗 ;集气瓶
(2)2KClO32KCl+3O2↑(或2KMnO4K2MnO4+MnO2+O2↑);B;集气瓶口有较大气泡向外冒出
(3)A;g;f;e;d;a
(4)CO2+Ca(OH)2=CaCO3↓+H2O
27.【答案】(1)大
(2)上部;氢氧化钙+二氧化碳→碳酸钙+水
(3)受热情况
(4)CBADE
28.【答案】(1)甲
(2)解:设参加反应的大理石的质量为x
生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
= x=10g
CaCO3%=40%
29.【答案】(1)A
(2)石灰石表面有气泡产生,澄清石灰水变浑浊
(3)解:①由图可知,参加反应的碳酸钙质量=15g-5g=10g,
设10g碳酸钙完全反应生成二氧化碳的质量为x,参加反应盐酸的质量为y
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
100 73 44
10g y x
x=4.4 g
y=7.3g
最多产生CO2气体的质量为4.4g。
②所加入稀盐酸的溶质质量分数为:
30.【答案】(1)容器内不再产生气泡(或电子天平的示数不再变化)
(2)2.40克;查表可知,大理石碎屑完全反应生成2.40克CO2,而块状大理石与其质量、成分都相同,所以完全反应后也能生成2.40克CO2
(3)解:18分钟时块状大理石生成CO2的质量为2.2克。设此时块状大理石中发生反应的CaCO3质量为x。
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2克
,
x=5克。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
浙教版初二科学4.4二氧化碳讲义
一、单选题
1.证明碳酸饮料中含有气体,最合理的做法是( )
A.将燃着的木条伸进碳酸饮料中,观察是否熄灭
B.用手在瓶口轻轻扇动,闻有无刺激性气味
C.振荡碳酸饮料瓶,观察瓶子是否变扁
D.振荡碳酸饮料瓶,将喷出的气体通入澄清石灰水,观察是否变浑浊
2.通常证明集气瓶中气体是二氧化碳的正确方法是( )
A.把带火星的木条放在装满气体的集气瓶中
B.把燃着的木条迅速插入装满气体的集气瓶中
C.通入澄清石灰水中
D.通入石蕊试液中
3.下列操作中只发生物理变化的是( )
A.将二氧化碳通入水中
B.将二氧化碳通入澄清石灰水中
C.将二氧化碳倾倒入盛有燃着蜡烛的烧杯中
D.将二氧化碳加压降温压缩成干冰
4.把干燥的蓝色石蕊试纸放在中,蓝色石蕊试纸不变色。将通入滴有紫色石蕊试液的水中,溶液变红色,将该溶液敞口加热一段时间,发现溶液的红色裉去,冷却到原温度后,再次通入,溶液又变红色。上述实验现象不能说明的是( )
A.能和水发生化学反应
B.的水溶液具有酸性
C.加热能使二氧化碳水溶液的酸性减弱
D.具有酸性
5.节能减排、低碳出行是我们倡导的生活方式.下列有关碳及其氧化物的说法中正确的是()
A.焦炭、一氧化碳、二氧化碳都具有还原性
B.二氧化碳和一氧化碳的组成元素相同,在一定条件下可以互相转化
C.二氧化碳通过紫色石蕊溶液,溶液变为红色,说明二氧化碳具有酸性
D.金刚石、石墨和C60都是由碳元素组成的单质,性质相同
6.下图所示的有关二氧化碳性质的实验中,只能证明二氧化碳的物理性质的是( )
A. B.
C. D.
7.下列是某兴趣小组制取二氧化碳,收集并检验该气体的有关实验操作,其中错误的是( )
A.图甲中推动注射器活塞时,长颈漏斗下端液面上升,说明气密性良好
B.图乙中长颈漏斗下端要伸入液面以下,是为了防止气体逸出
C.图丙装置中植物油的作用是防止二氧化碳气体溶于水
D.图丁中为了检验二氧化碳气体,滴入的试剂为氢氧化钠溶液
8.点燃两支长度不同的蜡烛,将其固定在桌面上,如图所示,如果用玻璃杯将两支蜡烛罩在里面,两支蜡烛最先熄灭的是( )
A.长的先熄灭 B.短的先熄灭 C.同时熄灭 D.无法判断
9.下列实验利用如图装置,可以进行的是( )
①用过氧化氢溶液与MnO2制氧气;
②用KMnO4固体制氧气;
③用KClO3与MnO2的混合物制氧气;
④用石灰石与稀盐酸制二氧化碳。
A.①④ B.①② C.②③ D.③④
10.如图所示,在一个盛有澄清石灰水的容器中有一支燃着的蜡烛,现用一只杯子将蜡烛罩住,猜想一下,杯子内会有什么现象发生( )
A.蜡烛燃烧不变,液面不变 B.火焰逐渐熄灭,液面下降
C.蜡烛燃烧更旺,液面上升 D.火焰逐渐熄灭,液面上升
11. 如图所示,若关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀打开Ⅱ阀,紫色小花不变红,则甲瓶中所盛的试剂可能是( )
①浓H2SO4,②浓NaOH溶液,③饱和NaCl溶液.
A.只有① B.只有② C.①② D.①②③
12.某兴趣小组利用如图装置对二氧化碳的性质进行探究,下列说法错误的是( )
A.B处现象说明二氧化碳能使紫色石蕊试液变红
B.C处溶液变浑浊,是因为生成了不溶于水的碳酸钙
C.D处的实验现象是下层蜡烛先熄灭,上层蜡烛后熄灭
D.D处现象说明二氧化碳不可燃,不助燃,密度比空气大
二、填空题
13. “低碳”是全世界的主题,以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福.
根据上述流程回答下列问题:
(1)上述流程中可循环利用的物质是 .
(2)除去机动车尾气中一氧化碳,下列方法中不正确的是 .
a.把混合气体通过灼热的氧化铜
b.把混合气体点燃
c.把混合气体倾倒到另一个容器中
(3)甲醇(CH3OH)燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,写出反应的化学方程式 ,如何证明燃烧产物中含有二氧化碳,你设计的实验方法是 (用化学方程式表示).
14.如图所示,将装满二氧化碳、氧气的试管倒置于盛有澄清石灰水的水槽中,则最后在试管内收集到的气体是 。试管内发生反应的化学方程式是 ,试管内还可观察到的现象是 。
15.木炭燃烧时能产生一氧化碳和二氧化碳.
(1)木炭和一氧化碳虽然是两种完全不同的物质,但它们的化学性质有很多相似之处,例如:它们都能与 反应,请写出一氧化碳与其反应的化学方程式 .
(2)一氧化碳和二氧化碳化学性质不同是因为 ,请写出可以鉴别它们的化学方程式 (写出一个即可).
16.在N2、H2、O2、CO2和空气中,能在空气中燃烧的气体是 ;能使带火星的木条复燃的是 ;空气中含量最多的是 ;能使澄清石灰水变浑浊的是 ;含有氧分子的是 。
17. 实验室现有氯酸钾、二氧化锰、石灰石、蜡烛、火柴及以下仪器(如图1):
请回答:
(1)仪器⑦的名称是 ;
(2)若补充一种常用仪器 酒精灯 (填名称),并利用上述部分仪器和药品可制取一种气体,该反应的化学方程式是 ;
(3)若补充一种药品,还能制取二氧化碳,并探究其性质(如图2):
①补充的药品是 ;
②图2中A观察到的现象是 ,根据这一现象说明二氧化碳具有的化学性质是 ;B中可用来测量生成二氧化碳气体的体积,其中在水面上放一层植物油的原因是 .
18.学校某兴趣小组利用如图所示的微型实验装置进行探究实验。
(1)先挤压右侧滴管并微热燃烧管,发现白磷燃烧而红磷不燃烧,原因是 。
(2)再挤压左侧滴管,发现白磷停止燃烧,原因是 。
(3)双球管中发生的分解反应是
(用化学方程式表示)。
三、实验探究题
19.是初中化学重要的一种气体,李琳同学设计了如图所示的实验来制取并验证其性质。根据要求回答问题。
(1)指出该装置中一处明显错误是 。
(2)B装置中观察到干石曼纸花变红,分析原因可能是____(填序号)。
A.生成的直接使石蕊纸花变红
B.产生的含有水分,与反应生成了使石蕊纸花变红
(3)已知碳酸钠与少量盐酸可发生如下反应:,甲、乙同学都用溶液来探究反应后装置中剩余溶液的成分。甲同学是一次性全部加入溶液,乙同学是逐滴加入溶液。你觉得 同学操作不合理,其理由是 。
20.如图为实验室制取和收集常见气体的装置示意图。
(1)在装入试剂前如何检查装置①的气密性: 。
(2)做“二氧化碳的制取实验”时在选择装置和药品时有以下考虑,不合理的是____(填序号)。
A.不可选用装置②完成实验,因为装置②中的分液漏斗无法伸入液面以下,无法达到液封的效果
B.若选用装置⑥收集二氧化碳,可得到一瓶干燥的二氧化碳
C.可用稀硫酸与石灰石反应,因为此反应速度适中,且易于收集二氧化碳
(3)最终小金选择装置①和⑤制取二氧化碳气体,检验二氧化碳是否已经收集满的方法是 。
(4)实验室可用装置③加热氯化铵固体和熟石灰[Ca(OH)2]固体混合物的方法制取氨气(NH3),收集氨气的装置只能用④,而不能用⑤或⑥,由此可知氨气的性质是 。
21.实验室常用稀盐酸和石灰石反应制取二氧化碳。
(1)该反应的化学方程式为 。
(2)图甲表示加入药品前的一个操作,其目的是 。
(3)检验生成的气体是二氧化碳的方法是 。
(4)实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,因为生成的微溶物硫酸钙会阻碍反应的进一步进行。某小组经研究,用图乙所示方法成功制得了大量CO2(反应物为稀硫酸和石灰石)。
推测:在稀硫酸中加入氯化铵并对溶液加热的目的都是 。
22.科学课堂上老师演示了如图所示的几个实验:
(1)图甲中蜡烛熄灭的原因是 ;
(2)图乙实验中, (填化学式)使紫色干花(用石落试液浸泡过)变红;
(3)图丙实验中,应观察到的实验现象是____(填序号)。
A.试管内液体上升
B.试管内液体变红
C.试管内的澄清石灰水变浑浊
23.人类发现二氧化碳经历了多个世纪,下列是其过程中的部分资料。
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使燃着的蜡烛熄灭的气体,后来被证实是。
资料二:1754年,布莱克将石灰石煅烧首次制得,并完成了如图甲所示的物质转化研究。
资料三:1766年,卡文迪许通过实验测得,室温下1体积水大约能溶解1体积二氧化碳气体。
(1)根据海尔蒙特的发现,可推测二氧化碳的化学性质是 。
(2)写出布莱克实验中反应③的化学方程式: 。
(3)如图乙,在室温下将容积为的广口瓶注满蒸馏水,通过导管缓慢通入。如果卡文迪许的结论是正确的,则在量筒中收集到的水约为 。
24.研究性学习小组中的小科同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】 在体积相同的盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。 实验装置和现象如图所示。 请你一起参与。
【注:NaOH为氢氧化钠, Ca(OH)2 为氢氧化钙】
【现象结论】 甲装置中产生的实验现象为 ,解释通常用石灰水而不用NaOH 溶液检验CO2的原因是 ;乙装置中的实验现象是 ,吸收CO2较多的装置是 (填“甲”或“乙”)。
【计算验证】 另一位同学小甬通过计算发现,等质量的 Ca(OH)2 和NaOH 吸收CO2的质量, Ca(OH)2 大于 NaOH。因此,他认为通常吸收CO2应该用饱和石灰水。
【思考评价】 请你对小甬同学的结论进行评价: 。
25.如图是研究二氧化碳性质的实验,②③为湿润的紫色石蕊试纸,①为干燥的紫色石蕊试纸,请回答下列问题。
(1)为了防止气体从长颈漏斗逸出,A稀盐酸中加入稀盐酸至 。
(2)B中能说明CO 的密度比空气大的实验现象是 ,可证明CO 与水反应的现象是 。
(3)C中观察到蜡烛自下而上熄灭,说明CO 具有的物理性质是 。
26. 如图是实验室制取气体的常用装置,请回答下列问题:
(1)写出带有标号的仪器名称① ,② .
(2)写出一个实验室制取氧气的化学方程式 ,用该方法制取氧气所选择的发生装置是 .若用排水法收集氧气,判断气瓶内氧气已收集满的依据是 .
(3)实验室制取二氧化碳,可选择发生装置为 .若要收集一瓶纯净、干燥的二氧化碳气体,请按照气流从左到右的方向,用仪器接口字母表示连接顺序.
发生装置端口→ ( )→( )→( )→( )→( ) .
(4)检验二氧化碳气体的方法是 .(用化学方程式表示)
27.CO2可以像倒水那样使阶梯蜡烛自下而上熄灭(如图甲),小明将一个小玻璃罩罩在两支点燃的蜡烛上(如图乙),却发现高处烛焰先熄灭。为了探究玻璃罩中烛焰熄灭顺序不同的原因,小明进行了如图丙、丁的实验。
实验一:将6个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图丙),分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如表。
容器编号 1 2 3 4 5 6
平均时间/秒 3.2 3.8 5.0 7.1 11.1 19.0
实验二:将3支温度计分别挂在小玻璃罩内不同位置(如图丁),点燃蜡烛,一段时间后发现温度计②示数明显增大,温度计①③示数增大不明显。
(1)图甲中CO2可以像倒水那样倒入大烧杯中,是因为二氧化碳密度比空气 (选填“大”或“小”)。
(2)根据实验一的结果,推测小玻璃罩内二氧化碳浓度较高的部位是 (选填“下部”、“中部”或“上部”)。容器内石灰水变浑浊的文字表达式为 。
(3)实验二探究的问题是蜡烛燃烧对小钟罩内不同位置 的影响。
(4)结合本次实验的研究结果,小明对乙实验中高处蜡烛先熄灭的原因做如下解释,合理的排序是 (填字母)。
A.二氧化碳在高处聚集,使高处氧气的浓度下降
B.蜡烛燃烧产生的热量使热的二氧化碳上升
C.蜡烛燃烧产生二氧化碳
D.高处氧气浓度低于低处氧气的浓度
E.高处蜡烛先熄灭
四、解答题
28.某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为20.0g)。
烧杯+盐酸 大理石 充分反应后烧杯+剩余物
甲 75.0g 25.0g 95.6g
乙 75.0g 30.0g 100.6g
丙 95.0g 25.0g 115.6g
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数.
29.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。如图甲是制取并检验CO2的装置,图乙是对图甲实验装置微型化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 (填字母)仪器相同。
(2)实验过程中,乙装置W型玻璃管中产生现象是 。
(3)某同学用图甲装置进行实验,锥形瓶B中石灰石的质量随加入稀盐酸质量的变化情况如图所示。求:
①最多产生CO2气体的质量;
②所加入稀盐酸的溶质质量分数。
30.为确定影响化学反应速度快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品(样品中杂质不与稀盐酸反应)各6克,分别与足量的、溶质质量分数相同的稀盐酸反应,实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量。记录的前18分钟的数据如下表:
时间(分) 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2的质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2的质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察图中哪一现象可判断反应结束? 。
(2)结合表格分析,6克块状大理石与稀盐酸反应最多能生成多少克二氧化碳? ;简要说明判断的理由: 。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】D
4.【答案】D
5.【答案】B
6.【答案】D
7.【答案】D
8.【答案】A
9.【答案】A
10.【答案】D
11.【答案】C
12.【答案】A
13.【答案】二氧化碳;bc;2CH3OH+3O22CO2+4H2O;CO2+Ca(OH)2═CaCO3↓+H2O
14.【答案】O2;CO2+Ca(OH)2=CaCO3↓+H2O;试管内液面上升,澄清石灰水变浑浊
15.【答案】(1)氧气;2CO+O2点燃2CO2;
(2)分子结构不同;CO2+Ca(OH)2=CaCO3↓+H2O.
16.【答案】H2;O2;N2;CO2;O2、空气
17.【答案】长颈漏斗;2KClO32KCl+3O2↑;稀盐酸;蜡烛自下而上依次熄灭;不能燃烧、也不支持燃烧;防止二氧化碳溶于水
18.【答案】(1)温度达到白磷的着火点,没有达到红磷的着火点
(2)CO2不支持燃烧
(3) +
19.【答案】(1)长颈漏斗未伸入液面以下
(2)B
(3)甲;无法验证剩余溶液的成分中是否含有少量
20.【答案】(1)关闭弹簧夹,然后向长颈漏斗内注水,若长颈漏斗内能形成一段稳定的水柱,说明装置的气密性良好
(2)A;B;C
(3)将一根燃着的木条放在集气瓶口,若木条熄灭,则证明二氧化碳已收集满
(4)密度比空气小,易溶于水
21.【答案】(1)
(2)检查装置气密性
(3)将生成的气体通入澄清石灰水中,若溶液变浑浊,则证明是二氧化碳
(4)增大硫酸钙在溶液中的溶解能力
22.【答案】(1))瓶内氧气被耗尽
(2)
(3)A;C
23.【答案】(1)不燃烧也不支持燃烧
(2)
(3)100
24.【答案】气球体积增大,溶液变浑浊;二氧化碳与石灰水作用有明显的实验现象,与氢氧化钠溶液作用无明显现象;气球体积增大;乙;不正确,因为氢氧化钙的溶解度很小,形成的饱和石灰水中溶质的质量分数很小
25.【答案】(1)没过长颈漏斗的下端
(2)②处紫色石蕊试纸比③处先变红;②③处湿润的紫色石蕊试纸变红,①处不变红
(3)密度比空气大
26.【答案】(1)长颈漏斗 ;集气瓶
(2)2KClO32KCl+3O2↑(或2KMnO4K2MnO4+MnO2+O2↑);B;集气瓶口有较大气泡向外冒出
(3)A;g;f;e;d;a
(4)CO2+Ca(OH)2=CaCO3↓+H2O
27.【答案】(1)大
(2)上部;氢氧化钙+二氧化碳→碳酸钙+水
(3)受热情况
(4)CBADE
28.【答案】(1)甲
(2)解:设参加反应的大理石的质量为x
生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
= x=10g
CaCO3%=40%
29.【答案】(1)A
(2)石灰石表面有气泡产生,澄清石灰水变浑浊
(3)解:①由图可知,参加反应的碳酸钙质量=15g-5g=10g,
设10g碳酸钙完全反应生成二氧化碳的质量为x,参加反应盐酸的质量为y
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
100 73 44
10g y x
x=4.4 g
y=7.3g
最多产生CO2气体的质量为4.4g。
②所加入稀盐酸的溶质质量分数为:
30.【答案】(1)容器内不再产生气泡(或电子天平的示数不再变化)
(2)2.40克;查表可知,大理石碎屑完全反应生成2.40克CO2,而块状大理石与其质量、成分都相同,所以完全反应后也能生成2.40克CO2
(3)解:18分钟时块状大理石生成CO2的质量为2.2克。设此时块状大理石中发生反应的CaCO3质量为x。
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2克
,
x=5克。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
