八下科学第二章微粒的模型与符号期末综合提高卷(含解析)
文档属性
| 名称 | 八下科学第二章微粒的模型与符号期末综合提高卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 260.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-06-13 12:19:51 | ||
图片预览



文档简介
八下科学第二章微粒的模型与符号期末综合提高卷
一、选择题(每小题2分,共40分)
1.下列不属于模型的是( )
A.原子结构B.节水标志C.甲烷分子结构 D.足球烯结构
2.药品“甲磺酸伊马替尼片”用于治疗慢性粒细胞白血病和恶性胃肠道间质肿瘤。甲磺酸伊马替尼的化学式为,下列关于甲磺酸伊马替尼的说法正确的是( )。
A.甲磺酸伊马替尼由8种元素组成B.甲磺酸伊马替尼由77个原子构成
C.甲磺酸伊马替尼中碳、氢、氧元素的质量比为30:35:4D.甲磺酸伊马替尼的相对分子质量是589
3.如下图是元素周期表的部分示意图,下列说法正确的是( )
A.它们都属于金属元素 B.C 元素的核电荷数为9
C.Al的相对原子质量是 26.98g D.13 号元素的离子符号是 A13+
4.推理是一种重要的科学思维方法。以下推理结果正确的是
A.分子是构成物质的微粒,因此物质一定都是由分子构成的
B.单质只含一种元素,因此含一种元素的物质一定是单质
C.质子数决定元素种类,因此同种元素质子数一定相同
D.化合物是由不同种元素组成的纯净物,因此不同种元素组成的物质一定是化合物
5. 由C2H2和C2H4O组成的混合气体中,经测定其中碳元素的质量分数为72%,则混合物中氧元素的质量分数为( )
A.32% B.22.65% C.19.56% D.2.14%
6.经实验证明,涂改液中含有很多挥发性有害物质,人吸入后易引起慢性中毒而产生头晕、头痛等症状,严重时会抽搐和呼吸困难。二氯甲烷()就是其中一种有害物质。下列关于二氯甲烷的叙述,其中正确的是( )。
①它是由碳、氢、氯3种元素组成的化合物 ②它是由氯气和甲烷组成的混合物 ③分子中碳、氢、氯元素的原子个数比是1:2:2 ④它是由多种原子直接构成的一种化合物
A.①③ B.①④ C.②③ D.②④
7.足球烯是一种超导物质,其化学式为。关于该物质有以下说法:①它是一种单质,②它是一种化合物,③它的一个分子中含有60个碳原子,④它的分子质量为12克,⑤它的相对分子质量为720。其中正确的是( )。
A.①④ B.②③ C.①③⑤ D.②③⑤
8.百合具有润肺止咳、养颜美容等功效,百合中含有秋水仙碱,其化学式为C22H25NO6,下列说法中正确的是( )
A.秋水仙碱由碳、氢、氧三种元素组成
B.一个秋水仙碱分子由22个碳原子、25个氢原子、1个氮原子和3个氧分子构成
C.秋水仙碱分子中碳、氢、氮、氧原子个数比为22:25:1:6
D.秋水仙碱中氢元素的质量分数最大
9.科学家们利用“O标记法探究光合作用,实验中分别将原料、和、提供给两组植物,来明确光合作用产物中氧元素的来源。其中原料中一个中含有的质子个数为
A.16 B.22 C.26 D.48
10.已知某原子的核电荷数为15,原子核中有16个中子,则该原子的相对原子质量约为( )。
A.15 B.16 C.46 D.31
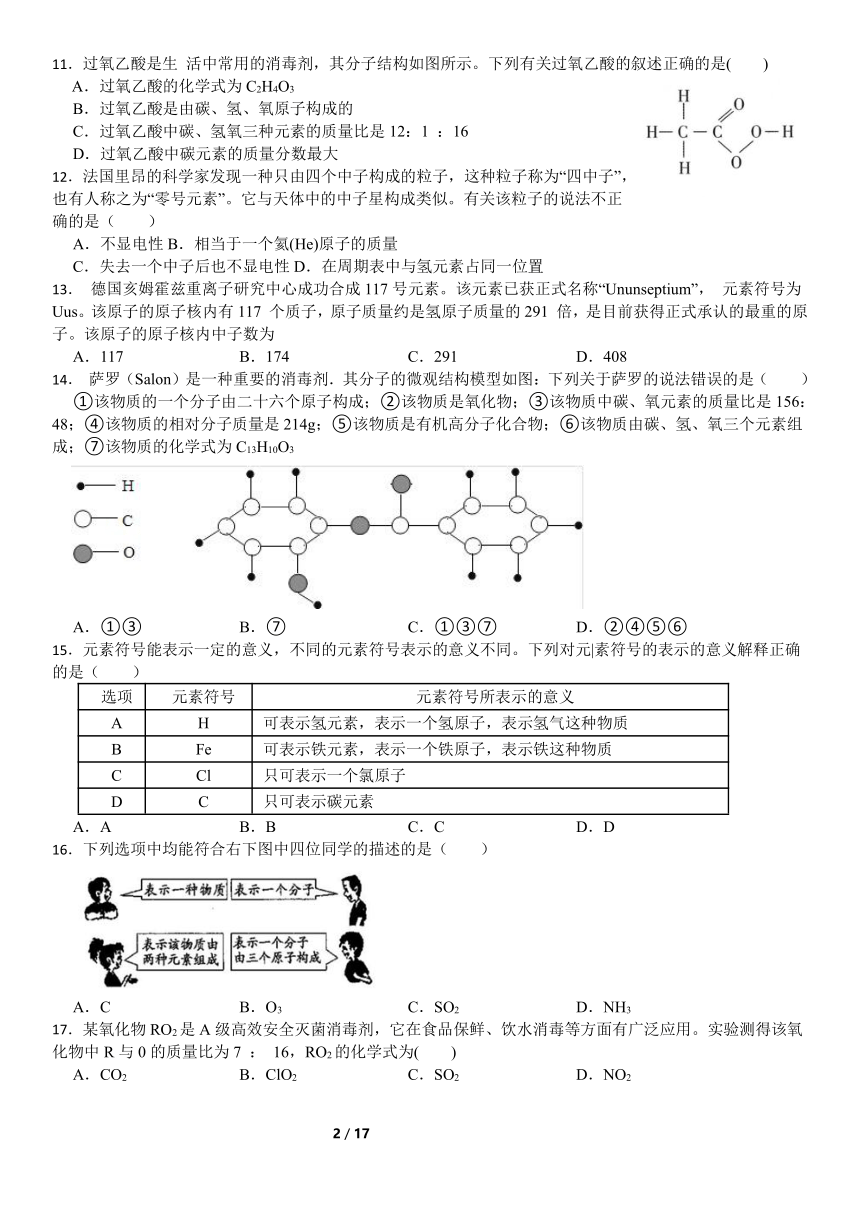
11.过氧乙酸是生 活中常用的消毒剂,其分子结构如图所示。下列有关过氧乙酸的叙述正确的是( )
A.过氧乙酸的化学式为C2H4O3
B.过氧乙酸是由碳、氢、氧原子构成的
C.过氧乙酸中碳、氢氧三种元素的质量比是12:1 :16
D.过氧乙酸中碳元素的质量分数最大
12.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性B.相当于一个氦(He)原子的质量
C.失去一个中子后也不显电性D.在周期表中与氢元素占同一位置
13. 德国亥姆霍兹重离子研究中心成功合成117号元素。该元素已获正式名称“Ununseptium”, 元素符号为Uus。该原子的原子核内有117 个质子,原子质量约是氢原子质量的291 倍,是目前获得正式承认的最重的原子。该原子的原子核内中子数为
A.117 B.174 C.291 D.408
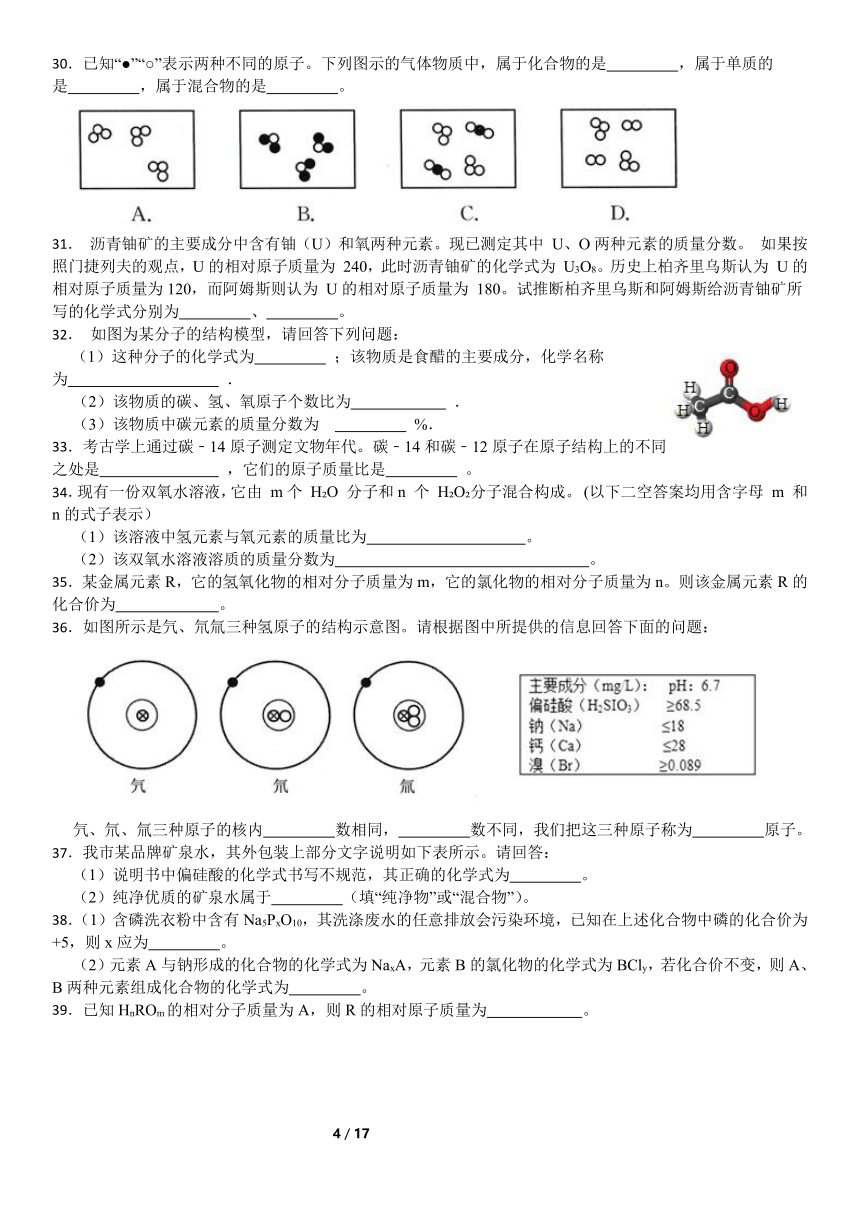
14. 萨罗(Salon)是一种重要的消毒剂.其分子的微观结构模型如图:下列关于萨罗的说法错误的是( )
①该物质的一个分子由二十六个原子构成;②该物质是氧化物;③该物质中碳、氧元素的质量比是156:48;④该物质的相对分子质量是214g;⑤该物质是有机高分子化合物;⑥该物质由碳、氢、氧三个元素组成;⑦该物质的化学式为C13H10O3
A.①③ B.⑦ C.①③⑦ D.②④⑤⑥
15.元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元|素符号的表示的意义解释正确的是( )
选项 元素符号 元素符号所表示的意义
A H 可表示氢元素,表示一个氢原子,表示氢气这种物质
B Fe 可表示铁元素,表示一个铁原子,表示铁这种物质
C Cl 只可表示一个氯原子
D C 只可表示碳元素
A.A B.B C.C D.D
16.下列选项中均能符合右下图中四位同学的描述的是( )
A.C B.O3 C.SO2 D.NH3
17.某氧化物RO2是A级高效安全灭菌消毒剂,它在食品保鲜、饮水消毒等方面有广泛应用。实验测得该氧化物中R与0的质量比为7 : 16,RO2的化学式为( )
A.CO2 B.ClO2 C.SO2 D.NO2
18.某元素的化合价是奇数价,其氧化物的相对分子质量为a,价态相同的硫酸盐相对分子质量为b,则此元素的化合价可能是( )
A. B. C. D.
19.在一定的条件下,向一密闭的容器内加入A,B,C,D四种物质各20g,充分反应后,测定其质量,得到数据如表:
物 质 A B C D
反应前质量(g) 20 20 20 20
反应后质量(g) 20 30 未知 14
下列说法不正确的是( )
A.其化学方程式为:2C+3D=5B B.物质A可能是该反应的催化剂
C.容器内发生了化合反应 D.反应后容器内C的质量为16g
20.某化合物的化学式为HnXO2n-1,则元素X的化合价可能是( )
A.+(2n+2) B.+(3n+2) C.+(3n-2) D.+(2n-1)
21.要比较CuSO4、FeSO4、CaSO4相对分子质量的大小,最简单的方法是( )
A.分别计算它们的相对分子质量B.计算所含的质量分数
C.比较Cu、Fe、Ca三种原子的相对原子质量D.计算所含金属元素的质量分数
22.Fe2O3+3CO高温3CO2+2Fe中,反应前后化合价发生变化的元素()
A.只有Fe B.只有Fe和C C.只有C和O D.Fe、C和O
23.在NaHS、NaHSO4和MgSO4组成的混合物中,测得其中S元素的质量分数为4X%,则该混合物中氧元素的质量分数( )
A.(100-4X)%B.(100-5X)%C.(100-6X)% D.(100-7X)%
24.有一A、B两种元素组成的化合物中,A、B两元素的质量比为3:8,A、B两元素的相对原子质量比3:4,则该化合物的化学式可表示为( )
A.AB B.AB2 C.A2B3 D.A2B
25.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )
A.x+y B.x+n-y C.x-n+y D.x+y+n
二、填空题(每空1分,共 39 分)
26.甲醇是一种无色、有特殊香味、易挥发的液体,可用于制造甲醛和农药等。已知甲醇由碳、氢、氧三种元素组成,其中氢元素的质量分数为12.5%,氧元素的质量分数为50%;一个甲醇分子中含有4个氢原子。则甲醇的相对分子质量是 ;一个甲醇分子中含氧原子的个数是 。
27.请用恰当的化学用语表示下列划线部分:
(1)石灰岩中含有钙元素: 。
(2)硫酸钙中含有的阴离子: 。
(3)岩石呈红色是含氢氧化铁所致,氢氧化铁元素显+3价: 。
28.作为相对原子质量标准的碳C—12可以写成 2C.一个 2C的原子的质量为a千克,一 个 2CO2分子的质量为b千克,若以 2CO2分子中的1个氧原子质量的1/16作为相对原子质量的标准,则 2CO的相对分子质量是 (假设 CO和CO2 两种分子中氧原子具有相同的中子数)
29.化学是从微观的角度研究物质的组成结构及其变化的学科,构成物质的粒子之间关系如图所示。据图回答下列问题:
(1)甲是 。
(2)在水、汞和氯化钠三种物质中,由离子构成的物质是 。保持水的化学性质的最小粒子是 。
(3)从微观来看,化学反应的实质是 。
30.已知“●”“○”表示两种不同的原子。下列图示的气体物质中,属于化合物的是 ,属于单质的是 ,属于混合物的是 。
31. 沥青铀矿的主要成分中含有铀(U)和氧两种元素。现已测定其中 U、O两种元素的质量分数。 如果按照门捷列夫的观点,U的相对原子质量为 240,此时沥青铀矿的化学式为 U3O8。历史上柏齐里乌斯认为 U的相对原子质量为120,而阿姆斯则认为 U的相对原子质量为 180。试推断柏齐里乌斯和阿姆斯给沥青铀矿所写的化学式分别为 、 。
32. 如图为某分子的结构模型,请回答下列问题:
(1)这种分子的化学式为 ;该物质是食醋的主要成分,化学名称为 .
(2)该物质的碳、氢、氧原子个数比为 .
(3)该物质中碳元素的质量分数为 %.
33.考古学上通过碳﹣14原子测定文物年代。碳﹣14和碳﹣12原子在原子结构上的不同之处是 ,它们的原子质量比是 。
34.现有一份双氧水溶液,它由 m个 H O 分子和n 个 H O 分子混合构成。 (以下二空答案均用含字母 m 和n的式子表示)
(1)该溶液中氢元素与氧元素的质量比为 。
(2)该双氧水溶液溶质的质量分数为 。
35.某金属元素R,它的氢氧化物的相对分子质量为m,它的氯化物的相对分子质量为n。则该金属元素R的化合价为 。
36.如图所示是氕、氘氚三种氢原子的结构示意图。请根据图中所提供的信息回答下面的问题:
氕、氘、氚三种原子的核内 数相同, 数不同,我们把这三种原子称为 原子。
37.我市某品牌矿泉水,其外包装上部分文字说明如下表所示。请回答:
(1)说明书中偏硅酸的化学式书写不规范,其正确的化学式为 。
(2)纯净优质的矿泉水属于 (填“纯净物”或“混合物”)。
38.(1)含磷洗衣粉中含有Na5PxO10,其洗涤废水的任意排放会污染环境,已知在上述化合物中磷的化合价为+5,则x应为 。
(2)元素A与钠形成的化合物的化学式为NaxA,元素B的氯化物的化学式为BCly,若化合价不变,则A、B两种元素组成化合物的化学式为 。
39.已知HnROm的相对分子质量为A,则R的相对原子质量为 。
三、实验探究题(每空1分,共10 分)
40.隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种还原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。
某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:
)
菜肴 半小时 6小时 18小时 24小时
炒青菜 0.6861 0.7982 4.3333 5.3624
韭菜炒蛋 1.8153 1.9249 2.8390 5.6306
红烧肉 2.4956 4.2558 4.0668 5.5188
红烧鲫鱼 / 2.0948 3.2300 7.2397
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483
。
请根据以上材料,回答下列问题:
(1)亚硝酸盐中含有亚硝酸根离子
,其中氮元素的化合价是 价。
(2)根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是: 。
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是 。
(4)用多种菜做实验的目的是 。
41. 1909年,英国科学家卢瑟福和他的助手用-束带正电荷的高速α粒子流轰击金箔,并根据如图所示的实验现象和已有研究,在1911年提出了原子的核式结构模型。
(1)卢瑟福提出核式结构模型过程中运用了许多相关知识,如“同种电荷相互排斥”。请再列举一点 。
(2)你认为卢瑟福选择金作为实验材料的理由有________(可多选)
A.金的相对原子质量大
B.金的延展性好,可制得很薄的金箔
C.金的颜色为黄色
D.金的熔点较高
42. 元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请按表中信息填空:
族 周期 0
一 1H 1.008 2 4.003
二 3 6.941 4 9.012 5B 10.81 ① 7X 14.01 8O 16.00 9F 19.00 10 20.18
三 11 22.99 ② 13 26.98 14 28.09 ③ 16S 32.06 17 35.45 18 39.95
(1)周期表中的①②③代表三种不同的元素,①是 (填名称)元素,②所代表的元素属于 元素(填“金属”或“非金属”),该元素原子在化学反应中容易 (“得到”或“失去”)电子;③所代表的元素与氮元素属于同一 (填“周期”或“族”)。
(2)氕、氘、氚分别表示氢元素三种原子,其原子中 数目不相等(选填“质子”、“中子”或“电子”)。
(3)②和氯元素组成的物质是由 (选填“分子”、“原子”或“离子”)构成的。
四、解答题
43.中成药“连花清瘟胶囊”的有效成分之一是连翘苷,其化学式为。已知连翘苷的相对分子质量为534,请你回答:
(1)按照物质的分类,连花清瘟胶囊属于 。(选填“混合物”或“化合物”)
(2)中x= 。
(3)连翘苷中碳元素、氢元素、氧元素的质量比为 。
(4)100g“连翘苷”中碳元素的质量为多少
44.“碳循环”和“氧循环”是自然界中重要的循环。
(1)“碳循环”和“氧循环”中的“碳”和“氧”指的是 (填“元素”“原子”或“离子”)。
(2) 88 g二氧化碳和 g氧气中含有相同质量的氧元素。
(3)下列对“碳循环”和“氧循环”的认识,正确的有____(可多选)。
A.每个人都在参与碳、氧循环
B.碳、氧循环过程中各元素守恒,其化合价不变
C.绿色植物的光合作用使自然界中氧原子的总数增加
D.碳、氧循环使大气中氧气和二氧化碳的含量保持相对稳定
45.从原子论到分子学说,原子——分子论的创立,奠定了近代化学的基础,阅读下列材料回答问题:
材料一:1803年,道尔顿提出原子论,认为所有物质都是由原子构成的。单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成。
材料二:1811年,阿伏加德罗引入新的概念——分子,提出了分子学说。对于化合物而言,分子相当于道尔顿所谓的“复杂原子”;对于单质而言,同种原子可以结合成单质原子。
(1)完成下列表格中的空格部分:
物质 甲烷 氯气 五氧化二磷 氦气
构成物质的微粒 (写微粒符号) CH4 Cl2 P2O5
(2)表中微粒中符合道尔顿“复杂原子”的是 (写化学式)。
(3)五氧化二磷的相对分子质量为 。
(4)你同意材料一中加点文字部分的观点吗 答: (填“同意”或“不同意”),请选用(1)表中的物质说明理由: 。
(5)从原子论的创立到分子学说的提出,谈谈你对科学理论的发展有何感想 。
46.清明节吃“青团”是湖州人的一种传统习俗。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。
(1)侧柏莲酮芳香油中C、H、O元素的质量比为 。
(2)计算侧柏莲酮芳香油中碳元素的质量分数(精确到0.1%)。
(3)5.84 克侧柏莲酮芳香油中的碳元素质量与多少克葡萄糖(C6H12O6)中的碳元素质量相同。
47.硫酸铵是农业中广泛使用的一种氮肥,其化学式为。试计算:
(1) 硫酸铵的相对分子质量。
(2) 硫酸铵中氮元素的质量分数。
(3) 尿素也是常用的一种氮肥,某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,根据它们含氮的质量分数分析肥效,购买哪种化肥更经济
答案解析部分
1.【答案】B
【解析】【分析】符号是一个标志,模型可以反应事物某些方面的特征,符号一般没这功能。
【解答】A、图中是原子结构的结构模型,属于模型,选项错误;
B、图中是节约用水的标识,不属于模型,选项正确;
C、图中是甲烷分子结构的结构模型,属于模型,选项错误;
D、图中是足球烯结构的结构模型,属于模型,选项错误,故选B。
故答案为:B。
2.【答案】D
【解析】【分析】A、根据化学式确定物质的元素组成分析;
B、根据同分子构成的物质,其分子由原子构成分析;
C、根据元素质量比为相对原子质量×原子个数之比分析;
D、根据相对分子质量为分子中各原子的相对原子质量之和分析。
【解答】A、 甲磺酸伊马替尼由碳、氢、氮、氧、硫五种元素组成 ,不符合题意;
B、 甲磺酸伊马替尼由分子构成,其一个分子由77个原子构成 ,不符合题意;
C、 甲磺酸伊马替尼中碳、氢、氧元素的质量比为(12×30):(1×35):(16×4) ,不符合题意;
D、 甲磺酸伊马替尼的相对分子质量是12×30+1×35+16×4+14×7+16×4+32= 589 ,符合题意;
故选D。
3.【答案】D
【解析】【分析】 A.Si元素和C元素属于非金属元素,故A说法错误;
B.C 元素的核电荷数为6,故B错误;
C.相对原子质量是有单位的,其单位为“1”,铝元素的相对原子质量质量是26.98,故C错误;
D.13 号元素为Al元素,的离子符号是 A13+ ,故D正确;
故答案为:D
【点评】根据相对原子质量单位为“1”,铝元素的相对原子质量质量是26.98进行解答;C和Si元素属于非金属元素;根据元素周期表提供的信息进行判断。
4.【答案】C
【解析】【分析】A、构成物质的微粒有分子、原子、离子。
B、根据单质的概念分析。
C、根据元素的定义分析。
D、根据化合物的定义来分析解答.
【解答】A. 构成物质的微粒除分子外,还有原子、离子也能构成物质;故错误;
B. 单质只含一种元素,含一种元素的物质不一定是单质,如氧气和臭氧的混合物中只含有一种元素,属于混合物,故错误;
C. 质子数相同的原子一定属于同种元素,同种元素质子数一定相同,故正确;
D. 化合物是由不同种元素组成的纯净物,化合物中最少含有两种元素,但是不同种元素组成的物质不一定是化合物,可能是混合物故正确。
故答案为:C。
5.【答案】C
【解析】【分析】先找与所给物质中固体的元素质量比,再由碳元素质量分数确定出其它元素的质量分数或质量分数之和,利用物质中元素质量关系计算出未知质量分数。
【解答】C2H4O可看作是C2H2和H2O,则C2H2和C2H4O组成的混合气体,可看作是C2H2和H2O两部分组成, 其中碳元素的质量分数为72%, 设C2H2中氢元素质量分数为x,24:2=72%:x,x=6%,则H2O的质量分数为1-72%-6%=22%,其中H2O中氢、氧元素质量比为1:8,则氧元素质量分数为。
故选C。
6.【答案】A
【解析】【分析】化学式,在宏观上表示一种物质,还表示物质是由什么元素组成的;
微观上,表示一个分子,还表示一个分子是由几个什么原子构成的。
【解答】① 由二氯甲烷的化学式可知,二氯甲烷是由碳、氢、氯3种元素组成的化合物,故正确。
② 由二氯甲烷的化学式可知,二氯甲烷是由碳、氢、氯3种元素组成的化合物,不是混合物,故错误。
③ 1个二氯甲烷分子是由1个碳原子、2个氢原子和2个氯原子构成的,则它的分子中碳、氢、氯元素的原子个数比是1:2:2,故正确。
④ 二氯甲烷是由二氯甲烷分子构成的,故错误。
所以,①③说法正确。
故答案为:A。
7.【答案】C
【解析】【分析】根据由同种元素组成的纯净物为单质,化学式右下角数字为一个分子中原子个数,相对分子质量为分子中各原子的相对原子质量之和分析。
【解答】 ①C60是一种由碳元素组成的单质,正确,②错误,③一个分子中含有60个碳原子,正确,④它的分子质量为12×60=720,错误,⑤正确。
故选C。
8.【答案】C
【解析】【分析】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。
【解答】A.秋水仙碱的化学式为C22H25NO6,可见它是由碳、氢、氮、氧四种元素组成的,故错误;
B.秋水仙碱的化学式为C22H25NO6,可见一个秋水仙碱分子中有22个碳原子、25个氢原子、1个氮原子和6个氧原子,故错误;
C.秋水仙碱的化学式为C22H25NO6,可见其中碳、氢、氮、氧原子个数比为22:25:1:6,故正确;
D.秋水仙碱的化学式为C22H25NO6,其中碳元素的质量为:12×22=264;氢元素的质量为1×25=25;氮元素的质量为14;氧元素的质量为16×6=96,可见其中碳元素的质量分数最大,故错误。
故答案为:C
9.【答案】B
【解析】【分析】光合作用过程中,二氧化碳中的氧原子可以转移到有机物中,也可以转移到氧气中,水中的氧原子可以转移到有机物中,也可以转移到氧气中。
【解答】用标记的H218O、CO2和H2O、C18O2分别供给两组植物,来明确光合作用产物中氧元素的来源。一个C18O2中含有的质子个数为6+8+8=22,故B正确,ACD错误。
故答案为:B。
10.【答案】D
【解析】【分析】根据相对原子质量=质子数+中子数分析。
【解答】 相对原子质量=质子数+中子数,原子中质子数=核电荷数,已知某原子的核电荷数为15,原子核中有16个中子,则该原子的相对原子质量约为31.
故选D。
11.【答案】A
【解析】【分析】 A、根据分子结构图示来分析解答;
B、根据分子结构图示来分析解答;
C、根据分子结构图示中元素组成来计算解答;
D、根据分子结构图示中元素组成来计算解答。
【解答】A、由题图可知,每个过氧乙酸分子由2个碳原子4个氢原子、3个氧原子构成,化学式为C2H4O3,A正确;
B、过氧乙酸由过氧乙酸分子构成,过氧乙酸分子由C、H、O原子构成,B错误;
C、过氧乙酸中C、H、O元素的质量比为( 12×2) :(4×1):( 16×3)= 6:1:12,故氧元素的质量分数最大,C、D错误。
故选A。
12.【答案】D
【解析】【分析】根据元素周期表中原子序数=质子数及中子呈中性分析。
【解答】A、中子呈中性, 只由四个中子构成的粒子也呈中性,不符合题意;
B、 氦的相对原子质量为4,该粒子的相对原子质量也为4,所以质量当于一个氦原子的质量 ,不符合题意;
C、 中子呈中性,失去一个中子后也不显电性 ,不符合题意;
D、 该元素为零号元素,在周期表中与氢元素不占同一位置 ,符合题意;
故选D。
13.【答案】B
【解析】【分析】根据氢原子相对原子质量为1, 相对原子质量=质子数+中子数,相对原子质量倍数即为原子质量倍数分析。
【解答】 Uus原子的原子核内有117 个质子,原子质量约是氢原子质量的291 倍,则相对原子质量为291,该原子中子数为 174.
故选B。
14.【答案】D
【解析】【解答】解:根据萨罗的分子模型图,1个萨罗分子是由13个碳原子、10个氢原子和3个氧原子构成的,则该物质的一个分子中含有26个原子;化学式为:C13H10O3.
①1个萨罗分子是由13个碳原子、10个氢原子和3个氧原子构成的,则该物质的一个分子中含有26个原子,故正确;
②由萨罗的化学式可知,它是由碳、氢、氧三种元素组成的,不符合氧化物是由两种元素组成的特征,故错误;
③萨罗(Salol)中碳元素与氧元素的质量比为(12×13):(16×3)=156:48,故正确;
④相对分子质量的单位不是“g”而是“1”,通常省略,故错误;
⑤有机高分子化合物的相对分子质量大到几万甚至几十万,而该物质色相对分子质量为:12×13+1×10+16×3=214,不属于有机高分子化合物,故错误;
⑥元素是个宏观概念,只讲种类不讲个数,故错误;
⑦由分子结构模型可知,萨罗的化学式为:C13H10O3.故正确.
故选D.
【分析】由分子结构模型书写出物质的化学式,然后进行相关的分析解答.
15.【答案】B
【解析】【分析】根据元素符号表示一种元素和该元素一个原子,若对应单质由原子构成,元素符号还表示一种物质分析。
【解答】A、H可表示氢元素、一个氢原子,但不能表示氢气这种物质,不符合题意;
B、Fe可表示铁元素、一个铁原子,还能表示铁这种物质,符合题意;
C、Cl可表示一个氯原子,还能表示氯元素,不符合题意;
D、C可表示碳元素、一个碳原子,还能表示碳这种物质,不符合题意;
故选B。
16.【答案】C
【解析】【分析】分析各个选项中化学式的含义,哪个完全符合四个条件,哪个就是正确选项。
【解答】A.C能够说明这种物质只由一种元素组成,故A错误;
B.O3能够表示臭氧这种物质,但是却表示该物质只由一种元素组成,故B错误;
C.SO2表示二氧化硫这种物质,还表示一个二氧化硫的分子,既能表示该物质由硫和氧两种元素组成,也可以表示一个分子由三个原子构成,故C正确;
D.NH3表示氨气这种物质,但是表示一个氨气分子由四个原子构成,故D错误。
故选C。
17.【答案】D
【解析】【分析】根据元素质量比与原子个数比计算R的相对原子质量,由此确定R的元素种类分析。
【解答】 R与0的质量比为7 : 16, 设R的相对原子质量为x,x:32=7:16,则x=14,R为氮元素, 化学式为NO2 。
故选D。
18.【答案】D
【解析】【分析】当化合价为奇数时,首先写出两种化合物的化学式,然后根据相对分子的质量为组成分子的各原子的相对原子质量之和列出两个方程,从而计算出该元素的化合价。【解答】设该元素化合价为+x价,相对原子质量为y。
当x为奇数时,氧化物化学式为 R2Ox,硫酸盐的化学式为R2(SO4)x,
根据相对分子质量的定义得到:
2y+16x=a,
2y+96x=b;
解得:。
故选D。
19.【答案】A
【解析】【分析】先根据质量守恒定律求出“未知”处的质量,然后再根据催化剂的概念、分解反应的概念和质量守恒定律逐一分析,即可做出正确选择.
【解答】解:A、由图表可知A没有参与反应,C质量减少了4g,D质量减少了6g,B的质量增加了10g,因此反应物是B,生成物是C和D,反应可表示为C+D→B,但不知微粒个数比,错误;
B、A物质的质量在反应前后没有改变,故可判断A物质可能是该反应的催化剂,正确;
C、根据质量守恒定律,则反应后C物质的质量=20×4﹣(20+30+14)=16g;C、D质量减少,而只有B增加,所以是两种物质生成一种物质,为化合反应,正确;
D、根据质量守恒定律,则反应后C物质的质量=20×4﹣(20+30+14)=16g,正确;
故选A.
20.【答案】C
【解析】【分析】根据化合物的化学式及H和O元素在化合物中的化合价,利用化合物中元素的正负化合价的代数和为0来解答。【解答】因化合物中H元素为+1价,O元素的化合价为-2价,
设元素X的化合价为x,由化学式为HnXO2n-1,根据化合物中元素的正负化合价的代数和为0,
则(+1)×n+x+(-2)×(2n-1)=0;
解得:x=+(3n-2)。
故选C。
21.【答案】C
【解析】【分析】根据相对分子质量的计算方法分析判断。
【解答】根据化学式可知,三个分子都由1个金属原子和1个 SO4 组成。
则它们的相对分子质量等于金属原子的相对原子质量与硫酸根原子团的相对原子质量之和。
要比较三者相对分子质量的大小,只需比较三个金属原子的相对原子质量大小即可。
故选C。
22.【答案】B
【解析】【解答】已知氧元素的化合价为-2价,Fe2O3中Fe化合价为+3价, Fe单质中化合价为0价;反应前CO中C元素的化合价为+2价,反应后CO2中C元素的化合价为+4价;由此可知反应前后化合价发生变化的元素为Fe和C;故选B.
【分析】根据在化合物中正负化合价代数和为零,进行解答
23.【答案】D
【解析】【分析】根据NaHS、MgSO4、NaHSO4的化学式,可以发现NaH相对原子质量和为24,可以看成与Mg是等同的,即可以把NaH它们看成一个整体,就可以通过硫的质量分数求镁的质量分数,余下的就是氧元素质量分数。
【解答】因为NaHS、NaHSO4组成中钠和氢的个数比是1:1,
它们的相对原子质量之和为:23+1=24;
因此可以把钠元素和氢元素放在一起看做镁元素;
这样三种物质相当于是MgS、MgSO4、MgSO4,
此时三种物质中镁和硫的个数比都是1:1;
硫元素的质量分数为4X%,
所以镁元素的质量分数为:,
则混合物中氧元素的质量分数为:1-4X%-3X%=(100-7X)%。
故选D。
24.【答案】B
【解析】【分析】原子的个数之比等于元素的实际质量与相对原子质量的比值之比。
【解答】在化学式中,A、B的原子个数之比为:,则该化合物的化学式为:AB2。
故选B。
25.【答案】D
【解析】【分析】原子失去电子带正电,得到电子带负电;相对原子质量=质子数+中子数。
【解答】某阳离子Mn+的核外电子共有x个电子,它是由该原子失去n个电子形成的,那么该原子的核外电子数为:x+n。
根据“质子数=核外电子数”可知,该原子的质子数为x+n;
那么它的相对原子质量为:x+n+y。
故选D。
26.【答案】32;1
【解析】【分析】(1)根据题意,甲醇是由碳、氢、氧三种元素组成的有机物,氢元素质量分数约为12.5%,且每个分子中含有4个氢原子分析。
(2)根据化学式的含义分析。
【解答】解:(1)甲醇的相对分子质量=1×4÷12.5%=32;
(2)一个甲醇分子中含氧原子的个数=32×50%÷16=1
27.【答案】(1)Ca
(2)
(3)
【解析】【分析】(1)根据钙元素的符号解答;
(2)硫酸钙中的阴离子就是硫酸根离子,据此写出化学符号;
(3)在元素符号的正上方标上正负号和数字,就是它的化合价。
【解答】(1)石灰岩中含有钙元素,符号为Ca;
(2)硫酸钙中含有的 阴离子为: ;
(3)氢氧化铁中国铁元素显+3价,那么符号为: 。
28.【答案】16(b+a)/(b-a)
【解析】【分析】根据相对分子质量的计算以及题干信息分析;
【解答】根据题意,一个 12CO2 分子中的1个氧原子质量为 , 则 2CO的分子质量是,则 2CO的相对分子质量是 。
29.【答案】(1)原子
(2)氯化钠;水分子
(3)分子分成原子,原子重新组合成新的分子
【解析】【分析】(1)在化学反应中,分子划分成原子,原子重新组成分子,所以甲是原子。
(2)离子构成的物质有:大多数盐、碱和活泼金属氧化物等。
物质是由分子构成的,保持物质的化学性质的最小粒子是分子。
(3)根据化学反应的实质分析。
【解答】(1)在化学反应中,分子划分成原子,原子重新组成分子,所以甲是原子。
(2)在水、汞和氯化钠三种物质中,氯化钠属于盐类,由离子构成的物质是氯化钠。
水是由水分子构成的,保持水的化学性质的最小粒子是水分子。
(3)从微观来看,化学反应的实质是分子分成原子,原子重新组合成新的分子。
30.【答案】B;A;CD
【解析】【分析】根据由同种分子构成的物质为纯净物,由不同种分子构成的物质为混合物,纯净物的分子中由同种原子构成,为单质,由不同种原子构成为化合物分析。
【解答】图示所给各物质中,B由同种分子构成,且每个分子由不同种原子构成,属于化合物,A由同种分子构成,且每个分子由同种原子构成,属于单质,C、D由不同种分子构成,属于混合物。
故答案为:B;A;CD。
31.【答案】U3O4;UO2
【解析】【分析】 根据:物质中某元素的质量分数=×100%.
【解答】 设齐乌斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为U3O4;
设阿姆斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为UO2.
32.【答案】(1)C2H4O2;醋酸(或乙酸)
(2)1:2:1
(3)40
【解析】【解答】(1)由分子结构模型可知,该物质的1个分子是由2个碳原子、4个氢原子和2个氧原子构成的,其化学式为C2H4O2,食醋是醋酸(或乙酸)的水溶液;故填:C2H4O2;醋酸(或乙酸);
(2)由醋酸的化学式可知,1个醋酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,故填:1:2:1;
(3)由醋酸的化学式可知,其中碳元素的质量分数为:=40%.故填:40.
【分析】(1)根据分子结构模型来分析其化学式;
(2)根据该物质的分子结构来分析;
(3)根据化合物中,元素质量分数的计算方法来分析.
33.【答案】 中子数不同;7:6
【解析】【分析】碳﹣12原子的核内有6个质子和6个中子,碳﹣14原子在考古学中常被用来测定出土文物的年代,该原子的核内有6个质子和8个中子。
【解答】解:碳﹣12原子的核内有6个质子和6个中子,碳﹣14原子的核内有6个质子和8个中子,两种原子中中子数不同;根据相对原子质量=质子数+中子数,可知碳14原子的质量与碳12原子的质量之比为14:12=7:6
故答案为:中子数不同 7:6
34.【答案】(1)(m+n)/8(m+2n)
(2)17n/(9m+17n)或
【解析】【分析】(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据物质的相对质量比=物质的实际质量比,溶质质量分数=溶质质量/溶质质量+溶剂质量分析。
【解答】(1) 该溶液中氢元素与氧元素的质量比为(2m+2n):[(m+2n)×16] = (m+n)/8(m+2n) .
(2) 该双氧水溶液溶质的质量分数为=。
故答案为:(1 )(m+n)/8(m+2n) ;(2) 17n/(9m+17n)或 。
35.【答案】
【解析】【分析】相对分子质量等于各原子的相对质量之和。
【解答】由题意可知,金属元素显正价,设该物质的化合价为x
则其氢氧化物为R(OH)x;
氯化物为RClx;
氢氧化物相对分子质量 m=R+(16+1)x;
氯化物的相对分子质量 n=R+35.5x;
上面两式子相减
n-m=(35.5-17)x
x=
故答案为:
36.【答案】质子;中子;氢
【解析】【分析】根据同种元素的不同种原子质子数相同,中子数不同分析。
【解答】 由图示的原子构成可知,氕、氘、氚三种原子的核内质子数相同,中子数不同,把这三种原子称为氢原子。
故答案为:质子;中子;氢。
37.【答案】(1)H2SiO3
(2)混合物
【解析】【分析】本题难度不大,掌握化学式与元素符号的书写方法、纯净物与混合物的判别方法是正确解答本题的关键。(1)由偏硅酸的化学式,偏硅酸是由氢、硅、氧三种元素组成的,书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写,进行分析解答;(2)既然是矿泉水,那么其中除水外一定还含有一些矿物元素,所以是混合物。
【解答】(1)书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.说明书中偏硅酸的化学式书写不规范,其正确的化学式为H2SiO3,故填:H2SiO3;
(2)既然是矿泉水,那么其中除水外一定还含有一些矿物元素,所以是混合物,故填:混合物。
故答案为:(1)H2SiO3;(2)混合物。
38.【答案】(1)+3
(2)BxAy
【解析】【分析】(1)在化学式中,正负化合价的代数和为零;
(2)首先根据两个化学式推算出A、B元素的化合价,再根据“正负化合价代数和为零”计算出A、B组成化合物时原子的个数之比即可。
【解答】(1)根据化学式 Na5PxO10可知,(+1)×5+(+5)x+(-2)×10=0,解得:x=+3;
(1)根据NaxA 得到:(+1)x+A=0,那么A的化合价为-x;根据 BCly得到:B+(-1)y=0,那么B的化合价为+y。设A、B组成化合物的化学式为BmAn,B根据正负化合价代数和为零得到:my+(-x)n=0,则它们的原子个数之比为:m:n=x:y,因此化学式为BxAy。
39.【答案】A-n-16m
【解析】【分析】相对分子质量等于相对原子质量与个数的乘积之和。
【解答】设R的相对原子质量为x,
那么:1×n+x+16m=A;
解得:x=A-n-16m。
40.【答案】(1)+3
(2)菜中的亚硝酸盐含量随时间的增加而增加,温度高随不密封菜中的亚硝酸盐含
(3)低温、密封,尽量缩短储存时间
(4)使得出的结论更客观,更具有普遍意义
【解析】【分析】(1)原子团的化合价等于各组成元素化合价的代数和;
(2)根据表格数据,分析亚硝酸盐含量随时间,温度和是否密封等因素的变化规律;
(3)根据前面得到的结论分析解答;
(4)在科学探究中,使用不同的器材多次完成实验,可以收集到多组数据,从而使得出的结论更客观,具有普遍意义。
【解答】(1)亚硝酸盐中含有亚硝酸根离子
,其中O元素的化合价是-2价,根据“原子团的化合价等于各组成元素化合价的代数和”得到:x+(-2)×2=-1,解得:x=+3价。
(2)根据表格数据可知:菜中的亚硝酸盐含量随时间的增加而增加;温度高,不密封菜中的亚硝酸盐含量会明显偏高。
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是:低温、密封,尽量缩短储存时间。
(4)用多种菜做实验的目的是:使得出的结论更客观,更具有普遍意义。
41.【答案】(1)力能改变物体运动状态
(2)A;B
【解析】【分析】
(1)原子是由原子核和核外电子组成的。
(2)金的延展性好,相对质量大,便于做靶核。
【解答】
(1)卢瑟福提出核式结构模型过程中运用了许多相关知识,如“同种电荷相互排斥”。另外还涉及到知识有:力能改变物体的运动状态;
(2)A.金的相对原子质量大,a粒子靠近金的原子核时更容易改变运动状态,故A符合题意;
B.金的延展性好,可制得很薄的金箔,便于a粒子通过,故B符合题意;
C.金的颜色为黄色,与a粒子散射实验关系不大,故C不符合题意;
D.金的熔点较高,与本实验没有多大的联系,故D不符合题意;
故选AB。
故答案为:(1)力能改变物体的运动状态;(2)AB。
【答案】(1)He
(2)CH4、P2O5
(3)142
(4)不同意;表格中的氯气(Cl2)就是由同种原子构成的分子
(5)科学理论的发展需要大胆创新(或科学理论是不断传承和发展的)
【解析】【分析】(1)根据化学式的书写分析
(2)根据化学式的书写分析
(3)根据相对分子质量计算
(4)根据题干信息分析;
(5)根据题干信息分析;
【解答】(1)氦气属于稀有气体,是由原子构成,故化学式即其元素符号,故填:
(2)根据题干信息,“1803年,道尔顿提出原子论,认为所有物质都是由原子构成的,单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子构成,“复杂原子"由不同原子按一定整数比例简单构成",表格中CH4、P2O5分别由不同种元素组成,属于化合物,故其属于复杂原子:
(3)五氧化二磷的相对分子质量是
(4)材料一中提到单质由原子直接构成,同种原子相互排斥不能结合,而氯气由氯分子构成,每个氯分子由两个相同的氯原子构成,故不同意其观点;
(5) 科学理论的发展 的感想是: 科学理论的发展需要大胆创新(或科学理论是不断传承和发展的)
43.【答案】(1)混合物
(2)34
(3)162:17:88
(4)60.7g
【解析】【分析】(1)根据连花清瘟胶囊含有多种物质,属于混合物来分析解答;
(2)根据相对分子质量就是化学式中各个原子的相对原子质量的总和来分析解答;
(3)根据化合物中各元素的质量比=各原子的相对原子质量×原子个数之比来分析解答;
(4)根据元素的质量=化合物的质量×元素的质量分数来分析解答。
【解答】(1)中成药“连花清瘟胶囊”的有效成分之一是连翘苷,则连花清瘟胶囊属于混合物;
(2)12×27+x+16×11=534,则x=34;
(3)连翘苷中碳元素、氢元素、氧元素的质量比为(12×27):(1×34):(16×11)=162:17:88;
(4)100g“连翘苷”中碳元素的质量为100g×(12×27/534)×100%≈60.7g。
44.【答案】(1)元素
(2)64
(3)A;D
【解析】【分析】(1)根据物质的组成来分析;
(2)根据元素的质量=化合物的质量X化合物中该元素的质量分数来分析;
(3) 根据碳循环和氧循环的原理来分析。
【解答】(1)物质是由元素组成的,所以“碳循环”和“氧循环”中的“碳”和“氧”指的是元素;
(2)氧气是由氧元素组成的,所需氧气的质量即为88g二氧化碳中氧元素的质量,为:88gxx100=64g;
(3) A、每个人都在参与碳、氧循环,A说法正确;
B、碳、氧循环过程中各元素质量守恒,但是化合价会发生改变,B说法错误;
C、绿色植物的作用是通过光合作用消耗二氧化碳、产生氧气,但是氧原子总数不变,C说法错误;
D、碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定,D说法正确;
故填: AD。
45.【答案】(1)60:5:8
(2)C10H10O的相对分子质量=12×10+10+16=146
碳元素的质量分数=120/146 × 100%=82.2%
(3)侧柏莲酮芳香油中碳元素质量=5.84g×120/146=4.8g葡萄糖中碳元素的质量分数=6×12/6×12+12+6×16=40%葡萄糖的质量=4.8g/40%=12g
【解析】【分析】(1)元素质量比等于各元素相对原子质量总和之比。侧柏莲酮芳香油中C、H、O元素的质量比=(12×10):(1×10):16=60:5:8
(2)元素质量分数等于该元素的相对原子质量总和与该物质的相对分子质量的比值;
(3)化合物中某元素质量=该物质的质量×该元素的质量分数,根据碳元素的质量守恒列式进行计算。
46【答案】(1)硫酸铵的相对分子质量=(14+1×4)×2+32+16×4=132。
(2)硫酸铵中氮元素的质量分数=×100%≈21.2%。
(3)尿素中氮元素的质量分数= ×100%≈46.7%,
某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,售价分别为1.3元和1.8元,1元钱能购买的硫酸铵的质量=×21.2%≈0.16kg,
1元钱能购买的尿素中含氮元素的质量=×46.7%≈0.26kg;
0.16kg<0.26kg,所以,购买尿素更经济。
【解析】【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)在化合物中元素的质量分数=×100%。
(3)由化合物中元素的质量分数的计算方法计算出尿素中氮元素的质量分数,结合题意,某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,进行分析。
1 / 1
一、选择题(每小题2分,共40分)
1.下列不属于模型的是( )
A.原子结构B.节水标志C.甲烷分子结构 D.足球烯结构
2.药品“甲磺酸伊马替尼片”用于治疗慢性粒细胞白血病和恶性胃肠道间质肿瘤。甲磺酸伊马替尼的化学式为,下列关于甲磺酸伊马替尼的说法正确的是( )。
A.甲磺酸伊马替尼由8种元素组成B.甲磺酸伊马替尼由77个原子构成
C.甲磺酸伊马替尼中碳、氢、氧元素的质量比为30:35:4D.甲磺酸伊马替尼的相对分子质量是589
3.如下图是元素周期表的部分示意图,下列说法正确的是( )
A.它们都属于金属元素 B.C 元素的核电荷数为9
C.Al的相对原子质量是 26.98g D.13 号元素的离子符号是 A13+
4.推理是一种重要的科学思维方法。以下推理结果正确的是
A.分子是构成物质的微粒,因此物质一定都是由分子构成的
B.单质只含一种元素,因此含一种元素的物质一定是单质
C.质子数决定元素种类,因此同种元素质子数一定相同
D.化合物是由不同种元素组成的纯净物,因此不同种元素组成的物质一定是化合物
5. 由C2H2和C2H4O组成的混合气体中,经测定其中碳元素的质量分数为72%,则混合物中氧元素的质量分数为( )
A.32% B.22.65% C.19.56% D.2.14%
6.经实验证明,涂改液中含有很多挥发性有害物质,人吸入后易引起慢性中毒而产生头晕、头痛等症状,严重时会抽搐和呼吸困难。二氯甲烷()就是其中一种有害物质。下列关于二氯甲烷的叙述,其中正确的是( )。
①它是由碳、氢、氯3种元素组成的化合物 ②它是由氯气和甲烷组成的混合物 ③分子中碳、氢、氯元素的原子个数比是1:2:2 ④它是由多种原子直接构成的一种化合物
A.①③ B.①④ C.②③ D.②④
7.足球烯是一种超导物质,其化学式为。关于该物质有以下说法:①它是一种单质,②它是一种化合物,③它的一个分子中含有60个碳原子,④它的分子质量为12克,⑤它的相对分子质量为720。其中正确的是( )。
A.①④ B.②③ C.①③⑤ D.②③⑤
8.百合具有润肺止咳、养颜美容等功效,百合中含有秋水仙碱,其化学式为C22H25NO6,下列说法中正确的是( )
A.秋水仙碱由碳、氢、氧三种元素组成
B.一个秋水仙碱分子由22个碳原子、25个氢原子、1个氮原子和3个氧分子构成
C.秋水仙碱分子中碳、氢、氮、氧原子个数比为22:25:1:6
D.秋水仙碱中氢元素的质量分数最大
9.科学家们利用“O标记法探究光合作用,实验中分别将原料、和、提供给两组植物,来明确光合作用产物中氧元素的来源。其中原料中一个中含有的质子个数为
A.16 B.22 C.26 D.48
10.已知某原子的核电荷数为15,原子核中有16个中子,则该原子的相对原子质量约为( )。
A.15 B.16 C.46 D.31
11.过氧乙酸是生 活中常用的消毒剂,其分子结构如图所示。下列有关过氧乙酸的叙述正确的是( )
A.过氧乙酸的化学式为C2H4O3
B.过氧乙酸是由碳、氢、氧原子构成的
C.过氧乙酸中碳、氢氧三种元素的质量比是12:1 :16
D.过氧乙酸中碳元素的质量分数最大
12.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性B.相当于一个氦(He)原子的质量
C.失去一个中子后也不显电性D.在周期表中与氢元素占同一位置
13. 德国亥姆霍兹重离子研究中心成功合成117号元素。该元素已获正式名称“Ununseptium”, 元素符号为Uus。该原子的原子核内有117 个质子,原子质量约是氢原子质量的291 倍,是目前获得正式承认的最重的原子。该原子的原子核内中子数为
A.117 B.174 C.291 D.408
14. 萨罗(Salon)是一种重要的消毒剂.其分子的微观结构模型如图:下列关于萨罗的说法错误的是( )
①该物质的一个分子由二十六个原子构成;②该物质是氧化物;③该物质中碳、氧元素的质量比是156:48;④该物质的相对分子质量是214g;⑤该物质是有机高分子化合物;⑥该物质由碳、氢、氧三个元素组成;⑦该物质的化学式为C13H10O3
A.①③ B.⑦ C.①③⑦ D.②④⑤⑥
15.元素符号能表示一定的意义,不同的元素符号表示的意义不同。下列对元|素符号的表示的意义解释正确的是( )
选项 元素符号 元素符号所表示的意义
A H 可表示氢元素,表示一个氢原子,表示氢气这种物质
B Fe 可表示铁元素,表示一个铁原子,表示铁这种物质
C Cl 只可表示一个氯原子
D C 只可表示碳元素
A.A B.B C.C D.D
16.下列选项中均能符合右下图中四位同学的描述的是( )
A.C B.O3 C.SO2 D.NH3
17.某氧化物RO2是A级高效安全灭菌消毒剂,它在食品保鲜、饮水消毒等方面有广泛应用。实验测得该氧化物中R与0的质量比为7 : 16,RO2的化学式为( )
A.CO2 B.ClO2 C.SO2 D.NO2
18.某元素的化合价是奇数价,其氧化物的相对分子质量为a,价态相同的硫酸盐相对分子质量为b,则此元素的化合价可能是( )
A. B. C. D.
19.在一定的条件下,向一密闭的容器内加入A,B,C,D四种物质各20g,充分反应后,测定其质量,得到数据如表:
物 质 A B C D
反应前质量(g) 20 20 20 20
反应后质量(g) 20 30 未知 14
下列说法不正确的是( )
A.其化学方程式为:2C+3D=5B B.物质A可能是该反应的催化剂
C.容器内发生了化合反应 D.反应后容器内C的质量为16g
20.某化合物的化学式为HnXO2n-1,则元素X的化合价可能是( )
A.+(2n+2) B.+(3n+2) C.+(3n-2) D.+(2n-1)
21.要比较CuSO4、FeSO4、CaSO4相对分子质量的大小,最简单的方法是( )
A.分别计算它们的相对分子质量B.计算所含的质量分数
C.比较Cu、Fe、Ca三种原子的相对原子质量D.计算所含金属元素的质量分数
22.Fe2O3+3CO高温3CO2+2Fe中,反应前后化合价发生变化的元素()
A.只有Fe B.只有Fe和C C.只有C和O D.Fe、C和O
23.在NaHS、NaHSO4和MgSO4组成的混合物中,测得其中S元素的质量分数为4X%,则该混合物中氧元素的质量分数( )
A.(100-4X)%B.(100-5X)%C.(100-6X)% D.(100-7X)%
24.有一A、B两种元素组成的化合物中,A、B两元素的质量比为3:8,A、B两元素的相对原子质量比3:4,则该化合物的化学式可表示为( )
A.AB B.AB2 C.A2B3 D.A2B
25.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为 ( )
A.x+y B.x+n-y C.x-n+y D.x+y+n
二、填空题(每空1分,共 39 分)
26.甲醇是一种无色、有特殊香味、易挥发的液体,可用于制造甲醛和农药等。已知甲醇由碳、氢、氧三种元素组成,其中氢元素的质量分数为12.5%,氧元素的质量分数为50%;一个甲醇分子中含有4个氢原子。则甲醇的相对分子质量是 ;一个甲醇分子中含氧原子的个数是 。
27.请用恰当的化学用语表示下列划线部分:
(1)石灰岩中含有钙元素: 。
(2)硫酸钙中含有的阴离子: 。
(3)岩石呈红色是含氢氧化铁所致,氢氧化铁元素显+3价: 。
28.作为相对原子质量标准的碳C—12可以写成 2C.一个 2C的原子的质量为a千克,一 个 2CO2分子的质量为b千克,若以 2CO2分子中的1个氧原子质量的1/16作为相对原子质量的标准,则 2CO的相对分子质量是 (假设 CO和CO2 两种分子中氧原子具有相同的中子数)
29.化学是从微观的角度研究物质的组成结构及其变化的学科,构成物质的粒子之间关系如图所示。据图回答下列问题:
(1)甲是 。
(2)在水、汞和氯化钠三种物质中,由离子构成的物质是 。保持水的化学性质的最小粒子是 。
(3)从微观来看,化学反应的实质是 。
30.已知“●”“○”表示两种不同的原子。下列图示的气体物质中,属于化合物的是 ,属于单质的是 ,属于混合物的是 。
31. 沥青铀矿的主要成分中含有铀(U)和氧两种元素。现已测定其中 U、O两种元素的质量分数。 如果按照门捷列夫的观点,U的相对原子质量为 240,此时沥青铀矿的化学式为 U3O8。历史上柏齐里乌斯认为 U的相对原子质量为120,而阿姆斯则认为 U的相对原子质量为 180。试推断柏齐里乌斯和阿姆斯给沥青铀矿所写的化学式分别为 、 。
32. 如图为某分子的结构模型,请回答下列问题:
(1)这种分子的化学式为 ;该物质是食醋的主要成分,化学名称为 .
(2)该物质的碳、氢、氧原子个数比为 .
(3)该物质中碳元素的质量分数为 %.
33.考古学上通过碳﹣14原子测定文物年代。碳﹣14和碳﹣12原子在原子结构上的不同之处是 ,它们的原子质量比是 。
34.现有一份双氧水溶液,它由 m个 H O 分子和n 个 H O 分子混合构成。 (以下二空答案均用含字母 m 和n的式子表示)
(1)该溶液中氢元素与氧元素的质量比为 。
(2)该双氧水溶液溶质的质量分数为 。
35.某金属元素R,它的氢氧化物的相对分子质量为m,它的氯化物的相对分子质量为n。则该金属元素R的化合价为 。
36.如图所示是氕、氘氚三种氢原子的结构示意图。请根据图中所提供的信息回答下面的问题:
氕、氘、氚三种原子的核内 数相同, 数不同,我们把这三种原子称为 原子。
37.我市某品牌矿泉水,其外包装上部分文字说明如下表所示。请回答:
(1)说明书中偏硅酸的化学式书写不规范,其正确的化学式为 。
(2)纯净优质的矿泉水属于 (填“纯净物”或“混合物”)。
38.(1)含磷洗衣粉中含有Na5PxO10,其洗涤废水的任意排放会污染环境,已知在上述化合物中磷的化合价为+5,则x应为 。
(2)元素A与钠形成的化合物的化学式为NaxA,元素B的氯化物的化学式为BCly,若化合价不变,则A、B两种元素组成化合物的化学式为 。
39.已知HnROm的相对分子质量为A,则R的相对原子质量为 。
三、实验探究题(每空1分,共10 分)
40.隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种还原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。
某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:
)
菜肴 半小时 6小时 18小时 24小时
炒青菜 0.6861 0.7982 4.3333 5.3624
韭菜炒蛋 1.8153 1.9249 2.8390 5.6306
红烧肉 2.4956 4.2558 4.0668 5.5188
红烧鲫鱼 / 2.0948 3.2300 7.2397
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483
。
请根据以上材料,回答下列问题:
(1)亚硝酸盐中含有亚硝酸根离子
,其中氮元素的化合价是 价。
(2)根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是: 。
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是 。
(4)用多种菜做实验的目的是 。
41. 1909年,英国科学家卢瑟福和他的助手用-束带正电荷的高速α粒子流轰击金箔,并根据如图所示的实验现象和已有研究,在1911年提出了原子的核式结构模型。
(1)卢瑟福提出核式结构模型过程中运用了许多相关知识,如“同种电荷相互排斥”。请再列举一点 。
(2)你认为卢瑟福选择金作为实验材料的理由有________(可多选)
A.金的相对原子质量大
B.金的延展性好,可制得很薄的金箔
C.金的颜色为黄色
D.金的熔点较高
42. 元素周期表是学习和研究化学的重要工具.下表是元素周期表中的一部分,请按表中信息填空:
族 周期 0
一 1H 1.008 2 4.003
二 3 6.941 4 9.012 5B 10.81 ① 7X 14.01 8O 16.00 9F 19.00 10 20.18
三 11 22.99 ② 13 26.98 14 28.09 ③ 16S 32.06 17 35.45 18 39.95
(1)周期表中的①②③代表三种不同的元素,①是 (填名称)元素,②所代表的元素属于 元素(填“金属”或“非金属”),该元素原子在化学反应中容易 (“得到”或“失去”)电子;③所代表的元素与氮元素属于同一 (填“周期”或“族”)。
(2)氕、氘、氚分别表示氢元素三种原子,其原子中 数目不相等(选填“质子”、“中子”或“电子”)。
(3)②和氯元素组成的物质是由 (选填“分子”、“原子”或“离子”)构成的。
四、解答题
43.中成药“连花清瘟胶囊”的有效成分之一是连翘苷,其化学式为。已知连翘苷的相对分子质量为534,请你回答:
(1)按照物质的分类,连花清瘟胶囊属于 。(选填“混合物”或“化合物”)
(2)中x= 。
(3)连翘苷中碳元素、氢元素、氧元素的质量比为 。
(4)100g“连翘苷”中碳元素的质量为多少
44.“碳循环”和“氧循环”是自然界中重要的循环。
(1)“碳循环”和“氧循环”中的“碳”和“氧”指的是 (填“元素”“原子”或“离子”)。
(2) 88 g二氧化碳和 g氧气中含有相同质量的氧元素。
(3)下列对“碳循环”和“氧循环”的认识,正确的有____(可多选)。
A.每个人都在参与碳、氧循环
B.碳、氧循环过程中各元素守恒,其化合价不变
C.绿色植物的光合作用使自然界中氧原子的总数增加
D.碳、氧循环使大气中氧气和二氧化碳的含量保持相对稳定
45.从原子论到分子学说,原子——分子论的创立,奠定了近代化学的基础,阅读下列材料回答问题:
材料一:1803年,道尔顿提出原子论,认为所有物质都是由原子构成的。单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成。
材料二:1811年,阿伏加德罗引入新的概念——分子,提出了分子学说。对于化合物而言,分子相当于道尔顿所谓的“复杂原子”;对于单质而言,同种原子可以结合成单质原子。
(1)完成下列表格中的空格部分:
物质 甲烷 氯气 五氧化二磷 氦气
构成物质的微粒 (写微粒符号) CH4 Cl2 P2O5
(2)表中微粒中符合道尔顿“复杂原子”的是 (写化学式)。
(3)五氧化二磷的相对分子质量为 。
(4)你同意材料一中加点文字部分的观点吗 答: (填“同意”或“不同意”),请选用(1)表中的物质说明理由: 。
(5)从原子论的创立到分子学说的提出,谈谈你对科学理论的发展有何感想 。
46.清明节吃“青团”是湖州人的一种传统习俗。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。
(1)侧柏莲酮芳香油中C、H、O元素的质量比为 。
(2)计算侧柏莲酮芳香油中碳元素的质量分数(精确到0.1%)。
(3)5.84 克侧柏莲酮芳香油中的碳元素质量与多少克葡萄糖(C6H12O6)中的碳元素质量相同。
47.硫酸铵是农业中广泛使用的一种氮肥,其化学式为。试计算:
(1) 硫酸铵的相对分子质量。
(2) 硫酸铵中氮元素的质量分数。
(3) 尿素也是常用的一种氮肥,某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,根据它们含氮的质量分数分析肥效,购买哪种化肥更经济
答案解析部分
1.【答案】B
【解析】【分析】符号是一个标志,模型可以反应事物某些方面的特征,符号一般没这功能。
【解答】A、图中是原子结构的结构模型,属于模型,选项错误;
B、图中是节约用水的标识,不属于模型,选项正确;
C、图中是甲烷分子结构的结构模型,属于模型,选项错误;
D、图中是足球烯结构的结构模型,属于模型,选项错误,故选B。
故答案为:B。
2.【答案】D
【解析】【分析】A、根据化学式确定物质的元素组成分析;
B、根据同分子构成的物质,其分子由原子构成分析;
C、根据元素质量比为相对原子质量×原子个数之比分析;
D、根据相对分子质量为分子中各原子的相对原子质量之和分析。
【解答】A、 甲磺酸伊马替尼由碳、氢、氮、氧、硫五种元素组成 ,不符合题意;
B、 甲磺酸伊马替尼由分子构成,其一个分子由77个原子构成 ,不符合题意;
C、 甲磺酸伊马替尼中碳、氢、氧元素的质量比为(12×30):(1×35):(16×4) ,不符合题意;
D、 甲磺酸伊马替尼的相对分子质量是12×30+1×35+16×4+14×7+16×4+32= 589 ,符合题意;
故选D。
3.【答案】D
【解析】【分析】 A.Si元素和C元素属于非金属元素,故A说法错误;
B.C 元素的核电荷数为6,故B错误;
C.相对原子质量是有单位的,其单位为“1”,铝元素的相对原子质量质量是26.98,故C错误;
D.13 号元素为Al元素,的离子符号是 A13+ ,故D正确;
故答案为:D
【点评】根据相对原子质量单位为“1”,铝元素的相对原子质量质量是26.98进行解答;C和Si元素属于非金属元素;根据元素周期表提供的信息进行判断。
4.【答案】C
【解析】【分析】A、构成物质的微粒有分子、原子、离子。
B、根据单质的概念分析。
C、根据元素的定义分析。
D、根据化合物的定义来分析解答.
【解答】A. 构成物质的微粒除分子外,还有原子、离子也能构成物质;故错误;
B. 单质只含一种元素,含一种元素的物质不一定是单质,如氧气和臭氧的混合物中只含有一种元素,属于混合物,故错误;
C. 质子数相同的原子一定属于同种元素,同种元素质子数一定相同,故正确;
D. 化合物是由不同种元素组成的纯净物,化合物中最少含有两种元素,但是不同种元素组成的物质不一定是化合物,可能是混合物故正确。
故答案为:C。
5.【答案】C
【解析】【分析】先找与所给物质中固体的元素质量比,再由碳元素质量分数确定出其它元素的质量分数或质量分数之和,利用物质中元素质量关系计算出未知质量分数。
【解答】C2H4O可看作是C2H2和H2O,则C2H2和C2H4O组成的混合气体,可看作是C2H2和H2O两部分组成, 其中碳元素的质量分数为72%, 设C2H2中氢元素质量分数为x,24:2=72%:x,x=6%,则H2O的质量分数为1-72%-6%=22%,其中H2O中氢、氧元素质量比为1:8,则氧元素质量分数为。
故选C。
6.【答案】A
【解析】【分析】化学式,在宏观上表示一种物质,还表示物质是由什么元素组成的;
微观上,表示一个分子,还表示一个分子是由几个什么原子构成的。
【解答】① 由二氯甲烷的化学式可知,二氯甲烷是由碳、氢、氯3种元素组成的化合物,故正确。
② 由二氯甲烷的化学式可知,二氯甲烷是由碳、氢、氯3种元素组成的化合物,不是混合物,故错误。
③ 1个二氯甲烷分子是由1个碳原子、2个氢原子和2个氯原子构成的,则它的分子中碳、氢、氯元素的原子个数比是1:2:2,故正确。
④ 二氯甲烷是由二氯甲烷分子构成的,故错误。
所以,①③说法正确。
故答案为:A。
7.【答案】C
【解析】【分析】根据由同种元素组成的纯净物为单质,化学式右下角数字为一个分子中原子个数,相对分子质量为分子中各原子的相对原子质量之和分析。
【解答】 ①C60是一种由碳元素组成的单质,正确,②错误,③一个分子中含有60个碳原子,正确,④它的分子质量为12×60=720,错误,⑤正确。
故选C。
8.【答案】C
【解析】【分析】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。
【解答】A.秋水仙碱的化学式为C22H25NO6,可见它是由碳、氢、氮、氧四种元素组成的,故错误;
B.秋水仙碱的化学式为C22H25NO6,可见一个秋水仙碱分子中有22个碳原子、25个氢原子、1个氮原子和6个氧原子,故错误;
C.秋水仙碱的化学式为C22H25NO6,可见其中碳、氢、氮、氧原子个数比为22:25:1:6,故正确;
D.秋水仙碱的化学式为C22H25NO6,其中碳元素的质量为:12×22=264;氢元素的质量为1×25=25;氮元素的质量为14;氧元素的质量为16×6=96,可见其中碳元素的质量分数最大,故错误。
故答案为:C
9.【答案】B
【解析】【分析】光合作用过程中,二氧化碳中的氧原子可以转移到有机物中,也可以转移到氧气中,水中的氧原子可以转移到有机物中,也可以转移到氧气中。
【解答】用标记的H218O、CO2和H2O、C18O2分别供给两组植物,来明确光合作用产物中氧元素的来源。一个C18O2中含有的质子个数为6+8+8=22,故B正确,ACD错误。
故答案为:B。
10.【答案】D
【解析】【分析】根据相对原子质量=质子数+中子数分析。
【解答】 相对原子质量=质子数+中子数,原子中质子数=核电荷数,已知某原子的核电荷数为15,原子核中有16个中子,则该原子的相对原子质量约为31.
故选D。
11.【答案】A
【解析】【分析】 A、根据分子结构图示来分析解答;
B、根据分子结构图示来分析解答;
C、根据分子结构图示中元素组成来计算解答;
D、根据分子结构图示中元素组成来计算解答。
【解答】A、由题图可知,每个过氧乙酸分子由2个碳原子4个氢原子、3个氧原子构成,化学式为C2H4O3,A正确;
B、过氧乙酸由过氧乙酸分子构成,过氧乙酸分子由C、H、O原子构成,B错误;
C、过氧乙酸中C、H、O元素的质量比为( 12×2) :(4×1):( 16×3)= 6:1:12,故氧元素的质量分数最大,C、D错误。
故选A。
12.【答案】D
【解析】【分析】根据元素周期表中原子序数=质子数及中子呈中性分析。
【解答】A、中子呈中性, 只由四个中子构成的粒子也呈中性,不符合题意;
B、 氦的相对原子质量为4,该粒子的相对原子质量也为4,所以质量当于一个氦原子的质量 ,不符合题意;
C、 中子呈中性,失去一个中子后也不显电性 ,不符合题意;
D、 该元素为零号元素,在周期表中与氢元素不占同一位置 ,符合题意;
故选D。
13.【答案】B
【解析】【分析】根据氢原子相对原子质量为1, 相对原子质量=质子数+中子数,相对原子质量倍数即为原子质量倍数分析。
【解答】 Uus原子的原子核内有117 个质子,原子质量约是氢原子质量的291 倍,则相对原子质量为291,该原子中子数为 174.
故选B。
14.【答案】D
【解析】【解答】解:根据萨罗的分子模型图,1个萨罗分子是由13个碳原子、10个氢原子和3个氧原子构成的,则该物质的一个分子中含有26个原子;化学式为:C13H10O3.
①1个萨罗分子是由13个碳原子、10个氢原子和3个氧原子构成的,则该物质的一个分子中含有26个原子,故正确;
②由萨罗的化学式可知,它是由碳、氢、氧三种元素组成的,不符合氧化物是由两种元素组成的特征,故错误;
③萨罗(Salol)中碳元素与氧元素的质量比为(12×13):(16×3)=156:48,故正确;
④相对分子质量的单位不是“g”而是“1”,通常省略,故错误;
⑤有机高分子化合物的相对分子质量大到几万甚至几十万,而该物质色相对分子质量为:12×13+1×10+16×3=214,不属于有机高分子化合物,故错误;
⑥元素是个宏观概念,只讲种类不讲个数,故错误;
⑦由分子结构模型可知,萨罗的化学式为:C13H10O3.故正确.
故选D.
【分析】由分子结构模型书写出物质的化学式,然后进行相关的分析解答.
15.【答案】B
【解析】【分析】根据元素符号表示一种元素和该元素一个原子,若对应单质由原子构成,元素符号还表示一种物质分析。
【解答】A、H可表示氢元素、一个氢原子,但不能表示氢气这种物质,不符合题意;
B、Fe可表示铁元素、一个铁原子,还能表示铁这种物质,符合题意;
C、Cl可表示一个氯原子,还能表示氯元素,不符合题意;
D、C可表示碳元素、一个碳原子,还能表示碳这种物质,不符合题意;
故选B。
16.【答案】C
【解析】【分析】分析各个选项中化学式的含义,哪个完全符合四个条件,哪个就是正确选项。
【解答】A.C能够说明这种物质只由一种元素组成,故A错误;
B.O3能够表示臭氧这种物质,但是却表示该物质只由一种元素组成,故B错误;
C.SO2表示二氧化硫这种物质,还表示一个二氧化硫的分子,既能表示该物质由硫和氧两种元素组成,也可以表示一个分子由三个原子构成,故C正确;
D.NH3表示氨气这种物质,但是表示一个氨气分子由四个原子构成,故D错误。
故选C。
17.【答案】D
【解析】【分析】根据元素质量比与原子个数比计算R的相对原子质量,由此确定R的元素种类分析。
【解答】 R与0的质量比为7 : 16, 设R的相对原子质量为x,x:32=7:16,则x=14,R为氮元素, 化学式为NO2 。
故选D。
18.【答案】D
【解析】【分析】当化合价为奇数时,首先写出两种化合物的化学式,然后根据相对分子的质量为组成分子的各原子的相对原子质量之和列出两个方程,从而计算出该元素的化合价。【解答】设该元素化合价为+x价,相对原子质量为y。
当x为奇数时,氧化物化学式为 R2Ox,硫酸盐的化学式为R2(SO4)x,
根据相对分子质量的定义得到:
2y+16x=a,
2y+96x=b;
解得:。
故选D。
19.【答案】A
【解析】【分析】先根据质量守恒定律求出“未知”处的质量,然后再根据催化剂的概念、分解反应的概念和质量守恒定律逐一分析,即可做出正确选择.
【解答】解:A、由图表可知A没有参与反应,C质量减少了4g,D质量减少了6g,B的质量增加了10g,因此反应物是B,生成物是C和D,反应可表示为C+D→B,但不知微粒个数比,错误;
B、A物质的质量在反应前后没有改变,故可判断A物质可能是该反应的催化剂,正确;
C、根据质量守恒定律,则反应后C物质的质量=20×4﹣(20+30+14)=16g;C、D质量减少,而只有B增加,所以是两种物质生成一种物质,为化合反应,正确;
D、根据质量守恒定律,则反应后C物质的质量=20×4﹣(20+30+14)=16g,正确;
故选A.
20.【答案】C
【解析】【分析】根据化合物的化学式及H和O元素在化合物中的化合价,利用化合物中元素的正负化合价的代数和为0来解答。【解答】因化合物中H元素为+1价,O元素的化合价为-2价,
设元素X的化合价为x,由化学式为HnXO2n-1,根据化合物中元素的正负化合价的代数和为0,
则(+1)×n+x+(-2)×(2n-1)=0;
解得:x=+(3n-2)。
故选C。
21.【答案】C
【解析】【分析】根据相对分子质量的计算方法分析判断。
【解答】根据化学式可知,三个分子都由1个金属原子和1个 SO4 组成。
则它们的相对分子质量等于金属原子的相对原子质量与硫酸根原子团的相对原子质量之和。
要比较三者相对分子质量的大小,只需比较三个金属原子的相对原子质量大小即可。
故选C。
22.【答案】B
【解析】【解答】已知氧元素的化合价为-2价,Fe2O3中Fe化合价为+3价, Fe单质中化合价为0价;反应前CO中C元素的化合价为+2价,反应后CO2中C元素的化合价为+4价;由此可知反应前后化合价发生变化的元素为Fe和C;故选B.
【分析】根据在化合物中正负化合价代数和为零,进行解答
23.【答案】D
【解析】【分析】根据NaHS、MgSO4、NaHSO4的化学式,可以发现NaH相对原子质量和为24,可以看成与Mg是等同的,即可以把NaH它们看成一个整体,就可以通过硫的质量分数求镁的质量分数,余下的就是氧元素质量分数。
【解答】因为NaHS、NaHSO4组成中钠和氢的个数比是1:1,
它们的相对原子质量之和为:23+1=24;
因此可以把钠元素和氢元素放在一起看做镁元素;
这样三种物质相当于是MgS、MgSO4、MgSO4,
此时三种物质中镁和硫的个数比都是1:1;
硫元素的质量分数为4X%,
所以镁元素的质量分数为:,
则混合物中氧元素的质量分数为:1-4X%-3X%=(100-7X)%。
故选D。
24.【答案】B
【解析】【分析】原子的个数之比等于元素的实际质量与相对原子质量的比值之比。
【解答】在化学式中,A、B的原子个数之比为:,则该化合物的化学式为:AB2。
故选B。
25.【答案】D
【解析】【分析】原子失去电子带正电,得到电子带负电;相对原子质量=质子数+中子数。
【解答】某阳离子Mn+的核外电子共有x个电子,它是由该原子失去n个电子形成的,那么该原子的核外电子数为:x+n。
根据“质子数=核外电子数”可知,该原子的质子数为x+n;
那么它的相对原子质量为:x+n+y。
故选D。
26.【答案】32;1
【解析】【分析】(1)根据题意,甲醇是由碳、氢、氧三种元素组成的有机物,氢元素质量分数约为12.5%,且每个分子中含有4个氢原子分析。
(2)根据化学式的含义分析。
【解答】解:(1)甲醇的相对分子质量=1×4÷12.5%=32;
(2)一个甲醇分子中含氧原子的个数=32×50%÷16=1
27.【答案】(1)Ca
(2)
(3)
【解析】【分析】(1)根据钙元素的符号解答;
(2)硫酸钙中的阴离子就是硫酸根离子,据此写出化学符号;
(3)在元素符号的正上方标上正负号和数字,就是它的化合价。
【解答】(1)石灰岩中含有钙元素,符号为Ca;
(2)硫酸钙中含有的 阴离子为: ;
(3)氢氧化铁中国铁元素显+3价,那么符号为: 。
28.【答案】16(b+a)/(b-a)
【解析】【分析】根据相对分子质量的计算以及题干信息分析;
【解答】根据题意,一个 12CO2 分子中的1个氧原子质量为 , 则 2CO的分子质量是,则 2CO的相对分子质量是 。
29.【答案】(1)原子
(2)氯化钠;水分子
(3)分子分成原子,原子重新组合成新的分子
【解析】【分析】(1)在化学反应中,分子划分成原子,原子重新组成分子,所以甲是原子。
(2)离子构成的物质有:大多数盐、碱和活泼金属氧化物等。
物质是由分子构成的,保持物质的化学性质的最小粒子是分子。
(3)根据化学反应的实质分析。
【解答】(1)在化学反应中,分子划分成原子,原子重新组成分子,所以甲是原子。
(2)在水、汞和氯化钠三种物质中,氯化钠属于盐类,由离子构成的物质是氯化钠。
水是由水分子构成的,保持水的化学性质的最小粒子是水分子。
(3)从微观来看,化学反应的实质是分子分成原子,原子重新组合成新的分子。
30.【答案】B;A;CD
【解析】【分析】根据由同种分子构成的物质为纯净物,由不同种分子构成的物质为混合物,纯净物的分子中由同种原子构成,为单质,由不同种原子构成为化合物分析。
【解答】图示所给各物质中,B由同种分子构成,且每个分子由不同种原子构成,属于化合物,A由同种分子构成,且每个分子由同种原子构成,属于单质,C、D由不同种分子构成,属于混合物。
故答案为:B;A;CD。
31.【答案】U3O4;UO2
【解析】【分析】 根据:物质中某元素的质量分数=×100%.
【解答】 设齐乌斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为U3O4;
设阿姆斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为UO2.
32.【答案】(1)C2H4O2;醋酸(或乙酸)
(2)1:2:1
(3)40
【解析】【解答】(1)由分子结构模型可知,该物质的1个分子是由2个碳原子、4个氢原子和2个氧原子构成的,其化学式为C2H4O2,食醋是醋酸(或乙酸)的水溶液;故填:C2H4O2;醋酸(或乙酸);
(2)由醋酸的化学式可知,1个醋酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,故填:1:2:1;
(3)由醋酸的化学式可知,其中碳元素的质量分数为:=40%.故填:40.
【分析】(1)根据分子结构模型来分析其化学式;
(2)根据该物质的分子结构来分析;
(3)根据化合物中,元素质量分数的计算方法来分析.
33.【答案】 中子数不同;7:6
【解析】【分析】碳﹣12原子的核内有6个质子和6个中子,碳﹣14原子在考古学中常被用来测定出土文物的年代,该原子的核内有6个质子和8个中子。
【解答】解:碳﹣12原子的核内有6个质子和6个中子,碳﹣14原子的核内有6个质子和8个中子,两种原子中中子数不同;根据相对原子质量=质子数+中子数,可知碳14原子的质量与碳12原子的质量之比为14:12=7:6
故答案为:中子数不同 7:6
34.【答案】(1)(m+n)/8(m+2n)
(2)17n/(9m+17n)或
【解析】【分析】(1)根据元素质量比为相对原子质量×原子个数之比分析;
(2)根据物质的相对质量比=物质的实际质量比,溶质质量分数=溶质质量/溶质质量+溶剂质量分析。
【解答】(1) 该溶液中氢元素与氧元素的质量比为(2m+2n):[(m+2n)×16] = (m+n)/8(m+2n) .
(2) 该双氧水溶液溶质的质量分数为=。
故答案为:(1 )(m+n)/8(m+2n) ;(2) 17n/(9m+17n)或 。
35.【答案】
【解析】【分析】相对分子质量等于各原子的相对质量之和。
【解答】由题意可知,金属元素显正价,设该物质的化合价为x
则其氢氧化物为R(OH)x;
氯化物为RClx;
氢氧化物相对分子质量 m=R+(16+1)x;
氯化物的相对分子质量 n=R+35.5x;
上面两式子相减
n-m=(35.5-17)x
x=
故答案为:
36.【答案】质子;中子;氢
【解析】【分析】根据同种元素的不同种原子质子数相同,中子数不同分析。
【解答】 由图示的原子构成可知,氕、氘、氚三种原子的核内质子数相同,中子数不同,把这三种原子称为氢原子。
故答案为:质子;中子;氢。
37.【答案】(1)H2SiO3
(2)混合物
【解析】【分析】本题难度不大,掌握化学式与元素符号的书写方法、纯净物与混合物的判别方法是正确解答本题的关键。(1)由偏硅酸的化学式,偏硅酸是由氢、硅、氧三种元素组成的,书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写,进行分析解答;(2)既然是矿泉水,那么其中除水外一定还含有一些矿物元素,所以是混合物。
【解答】(1)书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.说明书中偏硅酸的化学式书写不规范,其正确的化学式为H2SiO3,故填:H2SiO3;
(2)既然是矿泉水,那么其中除水外一定还含有一些矿物元素,所以是混合物,故填:混合物。
故答案为:(1)H2SiO3;(2)混合物。
38.【答案】(1)+3
(2)BxAy
【解析】【分析】(1)在化学式中,正负化合价的代数和为零;
(2)首先根据两个化学式推算出A、B元素的化合价,再根据“正负化合价代数和为零”计算出A、B组成化合物时原子的个数之比即可。
【解答】(1)根据化学式 Na5PxO10可知,(+1)×5+(+5)x+(-2)×10=0,解得:x=+3;
(1)根据NaxA 得到:(+1)x+A=0,那么A的化合价为-x;根据 BCly得到:B+(-1)y=0,那么B的化合价为+y。设A、B组成化合物的化学式为BmAn,B根据正负化合价代数和为零得到:my+(-x)n=0,则它们的原子个数之比为:m:n=x:y,因此化学式为BxAy。
39.【答案】A-n-16m
【解析】【分析】相对分子质量等于相对原子质量与个数的乘积之和。
【解答】设R的相对原子质量为x,
那么:1×n+x+16m=A;
解得:x=A-n-16m。
40.【答案】(1)+3
(2)菜中的亚硝酸盐含量随时间的增加而增加,温度高随不密封菜中的亚硝酸盐含
(3)低温、密封,尽量缩短储存时间
(4)使得出的结论更客观,更具有普遍意义
【解析】【分析】(1)原子团的化合价等于各组成元素化合价的代数和;
(2)根据表格数据,分析亚硝酸盐含量随时间,温度和是否密封等因素的变化规律;
(3)根据前面得到的结论分析解答;
(4)在科学探究中,使用不同的器材多次完成实验,可以收集到多组数据,从而使得出的结论更客观,具有普遍意义。
【解答】(1)亚硝酸盐中含有亚硝酸根离子
,其中O元素的化合价是-2价,根据“原子团的化合价等于各组成元素化合价的代数和”得到:x+(-2)×2=-1,解得:x=+3价。
(2)根据表格数据可知:菜中的亚硝酸盐含量随时间的增加而增加;温度高,不密封菜中的亚硝酸盐含量会明显偏高。
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是:低温、密封,尽量缩短储存时间。
(4)用多种菜做实验的目的是:使得出的结论更客观,更具有普遍意义。
41.【答案】(1)力能改变物体运动状态
(2)A;B
【解析】【分析】
(1)原子是由原子核和核外电子组成的。
(2)金的延展性好,相对质量大,便于做靶核。
【解答】
(1)卢瑟福提出核式结构模型过程中运用了许多相关知识,如“同种电荷相互排斥”。另外还涉及到知识有:力能改变物体的运动状态;
(2)A.金的相对原子质量大,a粒子靠近金的原子核时更容易改变运动状态,故A符合题意;
B.金的延展性好,可制得很薄的金箔,便于a粒子通过,故B符合题意;
C.金的颜色为黄色,与a粒子散射实验关系不大,故C不符合题意;
D.金的熔点较高,与本实验没有多大的联系,故D不符合题意;
故选AB。
故答案为:(1)力能改变物体的运动状态;(2)AB。
【答案】(1)He
(2)CH4、P2O5
(3)142
(4)不同意;表格中的氯气(Cl2)就是由同种原子构成的分子
(5)科学理论的发展需要大胆创新(或科学理论是不断传承和发展的)
【解析】【分析】(1)根据化学式的书写分析
(2)根据化学式的书写分析
(3)根据相对分子质量计算
(4)根据题干信息分析;
(5)根据题干信息分析;
【解答】(1)氦气属于稀有气体,是由原子构成,故化学式即其元素符号,故填:
(2)根据题干信息,“1803年,道尔顿提出原子论,认为所有物质都是由原子构成的,单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子构成,“复杂原子"由不同原子按一定整数比例简单构成",表格中CH4、P2O5分别由不同种元素组成,属于化合物,故其属于复杂原子:
(3)五氧化二磷的相对分子质量是
(4)材料一中提到单质由原子直接构成,同种原子相互排斥不能结合,而氯气由氯分子构成,每个氯分子由两个相同的氯原子构成,故不同意其观点;
(5) 科学理论的发展 的感想是: 科学理论的发展需要大胆创新(或科学理论是不断传承和发展的)
43.【答案】(1)混合物
(2)34
(3)162:17:88
(4)60.7g
【解析】【分析】(1)根据连花清瘟胶囊含有多种物质,属于混合物来分析解答;
(2)根据相对分子质量就是化学式中各个原子的相对原子质量的总和来分析解答;
(3)根据化合物中各元素的质量比=各原子的相对原子质量×原子个数之比来分析解答;
(4)根据元素的质量=化合物的质量×元素的质量分数来分析解答。
【解答】(1)中成药“连花清瘟胶囊”的有效成分之一是连翘苷,则连花清瘟胶囊属于混合物;
(2)12×27+x+16×11=534,则x=34;
(3)连翘苷中碳元素、氢元素、氧元素的质量比为(12×27):(1×34):(16×11)=162:17:88;
(4)100g“连翘苷”中碳元素的质量为100g×(12×27/534)×100%≈60.7g。
44.【答案】(1)元素
(2)64
(3)A;D
【解析】【分析】(1)根据物质的组成来分析;
(2)根据元素的质量=化合物的质量X化合物中该元素的质量分数来分析;
(3) 根据碳循环和氧循环的原理来分析。
【解答】(1)物质是由元素组成的,所以“碳循环”和“氧循环”中的“碳”和“氧”指的是元素;
(2)氧气是由氧元素组成的,所需氧气的质量即为88g二氧化碳中氧元素的质量,为:88gxx100=64g;
(3) A、每个人都在参与碳、氧循环,A说法正确;
B、碳、氧循环过程中各元素质量守恒,但是化合价会发生改变,B说法错误;
C、绿色植物的作用是通过光合作用消耗二氧化碳、产生氧气,但是氧原子总数不变,C说法错误;
D、碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定,D说法正确;
故填: AD。
45.【答案】(1)60:5:8
(2)C10H10O的相对分子质量=12×10+10+16=146
碳元素的质量分数=120/146 × 100%=82.2%
(3)侧柏莲酮芳香油中碳元素质量=5.84g×120/146=4.8g葡萄糖中碳元素的质量分数=6×12/6×12+12+6×16=40%葡萄糖的质量=4.8g/40%=12g
【解析】【分析】(1)元素质量比等于各元素相对原子质量总和之比。侧柏莲酮芳香油中C、H、O元素的质量比=(12×10):(1×10):16=60:5:8
(2)元素质量分数等于该元素的相对原子质量总和与该物质的相对分子质量的比值;
(3)化合物中某元素质量=该物质的质量×该元素的质量分数,根据碳元素的质量守恒列式进行计算。
46【答案】(1)硫酸铵的相对分子质量=(14+1×4)×2+32+16×4=132。
(2)硫酸铵中氮元素的质量分数=×100%≈21.2%。
(3)尿素中氮元素的质量分数= ×100%≈46.7%,
某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,售价分别为1.3元和1.8元,1元钱能购买的硫酸铵的质量=×21.2%≈0.16kg,
1元钱能购买的尿素中含氮元素的质量=×46.7%≈0.26kg;
0.16kg<0.26kg,所以,购买尿素更经济。
【解析】【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)在化合物中元素的质量分数=×100%。
(3)由化合物中元素的质量分数的计算方法计算出尿素中氮元素的质量分数,结合题意,某市场中硫酸铵和尿素每千克售价分别为1.3元和1.8元,进行分析。
1 / 1
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
