第2章第三节原子结构的模型课件(第2课时)
文档属性
| 名称 | 第2章第三节原子结构的模型课件(第2课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2016-02-24 00:00:00 | ||
图片预览








文档简介
课件25张PPT。原子结构的模型第二课时第三节分析表格,可得出什么结论?(1)核电荷数=质子数=核外电子数。
(2)中子数不一定等于质子数。
(3)原子内可以没有中子。
(4)原子的种类不同,质子数一定不同。原子{质子核外电子中子原子核{(+)(—)(+) 1、核电荷数?不带电2、原子核内哪些微粒数目是相等的?
氧原子 8个质子碳原子 6个质子氢原子 1个质子氦原子 2个质子硫原子 16个质子氯原子 17个质子1、科学上把具有相同的质子数(即核电荷数)的一类原子总称为元素。例如:我们把质子数为8的氧原子总称为氧元素。氧分子、二氧化碳分子、水分子中都有氧原子,且氧原子原子核内都有8个质子,属于同一类 元素。同种元素的原子核电荷数一定相同, 不同种元素的原子核电荷数一定不同,
元素的种类由原子中的核电荷数决定。2、元素的特征:读图:(1)A原子核中有___个质子, ___个中子。
(2)B原子核中有 ___个质子,___个中子。
(3)C原子核中有___个质子,____个中子。· 8 8 8 98 10 他们是同一种元素吗?这三个原子完全一样?是同一元素,因为质子数相同,都是氧元素
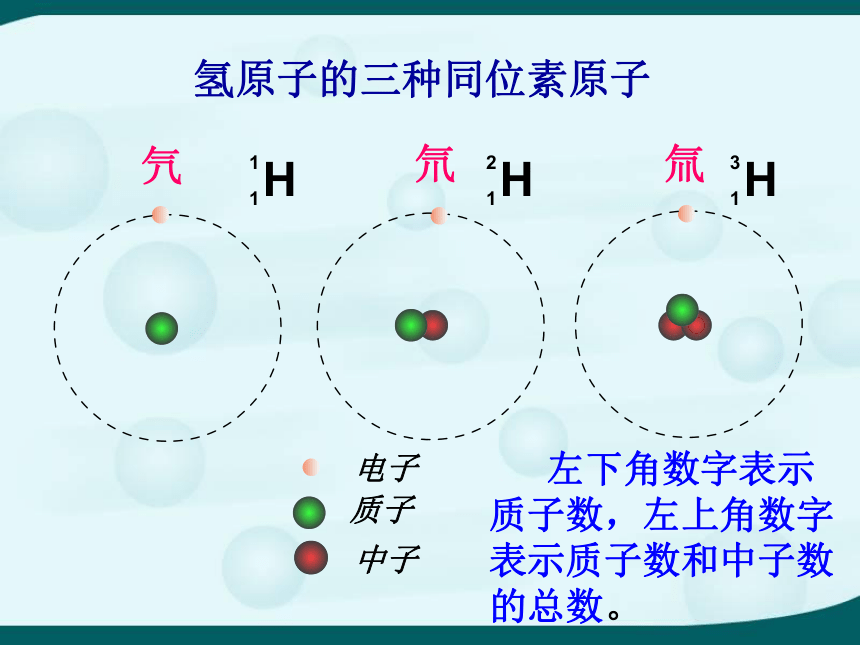
他们不一样,因为中子数不同3、原子中原子核内质子数相同、中子数不相同的同类原子统称为同位素(原子)。 如原子核内质子数是8个的所有原子(不管中子数是多少)都是氧原子,都是氧元素的同位素原子。元素与同位素的区别:
元素是同位素的总称,
同位素是一种元素的不同种原子。 左下角数字表示质子数,左上角数字表示质子数和中子数的总数。考考你R:表示某种元素
Z:表示这种元素的质子数(核电荷数)
A:质子数(Z)和中子数(N)的总数
即:A = Z + N (质量数)写出氧元素的三种同位素原子的符号? 【思考】 氧的三种同位素原子其核外电子各有几个?完成下表并说说原因。888111常见元素的同位素及其符号和用途 示踪4、原子的同位素的应用四、带电的原子——离子【现象】 钠剧烈燃烧,产生白烟,反应结束后瓶内有白色固体。
钠原子失去一个电子成为一个带正电的微粒叫钠离子氯原子得到一个电子成为一个带负电的微粒 叫氯离子1.我们把带电的原子(或原子团)叫离子2.离子也是构成物质的一种微粒。3.构成物质微粒共有分子、原子、离子。四、离子阳离子:带正电的原子或原子团。阴离子:带负电的原子或原子团。练习:1、氕、氘、氚三种原子具有相同的( )
A、原子质量 B、原子核结构
C、核电荷数 D、中子数C2、 我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦3。氦3的原子核是由一个中子和两个质子构成的,其原子核外电子数为( )
A、1 B、2 C、3 D、6B3.有两种原子,所含的质子数相同,下列说法正确的是 ( )
A.它们属于同种元素
B.它们属于不同种元素
C.它们属于同种原子
D.以上叙述都不对
4.氕、氘、氚三种原子的______相同,互为_________。
A质子数同位素原子5.具有相同_________的同类原子总称为元素,铁钉、铁锈中都含有________。
6.元素的种类决定于原子的 ( )
A.中子数 B.质子数
C.相对原子质量 D.电子数
7.下列有关氯化钠的叙述正确的是 ( )
A.氯化钠由氯化钠分子构成
B.氯化钠由钠原子和氯原子构成
C.氯化钠由钠离子和氯离子构成
D.以上叙述都不对核电荷数铁元素B C8.图1-7是水分子分解示意图,该图说明了 ( )
A.水由氢气和氧气组成
B.水由水原子构成
C.水分子中含有氢分子和氧分子
D.水分子在化学反应中可以再分
?
?图1-7D9.科学家制造出原子核内质子数为112的新原子,关于该新原子的下列叙述正确的是 ( )
A.其核内中子数为112
B.其核外电子数为112
C.原子带正电荷112个
D.以上都不对
10.下列叙述正确的是 ( )
A.二氧化碳是由碳和氧气组成的
B.1个二氧化碳分子是由2个氧原子和1个碳原子构成的
C.二氧化碳是由碳原子和氧原子组成的
D.二氧化碳分子是由2个氧原子和1个碳原子构成的BB11.下列有关原子的说法正确的是 ( )
A.原子是不可再分的最小微粒
B.原子都是由质子、中子和电子构成的
C.原子的类别是由原子核内的质子数决定的
D.以上说法都不确切
12.下列叙述正确的是( )
A、 属于同位素不同原子即其核电荷数相同但核外电子数不同。
B、 属于同位素不同原子即其核电荷数相同但中子数不同。
C、 属于同位素不同原子即其核外电子数相同但核电荷数不同。
D、属于同位素不同原子即其中子数相同但核外电子数不同。 CB
(2)中子数不一定等于质子数。
(3)原子内可以没有中子。
(4)原子的种类不同,质子数一定不同。原子{质子核外电子中子原子核{(+)(—)(+) 1、核电荷数?不带电2、原子核内哪些微粒数目是相等的?
氧原子 8个质子碳原子 6个质子氢原子 1个质子氦原子 2个质子硫原子 16个质子氯原子 17个质子1、科学上把具有相同的质子数(即核电荷数)的一类原子总称为元素。例如:我们把质子数为8的氧原子总称为氧元素。氧分子、二氧化碳分子、水分子中都有氧原子,且氧原子原子核内都有8个质子,属于同一类 元素。同种元素的原子核电荷数一定相同, 不同种元素的原子核电荷数一定不同,
元素的种类由原子中的核电荷数决定。2、元素的特征:读图:(1)A原子核中有___个质子, ___个中子。
(2)B原子核中有 ___个质子,___个中子。
(3)C原子核中有___个质子,____个中子。· 8 8 8 98 10 他们是同一种元素吗?这三个原子完全一样?是同一元素,因为质子数相同,都是氧元素
他们不一样,因为中子数不同3、原子中原子核内质子数相同、中子数不相同的同类原子统称为同位素(原子)。 如原子核内质子数是8个的所有原子(不管中子数是多少)都是氧原子,都是氧元素的同位素原子。元素与同位素的区别:
元素是同位素的总称,
同位素是一种元素的不同种原子。 左下角数字表示质子数,左上角数字表示质子数和中子数的总数。考考你R:表示某种元素
Z:表示这种元素的质子数(核电荷数)
A:质子数(Z)和中子数(N)的总数
即:A = Z + N (质量数)写出氧元素的三种同位素原子的符号? 【思考】 氧的三种同位素原子其核外电子各有几个?完成下表并说说原因。888111常见元素的同位素及其符号和用途 示踪4、原子的同位素的应用四、带电的原子——离子【现象】 钠剧烈燃烧,产生白烟,反应结束后瓶内有白色固体。
钠原子失去一个电子成为一个带正电的微粒叫钠离子氯原子得到一个电子成为一个带负电的微粒 叫氯离子1.我们把带电的原子(或原子团)叫离子2.离子也是构成物质的一种微粒。3.构成物质微粒共有分子、原子、离子。四、离子阳离子:带正电的原子或原子团。阴离子:带负电的原子或原子团。练习:1、氕、氘、氚三种原子具有相同的( )
A、原子质量 B、原子核结构
C、核电荷数 D、中子数C2、 我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦3。氦3的原子核是由一个中子和两个质子构成的,其原子核外电子数为( )
A、1 B、2 C、3 D、6B3.有两种原子,所含的质子数相同,下列说法正确的是 ( )
A.它们属于同种元素
B.它们属于不同种元素
C.它们属于同种原子
D.以上叙述都不对
4.氕、氘、氚三种原子的______相同,互为_________。
A质子数同位素原子5.具有相同_________的同类原子总称为元素,铁钉、铁锈中都含有________。
6.元素的种类决定于原子的 ( )
A.中子数 B.质子数
C.相对原子质量 D.电子数
7.下列有关氯化钠的叙述正确的是 ( )
A.氯化钠由氯化钠分子构成
B.氯化钠由钠原子和氯原子构成
C.氯化钠由钠离子和氯离子构成
D.以上叙述都不对核电荷数铁元素B C8.图1-7是水分子分解示意图,该图说明了 ( )
A.水由氢气和氧气组成
B.水由水原子构成
C.水分子中含有氢分子和氧分子
D.水分子在化学反应中可以再分
?
?图1-7D9.科学家制造出原子核内质子数为112的新原子,关于该新原子的下列叙述正确的是 ( )
A.其核内中子数为112
B.其核外电子数为112
C.原子带正电荷112个
D.以上都不对
10.下列叙述正确的是 ( )
A.二氧化碳是由碳和氧气组成的
B.1个二氧化碳分子是由2个氧原子和1个碳原子构成的
C.二氧化碳是由碳原子和氧原子组成的
D.二氧化碳分子是由2个氧原子和1个碳原子构成的BB11.下列有关原子的说法正确的是 ( )
A.原子是不可再分的最小微粒
B.原子都是由质子、中子和电子构成的
C.原子的类别是由原子核内的质子数决定的
D.以上说法都不确切
12.下列叙述正确的是( )
A、 属于同位素不同原子即其核电荷数相同但核外电子数不同。
B、 属于同位素不同原子即其核电荷数相同但中子数不同。
C、 属于同位素不同原子即其核外电子数相同但核电荷数不同。
D、属于同位素不同原子即其中子数相同但核外电子数不同。 CB
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
