元素周期律和元素周期表1课件
图片预览





文档简介
课件21张PPT。 第 二 节
元素周期律和元素周期表预习提问默写1-20号元素符号(按周期表上的格式)
1、原子序数等于什么?
2、什么是周期性变化?
3、什么是元素周期律?
4、元素原子的哪些性质呈现周期性变化?
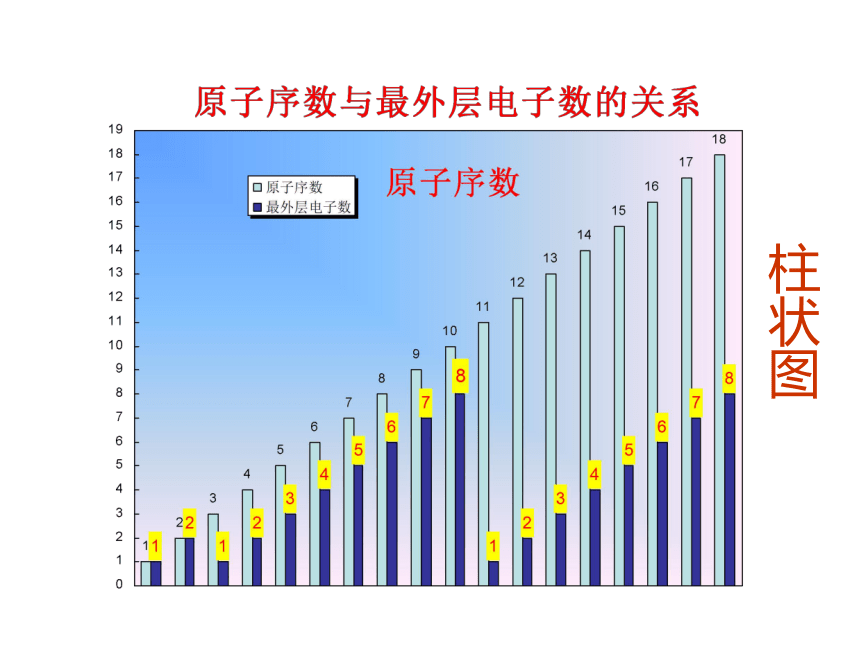
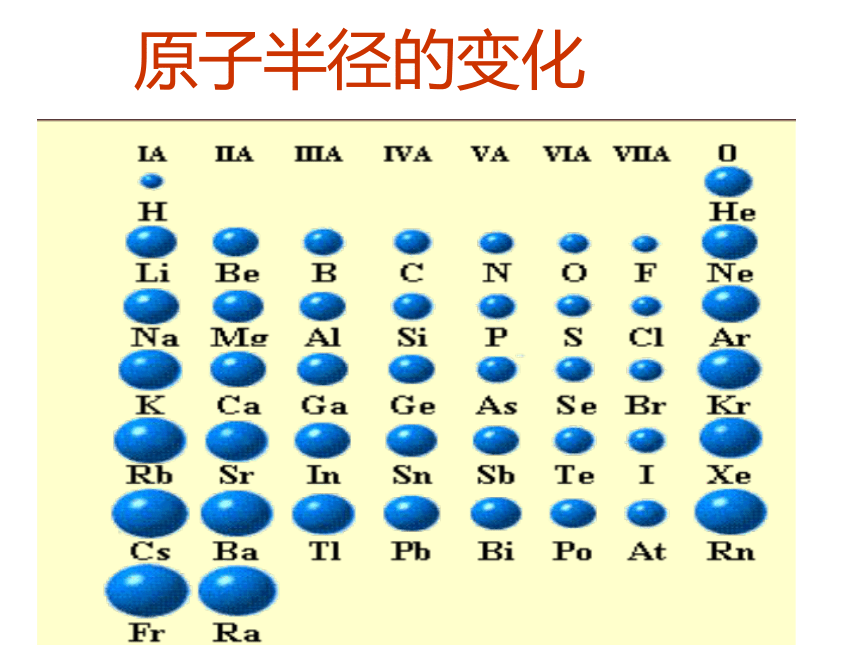
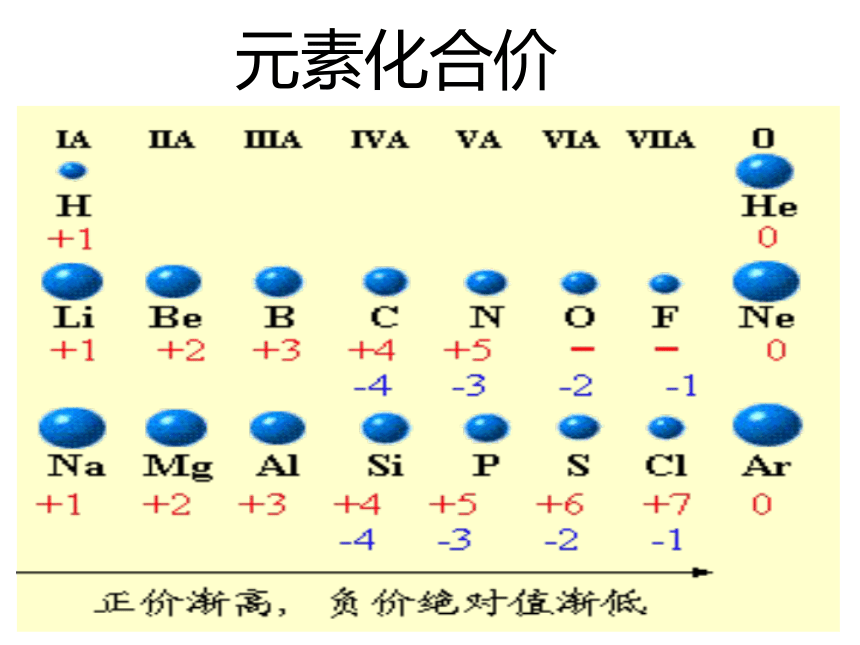
最外层电子排布;原子半径;元素的化合价1-18号原子核外电子排布柱状图原子半径的变化折线图元素化合价折线图探究一:元素周期律1 、定义
元素的性质随着原子序数的递增而呈周期性变化(1)最外层电子数排布:从1 → 8(H、He除外)(2)原子半径:大 → 小(除稀有气体外)(3)元素化合价:最高正价+1 → +7
最低负价-4 → -1
稀有气体为0思考:引起元素性质周期性变化的实质?随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(第一层 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 , -4→-1(稀有气体元素为零)决定了归纳出引起了2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。完成预习检测:B C A思考:原子半径的大小是如何变化的?
阴阳离子的半径又如何比较呢?完成学案探究一:元素周期律探究二:微粒半径大小的比较Li、Na 、 K
Na、Mg、Al
(3)Ca2+、 Cl-、 S2-
(4)Cl 、 Cl-
(5)Na 、 Na+规律:一层、二核、三电子
(1)电子层越多,半径越大
(2)电子层相同,核电荷数(质子数)越大半径越小。
(3)同种元素形成的微粒,核外电子越多,半径越大K>Na>LiNa>Na+ClMg>Al例题:比较下列微粒半径的大小完成学案中的微粒比较以及例题1、变式训练1预习提问
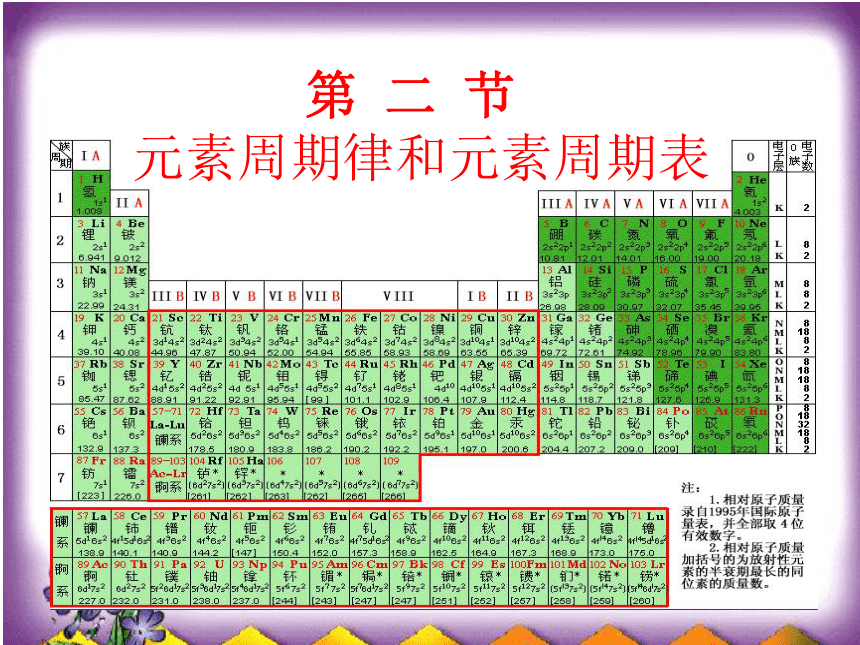
1、通过元素周期表可以知道哪些信息?
2、元素周期表的结构是怎样的?元素周期表的结构元素周期表结构周期:7个族:16个
(共18个纵列)短周期:第1、2、3周期,分别有2、8、8种元素长周期:第4、5、6周期,分别有18、18、32种元素不完全周期:第7周期,有20多种元素,排满应为32种元素主族:7个(ⅠA~Ⅶ A)副族:7个( Ⅰ B~Ⅶ B)第Ⅷ族:1个(第8、9、10三个纵列)零族:1个(稀有气体)三长三短一不全七主七副零八族七横十八纵7161871.2.34.5.677A7B18、9、100探究三:元素周期表中的几个等量关系 (2)周期序数=电子层数(电子层数决定周期数)(3)主族序数=最外层电子数=元素的最高正价(1)原子序数=核内质子数=原子的核外电子数(4)非金属元素:|最高正价|+|负价|=8完成学案中的例题2变式练习:推测第3周期第ⅥA族元素硫 S例:指出 、 在元素周期表中的位置C:第2周期第A族 Si:第3周期第VIA族2、请在虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线、标出周期序数和族序数、标出每周期包含的原子数目。 1
2
3
4
5
6
7
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
ⅠA ⅡAⅢBⅣBⅤB ⅥB ⅦB Ⅷ ⅠBⅡBⅢA ⅣAⅤAⅥAⅦA 02
8
8
18
18
32
32
2
10
18
36
54
86
118
小结:非金属元素均在主族和0族里思考:全部是金属的主族、全部是非金属的主族?小 结1、最外层电子排布;原子半径;元素的化合价随原子序数的递增呈周期性变化。
2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。
3、微粒半径大小的比较。
4、元素周期表的结构:三长三短一不全;
七主七副零八族。
总结:周期表的结构课堂检测1、X:第4周期ⅠA族; Y:第5周期ⅦA族;
2—8 A D BD BD D D D
9、 第5周期ⅦA族
10、3 VIA
11、AB A B AB ED D D A
元素周期律和元素周期表预习提问默写1-20号元素符号(按周期表上的格式)
1、原子序数等于什么?
2、什么是周期性变化?
3、什么是元素周期律?
4、元素原子的哪些性质呈现周期性变化?
最外层电子排布;原子半径;元素的化合价1-18号原子核外电子排布柱状图原子半径的变化折线图元素化合价折线图探究一:元素周期律1 、定义
元素的性质随着原子序数的递增而呈周期性变化(1)最外层电子数排布:从1 → 8(H、He除外)(2)原子半径:大 → 小(除稀有气体外)(3)元素化合价:最高正价+1 → +7
最低负价-4 → -1
稀有气体为0思考:引起元素性质周期性变化的实质?随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(第一层 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 , -4→-1(稀有气体元素为零)决定了归纳出引起了2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。完成预习检测:B C A思考:原子半径的大小是如何变化的?
阴阳离子的半径又如何比较呢?完成学案探究一:元素周期律探究二:微粒半径大小的比较Li、Na 、 K
Na、Mg、Al
(3)Ca2+、 Cl-、 S2-
(4)Cl 、 Cl-
(5)Na 、 Na+规律:一层、二核、三电子
(1)电子层越多,半径越大
(2)电子层相同,核电荷数(质子数)越大半径越小。
(3)同种元素形成的微粒,核外电子越多,半径越大K>Na>LiNa>Na+Cl
1、通过元素周期表可以知道哪些信息?
2、元素周期表的结构是怎样的?元素周期表的结构元素周期表结构周期:7个族:16个
(共18个纵列)短周期:第1、2、3周期,分别有2、8、8种元素长周期:第4、5、6周期,分别有18、18、32种元素不完全周期:第7周期,有20多种元素,排满应为32种元素主族:7个(ⅠA~Ⅶ A)副族:7个( Ⅰ B~Ⅶ B)第Ⅷ族:1个(第8、9、10三个纵列)零族:1个(稀有气体)三长三短一不全七主七副零八族七横十八纵7161871.2.34.5.677A7B18、9、100探究三:元素周期表中的几个等量关系 (2)周期序数=电子层数(电子层数决定周期数)(3)主族序数=最外层电子数=元素的最高正价(1)原子序数=核内质子数=原子的核外电子数(4)非金属元素:|最高正价|+|负价|=8完成学案中的例题2变式练习:推测第3周期第ⅥA族元素硫 S例:指出 、 在元素周期表中的位置C:第2周期第A族 Si:第3周期第VIA族2、请在虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线、标出周期序数和族序数、标出每周期包含的原子数目。 1
2
3
4
5
6
7
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
ⅠA ⅡAⅢBⅣBⅤB ⅥB ⅦB Ⅷ ⅠBⅡBⅢA ⅣAⅤAⅥAⅦA 02
8
8
18
18
32
32
2
10
18
36
54
86
118
小结:非金属元素均在主族和0族里思考:全部是金属的主族、全部是非金属的主族?小 结1、最外层电子排布;原子半径;元素的化合价随原子序数的递增呈周期性变化。
2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。
3、微粒半径大小的比较。
4、元素周期表的结构:三长三短一不全;
七主七副零八族。
总结:周期表的结构课堂检测1、X:第4周期ⅠA族; Y:第5周期ⅦA族;
2—8 A D BD BD D D D
9、 第5周期ⅦA族
10、3 VIA
11、AB A B AB ED D D A
