第三节元素周期表的应用第二课时
图片预览





文档简介
课件17张PPT。鲁科版普通高中课程标准实验教科书 化学2(必修)第一章
第三节元素周期表的应用
(第二课时)
【写方程式】
1.氯气+水
2.氯气尾气处理
3.氯气与二氧化硫混合通入水中
4.钠+水
5.钠+氧气(常温、加热分别写)
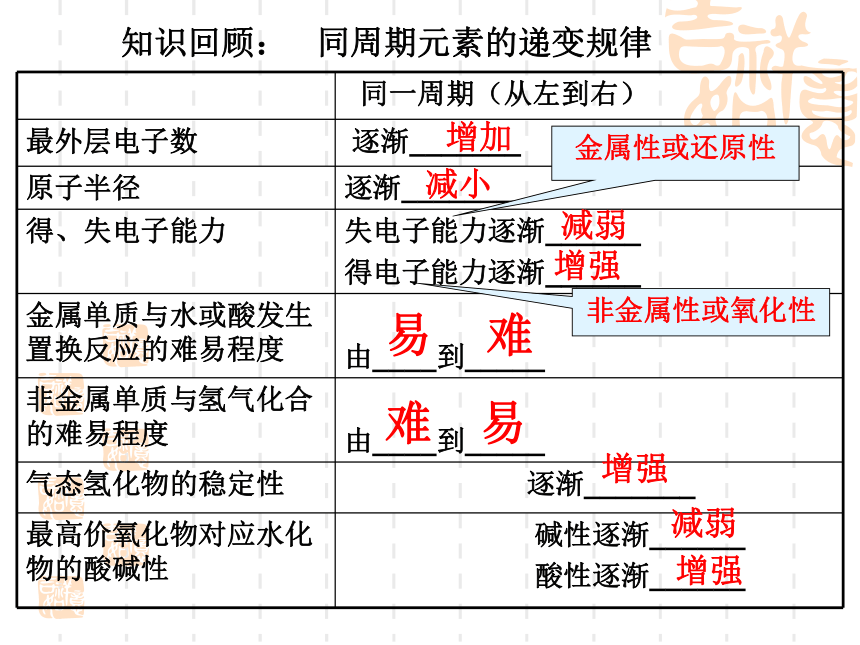
6.钠+硫酸铜溶液知识回顾: 同周期元素的递变规律增加减小减弱增强易难难易增强减弱增强金属性或还原性非金属性或氧化性1.第ⅠA族所有元素统称为碱金属。
2.因为同主族元素的原子最外层电子数相同,故同主族元素性质完全相同。
3.碱金属单质从上往下密度逐渐增大;熔沸点逐渐降低
4.卤族元素单质从上往下密度逐渐增大;熔沸点逐渐升高
5.人们在靠近金属与非金属分界线附近寻找半导体材料;在过渡金属中寻找优良的催化剂;在氯、硫等非金属中寻找新型农药。
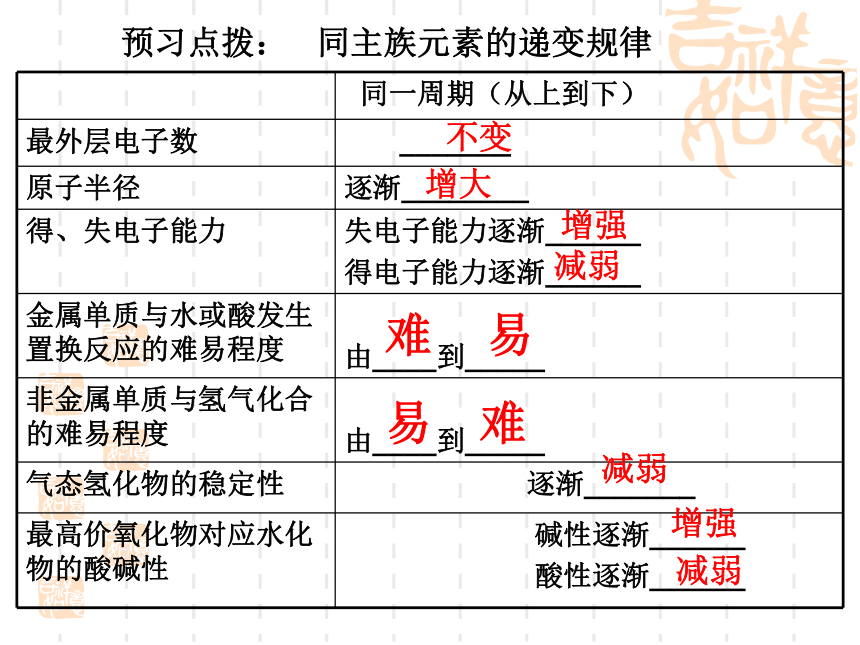
预习点拨: 同主族元素的递变规律不变增大增强减弱难易易难减弱增强减弱从上到下,随着原子核外电子层数增多,
原子半径增大,原子核对最外层电子的吸引力减小,
元素原子失电子能力增强,得电子的能力减弱。最外层电子数相同,化学性质相似;
从上到下,电子层数逐渐增多探究:同主族元素的性质1、卤族元素性质的递变规律卤素单质的物理性质有较大差别,在常温下,F2、Cl2是气体,Br2是液体, I2是固体。
它们的颜色由浅 到深 ,颜色分别为浅黄绿色、黄绿色、深红棕色、紫黑色。
氟、氯、溴、碘在常压下的沸点和熔点也依次增大,密度增大,卤素单质的物理性质0+7+7+7-1-1-1-1减弱冷暗处爆炸光照或点燃剧烈FBrClI弱弱难弱减弱200℃缓慢更高温度 缓慢【练习】写下列方程式
1.单质碘与水反应
2.单质溴与氢氧化钠溶液反应
3.氟气与氢气反应用X2代表卤素单质,写出卤素单质与水、氢氧化钠反应的通式【特殊记忆】
1.2F2+2H2O=4HF+O2
2.卤化氢(HX)的水溶液都显酸性,从上往下酸性增强——与非金属性判断无关通过比较K与Na的异同,
完成学案中的相关内容2、 碱金属(ⅠA)元素性质的递变规律1个增多活泼逐渐增强水、氧气Li2ONa2O2氧化物燃烧爆炸爆炸增强【知识归纳】学案【例1】 【例2】BDB概括·整合相同相同相同增多增多增多增强增强增强增强增大增多增强增强增强减小减弱减弱减弱减弱减弱减弱减弱+1-+7 -4--1【例3】
【特别提醒】B(1)C F (2)N (3)O Al
(4)Al (5)Na K (6)C
(7)Cl K【当堂检测】B BC B C
【课后拓展】1-6:DDCACC 7:BF
8.(1)> < (2)>> (3)>< (4)<> (5)>>
强 强 强 弱 强
9.(1)Ne F F2 Na (2)NaOH HClO4 Al(OH)3
(3)HF (4)Na (5)NH3
F- Al Al(OH)3
2Al+6H+=2Al3++3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
S在周期表中元素原子的变化规律预习检测
C AD D(第二课时)预习学案点评
第三节元素周期表的应用
(第二课时)
【写方程式】
1.氯气+水
2.氯气尾气处理
3.氯气与二氧化硫混合通入水中
4.钠+水
5.钠+氧气(常温、加热分别写)
6.钠+硫酸铜溶液知识回顾: 同周期元素的递变规律增加减小减弱增强易难难易增强减弱增强金属性或还原性非金属性或氧化性1.第ⅠA族所有元素统称为碱金属。
2.因为同主族元素的原子最外层电子数相同,故同主族元素性质完全相同。
3.碱金属单质从上往下密度逐渐增大;熔沸点逐渐降低
4.卤族元素单质从上往下密度逐渐增大;熔沸点逐渐升高
5.人们在靠近金属与非金属分界线附近寻找半导体材料;在过渡金属中寻找优良的催化剂;在氯、硫等非金属中寻找新型农药。
预习点拨: 同主族元素的递变规律不变增大增强减弱难易易难减弱增强减弱从上到下,随着原子核外电子层数增多,
原子半径增大,原子核对最外层电子的吸引力减小,
元素原子失电子能力增强,得电子的能力减弱。最外层电子数相同,化学性质相似;
从上到下,电子层数逐渐增多探究:同主族元素的性质1、卤族元素性质的递变规律卤素单质的物理性质有较大差别,在常温下,F2、Cl2是气体,Br2是液体, I2是固体。
它们的颜色由浅 到深 ,颜色分别为浅黄绿色、黄绿色、深红棕色、紫黑色。
氟、氯、溴、碘在常压下的沸点和熔点也依次增大,密度增大,卤素单质的物理性质0+7+7+7-1-1-1-1减弱冷暗处爆炸光照或点燃剧烈FBrClI弱弱难弱减弱200℃缓慢更高温度 缓慢【练习】写下列方程式
1.单质碘与水反应
2.单质溴与氢氧化钠溶液反应
3.氟气与氢气反应用X2代表卤素单质,写出卤素单质与水、氢氧化钠反应的通式【特殊记忆】
1.2F2+2H2O=4HF+O2
2.卤化氢(HX)的水溶液都显酸性,从上往下酸性增强——与非金属性判断无关通过比较K与Na的异同,
完成学案中的相关内容2、 碱金属(ⅠA)元素性质的递变规律1个增多活泼逐渐增强水、氧气Li2ONa2O2氧化物燃烧爆炸爆炸增强【知识归纳】学案【例1】 【例2】BDB概括·整合相同相同相同增多增多增多增强增强增强增强增大增多增强增强增强减小减弱减弱减弱减弱减弱减弱减弱+1-+7 -4--1【例3】
【特别提醒】B(1)C F (2)N (3)O Al
(4)Al (5)Na K (6)C
(7)Cl K【当堂检测】B BC B C
【课后拓展】1-6:DDCACC 7:BF
8.(1)> < (2)>> (3)>< (4)<> (5)>>
强 强 强 弱 强
9.(1)Ne F F2 Na (2)NaOH HClO4 Al(OH)3
(3)HF (4)Na (5)NH3
F- Al Al(OH)3
2Al+6H+=2Al3++3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
S在周期表中元素原子的变化规律预习检测
C AD D(第二课时)预习学案点评
