必修2第一章复习[1]课件
图片预览








文档简介
课件28张PPT。第一章
原子结构与元素周期律
复习1.原子结构
2.核外电子排布
3.元素周期律元素周期表及其应用
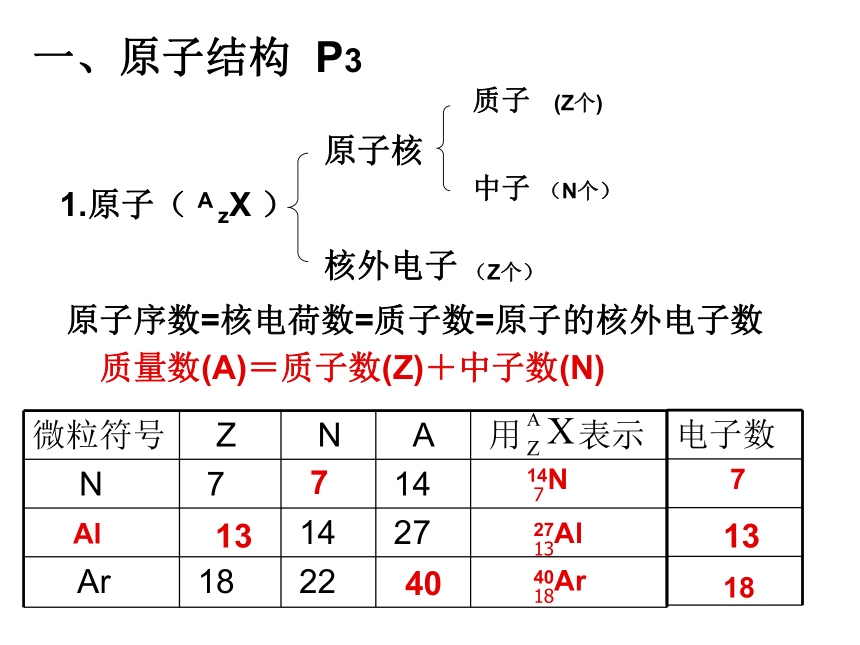
本章重点内容: 质量数(A)=质子数(Z)+中子数(N)原子序数=核电荷数=质子数=原子的核外电子数质子核外电子中子1.原子( A zX )一、原子结构 P3原子核(Z个)(Z个)(N个)714N7713Al27Al13134040Ar18182. 离子电子数阳离子(Xc+):电子数=阴离子(Xc-):电子数=如:某M 2-核外18个电子,质量数32,则中子数为多少?Z = 18 - 2 = 16N = A – Z = 32 - 16 = 16质子数-C质子数+C3.元素、核素、同位素 (书P4)具有一定数目的质子和一定数目的中子的一种原子。质子数相同而中子数不同的同一元素的不同核素互称为同位素。(对于原子来说)具有相同质子数(核电荷数)的同一类原子的总称。核素: 元素:同位素:同一元素的不同原子(即质子数相同;中子数不同)决定元素种类的是_______________质子数(或核电荷数)决定核素(原子)种类的是_______________质子数和中子数判断条件:练习:? 1、下列各组物质中,互为同位素的是( )
(A)O2、O3 (B)H2、D2、T2
(C)H2O、D2O、 T2O (D) 20Ca 和20 Ca4042D2、下列各组中属于同位素关系的是( )
A. 与 B.T2O与H2O
C. 与 D.金刚石与石墨A它们是什么关系?回顾:什么是同素异形体?1. 某元素的离子Rn+核外有X个电子,该元素的质量数为A,则该原子里的中子数为 ( )
A、 A-X-n B、 A+X+n
C、 A-X+n D、 A+X-nA2.某元素 R 的核外电子数等于中子数,2.8g该元素单质R与氧气完全反应,可得到6g化合物RO2。求该元素原子质量数,该元素是?综合训练:28 Si(硅)提示:质量数近似等于原子量的整数部分2) 每一层最多容纳的电子数为2n2二.核外电子排布规律: P61)电子总是尽先排布在能量最低的电子层里2→ 8 →32→18→50···→ 2n23)最外层电子数不超过8个电子
(当第一层为最外层时,不超过2个)4)次外层不超过18个电子熟练掌握1~20号元素原子核外电子的排布及惰性元素的核外电子排布电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q练:画出氡的核外电子排布1. 下列各题中的物质均由核电荷数为1~10的元素组成。请填写分子式:
(1)只有两个原子核和两个电子组成的分子是_________________。
(2)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合的分子是_______。
(3)1个L层有5个电子的原子和3个只有1个电子的原子结合的分子是____________。
(4)由两个原子核及10个电子结合成的分子是___________________,由5个原子核10个电子结合成的分子是____________。H2CO2NH3HFCH4思考:你知道哪些10电子微粒?课堂训练:10电子:分子:
阳离子:
阴离子:Ne HF H2O NH3 CH4Na+ Mg2+ Al3+ H3O+ NH4+F- OH- O2- N3-2. 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,则A、B各为 ( )
A. 碳原子,铍原子 B. 碳原子,铝原子
C. 硅原子,钠原子 D. 氯原子,钠原子BA三.微粒半径大小的比较:b.电子层数相同的微粒,原子序数越大,半径越小 a. 一般情况下,微粒的电子层数越多,半径越大c.同种元素形成的微粒,核外电子数越多半径越大:阴离子半径>原子半径>阳离子半径方法:一层、二核、三电子 2、下列微粒的半径比值大于1的是( )
A. Na+/Na B. K+/S2-
C. N/C D. Cl-/Cl D><>>1、比较下列微粒半径大小: 零族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族第8、9、10三个纵列副族及第VIII族元素统称过渡金属或过渡元素(共18个纵列16个族)练习(每日一练) 绘制周期表的边框,金属与非金属的分界线;标出周期序数和族序数;写出前20号元素;找出Fe的位置、标出镧系锕系的位置;写出每一周期包含的元素种数;写出0族元素、并标出它们的原子序数。元素周期表IAIIAIIIAIVAVAVIAVIIA0IIIB
过渡元素镧系锕系IVBVBVIBVIIBVIII第五周期ⅥA族元素的原子序数为多少?52Fe2
8
8
18
18
32
322
10
18
36
54
86
118ABMNOPQⅠBⅡBDH I J15镧系R1、判断原子半径 半径最小的原子是:______(1)、同周期原子半径规律:___________(2)、同主族原子半径规律:___________周期表应用 短周期元素原子中,半径最大的原子是(稀有 气体除外):______从左到右,逐渐减小从上到下,逐渐增大HNa2.元素化合价与元素在周期表中位置的关系。?
(1)周期序数=
主族序数= =主族元素最高_________
(2)最高正价+|最低负价|=
(3)特殊:氧元素的化合价一般是 价,而氟元素 正化合价。 元素只有正化合价而无负价。最外层电子数正化合价8-2无金属电子层数1. 已知下列元素的原子半径为: 根据以根据以上数据,磷原子的半径可能是( )
A. 0.080nm B. 0.110nm C. 0.120nm D. 0.070nm
B 练习2、 34号元素是第__________周期元素;族序数是_______;最高正价是________。
若用A表示该元素,其气态氢化物的化学式是________。
第四+6价H2AⅥA3. A元素的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是( )
A. B2A3 B.B2A C. BA2 D.BAA同周期元素性质递变规律(以第三周期为例)由易到难(金属性、还原性)从左到右,失电子能力减弱, 得电子能力增加由难到易稳定性增强碱性减弱,酸性增强依次减小(非金属性、氧化性)NaOHMg(OH)2Al(OH)3H4SiO4H3PO4H2SO4HClO4强碱中强碱两性氢
氧化物弱酸中强
酸强酸最强
的酸同主族元素性质递变的比较(从上到下)相同相同(F、O除外)增大增强减弱难易增强减弱易难减弱1 、X元素的阳离子和Y元素的阴离子具有相同的核外电子结 构,下列叙述正确的是( )
A.原子序数X<Y B.原子半径X<Y
C.离子半径X>Y D.原子最外层电子数X<Y
2、下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl
D.非金属性:F>O>S
DC3. 下列各组元素性质递变情况错误的是( )
A.Li 、 Be 、 B原子最外层电子数依次增多
B.P、S、Cl最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强C 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At得电子能力逐渐增强失电子能力逐渐增强失电子能力逐渐增强得电子能力逐渐增强非金属区 金属区(除H外)小结元素金属性(失电子的能力)强弱判断依据:①单质与水或酸置换出氢的难易程度(或反应
的剧烈程度)。反应越易,说明金属性就越强;②最高价氧化物对应水化物的碱性强弱。碱性越
强,说明其金属性也就越强,反之则弱;④金属间的置换反应,金属性强的可以置换出金属性弱的金属③金属活动顺序表⑤金属阳离子的氧化性越强对应金属失电子能力越弱⑥元素在周期中的位置元素非金属性(得电子的能力)强弱判断依据:①单质与氢气化合的难易程度、条件及生成氢化
物的稳定性。②最高价氧化物对应水化物酸性强弱。酸性越
强说明其非金属性越强。③非金属单质间的置换反应(Cl2>I2)④阴离子的还原性,还原性越强对应的非金属元素的得电子能力越弱⑤与变价金属反应,产物中金属的化合价越高,非金属的得电子能力越强⑥元素在周期中的位置
原子结构与元素周期律
复习1.原子结构
2.核外电子排布
3.元素周期律元素周期表及其应用
本章重点内容: 质量数(A)=质子数(Z)+中子数(N)原子序数=核电荷数=质子数=原子的核外电子数质子核外电子中子1.原子( A zX )一、原子结构 P3原子核(Z个)(Z个)(N个)714N7713Al27Al13134040Ar18182. 离子电子数阳离子(Xc+):电子数=阴离子(Xc-):电子数=如:某M 2-核外18个电子,质量数32,则中子数为多少?Z = 18 - 2 = 16N = A – Z = 32 - 16 = 16质子数-C质子数+C3.元素、核素、同位素 (书P4)具有一定数目的质子和一定数目的中子的一种原子。质子数相同而中子数不同的同一元素的不同核素互称为同位素。(对于原子来说)具有相同质子数(核电荷数)的同一类原子的总称。核素: 元素:同位素:同一元素的不同原子(即质子数相同;中子数不同)决定元素种类的是_______________质子数(或核电荷数)决定核素(原子)种类的是_______________质子数和中子数判断条件:练习:? 1、下列各组物质中,互为同位素的是( )
(A)O2、O3 (B)H2、D2、T2
(C)H2O、D2O、 T2O (D) 20Ca 和20 Ca4042D2、下列各组中属于同位素关系的是( )
A. 与 B.T2O与H2O
C. 与 D.金刚石与石墨A它们是什么关系?回顾:什么是同素异形体?1. 某元素的离子Rn+核外有X个电子,该元素的质量数为A,则该原子里的中子数为 ( )
A、 A-X-n B、 A+X+n
C、 A-X+n D、 A+X-nA2.某元素 R 的核外电子数等于中子数,2.8g该元素单质R与氧气完全反应,可得到6g化合物RO2。求该元素原子质量数,该元素是?综合训练:28 Si(硅)提示:质量数近似等于原子量的整数部分2) 每一层最多容纳的电子数为2n2二.核外电子排布规律: P61)电子总是尽先排布在能量最低的电子层里2→ 8 →32→18→50···→ 2n23)最外层电子数不超过8个电子
(当第一层为最外层时,不超过2个)4)次外层不超过18个电子熟练掌握1~20号元素原子核外电子的排布及惰性元素的核外电子排布电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q练:画出氡的核外电子排布1. 下列各题中的物质均由核电荷数为1~10的元素组成。请填写分子式:
(1)只有两个原子核和两个电子组成的分子是_________________。
(2)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合的分子是_______。
(3)1个L层有5个电子的原子和3个只有1个电子的原子结合的分子是____________。
(4)由两个原子核及10个电子结合成的分子是___________________,由5个原子核10个电子结合成的分子是____________。H2CO2NH3HFCH4思考:你知道哪些10电子微粒?课堂训练:10电子:分子:
阳离子:
阴离子:Ne HF H2O NH3 CH4Na+ Mg2+ Al3+ H3O+ NH4+F- OH- O2- N3-2. 今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,则A、B各为 ( )
A. 碳原子,铍原子 B. 碳原子,铝原子
C. 硅原子,钠原子 D. 氯原子,钠原子BA三.微粒半径大小的比较:b.电子层数相同的微粒,原子序数越大,半径越小 a. 一般情况下,微粒的电子层数越多,半径越大c.同种元素形成的微粒,核外电子数越多半径越大:阴离子半径>原子半径>阳离子半径方法:一层、二核、三电子 2、下列微粒的半径比值大于1的是( )
A. Na+/Na B. K+/S2-
C. N/C D. Cl-/Cl D>
过渡元素镧系锕系IVBVBVIBVIIBVIII第五周期ⅥA族元素的原子序数为多少?52Fe2
8
8
18
18
32
322
10
18
36
54
86
118ABMNOPQⅠBⅡBDH I J15镧系R1、判断原子半径 半径最小的原子是:______(1)、同周期原子半径规律:___________(2)、同主族原子半径规律:___________周期表应用 短周期元素原子中,半径最大的原子是(稀有 气体除外):______从左到右,逐渐减小从上到下,逐渐增大HNa2.元素化合价与元素在周期表中位置的关系。?
(1)周期序数=
主族序数= =主族元素最高_________
(2)最高正价+|最低负价|=
(3)特殊:氧元素的化合价一般是 价,而氟元素 正化合价。 元素只有正化合价而无负价。最外层电子数正化合价8-2无金属电子层数1. 已知下列元素的原子半径为: 根据以根据以上数据,磷原子的半径可能是( )
A. 0.080nm B. 0.110nm C. 0.120nm D. 0.070nm
B 练习2、 34号元素是第__________周期元素;族序数是_______;最高正价是________。
若用A表示该元素,其气态氢化物的化学式是________。
第四+6价H2AⅥA3. A元素的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是( )
A. B2A3 B.B2A C. BA2 D.BAA同周期元素性质递变规律(以第三周期为例)由易到难(金属性、还原性)从左到右,失电子能力减弱, 得电子能力增加由难到易稳定性增强碱性减弱,酸性增强依次减小(非金属性、氧化性)NaOHMg(OH)2Al(OH)3H4SiO4H3PO4H2SO4HClO4强碱中强碱两性氢
氧化物弱酸中强
酸强酸最强
的酸同主族元素性质递变的比较(从上到下)相同相同(F、O除外)增大增强减弱难易增强减弱易难减弱1 、X元素的阳离子和Y元素的阴离子具有相同的核外电子结 构,下列叙述正确的是( )
A.原子序数X<Y B.原子半径X<Y
C.离子半径X>Y D.原子最外层电子数X<Y
2、下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl
D.非金属性:F>O>S
DC3. 下列各组元素性质递变情况错误的是( )
A.Li 、 Be 、 B原子最外层电子数依次增多
B.P、S、Cl最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强C 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At得电子能力逐渐增强失电子能力逐渐增强失电子能力逐渐增强得电子能力逐渐增强非金属区 金属区(除H外)小结元素金属性(失电子的能力)强弱判断依据:①单质与水或酸置换出氢的难易程度(或反应
的剧烈程度)。反应越易,说明金属性就越强;②最高价氧化物对应水化物的碱性强弱。碱性越
强,说明其金属性也就越强,反之则弱;④金属间的置换反应,金属性强的可以置换出金属性弱的金属③金属活动顺序表⑤金属阳离子的氧化性越强对应金属失电子能力越弱⑥元素在周期中的位置元素非金属性(得电子的能力)强弱判断依据:①单质与氢气化合的难易程度、条件及生成氢化
物的稳定性。②最高价氧化物对应水化物酸性强弱。酸性越
强说明其非金属性越强。③非金属单质间的置换反应(Cl2>I2)④阴离子的还原性,还原性越强对应的非金属元素的得电子能力越弱⑤与变价金属反应,产物中金属的化合价越高,非金属的得电子能力越强⑥元素在周期中的位置
