(鲁科版)高中化学必修二课件:2-2 化学反应的限度(共38张PPT)
文档属性
| 名称 | (鲁科版)高中化学必修二课件:2-2 化学反应的限度(共38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 420.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-17 00:00:00 | ||
图片预览











文档简介
课件38张PPT。第二节 化学反应的限度
知识回顾 已知合成氨反应: N2(g)+3H2(g) 2NH3(g)
在298K时:ΔH=-92.2kJ·mol-1
ΔS= -198.2J·K -1 ·mol-1
请根据反应的焓变和熵变分析298K时合成氨反应能否自发进行。根据判据计算:
ΔH - TΔS
= -92.2kJ·mol-1 -298K×(-198.2×10-3
kJ·K -1 ·mol-1 ) =-33.1 kJ·mol-1 <0
该反应常温下能自发进行,这是否就足够了呢?【复习回顾】
1.可逆反应
(1)定义
条件下,既能向 方向进行,又能向 方向进行的化学反应。
(2)特点
①相同条件,正、逆反应 ;
②反应物与生成物同时存在;
③任一组分的转化率均 100%。相同正反应逆反应同时进行小于2.化学平衡状态
(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率 ,反应体系中所有参加反应的物质的 保持不变的状态。
(2)特征
①动:化学平衡是一种动态平衡。
②等: 。
③定:反应物和生成物的 保持不变。
④变:条件改变,平衡状态可能改变,新条件下建立新的平衡状态。v(正)=v(逆)相等浓度浓度想一想 可逆反应进行到一定程度就会达到平衡状态,你知道这时平衡体系中反应物和生成物各占多少吗?反应到底进行到什么程度? 为更准确的了解可逆反应的进程,定量的描述化学反应的限度,我们将学习一个新的概念——
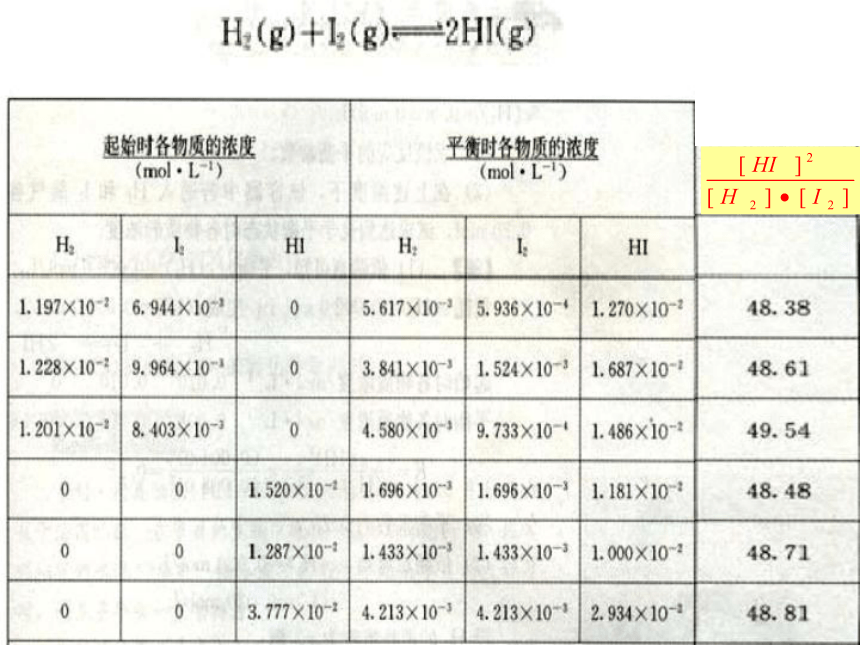
化学平衡常数54.554.654.454.3根据表中的数据计算出平衡时 的值,并分析其中规律。
?730.6K规律小结通过分析实验数据得出:
(1)温度相同时,达到化学平衡状态 为一常数;
(2)这个常数与反应的起始浓度大小无关;
(3)这个常数与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
一、化学平衡常数(K)1、定义:
在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。K =2、表达式:3、书写平衡常数关系式规则一 如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。
如:CaCO3(s) CaO(s)+CO2(g)
K= [CO2]
写出下表中各反应的平衡常数表达式。书山有路mol·L-11(mol·L-1 )2
3、书写平衡常数关系式的规则二 同一个可逆反应,平衡常数的表达式不是唯一的,它与化学方程式的书写方式有关。书写方式不同,各反应物、生成物的化学计量数不同,平衡常数表达式就不同。每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
对于同一个反应,正反应和逆反应的平衡常数互为倒数。
平衡常数的单位与化学方程式表示形式相对应。学海无涯 4、平衡常数K的意义
平衡常数的大小反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。5、影响因素---------K只与温度有关。
对于放热反应:
升高温度,K值 ;反之K值 。
对于吸热反应:
升高温度,K值 ;反之K值 。增大减小减小增大6、应用
(1)判断、比较可逆反应进行程度的大小。
K值越大,反应进行的程度越大;
K值越小,反应进行的程度越小。
(2)判断可逆反应是否达到化学平衡状态
对于可逆反应aA(g)+bB(g)?? cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:知识链接
c(B)、[B]都可以表示物质B的物质的量浓度。我们用c(B)表示反应体系中物质B任意状态时的浓度,用c0(B)表示物质B的初始浓度,用[B]表示物质B在化学平衡状态时的浓度。迁移应用例1、(2006上海,25)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______ , K值大小与温度的关系是温度升高,K值______ __。(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(后略) 化学反应进行的程度越大可能增大也可能减小例2.(2008山东,14)
高温下,某反应达到平衡,平衡常数= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小催化剂高温
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2二、相关计算
有关化学平衡问题的计算,可按下列步骤建立模式,确定关系进行计算。例如:可逆反应mA(g)+nB(g)?? pC(g)+qD(g),假定反应物A、B的起始加入量分别为a mol、b mol,达到平衡时,设A物质转化的物质的量为mx mol。
(1)模式: mA(g)+nB(g)?? pC(g)+qD(g)
起始量 a b 0 0
变化量 mx nx px qx
平衡量 a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(变)
对于生成物:n(平)=n(始)+n(变)(2)步骤
①确定反应物或生成物的起始加入量。
②确定反应过程的变化量。
③确定平衡量。
④依据题干中的条件建立等式关系进行解答。
【名师点击】 解答化学平衡计算题,要注意构建解题模式,熟练掌握有关物质的量、物质的量浓度、转化率、产率、某组分百分含量等各种计算关系式,并不断总结各种题型的解题方法、技巧及规律。例3、(2007海南·16)PCl5的热分解反应如下: PCl5(g) PCl3(g) + Cl2(g) (1)? 写出反应的平衡常数表达式; (2)? 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。例4、(2007山东,28)
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容这一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2 2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后体系总压强为0.10MPa.该反应的平衡常数等于____
②平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”“<”或“=”)例5、已知可逆反应:
M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率为________
(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_______。
三、反应条件对化学平衡的影响
化学平衡的移动
(1)原因:反应条件改变引起 。
(2)方向:若v(正)>v(逆)时,平衡向 方向移动;
若v(正)<v(逆)时,平衡向 方向移动。v(正)≠v(逆)正反应逆反应2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 减小正向增大逆向温度对化学平衡的影响正 向正 向 升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。交流 研讨1、温度对化学平衡的影响 温度对化学平衡的影响是通过改变平衡常数实现的。交流 研讨 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)的平衡常数K 与
浓度商Q = 的关系,讨论改变反应物或生成物浓度对化学
平衡的影响。
Q < KQ > K交流 研讨2、浓度对化学平衡的影响 请根据提供的试剂和仪器,按照设计的实验方 案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
改变浓度,若QK,平衡逆向移动。溶液呈血红色后加深正向移动溶液呈血红色后加深
正向移动 2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么? 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。原平衡状态 新平衡状态 平 衡 移 动浓度
借助Q与K的相对大小进行判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的小结①若a+b≠m
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
②若a+b=m
改变压强,平衡 移动。气体体积减小气体体积增大不3、压强对化学平衡的影响1、在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) ΔH>0,
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡________,c(CO)______。
(2)减小密闭容器体积,保持温度不变,则平衡________________,c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器体积不变,升高温度,则平衡________________,c(CO)________。 练习2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动BD3、(2007上海,25)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)=CH3OH(g)
(1)反应达到平衡时,平衡常数表达式K=_____,
升高温度,K值 ___ (填“增大”“减小”或“不变”)。
(后略)减小
在298K时:ΔH=-92.2kJ·mol-1
ΔS= -198.2J·K -1 ·mol-1
请根据反应的焓变和熵变分析298K时合成氨反应能否自发进行。根据判据计算:
ΔH - TΔS
= -92.2kJ·mol-1 -298K×(-198.2×10-3
kJ·K -1 ·mol-1 ) =-33.1 kJ·mol-1 <0
该反应常温下能自发进行,这是否就足够了呢?【复习回顾】
1.可逆反应
(1)定义
条件下,既能向 方向进行,又能向 方向进行的化学反应。
(2)特点
①相同条件,正、逆反应 ;
②反应物与生成物同时存在;
③任一组分的转化率均 100%。相同正反应逆反应同时进行小于2.化学平衡状态
(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率 ,反应体系中所有参加反应的物质的 保持不变的状态。
(2)特征
①动:化学平衡是一种动态平衡。
②等: 。
③定:反应物和生成物的 保持不变。
④变:条件改变,平衡状态可能改变,新条件下建立新的平衡状态。v(正)=v(逆)相等浓度浓度想一想 可逆反应进行到一定程度就会达到平衡状态,你知道这时平衡体系中反应物和生成物各占多少吗?反应到底进行到什么程度? 为更准确的了解可逆反应的进程,定量的描述化学反应的限度,我们将学习一个新的概念——
化学平衡常数54.554.654.454.3根据表中的数据计算出平衡时 的值,并分析其中规律。
?730.6K规律小结通过分析实验数据得出:
(1)温度相同时,达到化学平衡状态 为一常数;
(2)这个常数与反应的起始浓度大小无关;
(3)这个常数与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
一、化学平衡常数(K)1、定义:
在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。K =2、表达式:3、书写平衡常数关系式规则一 如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。
如:CaCO3(s) CaO(s)+CO2(g)
K= [CO2]
写出下表中各反应的平衡常数表达式。书山有路mol·L-11(mol·L-1 )2
3、书写平衡常数关系式的规则二 同一个可逆反应,平衡常数的表达式不是唯一的,它与化学方程式的书写方式有关。书写方式不同,各反应物、生成物的化学计量数不同,平衡常数表达式就不同。每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
对于同一个反应,正反应和逆反应的平衡常数互为倒数。
平衡常数的单位与化学方程式表示形式相对应。学海无涯 4、平衡常数K的意义
平衡常数的大小反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。5、影响因素---------K只与温度有关。
对于放热反应:
升高温度,K值 ;反之K值 。
对于吸热反应:
升高温度,K值 ;反之K值 。增大减小减小增大6、应用
(1)判断、比较可逆反应进行程度的大小。
K值越大,反应进行的程度越大;
K值越小,反应进行的程度越小。
(2)判断可逆反应是否达到化学平衡状态
对于可逆反应aA(g)+bB(g)?? cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:知识链接
c(B)、[B]都可以表示物质B的物质的量浓度。我们用c(B)表示反应体系中物质B任意状态时的浓度,用c0(B)表示物质B的初始浓度,用[B]表示物质B在化学平衡状态时的浓度。迁移应用例1、(2006上海,25)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______ , K值大小与温度的关系是温度升高,K值______ __。(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(后略) 化学反应进行的程度越大可能增大也可能减小例2.(2008山东,14)
高温下,某反应达到平衡,平衡常数= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小催化剂高温
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2二、相关计算
有关化学平衡问题的计算,可按下列步骤建立模式,确定关系进行计算。例如:可逆反应mA(g)+nB(g)?? pC(g)+qD(g),假定反应物A、B的起始加入量分别为a mol、b mol,达到平衡时,设A物质转化的物质的量为mx mol。
(1)模式: mA(g)+nB(g)?? pC(g)+qD(g)
起始量 a b 0 0
变化量 mx nx px qx
平衡量 a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(变)
对于生成物:n(平)=n(始)+n(变)(2)步骤
①确定反应物或生成物的起始加入量。
②确定反应过程的变化量。
③确定平衡量。
④依据题干中的条件建立等式关系进行解答。
【名师点击】 解答化学平衡计算题,要注意构建解题模式,熟练掌握有关物质的量、物质的量浓度、转化率、产率、某组分百分含量等各种计算关系式,并不断总结各种题型的解题方法、技巧及规律。例3、(2007海南·16)PCl5的热分解反应如下: PCl5(g) PCl3(g) + Cl2(g) (1)? 写出反应的平衡常数表达式; (2)? 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。例4、(2007山东,28)
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容这一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2 2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后体系总压强为0.10MPa.该反应的平衡常数等于____
②平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”“<”或“=”)例5、已知可逆反应:
M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率为________
(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_______。
三、反应条件对化学平衡的影响
化学平衡的移动
(1)原因:反应条件改变引起 。
(2)方向:若v(正)>v(逆)时,平衡向 方向移动;
若v(正)<v(逆)时,平衡向 方向移动。v(正)≠v(逆)正反应逆反应2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 减小正向增大逆向温度对化学平衡的影响正 向正 向 升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。交流 研讨1、温度对化学平衡的影响 温度对化学平衡的影响是通过改变平衡常数实现的。交流 研讨 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)的平衡常数K 与
浓度商Q = 的关系,讨论改变反应物或生成物浓度对化学
平衡的影响。
Q < KQ > K交流 研讨2、浓度对化学平衡的影响 请根据提供的试剂和仪器,按照设计的实验方 案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
改变浓度,若Q
正向移动 2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么? 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。原平衡状态 新平衡状态 平 衡 移 动浓度
借助Q与K的相对大小进行判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的小结①若a+b≠m
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
②若a+b=m
改变压强,平衡 移动。气体体积减小气体体积增大不3、压强对化学平衡的影响1、在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) ΔH>0,
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡________,c(CO)______。
(2)减小密闭容器体积,保持温度不变,则平衡________________,c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器体积不变,升高温度,则平衡________________,c(CO)________。 练习2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动BD3、(2007上海,25)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)=CH3OH(g)
(1)反应达到平衡时,平衡常数表达式K=_____,
升高温度,K值 ___ (填“增大”“减小”或“不变”)。
(后略)减小
