2.3原子结构的模型(第二课时) 同步练习(含解析)
文档属性
| 名称 | 2.3原子结构的模型(第二课时) 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 220.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-01-06 22:18:18 | ||
图片预览



文档简介
2.3原子结构的模型(第二课时)
一、选择题
1.商场的货架上会看到标有“补钙”“补铁”“补碘”等字样的食品和保健品,这里的钙、铁、碘指的是( )
A.离子 B.原子 C.分子 D.元素
2.化学中把众多原子划分为不同种元素的依据是( )
A.相对原子质量的大小 B.核外电子数
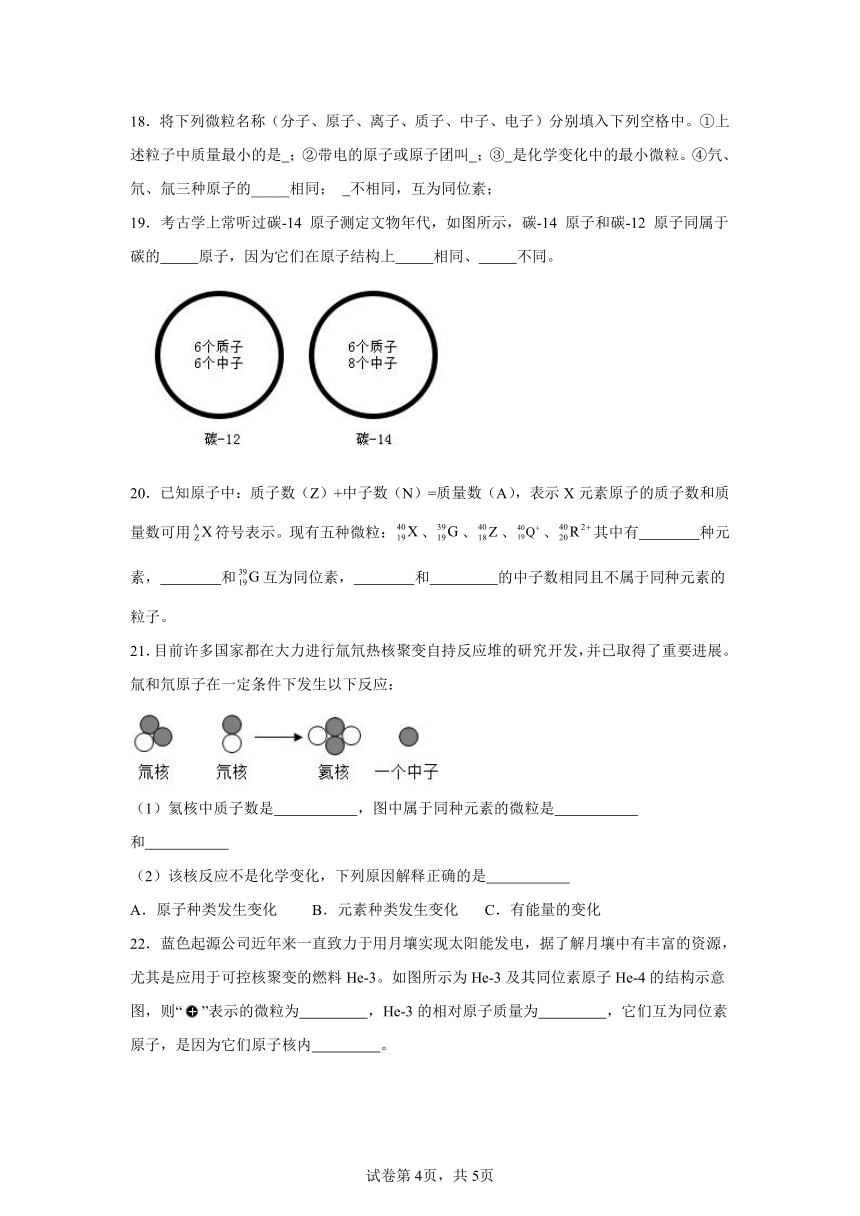
C.核内中子数 D.核内质子数
3.原子失去一个电子后成为( )
A.带一个单位正电荷的阳离子
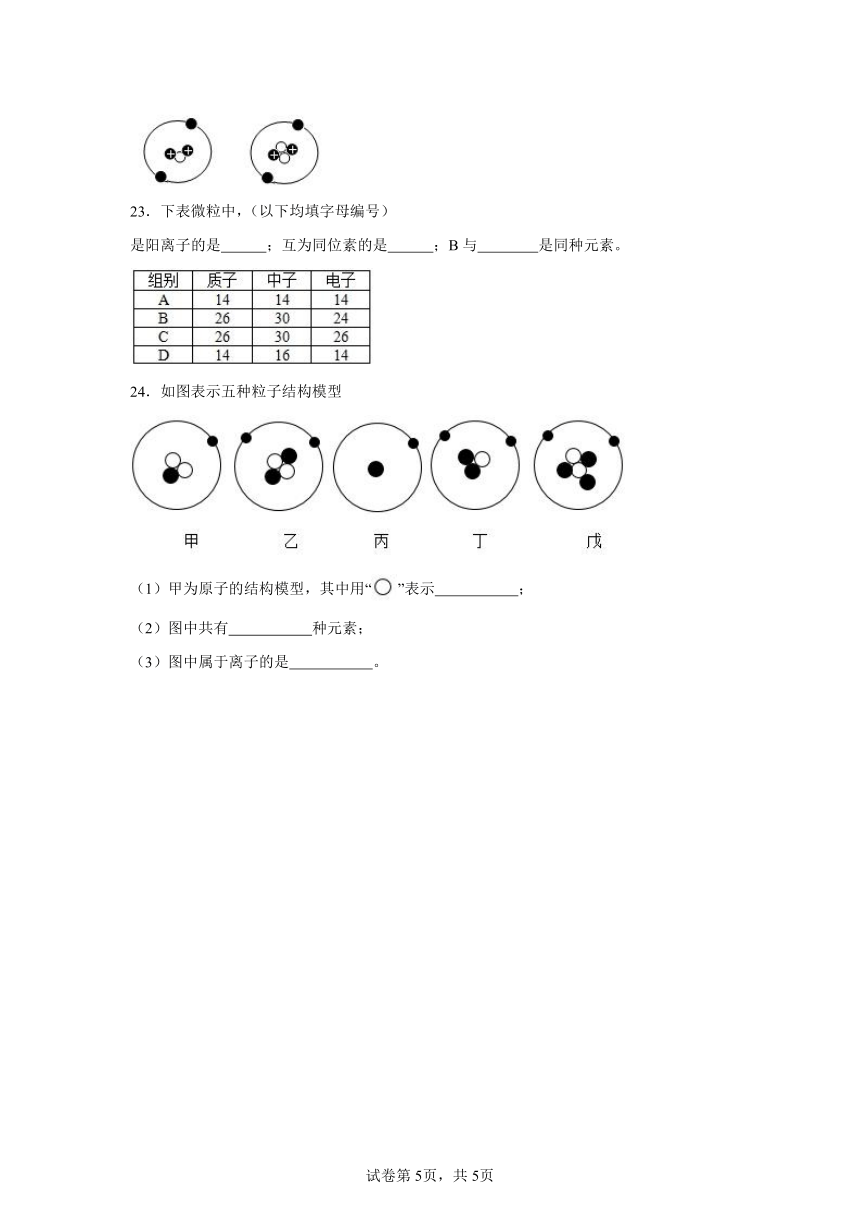
B.带一个单位负电荷的阳离子
C.带一个单位正电荷的阴离子
D.带一个单位负电荷的阴离子
4.关于离子和原子的关系说法错误的是( )
A.离子是带电的原子或原子团,带电的微粒不一定是离子
B.离子是由原子得到或失去电子形成的
C.从结构上看,原子中核内质子数等于核外电子数,而在离子中两个数不相等
D.钠离子和钠原子的质子数相同,所以它们属于同种微粒
5.良渚古城遗址被列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳原子含量测定,推测其年代距今年。碳原子与碳原子不同的是( )
A.质子数 B.核电荷数 C.电子数 D.中子数
6.2022年9月,温州朔门古港遗址的发现重现了温州“千年商港”的盛况,经碳-14测定该遗址建于东晋时期。碳-14是碳-12的一种同位素,下列关于同位素的说法正确的是( )
A.碳-14 和碳-12 的在元素周期表中位于相同的格子
B.碳-14和碳-12的主要区别是电子数不同
C.碳-14的中子数是6
D.碳-14和碳-12的化学性质不同,所以碳-14能测遗址年代而碳-12不能
7.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。碳-14原子在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子、8个中子 B.氮原子核,含7个质子、7个中子
C.氮原子核,含7个质子、6个中子 D.氧原子核,含7个质子、8个中子
8.“九天揽月,探索不止。”2024年5月3日17时27分,在海南文昌航天发射场,长征五号遥八火箭载着嫦娥六号探测器点火升空,奔向38万公里之外的月球。嫦娥六号开启月球背面取样之旅。月球上的土壤含有丰富的氦-3,氦-3是理想的核聚变燃料,地球上的氦元素主要以氦-4形式存在。氦-3和氦-4互为同位素原子(如右图),它们不相同的是( )
A.质子数 B.中子数 C.电子数 D.原子数
9.科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。据此推断,当一种元素的原子经放射变化后,结果变化了另一种元素的原子,它一定是放射了( )
A.电子 B.中子 C.质子 D.原子核
10.科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如表示核内有6个质子和7个中子的碳原子。下列关于和的说法中错误的是( )
A.各取一个原子相比较,中子数相同
B.属于同种元素
C.各取一个原子相比较,核外电子数相同
D.各取一个原子相比较,质子数相同
11.如图为氯化钠形成的微观模型图。关于氯化钠的形成,下列表述正确的是( )
A.氯化钠由钠原子和氯原子构成
B.钠原子失去电子变成阳离子
C.钠原子失去电子、氯原子得到电子后相互吸引,构成氯化钠分子
D.有些氯化钠带正电,有些氯化钠带负电,聚合在一起构成电中性的氯化钠
12.如图为三种原子的部分信息(质量数=质子数+中子数),下列说法正确的是( )
A.A与B属于同种元素
B.A与B中子数相同
C.A与C互为同位素原子
D.C的核外电子数为21
13.对钠原子和钠离子的叙述错误的是( )
A.都属于钠元素 B.化学性质相同
C.钠离子比钠原子少一个电子 D.核电荷数相同
14.核外电子数相同,核内质子数不同的两种粒子,它们不可能是( )
A.一种元素的原子和另一种元素的离子 B.同种元素的原子和离子
C.一个物质分子和离子 D.两种不同元素的离子
15.如图表示四种原子的结构模型(“”、“”和“”分别表示电子、中子、质子),下列说法正确的是 ( )
A.甲、丙的核电荷数不同 B.甲、丙为同一种原子
C.乙、丁属于同一种元素 D.甲、乙互为同位素原子
二、填空题
16.请从“构成物质微粒”的角度对下列物质进行分类:氢气、水、硫酸铜、汞、氯化钠、氦气。写化学式)
①由原子构成的物质: ;
②由分子构成的物质: ;
③由离子构成的物质: 。
17.氕、氘、氚三种原子的 数相同,互为 。
18.将下列微粒名称(分子、原子、离子、质子、中子、电子)分别填入下列空格中。①上述粒子中质量最小的是 ;②带电的原子或原子团叫 ;③ 是化学变化中的最小微粒。④氕、氘、氚三种原子的_____相同; 不相同,互为同位素;
19.考古学上常听过碳-14 原子测定文物年代,如图所示,碳-14 原子和碳-12 原子同属于碳的 原子,因为它们在原子结构上 相同、 不同。
20.已知原子中:质子数(Z)+中子数(N)=质量数(A),表示X元素原子的质子数和质量数可用符号表示。现有五种微粒:、、、、其中有 种元素, 和互为同位素, 和 的中子数相同且不属于同种元素的粒子。
21.目前许多国家都在大力进行氚氘热核聚变自持反应堆的研究开发,并已取得了重要进展。氚和氘原子在一定条件下发生以下反应:
(1)氦核中质子数是 ,图中属于同种元素的微粒是 和
(2)该核反应不是化学变化,下列原因解释正确的是
A.原子种类发生变化 B.元素种类发生变化 C.有能量的变化
22.蓝色起源公司近年来一直致力于用月壤实现太阳能发电,据了解月壤中有丰富的资源,尤其是应用于可控核聚变的燃料He-3。如图所示为He-3及其同位素原子He-4的结构示意图,则“”表示的微粒为 ,He-3的相对原子质量为 ,它们互为同位素原子,是因为它们原子核内 。
23.下表微粒中,(以下均填字母编号)
是阳离子的是 ;互为同位素的是 ;B与 是同种元素。
24.如图表示五种粒子结构模型
(1)甲为原子的结构模型,其中用“”表示 ;
(2)图中共有 种元素;
(3)图中属于离子的是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A D D A B B C A
题号 11 12 13 14 15
答案 B C B B C
1.D
【详解】“补钙”、“补铁”、“补碘”等字样的食品和保健品,这里的“钙、铁、碘”不是以单质、分子、原子等形式存在,这里所指的“钙、铁、碘”是强调存在的元素,与具体形态无关。故选D。
2.D
【详解】由元素的概念可知,具有相同质子数的原子属于同一种元素,所以依据原子核内的质子数不同,可把众多原子划分为不同元素,故选D。
3.A
【分析】根据质子数和电子数关系判断带电荷情况。
【详解】原子中质子数=电子数,原子不带电荷。原子失去一个电子后,质子数小于电子数,带一个单位的正电,带正电的是阳离子。所以原子失去一个电子后成为带一个单位正电荷的阳离子。
故选A。
4.D
【详解】A、带电的原子或原子团叫离子,带电的微粒不一定是离子,例如电子带负电,却不是离子,故说法正确;
B、原子可以通过得失电子形成阴阳离子,故说法正确;
C、核内质子数等于核外电子数为原子,核内质子数不等于核外电子数为离子,故说法正确;
D、同一元素的两种粒子,其原子核内质子数一定相同,钠离子和钠原子的质子数相同,但它们不属于同种微粒,错误。
故选:D
5.D
【详解】A、碳-14原子与碳-12原子均是碳元素形成的原子,它们的质子数相同,故选项错误;
B、原子中核电荷数=核内质子数,碳-14原子与碳-12原子的质子数相同,则核电荷数相同,故选项错误;
C、原子中核电荷数=核内质子数=核外电子数,碳-14原子与碳-12原子的质子数相同,则电子数相同,故选项错误;
D、相对原子质量=质子数+中子数,碳-14原子与碳-12原子的质子数相同,但它们的相对原子质量不同,则它们的中子数一定不同,故选项正确。
故选D。
6.A
【详解】A、碳-14 和碳-12 的质子数相同,都属于碳元素,在元素周期表中位于相同的格子,选项正确;
B、碳-14和碳-12的质子数都为6,主要区别是中子数不同,选项错误;
C、碳-14的质子数为6,则其中子数=14 6=8,选项错误;
D、碳-14和碳-12的中子数不同,所以碳-14能测遗址年代而碳-12不能,选项错误;
故选A。
7.B
【详解】由于碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,所以该原子核内的质子数成为7,因此该原子核成为氮原子的原子核,其核内质子数是7中子数也是7。
故选B。
8.B
【详解】质子数相同中子数不同的同一元素的原子互称同位素,氦-3和氦-4是质子数相同、中子数不同的同一种元素的原子,属于同位素,故B符合题意,ACD不符合题意。
故选B。
9.C
【详解】元素的种类主要由原子的质子数或核电荷数决定,该原子经过放射变化后,结果变成了另一种元素的原子,说明原子的质子数发生了变化,故放射出了质子。
故选C。
10.A
【详解】A、用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,的中子数=131 53=78,的中子数=127 53=74,选项错误;
B、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,属于同一种元素,选项正确;
C、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,原子中的质子数与核外电子数相同,所以各取一个原子相比较,核外电子数相同,选项正确;
D、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,选项正确,故选A。
11.B
【详解】A、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,氯化钠是由钠离子和氯离子构成的物质,故说法错误;
B、由形成过程图可知,钠原子失去1个电子变为阳离子,故说法正确;
C、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误;
D、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误。
故选B。
12.C
【详解】A、A和B的核内质子数不同,故不是同种元素,错误;
B、A的中子数=19﹣9=10,B的中子数=39﹣19=20,错误;
C、A和C的核内质子数相同,互为同位素原子,正确;
D、在原子中质子数=核外电子数,C的核外电子数=9,错误;
故选C。
13.B
【分析】若核内质子数等于核外电子数则为原子;若核内质子数大于核外电子数则为阳离子,是原子失去电子形成的;若核内质子数小于核外电子数则为阴离子,是原子得到电子形成的。
【详解】A、Na+是钠原子失去一个电子后形成的,质子数没有改变,钠原子、钠离子具有相同的质子数,都属于钠元素,故A正确;
B、Na+是钠原子失去一个电子后形成的,二者的最外层电子数不同,化学性质不相同,故选B不正确;
C、钠离子比钠原子少一个电子,故C正确;
D、Na+是钠原子失去一个电子后形成的,质子数没有改变,所以钠原子、钠离子具有相同的质子数,质子数=核电荷数,二者的核电荷数相同,故D正确。故选B。
14.B
【详解】A、一种元素的原子和另一种元素的离子,符合不同质子数、相同电子数的两种粒子,故A正确;
B、同一元素,质子数就一定相同,不可能是同种元素的原子和离子,故B错误;
C、一个物质的分子和离子,如水和氟离子,质子数不相同,核外电子数相同,故C正确;
D、不同元素的离子,如Na+ 和 Mg2+,都是离子,而且质子数不同,而电子数相同,故D正确。
故选B。
15.C
【详解】A、甲和丙的质子数相同,对于原子而言,其核电荷数=质子数=核外电子数,故甲、丙的核电荷数相同,故该说法错误;
B、甲、丙的质子数相同,中子数不同,故它们不是同一种原子,故该选项错误;
C、决定元素种类的是核内质子数,乙、丁两种原子的质子数相同,故它们属于同一种元素,故该选项正确;
D、甲、乙的质子数不相同,不互为同位素,故该选项错误。
故选C。
16. Hg、He H2、H2O CuSO4、NaCl
【详解】(1)因为金属和固态非金属单质以及稀有气体由原子构成,所以由原子构成的有汞、氦气,化学式为:Hg、He。
(2)气态单质、共价化合物一般由分子构成,所以由分子构成的有氢气、水,化学式为:H2、H2O。
(3)金属化合物是由离子构成的,所以由离子构成的有硫酸铜、氯化钠,化学式为: CuSO4、NaCl。
17. 质子 同位素
【分析】原子序数(质子数)相同而质量数(中子数)不同的原子互为同位素。
【详解】氕、氘、氚三种原子都属于氢原子,因此质子数或核电荷数相同,所不同的是其中子数不同,故质量也不同,三者互为同位素。
18.
【详解】①电子的质量很小,可以忽略,所以相对原子质量约为质子数和中子数之和,故答案为电子;
②离子是带电的原子或原子团;故答案为离子;
③原子是化学变化中的最小微粒;故答案为原子;
④同位素是指具有相同核电荷但不同原子质量的原子称为同位素,则同位素的不同原子质子数相同。氕、氘、氚三种原子的质子数相同,中子数不相同,互为同位素;故答案为质子、中子。
19. 同位素 质子数 中子数
【详解】碳-14 原子和碳-12 原子的质子数相同,故同属于碳的同位素原子,它们在原子结构上质子数相同,中子数不同。
20. 3
【分析】核电荷数相同的一类原子为一种元素;有相同质子数,不同中子数的原子互为同位素;中子数=质量数-质子数。
【详解】的质子数为19,质量数为40,那么该原子的中子数:40-19=21;的质子数为19,质量数为39,那么该原子的中子数:39-19=20;的质子数为18,质量数为40,那么该原子的中子数:40-18=22;的质子数为19,质量数为40,那么该原子的中子数:40-19=21;的质子数为20,质量数为40,那么该原子的中子数:40-20=20;所以共有3种元素,、的质子数相同,中子数不同,故互为同位素;和的质子数不同,但中子数都是20。
21. 2 氚 氘 AB
【分析】化学变化的本质是有新物质生成,即分子分解为原子,原子重新组合成分子的过程;在发生化学变化的过程中,原子的种类和数量都保持不变。
【详解】(1)根据氦核的结构图可知,它的原子核由2个中子和2个质子组成; 氚和氘的原子核都具有2个质子,所以它们是同种元素的微粒。
(2)该核反应不是化学变化,原因是:①原子种类发生改变;②元素种类发生变化,故选AB。
22. 质子 3 质子数相同,中子数不同
【详解】原子由居于原子中心的带正电的原子核和核外带负电的电子构成,原子核由质子和中子两种粒子构成,质子带正电荷,中子不带电,则“”表示的微粒为质子;由图可知,He-3原子中含有两个质子和一个中子,相对原子质量≈质子数+中子数≈2+1=3;质子数相同而中子数不同的同一种元素的不同原子互为同位素,He-3和He-4互为同位素原子,因为它们原子核内质子数相同,中子数不同。
23. B A、D C
【分析】阳离子是带正电荷的原子;决定元素种类的是核内质子数,质子数相同的属于同种元素;同位素是指质子数相同中子数不同的同种元素的不同原子.
【详解】B失去了2个电子,带2个单位正电荷,属于阳离子;B和C质子数都是26,属于同种元素;A和D质子数相同,中子数不同,属于同位素.
故答案为B; AD;C
【点睛】解答本题关键是熟悉阳离子、同位素的概念,并能灵活进行判断.
24. 中子 三 戊
【详解】(1)原子由原子核和核外电子构成,原子核由质子和中子构成,根据原子中质子数=核外电子数,可知“ ”表示中子。
(2)“”表示质子,质子数决定元素种类,甲、乙、丙、丁、戊的质子数分别为1、2、1、2、3,所以图中共有三种元素。
(3)原子得失电子形成离子,图戊的质子数为3,核外电子数为2,整体带一个单位正电荷,属于阳离子。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.商场的货架上会看到标有“补钙”“补铁”“补碘”等字样的食品和保健品,这里的钙、铁、碘指的是( )
A.离子 B.原子 C.分子 D.元素
2.化学中把众多原子划分为不同种元素的依据是( )
A.相对原子质量的大小 B.核外电子数
C.核内中子数 D.核内质子数
3.原子失去一个电子后成为( )
A.带一个单位正电荷的阳离子
B.带一个单位负电荷的阳离子
C.带一个单位正电荷的阴离子
D.带一个单位负电荷的阴离子
4.关于离子和原子的关系说法错误的是( )
A.离子是带电的原子或原子团,带电的微粒不一定是离子
B.离子是由原子得到或失去电子形成的
C.从结构上看,原子中核内质子数等于核外电子数,而在离子中两个数不相等
D.钠离子和钠原子的质子数相同,所以它们属于同种微粒
5.良渚古城遗址被列入世界遗产名录。考古学家通过对有关遗址出土文物中的碳原子含量测定,推测其年代距今年。碳原子与碳原子不同的是( )
A.质子数 B.核电荷数 C.电子数 D.中子数
6.2022年9月,温州朔门古港遗址的发现重现了温州“千年商港”的盛况,经碳-14测定该遗址建于东晋时期。碳-14是碳-12的一种同位素,下列关于同位素的说法正确的是( )
A.碳-14 和碳-12 的在元素周期表中位于相同的格子
B.碳-14和碳-12的主要区别是电子数不同
C.碳-14的中子数是6
D.碳-14和碳-12的化学性质不同,所以碳-14能测遗址年代而碳-12不能
7.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。碳-14原子在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子、8个中子 B.氮原子核,含7个质子、7个中子
C.氮原子核,含7个质子、6个中子 D.氧原子核,含7个质子、8个中子
8.“九天揽月,探索不止。”2024年5月3日17时27分,在海南文昌航天发射场,长征五号遥八火箭载着嫦娥六号探测器点火升空,奔向38万公里之外的月球。嫦娥六号开启月球背面取样之旅。月球上的土壤含有丰富的氦-3,氦-3是理想的核聚变燃料,地球上的氦元素主要以氦-4形式存在。氦-3和氦-4互为同位素原子(如右图),它们不相同的是( )
A.质子数 B.中子数 C.电子数 D.原子数
9.科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。据此推断,当一种元素的原子经放射变化后,结果变化了另一种元素的原子,它一定是放射了( )
A.电子 B.中子 C.质子 D.原子核
10.科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如表示核内有6个质子和7个中子的碳原子。下列关于和的说法中错误的是( )
A.各取一个原子相比较,中子数相同
B.属于同种元素
C.各取一个原子相比较,核外电子数相同
D.各取一个原子相比较,质子数相同
11.如图为氯化钠形成的微观模型图。关于氯化钠的形成,下列表述正确的是( )
A.氯化钠由钠原子和氯原子构成
B.钠原子失去电子变成阳离子
C.钠原子失去电子、氯原子得到电子后相互吸引,构成氯化钠分子
D.有些氯化钠带正电,有些氯化钠带负电,聚合在一起构成电中性的氯化钠
12.如图为三种原子的部分信息(质量数=质子数+中子数),下列说法正确的是( )
A.A与B属于同种元素
B.A与B中子数相同
C.A与C互为同位素原子
D.C的核外电子数为21
13.对钠原子和钠离子的叙述错误的是( )
A.都属于钠元素 B.化学性质相同
C.钠离子比钠原子少一个电子 D.核电荷数相同
14.核外电子数相同,核内质子数不同的两种粒子,它们不可能是( )
A.一种元素的原子和另一种元素的离子 B.同种元素的原子和离子
C.一个物质分子和离子 D.两种不同元素的离子
15.如图表示四种原子的结构模型(“”、“”和“”分别表示电子、中子、质子),下列说法正确的是 ( )
A.甲、丙的核电荷数不同 B.甲、丙为同一种原子
C.乙、丁属于同一种元素 D.甲、乙互为同位素原子
二、填空题
16.请从“构成物质微粒”的角度对下列物质进行分类:氢气、水、硫酸铜、汞、氯化钠、氦气。写化学式)
①由原子构成的物质: ;
②由分子构成的物质: ;
③由离子构成的物质: 。
17.氕、氘、氚三种原子的 数相同,互为 。
18.将下列微粒名称(分子、原子、离子、质子、中子、电子)分别填入下列空格中。①上述粒子中质量最小的是 ;②带电的原子或原子团叫 ;③ 是化学变化中的最小微粒。④氕、氘、氚三种原子的_____相同; 不相同,互为同位素;
19.考古学上常听过碳-14 原子测定文物年代,如图所示,碳-14 原子和碳-12 原子同属于碳的 原子,因为它们在原子结构上 相同、 不同。
20.已知原子中:质子数(Z)+中子数(N)=质量数(A),表示X元素原子的质子数和质量数可用符号表示。现有五种微粒:、、、、其中有 种元素, 和互为同位素, 和 的中子数相同且不属于同种元素的粒子。
21.目前许多国家都在大力进行氚氘热核聚变自持反应堆的研究开发,并已取得了重要进展。氚和氘原子在一定条件下发生以下反应:
(1)氦核中质子数是 ,图中属于同种元素的微粒是 和
(2)该核反应不是化学变化,下列原因解释正确的是
A.原子种类发生变化 B.元素种类发生变化 C.有能量的变化
22.蓝色起源公司近年来一直致力于用月壤实现太阳能发电,据了解月壤中有丰富的资源,尤其是应用于可控核聚变的燃料He-3。如图所示为He-3及其同位素原子He-4的结构示意图,则“”表示的微粒为 ,He-3的相对原子质量为 ,它们互为同位素原子,是因为它们原子核内 。
23.下表微粒中,(以下均填字母编号)
是阳离子的是 ;互为同位素的是 ;B与 是同种元素。
24.如图表示五种粒子结构模型
(1)甲为原子的结构模型,其中用“”表示 ;
(2)图中共有 种元素;
(3)图中属于离子的是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 D D A D D A B B C A
题号 11 12 13 14 15
答案 B C B B C
1.D
【详解】“补钙”、“补铁”、“补碘”等字样的食品和保健品,这里的“钙、铁、碘”不是以单质、分子、原子等形式存在,这里所指的“钙、铁、碘”是强调存在的元素,与具体形态无关。故选D。
2.D
【详解】由元素的概念可知,具有相同质子数的原子属于同一种元素,所以依据原子核内的质子数不同,可把众多原子划分为不同元素,故选D。
3.A
【分析】根据质子数和电子数关系判断带电荷情况。
【详解】原子中质子数=电子数,原子不带电荷。原子失去一个电子后,质子数小于电子数,带一个单位的正电,带正电的是阳离子。所以原子失去一个电子后成为带一个单位正电荷的阳离子。
故选A。
4.D
【详解】A、带电的原子或原子团叫离子,带电的微粒不一定是离子,例如电子带负电,却不是离子,故说法正确;
B、原子可以通过得失电子形成阴阳离子,故说法正确;
C、核内质子数等于核外电子数为原子,核内质子数不等于核外电子数为离子,故说法正确;
D、同一元素的两种粒子,其原子核内质子数一定相同,钠离子和钠原子的质子数相同,但它们不属于同种微粒,错误。
故选:D
5.D
【详解】A、碳-14原子与碳-12原子均是碳元素形成的原子,它们的质子数相同,故选项错误;
B、原子中核电荷数=核内质子数,碳-14原子与碳-12原子的质子数相同,则核电荷数相同,故选项错误;
C、原子中核电荷数=核内质子数=核外电子数,碳-14原子与碳-12原子的质子数相同,则电子数相同,故选项错误;
D、相对原子质量=质子数+中子数,碳-14原子与碳-12原子的质子数相同,但它们的相对原子质量不同,则它们的中子数一定不同,故选项正确。
故选D。
6.A
【详解】A、碳-14 和碳-12 的质子数相同,都属于碳元素,在元素周期表中位于相同的格子,选项正确;
B、碳-14和碳-12的质子数都为6,主要区别是中子数不同,选项错误;
C、碳-14的质子数为6,则其中子数=14 6=8,选项错误;
D、碳-14和碳-12的中子数不同,所以碳-14能测遗址年代而碳-12不能,选项错误;
故选A。
7.B
【详解】由于碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,所以该原子核内的质子数成为7,因此该原子核成为氮原子的原子核,其核内质子数是7中子数也是7。
故选B。
8.B
【详解】质子数相同中子数不同的同一元素的原子互称同位素,氦-3和氦-4是质子数相同、中子数不同的同一种元素的原子,属于同位素,故B符合题意,ACD不符合题意。
故选B。
9.C
【详解】元素的种类主要由原子的质子数或核电荷数决定,该原子经过放射变化后,结果变成了另一种元素的原子,说明原子的质子数发生了变化,故放射出了质子。
故选C。
10.A
【详解】A、用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,的中子数=131 53=78,的中子数=127 53=74,选项错误;
B、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,属于同一种元素,选项正确;
C、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,原子中的质子数与核外电子数相同,所以各取一个原子相比较,核外电子数相同,选项正确;
D、用元素符号左下角数字表示原子的质子数,和的质子数均为53,两种原子的质子数相同,选项正确,故选A。
11.B
【详解】A、因氯化钠是阴阳离子通过静电作用形成的化合物,其构成微粒为离子,氯化钠是由钠离子和氯离子构成的物质,故说法错误;
B、由形成过程图可知,钠原子失去1个电子变为阳离子,故说法正确;
C、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误;
D、1个钠离子带一个单位的正电荷,1个氯离子带一个单位的负电荷,则钠离子与氯离子之间相互吸引,构成电中性的氯化钠,故说法错误。
故选B。
12.C
【详解】A、A和B的核内质子数不同,故不是同种元素,错误;
B、A的中子数=19﹣9=10,B的中子数=39﹣19=20,错误;
C、A和C的核内质子数相同,互为同位素原子,正确;
D、在原子中质子数=核外电子数,C的核外电子数=9,错误;
故选C。
13.B
【分析】若核内质子数等于核外电子数则为原子;若核内质子数大于核外电子数则为阳离子,是原子失去电子形成的;若核内质子数小于核外电子数则为阴离子,是原子得到电子形成的。
【详解】A、Na+是钠原子失去一个电子后形成的,质子数没有改变,钠原子、钠离子具有相同的质子数,都属于钠元素,故A正确;
B、Na+是钠原子失去一个电子后形成的,二者的最外层电子数不同,化学性质不相同,故选B不正确;
C、钠离子比钠原子少一个电子,故C正确;
D、Na+是钠原子失去一个电子后形成的,质子数没有改变,所以钠原子、钠离子具有相同的质子数,质子数=核电荷数,二者的核电荷数相同,故D正确。故选B。
14.B
【详解】A、一种元素的原子和另一种元素的离子,符合不同质子数、相同电子数的两种粒子,故A正确;
B、同一元素,质子数就一定相同,不可能是同种元素的原子和离子,故B错误;
C、一个物质的分子和离子,如水和氟离子,质子数不相同,核外电子数相同,故C正确;
D、不同元素的离子,如Na+ 和 Mg2+,都是离子,而且质子数不同,而电子数相同,故D正确。
故选B。
15.C
【详解】A、甲和丙的质子数相同,对于原子而言,其核电荷数=质子数=核外电子数,故甲、丙的核电荷数相同,故该说法错误;
B、甲、丙的质子数相同,中子数不同,故它们不是同一种原子,故该选项错误;
C、决定元素种类的是核内质子数,乙、丁两种原子的质子数相同,故它们属于同一种元素,故该选项正确;
D、甲、乙的质子数不相同,不互为同位素,故该选项错误。
故选C。
16. Hg、He H2、H2O CuSO4、NaCl
【详解】(1)因为金属和固态非金属单质以及稀有气体由原子构成,所以由原子构成的有汞、氦气,化学式为:Hg、He。
(2)气态单质、共价化合物一般由分子构成,所以由分子构成的有氢气、水,化学式为:H2、H2O。
(3)金属化合物是由离子构成的,所以由离子构成的有硫酸铜、氯化钠,化学式为: CuSO4、NaCl。
17. 质子 同位素
【分析】原子序数(质子数)相同而质量数(中子数)不同的原子互为同位素。
【详解】氕、氘、氚三种原子都属于氢原子,因此质子数或核电荷数相同,所不同的是其中子数不同,故质量也不同,三者互为同位素。
18.
【详解】①电子的质量很小,可以忽略,所以相对原子质量约为质子数和中子数之和,故答案为电子;
②离子是带电的原子或原子团;故答案为离子;
③原子是化学变化中的最小微粒;故答案为原子;
④同位素是指具有相同核电荷但不同原子质量的原子称为同位素,则同位素的不同原子质子数相同。氕、氘、氚三种原子的质子数相同,中子数不相同,互为同位素;故答案为质子、中子。
19. 同位素 质子数 中子数
【详解】碳-14 原子和碳-12 原子的质子数相同,故同属于碳的同位素原子,它们在原子结构上质子数相同,中子数不同。
20. 3
【分析】核电荷数相同的一类原子为一种元素;有相同质子数,不同中子数的原子互为同位素;中子数=质量数-质子数。
【详解】的质子数为19,质量数为40,那么该原子的中子数:40-19=21;的质子数为19,质量数为39,那么该原子的中子数:39-19=20;的质子数为18,质量数为40,那么该原子的中子数:40-18=22;的质子数为19,质量数为40,那么该原子的中子数:40-19=21;的质子数为20,质量数为40,那么该原子的中子数:40-20=20;所以共有3种元素,、的质子数相同,中子数不同,故互为同位素;和的质子数不同,但中子数都是20。
21. 2 氚 氘 AB
【分析】化学变化的本质是有新物质生成,即分子分解为原子,原子重新组合成分子的过程;在发生化学变化的过程中,原子的种类和数量都保持不变。
【详解】(1)根据氦核的结构图可知,它的原子核由2个中子和2个质子组成; 氚和氘的原子核都具有2个质子,所以它们是同种元素的微粒。
(2)该核反应不是化学变化,原因是:①原子种类发生改变;②元素种类发生变化,故选AB。
22. 质子 3 质子数相同,中子数不同
【详解】原子由居于原子中心的带正电的原子核和核外带负电的电子构成,原子核由质子和中子两种粒子构成,质子带正电荷,中子不带电,则“”表示的微粒为质子;由图可知,He-3原子中含有两个质子和一个中子,相对原子质量≈质子数+中子数≈2+1=3;质子数相同而中子数不同的同一种元素的不同原子互为同位素,He-3和He-4互为同位素原子,因为它们原子核内质子数相同,中子数不同。
23. B A、D C
【分析】阳离子是带正电荷的原子;决定元素种类的是核内质子数,质子数相同的属于同种元素;同位素是指质子数相同中子数不同的同种元素的不同原子.
【详解】B失去了2个电子,带2个单位正电荷,属于阳离子;B和C质子数都是26,属于同种元素;A和D质子数相同,中子数不同,属于同位素.
故答案为B; AD;C
【点睛】解答本题关键是熟悉阳离子、同位素的概念,并能灵活进行判断.
24. 中子 三 戊
【详解】(1)原子由原子核和核外电子构成,原子核由质子和中子构成,根据原子中质子数=核外电子数,可知“ ”表示中子。
(2)“”表示质子,质子数决定元素种类,甲、乙、丙、丁、戊的质子数分别为1、2、1、2、3,所以图中共有三种元素。
(3)原子得失电子形成离子,图戊的质子数为3,核外电子数为2,整体带一个单位正电荷,属于阳离子。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
