3.1 空气与氧气 第1课时(课件 22张PPT)
文档属性
| 名称 | 3.1 空气与氧气 第1课时(课件 22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 44.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-04-21 16:16:24 | ||
图片预览




文档简介
(共22张PPT)
1
新课导入
(1)天空二号太空舱内有氧气吗?
(2)太空舱内的气体是纯氧吗?
(3)如果你是设计师,你会如何设计太空舱内的气体成分?
阿波罗一号火灾事故科普卡
1967年1月27日,美国阿波罗1号在地面测试时,纯氧舱突发火灾,指令长维吉尔·格里森、高级飞行员爱德华·怀特、飞行员罗杰·查菲三名宇航员不幸丧生。
3.1.1 空气与氧气
【核心概念】
1.物质的结构与性质
【学习内容与要求】
1.2 空气与水是重要的物质
④知道空气主要成分的体积分数,认识空气对人类的重要作用。
1.科学观念:知道空气的组成,以及各主要成分的体积分数,学会用科学的现象和实验来验证空气的成分。
2.科学思维:通过实验探究空气的组成,了解探究的一般过程;会分析实验结果偏大或偏小的原因;培养学生自主学习能力。
3.探究实践:学会用科学的现象和实验来验证空气的成分,理解空气中氧气含量测定的方法、原理;能简单设计减小误差的实验方案。
4.态度责任:通过对空气的组成的实验探究,激发学习和探究的兴趣,培养合作和勤于思考的科学作风,体喻探究成功的乐趣。
2
核心概念与素养
3
新知探究
1.1 确定含量的表达方式
任务一:设计实验测定空气中氧气的含量
(1)根据元素质量分数的相关知识说说如何表示空气中氧气的含量?
(2)利用上述方法表示空气中氧气含量的方式存在怎样的困难?有其他的方法吗?
(3)根据上述方法,需要测量哪些量?
空气的体积
这部分空气中氧气的体积
(4)请你根据上述方法初步设计出测定空气中氧气含量(体积分数)的实验装置及方案。
1.2 器材选择
(2)在选择将氧气反应掉的这种“物质”时,除了要求能把氧气消耗掉,
还有其他要求吗?
(1)空气中的氧气如何“分离”出来?
无法单独分离提取出来,可以采取反应掉的方式
不与空气中的其他成分反应
反应生成的物质不能是气体
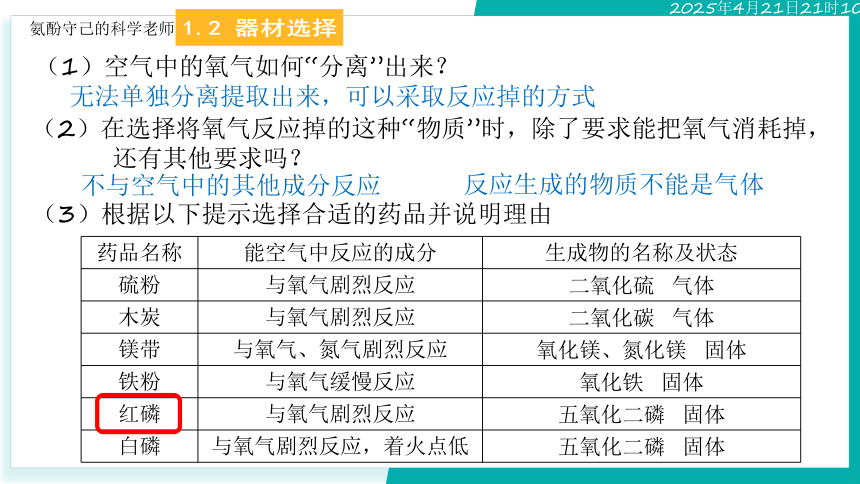
(3)根据以下提示选择合适的药品并说明理由
药品名称 能空气中反应的成分 生成物的名称及状态
硫粉 与氧气剧烈反应 二氧化硫 气体
木炭 与氧气剧烈反应 二氧化碳 气体
镁带 与氧气、氮气剧烈反应 氧化镁、氮化镁 固体
铁粉 与氧气缓慢反应 氧化铁 固体
红磷 与氧气剧烈反应 五氧化二磷 固体
白磷 与氧气剧烈反应,着火点低 五氧化二磷 固体
(4)能否直接用周围的空气作为实验对象并说明理由
不能,反应时间太久,且一边将氧气反应掉,周围的空气会同时进行补充
建构密闭系统
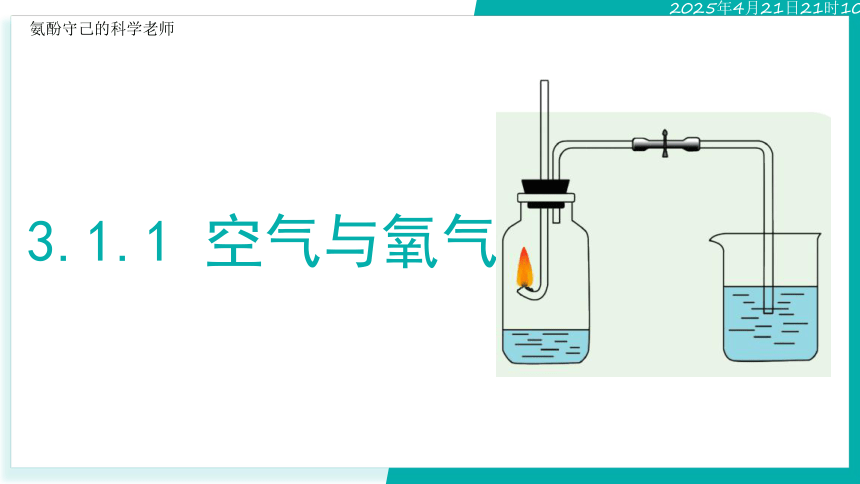
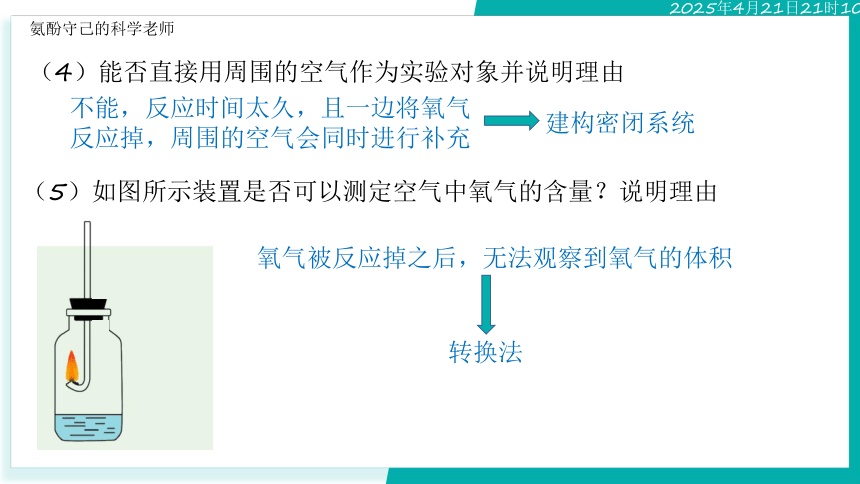
(5)如图所示装置是否可以测定空气中氧气的含量?说明理由
氧气被反应掉之后,无法观察到氧气的体积
转换法
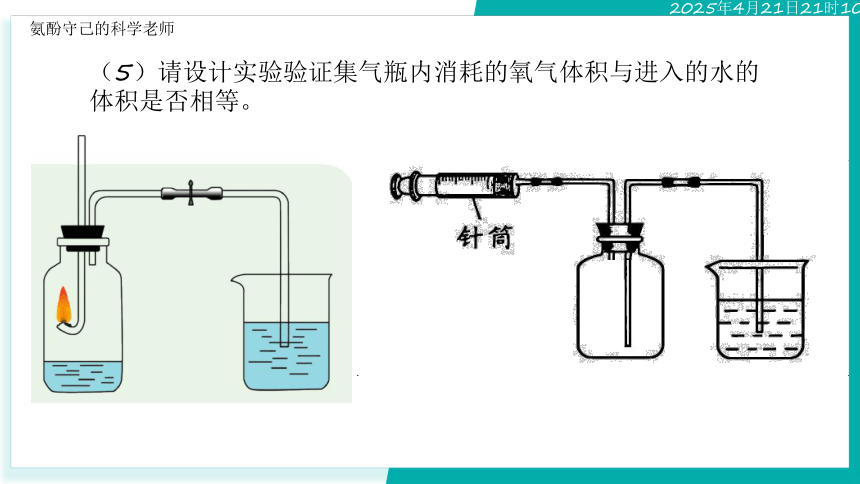
(5)请设计实验验证集气瓶内消耗的氧气体积与进入的水的体积是否相等。
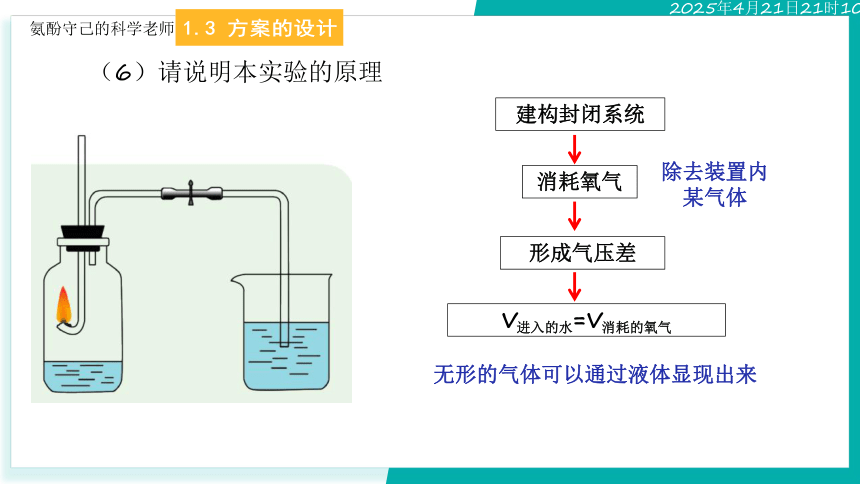
(6)请说明本实验的原理
无形的气体可以通过液体显现出来
除去装置内某气体
建构封闭系统
形成气压差
V进入的水=V消耗的氧气
消耗氧气
1.3 方案的设计
(6)请根据所给实验装置修改你的实验方案
④取:取足量的红磷在燃烧匙上
⑤放: 将燃烧匙置于酒精灯上点燃红磷,迅速放入广口瓶中
⑥塞:塞紧橡胶塞。
①查:检查装置的气密性
②夹:实验开始时在橡皮管上夹好止水夹,
③加:往集气瓶内加入一部分的水至第一条线,剩余容积已五等分。
⑦观察瓶内现象_______________________________
⑨开:打开止水夹后,观察到 _________________ ,瓶内水位 _______________________ ,消耗的气体跟剩下的气体的体积比约为 。
⑧荡:火焰熄灭后,振荡冷却至室温。
实验说明: 。
红磷继续燃烧,产生大量的白烟并放出大量的热
水从烧杯倒吸入集气瓶内
上升,约占瓶容积的1/5
1:4
氧气约占空气体积的五分之一
测得的氧气体积偏小
红磷量不足(氧气没有消耗完)
未冷却到室温就打开止水夹(剩余气体处于膨胀状态)
还有部分水残留在导管中(V消耗的氧气=V进入的水)
装置气密性不好
测得的氧气体积偏大
未夹或未夹紧止水夹(集气瓶内其他气体逸出)
点燃红磷塞瓶塞较慢((集气瓶内其他气体逸出)
集气瓶内其他气体被消耗
思考:请你设计“测定空气中氧气含量的实验”,尽可能减小误差,并把你的实验方案与同学交流。
有同学认为集气瓶体积是不规则的,不方便进行五等分,你有什么好的建议?
实验反思
(1)如何检查装置气密性?
热膨胀法:将导管口放入水中,双手捂住集气瓶(使瓶内气体受热膨胀),若导管口出现气泡,松开双手后,导管内形成一段稳定的倒吸水柱,则证明装置气密性良好。
(2)实验开始前为什么要在集气瓶底装少量水?
①防止生成的热的P2O5直接掉落在瓶底导致集气瓶受热不均而破裂。
②冷却燃烧后的气体,溶解生成的 P2O5 固体。
(3)为什么烧杯内的水会进入到集气瓶内
红磷和氧气发生反应生成的 P2O5 是固体,同时 P2O5 溶于水,使瓶内气体压强减小,打开止水夹后,大气压把水压入集气瓶中,直至内外压强相等。
(4)如果用木炭、硫等代替红磷来做实验,结果如何?
木炭燃烧生成的是气体二氧化碳,瓶内压强几乎不变。
实验药品:汞
实验装置:曲颈甑、汞槽、玻璃钟罩(形成密闭空间)
实验方法:转换法
思考以下问题:
1.氧化汞是哪两种物质反应的产物?
2.生成的氧化汞是固体还是气体?
3.氧气被消耗后,钟罩内的水银液面为什么会上升?
4.完善“空气中氧气的体积分数”的结果表达模型:
2.1 空气成分
任务二:学会用科学的现象和实验来验证空气的成分。
空气的体积组成
空气的体积组成
各种实验测定表明,空气中有多种成分。各成分的体积大约是:
78%
21%
1%
稀有气体 0.93%
二氧化碳 0.04%
其他气体
和杂质 0.03 %
78%
21%
1%
在通常情况下,空气中各成分的比例保持相对稳定。
2.2 成分证明
1.将二氧化碳通入石灰水中, 石灰水是否变浑浊?_______。如图所示,用大针筒把空气压入石灰水中。石灰水是否变浑浊?_________。这说明空气中含有 __________。
变浑浊
变浑浊
二氧化碳
把空气压入石灰水中,变浑浊的速度怎么样?
说明:空气中含有二氧化碳,含量较少。
变浑浊的速度比较慢。
2. 取一瓶空气和一瓶氧气,把一根燃着的木条先后插入两集气瓶中,观察木条在两集气瓶中燃烧的剧烈程度是否相同。_______________。
合理的解释是 ____________________________。
空气中燃着的木条
燃着的木条伸入氧气中
木条在空气中继续燃烧,
木条在氧气中燃烧得更剧烈
不相同
空气中含有氧气,但不纯
氧气能支持燃烧。在其他条件相同的情况下,氧气的纯度越高,燃烧会越剧烈。
3. 把 1 滴水滴在白色的无水硫酸铜(CuSO4)粉末上,观察无水硫酸铜粉末颜色的变化情况。_______________。
由白色变成蓝色
无水硫酸铜
硫酸铜晶体
白色的无水硫酸铜可以用来检验是否有水存在。
滴水
白色的无水硫酸铜变蓝色
把一些碎冰放入一个干燥的烧杯里,用表面皿盖在烧杯口上。过一会儿,在表面皿里加一些无水硫酸铜,发现 _______________________。出现这一现象的原因是 ________________________。这说明空气中含有 ________________。
空气中的水蒸气遇冷液化成水
水分
思考:
在生活中,从哪些现象中可以知道空气中存在水蒸气?
刚拿出冰箱的可乐
冬天,进入室内的眼镜
受潮的饼干
露珠
通过以上的活动可以初步确定,空气中至少含有 CO2、O2和水蒸气等物质。
1
新课导入
(1)天空二号太空舱内有氧气吗?
(2)太空舱内的气体是纯氧吗?
(3)如果你是设计师,你会如何设计太空舱内的气体成分?
阿波罗一号火灾事故科普卡
1967年1月27日,美国阿波罗1号在地面测试时,纯氧舱突发火灾,指令长维吉尔·格里森、高级飞行员爱德华·怀特、飞行员罗杰·查菲三名宇航员不幸丧生。
3.1.1 空气与氧气
【核心概念】
1.物质的结构与性质
【学习内容与要求】
1.2 空气与水是重要的物质
④知道空气主要成分的体积分数,认识空气对人类的重要作用。
1.科学观念:知道空气的组成,以及各主要成分的体积分数,学会用科学的现象和实验来验证空气的成分。
2.科学思维:通过实验探究空气的组成,了解探究的一般过程;会分析实验结果偏大或偏小的原因;培养学生自主学习能力。
3.探究实践:学会用科学的现象和实验来验证空气的成分,理解空气中氧气含量测定的方法、原理;能简单设计减小误差的实验方案。
4.态度责任:通过对空气的组成的实验探究,激发学习和探究的兴趣,培养合作和勤于思考的科学作风,体喻探究成功的乐趣。
2
核心概念与素养
3
新知探究
1.1 确定含量的表达方式
任务一:设计实验测定空气中氧气的含量
(1)根据元素质量分数的相关知识说说如何表示空气中氧气的含量?
(2)利用上述方法表示空气中氧气含量的方式存在怎样的困难?有其他的方法吗?
(3)根据上述方法,需要测量哪些量?
空气的体积
这部分空气中氧气的体积
(4)请你根据上述方法初步设计出测定空气中氧气含量(体积分数)的实验装置及方案。
1.2 器材选择
(2)在选择将氧气反应掉的这种“物质”时,除了要求能把氧气消耗掉,
还有其他要求吗?
(1)空气中的氧气如何“分离”出来?
无法单独分离提取出来,可以采取反应掉的方式
不与空气中的其他成分反应
反应生成的物质不能是气体
(3)根据以下提示选择合适的药品并说明理由
药品名称 能空气中反应的成分 生成物的名称及状态
硫粉 与氧气剧烈反应 二氧化硫 气体
木炭 与氧气剧烈反应 二氧化碳 气体
镁带 与氧气、氮气剧烈反应 氧化镁、氮化镁 固体
铁粉 与氧气缓慢反应 氧化铁 固体
红磷 与氧气剧烈反应 五氧化二磷 固体
白磷 与氧气剧烈反应,着火点低 五氧化二磷 固体
(4)能否直接用周围的空气作为实验对象并说明理由
不能,反应时间太久,且一边将氧气反应掉,周围的空气会同时进行补充
建构密闭系统
(5)如图所示装置是否可以测定空气中氧气的含量?说明理由
氧气被反应掉之后,无法观察到氧气的体积
转换法
(5)请设计实验验证集气瓶内消耗的氧气体积与进入的水的体积是否相等。
(6)请说明本实验的原理
无形的气体可以通过液体显现出来
除去装置内某气体
建构封闭系统
形成气压差
V进入的水=V消耗的氧气
消耗氧气
1.3 方案的设计
(6)请根据所给实验装置修改你的实验方案
④取:取足量的红磷在燃烧匙上
⑤放: 将燃烧匙置于酒精灯上点燃红磷,迅速放入广口瓶中
⑥塞:塞紧橡胶塞。
①查:检查装置的气密性
②夹:实验开始时在橡皮管上夹好止水夹,
③加:往集气瓶内加入一部分的水至第一条线,剩余容积已五等分。
⑦观察瓶内现象_______________________________
⑨开:打开止水夹后,观察到 _________________ ,瓶内水位 _______________________ ,消耗的气体跟剩下的气体的体积比约为 。
⑧荡:火焰熄灭后,振荡冷却至室温。
实验说明: 。
红磷继续燃烧,产生大量的白烟并放出大量的热
水从烧杯倒吸入集气瓶内
上升,约占瓶容积的1/5
1:4
氧气约占空气体积的五分之一
测得的氧气体积偏小
红磷量不足(氧气没有消耗完)
未冷却到室温就打开止水夹(剩余气体处于膨胀状态)
还有部分水残留在导管中(V消耗的氧气=V进入的水)
装置气密性不好
测得的氧气体积偏大
未夹或未夹紧止水夹(集气瓶内其他气体逸出)
点燃红磷塞瓶塞较慢((集气瓶内其他气体逸出)
集气瓶内其他气体被消耗
思考:请你设计“测定空气中氧气含量的实验”,尽可能减小误差,并把你的实验方案与同学交流。
有同学认为集气瓶体积是不规则的,不方便进行五等分,你有什么好的建议?
实验反思
(1)如何检查装置气密性?
热膨胀法:将导管口放入水中,双手捂住集气瓶(使瓶内气体受热膨胀),若导管口出现气泡,松开双手后,导管内形成一段稳定的倒吸水柱,则证明装置气密性良好。
(2)实验开始前为什么要在集气瓶底装少量水?
①防止生成的热的P2O5直接掉落在瓶底导致集气瓶受热不均而破裂。
②冷却燃烧后的气体,溶解生成的 P2O5 固体。
(3)为什么烧杯内的水会进入到集气瓶内
红磷和氧气发生反应生成的 P2O5 是固体,同时 P2O5 溶于水,使瓶内气体压强减小,打开止水夹后,大气压把水压入集气瓶中,直至内外压强相等。
(4)如果用木炭、硫等代替红磷来做实验,结果如何?
木炭燃烧生成的是气体二氧化碳,瓶内压强几乎不变。
实验药品:汞
实验装置:曲颈甑、汞槽、玻璃钟罩(形成密闭空间)
实验方法:转换法
思考以下问题:
1.氧化汞是哪两种物质反应的产物?
2.生成的氧化汞是固体还是气体?
3.氧气被消耗后,钟罩内的水银液面为什么会上升?
4.完善“空气中氧气的体积分数”的结果表达模型:
2.1 空气成分
任务二:学会用科学的现象和实验来验证空气的成分。
空气的体积组成
空气的体积组成
各种实验测定表明,空气中有多种成分。各成分的体积大约是:
78%
21%
1%
稀有气体 0.93%
二氧化碳 0.04%
其他气体
和杂质 0.03 %
78%
21%
1%
在通常情况下,空气中各成分的比例保持相对稳定。
2.2 成分证明
1.将二氧化碳通入石灰水中, 石灰水是否变浑浊?_______。如图所示,用大针筒把空气压入石灰水中。石灰水是否变浑浊?_________。这说明空气中含有 __________。
变浑浊
变浑浊
二氧化碳
把空气压入石灰水中,变浑浊的速度怎么样?
说明:空气中含有二氧化碳,含量较少。
变浑浊的速度比较慢。
2. 取一瓶空气和一瓶氧气,把一根燃着的木条先后插入两集气瓶中,观察木条在两集气瓶中燃烧的剧烈程度是否相同。_______________。
合理的解释是 ____________________________。
空气中燃着的木条
燃着的木条伸入氧气中
木条在空气中继续燃烧,
木条在氧气中燃烧得更剧烈
不相同
空气中含有氧气,但不纯
氧气能支持燃烧。在其他条件相同的情况下,氧气的纯度越高,燃烧会越剧烈。
3. 把 1 滴水滴在白色的无水硫酸铜(CuSO4)粉末上,观察无水硫酸铜粉末颜色的变化情况。_______________。
由白色变成蓝色
无水硫酸铜
硫酸铜晶体
白色的无水硫酸铜可以用来检验是否有水存在。
滴水
白色的无水硫酸铜变蓝色
把一些碎冰放入一个干燥的烧杯里,用表面皿盖在烧杯口上。过一会儿,在表面皿里加一些无水硫酸铜,发现 _______________________。出现这一现象的原因是 ________________________。这说明空气中含有 ________________。
空气中的水蒸气遇冷液化成水
水分
思考:
在生活中,从哪些现象中可以知道空气中存在水蒸气?
刚拿出冰箱的可乐
冬天,进入室内的眼镜
受潮的饼干
露珠
通过以上的活动可以初步确定,空气中至少含有 CO2、O2和水蒸气等物质。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
