化学反应的快慢和限度 课件2
图片预览










文档简介
课件80张PPT。第2节 化学反应的快慢和限度
第1课时 化学反应的快慢自主预习区1.了解化学反应速率的概念和表示方法。
2.掌握有关化学反应速率的计算。
3.知道浓度、温度和催化剂等条件对化学反应速率的影响。
4.了解如何调控化学反应的快慢。1.概念:用来描述化学反应的______的物理量。
2.表示方法:用单位时间里______________________或_______________的变化量来表示。一、化学反应速率[填一填] 快慢反应物浓度生成物浓度[记一记] 1.单位时间内,反应物消耗的物质的量越多,是不是反应速率越快?
答案:不一定,反应物物质的量消耗多,浓度变化不一定大。[练一练] 1.内因:_____________________。
2.外因
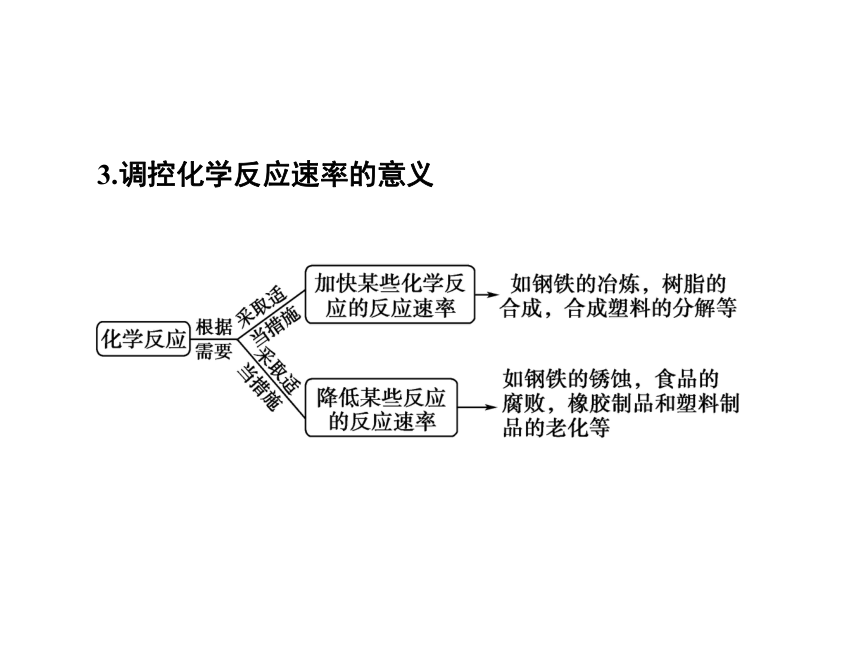
当其他条件不变时,只改变一个条件,对化学反应速率的影响,如下表所示。二、影响化学反应的因素[填一填] 反应物的性质加快反应速率减慢反应速率加快反应速率减慢反应速率加快加快反应速率减慢反应速率越大溶剂3.调控化学反应速率的意义(1)可以用化学反应中的不同物质浓度的变化表示同一个反应的化学反应速率。
(2)压强对反应速率的影响只适用于一些有气体物质参加的反应。
(3)增加固体反应物的用量,化学反应速率的变化忽略不计,只有将大颗粒的反应物变为小颗粒的反应物,才明显加快反应速率。[记一记] 2.(1)在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量 ④将固体块状反应物磨成粉末 ⑤增大压强
A.只有①②④ B.只有②④
C.只有①②③④ D.全部[练一练] (2)通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是( )
答案:(1)A (2)C互动探究区一、化学反应速率 在一定条件下,反应N2(g)+3H2(g)??2NH3(g)在10 L恒容密闭容器中进行,测得2 min内,H2的物质的量由20 mol减少到8 mol,则2 min内H2的化学反应速率为( )
A.1.2 mol·L-1·min-1 B.1.8 mol·L-1·min-1
C.0.6 mol·L-1·min-1 D.0.2 mol·L-1·min-1 (1)化学反应速率的单位可表示为:
mol/(L·min)、mol·(L·min)-1、mol·L-1·min-1,不能省略不同量之间的“·”,如错写为mol L-1 min-1。
(2)在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为不变的常数,因此不能选用固体或纯液体物质来表示化学反应速率。1.(1)求例1中,2 min内NH3的化学反应速率。
(2)若在另一条件下,反应N2(g)+3H2(g)??2NH3(g)用N2表示的反应速率为0.005 mol·(L·s)-1,与例1相比哪一反应进行得快?1.改变反应物或生成物的浓度,以控制反应速率,但固体或纯液体的浓度可视为常数,改变其用量,化学反应速率不会改变。
2.升高温度对于任何化学反应,其反应速率都加快,一般温度每升高10 ℃,化学反应速率增大2~4倍。
3.对于有气体参加的化学反应,改变压强时,体积改变导致反应物浓度改变,反应速率也随之发生改变。二、调控化学反应速率的方法4.选择适当的催化剂,可有效地调控化学反应速率。
5.增大反应物的接触面积、溶剂的性质、光波、声波等都能影响化学反应速率。 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是(双选)( )A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3
点拨: 解答本题要注意以下两点:
(1)先分析图中4条曲线对应的反应速率的快慢。
(2)根据反应分析影响反应速率的条件。 由图知,反应速率:a>b>c>d;由外界条件对反应速率的影响知,温度高、浓度大、固体表面积大,反应速率就快,则1组最慢,2组稍快,由于3组温度高但固体表面积小,4组温度低但固体表面积大,因此,无法确定3组与4组的反应速率的快慢,但均比2组快,故A、C项均有可能。
答案:AC 对于有气体参加的反应,改变压强对反应速率的影响,实际上是通过改变反应容器的体积从而改变了气体反应物的浓度来实现的,如缩小体积,压强增大,气体反应物的浓度增大,反应速率加快,若体积不变,充入与反应无关的气体(如稀有气体),总压强增大了,但反应物浓度并没有变化,因此化学反应速率不变。 解析:压缩容器,体积减小,参与反应的气体浓度增大,化学反应速率加快,A、C都可以。升高温度反应速率加快,D可以。恒容时充入稀有气体,容器体积不变,反应物的浓度不变,故反应速率不变,B不可以。
答案:B巩固训练区1.在下列过程中,需要加快化学反应速率的是( )
A.钢铁腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:在工农业生产和日常生活中,我们应尽量防止钢铁腐蚀、食物腐烂、塑料老化,以便延长钢铁和塑料的使用寿命以及延长食物的保存时间,所以A、B、D三项均应减慢化学反应速率;工业炼钢应尽量在单位时间内多出钢,所以应加快化学反应速率,故C对。
答案:C2.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8 mol/(L·s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显解析:A项,固体或纯液体的浓度可视为常数,一般不用固体或纯液体表示化学反应速率;B项,0.8 mol/(L·s)表示1 s时间内,某物质的浓度变化了0.8 mol/L;D项,有些化学反应速率很快,但无明显现象,例如盐酸和氢氧化钠溶液反应。
答案:C3.当温度不变时,恒容的容器中进行反应2A===B,若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20秒,那么由0.06 mol·L-1降到0.036 mol·L-1,所需反应的时间为( )
A.等于10秒 B.等于12秒
C.大于12秒 D.小于12秒4.下列条件下的反应,放出氢气最快的是( )解析:铜与硫酸不反应;镁与稀硝酸产生一氧化氮,不产生氢气;铝比铁活泼,相同条件下与盐酸反应时,铝反应快。
答案:B5.在下列事实中,各是什么因素影响了化学反应速率。
(1)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时,混合气体爆炸__________。
(2)熔化的KClO3放出气泡速率很慢,撒入少量MnO2很快产生气体__________。
(3)同浓度同体积的盐酸中放入同样大小的镁条和铝条,产生的气体有快有慢________________。(4)夏天食品易变质,而冬天不易发生该现象__________。
(5)同样大小的石灰石分别在1 mol·L-1盐酸和0.1 mol·L-1盐酸中反应速率不同________。
答案:(1)光照 (2)催化剂 (3)反应物本质的性质
(4)温度 (5)浓度第2课时 化学反应的限度自主预习区1.知道可逆反应的特征。
2.了解化学反应的进行有一定限度,了解化学平衡的特征。
3.了解化学平衡的移动。1.定义
在______条件下,既能_____________________,同时又能____________________的反应。
2.特点
可逆反应的反应物_______________转化为生成物,反应只能进行到一定限度。一、可逆反应[填一填] 同一向正反应方向进行向逆反应方向进行不可能全部[记一记] [练一练] 1.概念
在一定条件下可逆反应进行到一定程度时,反应物和生成物的
浓度___________,正反应速率和逆反应速率_____,这种状态称为化学平衡状态,简称化学平衡。达到化学平衡时,正、逆反应仍在继续进行,因此化学平衡是一种_________。二、化学平衡 [填一填] 保持不变相等动态平衡2.化学平衡的移动
(1)概念:已达化学平衡的可逆反应,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起______________的过程。
(2)化学平衡移动的影响因素
影响化学平衡移动的因素有:_____、______________、________等。新的化学平衡温度反应物浓度压强化学平衡的特征
(1)“逆”:可逆反应。
(2)“动”:达平衡状态时,可逆反应并未停止,因此化学平衡是动态平衡。
(3)“等”:平衡状态时,正、逆反应的速率相等。
(4)“定”:平衡时,反应体系中各成分的物质的量、质量、含量(浓度或物质的量分数或气体的体积分数)保持恒定。
(5)“变”:改变条件,化学平衡状态发生改变。[记一记] 2.(1)化学反应达到化学平衡时,反应停止了吗?
(2)下列关于化学反应限度的叙述错误的是( )
A.不同的化学反应,限度可能不同
B.可以通过改变温度来控制化学反应的限度
C.可以通过延长化学反应的时间来改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,正、逆反应速率相等[练一练] 答案:(1)没有停止。化学平衡是一种动态平衡,正、逆反应仍在进行。
(2)C互动探究区一、化学平衡的建立2.反应进行中
反应物的浓度逐渐减小,正反应速率逐渐减小;
生成物的浓度逐渐增大,逆反应速率逐渐增大。
3.肯定最终有一时刻,正反应速率与逆反应速率相等,此时,反应物的浓度不再改变,生成物的浓度也不再改变。
4.在直角坐标系中用图象表示出v(正)、v(逆)变化与反应时间变化的关系。(见下图) 某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如右图所示。
(1)由图中数据分析,该反应的化学方程式为______________________________。
(2)反应开始至2 min,Z的平均反应速率为______________________。(3)判断:第5分钟时,反应是否达到平衡?________;第5分钟时,Z的生成速率________Z的消耗速率(填“大于”、“小于”或“等于”)。
点拨:(1)写反应的化学方程式,关键是确定反应物、生成物以及方程式中X、Y、Z三种物质的化学计量数。一般反应物物质的量随反应的进行不断减小,生成物物质的量随反应的进行不断增加。
(2)各组分的物质的量不再变化时反应达平衡状态。 (1)由图可知,X、Y为反应物,Z为生成物。结合图示X、Y、Z三种物质物质的量的变化量即可求出它们的化学计量数,即Δn(X)∶Δn(Y)∶Δn(Z)=(1.0-0.7)∶(1.0-0.9)∶(0.2-0)=3∶1∶2,故该反应方程式的化学计量数之比为3∶1∶2。
(2)Z物质在2 min内的平均反应速率,可先通过求出Z物质的物质的量浓度的变化量,再根据反应速率的计算式(Δc/Δt)求解。(3)因为反应开始后的某个时刻,各物质的物质的量都不再改变,说明该反应是可逆反应,并且在该时刻建立了化学平衡。即至少在第2分钟之前,反应尚未达到平衡;第5分钟时,各物质的物质的量不变,达到平衡状态,v(正)=v(逆)。 (1)确定反应为可逆反应的方法:若反应达到最大限度时,各组分的量均不为零,该反应为可逆反应。
(2)可逆反应达到平衡后,各组分的量不随反应时间的改变而改变。下列叙述中,正确的是( )
A.点c处正反应速率和逆反应速率相等
B.点a处的正反应速率比点b处的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率解析:该图示为n~t图象,随反应的进行,n(H2)越来越小,正反应速率逐渐减慢,故B项对;点c处只是二者的物质的量相等,但是仍在变化,未达到平衡,因此,v(正)与v(逆)不相等,故A项错;由于点d和点e都是平衡点,因此两点时v(N2)相同,故C项错;由于t2时刻已达到化学平衡,因此v(正)=v(逆),故D项错。
答案:B1.v正=v逆。
2.各组分的物质的量、质量、浓度、含量保持不变。
3.由“变”到“不变”,“不变”则达平衡:题给物理量当建立平衡 的过程中是不断变化的,若该物理量不再变化,则该反应已达平衡。二、化学平衡状态的判断依据点拨:解答本题要注意以下三点:
(1)达平衡时,v(正)=v(逆)。
(2)达平衡时,各物质浓度不再变化。
(3)平衡浓度与化学方程式中的系数无关。 各反应物质均为气体,反应过程中气体的总质量一定,体积一定,因此密度为定值,与反应是否达平衡状态无关,A错;B项恰恰表示了当达到化学平衡时的情况:各组成成分的浓度不再变化,B对;C项假设开始投入2 mol X、4 mol Y进行反应,当有1 mol X和2 mol Y反应生成2 mol Z时,X、Y、Z的浓度之比为1∶2∶2,但并不一定是达到平衡时的状态,C错;D项中消耗X与生成Z均为正反应速率,没有表达正、逆反应速率的关系,D错。
答案:B 不能把平衡时反应混合物组成不变误认为相等或等于化学计量数之比。2.例2中的可逆反应:(1)若容器内压强保持不变,该可逆反应是否达平衡状态?
(2)单位时间内消耗0.1 mol X同时消耗0.2 mol Z,该可逆反应是否达平衡状态?解析:(1)由于该反应为气体物质的量减小的反应,从正向建立平衡的过程中,容器内总压强是不断减小的,只有达平衡状态时,压强才保持不变,故该反应已平衡。
(2)消耗X表示正反应,消耗Z表示逆反应,当单位时间内消耗0.2 mol Z时,应同时生成0.1 mol X,即单位时间内消耗X和生成X的量相同,v正=v逆,反应已达平衡。
答案:(1)达平衡状态 (2)达平衡状态巩固训练区解析:化学平衡是动态平衡,18O2的加入定会与SO2结合生成含18O的SO3,同时含18O的SO3又会分解得到SO2和O2,使SO2、O2中也含有18O,因此18O存在于SO2、O2、SO3这三种物质中。
答案:D2.下列关于化学平衡状态的说法中正确的是( )
A.改变外界条件不能改变化学反应的平衡状态
B.当可逆反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当可逆反应达到平衡状态时,该反应立刻停止不再进行
D.当可逆反应达到化学平衡状态时,反应物和生成物的浓度一定相等解析:化学平衡是一定条件下的平衡,当条件改变时,平衡就会被破坏,即平衡就会发生移动,直至达到新条件下的新平衡,则A错;化学平衡状态是可逆反应所能进行到的最大限度,反过来说,如果一个可逆反应在一定条件下进行到了最大限度,该可逆反应也就达到了化学平衡状态,则B正确;可逆反应达到了化学平衡状态时,反应并没有真正停止,而是v(正)=v(逆)≠0的动态平衡,则C错;当可逆反应达到化学平衡状态时,反应混合物中各组分浓度保持不变,并不一定相等,则D错。
答案:B解析:A选项中,速率之比等于系数之比,应为1∶2;B选项出现的净速率在中学没出现过,但根据平均速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程,而逆反应速率是增大的过程;D选项是平衡的特征,正确。
答案:BD4.某可逆反应在t1时刻达平衡状态,t2时刻改变影响平衡的某一条件后在t3时刻建立新的化学平衡(如图所示),下列说法正确的是( )
A.t2时刻之后,化学平衡未发生移动
B.从t2到t3,化学平衡向正反应方向移动
C.从t2到t3,化学平衡向逆反应方向移动
D.从t2到t3,化学平衡是否移动无法判断解析:在原化学平衡的基础上,t2时刻v正≠v逆,化学平衡一定发生移动,又由于t2时刻v逆>v正,故该化学平衡向逆反应方向移动。
答案:C
第1课时 化学反应的快慢自主预习区1.了解化学反应速率的概念和表示方法。
2.掌握有关化学反应速率的计算。
3.知道浓度、温度和催化剂等条件对化学反应速率的影响。
4.了解如何调控化学反应的快慢。1.概念:用来描述化学反应的______的物理量。
2.表示方法:用单位时间里______________________或_______________的变化量来表示。一、化学反应速率[填一填] 快慢反应物浓度生成物浓度[记一记] 1.单位时间内,反应物消耗的物质的量越多,是不是反应速率越快?
答案:不一定,反应物物质的量消耗多,浓度变化不一定大。[练一练] 1.内因:_____________________。
2.外因
当其他条件不变时,只改变一个条件,对化学反应速率的影响,如下表所示。二、影响化学反应的因素[填一填] 反应物的性质加快反应速率减慢反应速率加快反应速率减慢反应速率加快加快反应速率减慢反应速率越大溶剂3.调控化学反应速率的意义(1)可以用化学反应中的不同物质浓度的变化表示同一个反应的化学反应速率。
(2)压强对反应速率的影响只适用于一些有气体物质参加的反应。
(3)增加固体反应物的用量,化学反应速率的变化忽略不计,只有将大颗粒的反应物变为小颗粒的反应物,才明显加快反应速率。[记一记] 2.(1)在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量 ④将固体块状反应物磨成粉末 ⑤增大压强
A.只有①②④ B.只有②④
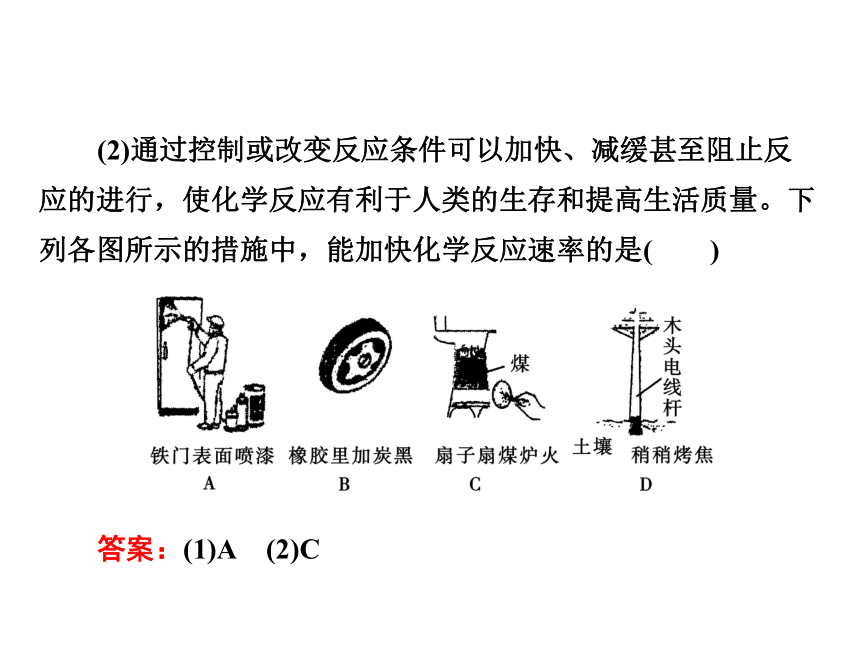
C.只有①②③④ D.全部[练一练] (2)通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是( )
答案:(1)A (2)C互动探究区一、化学反应速率 在一定条件下,反应N2(g)+3H2(g)??2NH3(g)在10 L恒容密闭容器中进行,测得2 min内,H2的物质的量由20 mol减少到8 mol,则2 min内H2的化学反应速率为( )
A.1.2 mol·L-1·min-1 B.1.8 mol·L-1·min-1
C.0.6 mol·L-1·min-1 D.0.2 mol·L-1·min-1 (1)化学反应速率的单位可表示为:
mol/(L·min)、mol·(L·min)-1、mol·L-1·min-1,不能省略不同量之间的“·”,如错写为mol L-1 min-1。
(2)在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为不变的常数,因此不能选用固体或纯液体物质来表示化学反应速率。1.(1)求例1中,2 min内NH3的化学反应速率。
(2)若在另一条件下,反应N2(g)+3H2(g)??2NH3(g)用N2表示的反应速率为0.005 mol·(L·s)-1,与例1相比哪一反应进行得快?1.改变反应物或生成物的浓度,以控制反应速率,但固体或纯液体的浓度可视为常数,改变其用量,化学反应速率不会改变。
2.升高温度对于任何化学反应,其反应速率都加快,一般温度每升高10 ℃,化学反应速率增大2~4倍。
3.对于有气体参加的化学反应,改变压强时,体积改变导致反应物浓度改变,反应速率也随之发生改变。二、调控化学反应速率的方法4.选择适当的催化剂,可有效地调控化学反应速率。
5.增大反应物的接触面积、溶剂的性质、光波、声波等都能影响化学反应速率。 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是(双选)( )A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3
点拨: 解答本题要注意以下两点:
(1)先分析图中4条曲线对应的反应速率的快慢。
(2)根据反应分析影响反应速率的条件。 由图知,反应速率:a>b>c>d;由外界条件对反应速率的影响知,温度高、浓度大、固体表面积大,反应速率就快,则1组最慢,2组稍快,由于3组温度高但固体表面积小,4组温度低但固体表面积大,因此,无法确定3组与4组的反应速率的快慢,但均比2组快,故A、C项均有可能。
答案:AC 对于有气体参加的反应,改变压强对反应速率的影响,实际上是通过改变反应容器的体积从而改变了气体反应物的浓度来实现的,如缩小体积,压强增大,气体反应物的浓度增大,反应速率加快,若体积不变,充入与反应无关的气体(如稀有气体),总压强增大了,但反应物浓度并没有变化,因此化学反应速率不变。 解析:压缩容器,体积减小,参与反应的气体浓度增大,化学反应速率加快,A、C都可以。升高温度反应速率加快,D可以。恒容时充入稀有气体,容器体积不变,反应物的浓度不变,故反应速率不变,B不可以。
答案:B巩固训练区1.在下列过程中,需要加快化学反应速率的是( )
A.钢铁腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:在工农业生产和日常生活中,我们应尽量防止钢铁腐蚀、食物腐烂、塑料老化,以便延长钢铁和塑料的使用寿命以及延长食物的保存时间,所以A、B、D三项均应减慢化学反应速率;工业炼钢应尽量在单位时间内多出钢,所以应加快化学反应速率,故C对。
答案:C2.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为“0.8 mol/(L·s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显解析:A项,固体或纯液体的浓度可视为常数,一般不用固体或纯液体表示化学反应速率;B项,0.8 mol/(L·s)表示1 s时间内,某物质的浓度变化了0.8 mol/L;D项,有些化学反应速率很快,但无明显现象,例如盐酸和氢氧化钠溶液反应。
答案:C3.当温度不变时,恒容的容器中进行反应2A===B,若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20秒,那么由0.06 mol·L-1降到0.036 mol·L-1,所需反应的时间为( )
A.等于10秒 B.等于12秒
C.大于12秒 D.小于12秒4.下列条件下的反应,放出氢气最快的是( )解析:铜与硫酸不反应;镁与稀硝酸产生一氧化氮,不产生氢气;铝比铁活泼,相同条件下与盐酸反应时,铝反应快。
答案:B5.在下列事实中,各是什么因素影响了化学反应速率。
(1)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时,混合气体爆炸__________。
(2)熔化的KClO3放出气泡速率很慢,撒入少量MnO2很快产生气体__________。
(3)同浓度同体积的盐酸中放入同样大小的镁条和铝条,产生的气体有快有慢________________。(4)夏天食品易变质,而冬天不易发生该现象__________。
(5)同样大小的石灰石分别在1 mol·L-1盐酸和0.1 mol·L-1盐酸中反应速率不同________。
答案:(1)光照 (2)催化剂 (3)反应物本质的性质
(4)温度 (5)浓度第2课时 化学反应的限度自主预习区1.知道可逆反应的特征。
2.了解化学反应的进行有一定限度,了解化学平衡的特征。
3.了解化学平衡的移动。1.定义
在______条件下,既能_____________________,同时又能____________________的反应。
2.特点
可逆反应的反应物_______________转化为生成物,反应只能进行到一定限度。一、可逆反应[填一填] 同一向正反应方向进行向逆反应方向进行不可能全部[记一记] [练一练] 1.概念
在一定条件下可逆反应进行到一定程度时,反应物和生成物的
浓度___________,正反应速率和逆反应速率_____,这种状态称为化学平衡状态,简称化学平衡。达到化学平衡时,正、逆反应仍在继续进行,因此化学平衡是一种_________。二、化学平衡 [填一填] 保持不变相等动态平衡2.化学平衡的移动
(1)概念:已达化学平衡的可逆反应,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起______________的过程。
(2)化学平衡移动的影响因素
影响化学平衡移动的因素有:_____、______________、________等。新的化学平衡温度反应物浓度压强化学平衡的特征
(1)“逆”:可逆反应。
(2)“动”:达平衡状态时,可逆反应并未停止,因此化学平衡是动态平衡。
(3)“等”:平衡状态时,正、逆反应的速率相等。
(4)“定”:平衡时,反应体系中各成分的物质的量、质量、含量(浓度或物质的量分数或气体的体积分数)保持恒定。
(5)“变”:改变条件,化学平衡状态发生改变。[记一记] 2.(1)化学反应达到化学平衡时,反应停止了吗?
(2)下列关于化学反应限度的叙述错误的是( )
A.不同的化学反应,限度可能不同
B.可以通过改变温度来控制化学反应的限度
C.可以通过延长化学反应的时间来改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,正、逆反应速率相等[练一练] 答案:(1)没有停止。化学平衡是一种动态平衡,正、逆反应仍在进行。
(2)C互动探究区一、化学平衡的建立2.反应进行中
反应物的浓度逐渐减小,正反应速率逐渐减小;
生成物的浓度逐渐增大,逆反应速率逐渐增大。
3.肯定最终有一时刻,正反应速率与逆反应速率相等,此时,反应物的浓度不再改变,生成物的浓度也不再改变。
4.在直角坐标系中用图象表示出v(正)、v(逆)变化与反应时间变化的关系。(见下图) 某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如右图所示。
(1)由图中数据分析,该反应的化学方程式为______________________________。
(2)反应开始至2 min,Z的平均反应速率为______________________。(3)判断:第5分钟时,反应是否达到平衡?________;第5分钟时,Z的生成速率________Z的消耗速率(填“大于”、“小于”或“等于”)。
点拨:(1)写反应的化学方程式,关键是确定反应物、生成物以及方程式中X、Y、Z三种物质的化学计量数。一般反应物物质的量随反应的进行不断减小,生成物物质的量随反应的进行不断增加。
(2)各组分的物质的量不再变化时反应达平衡状态。 (1)由图可知,X、Y为反应物,Z为生成物。结合图示X、Y、Z三种物质物质的量的变化量即可求出它们的化学计量数,即Δn(X)∶Δn(Y)∶Δn(Z)=(1.0-0.7)∶(1.0-0.9)∶(0.2-0)=3∶1∶2,故该反应方程式的化学计量数之比为3∶1∶2。
(2)Z物质在2 min内的平均反应速率,可先通过求出Z物质的物质的量浓度的变化量,再根据反应速率的计算式(Δc/Δt)求解。(3)因为反应开始后的某个时刻,各物质的物质的量都不再改变,说明该反应是可逆反应,并且在该时刻建立了化学平衡。即至少在第2分钟之前,反应尚未达到平衡;第5分钟时,各物质的物质的量不变,达到平衡状态,v(正)=v(逆)。 (1)确定反应为可逆反应的方法:若反应达到最大限度时,各组分的量均不为零,该反应为可逆反应。
(2)可逆反应达到平衡后,各组分的量不随反应时间的改变而改变。下列叙述中,正确的是( )
A.点c处正反应速率和逆反应速率相等
B.点a处的正反应速率比点b处的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率解析:该图示为n~t图象,随反应的进行,n(H2)越来越小,正反应速率逐渐减慢,故B项对;点c处只是二者的物质的量相等,但是仍在变化,未达到平衡,因此,v(正)与v(逆)不相等,故A项错;由于点d和点e都是平衡点,因此两点时v(N2)相同,故C项错;由于t2时刻已达到化学平衡,因此v(正)=v(逆),故D项错。
答案:B1.v正=v逆。
2.各组分的物质的量、质量、浓度、含量保持不变。
3.由“变”到“不变”,“不变”则达平衡:题给物理量当建立平衡 的过程中是不断变化的,若该物理量不再变化,则该反应已达平衡。二、化学平衡状态的判断依据点拨:解答本题要注意以下三点:
(1)达平衡时,v(正)=v(逆)。
(2)达平衡时,各物质浓度不再变化。
(3)平衡浓度与化学方程式中的系数无关。 各反应物质均为气体,反应过程中气体的总质量一定,体积一定,因此密度为定值,与反应是否达平衡状态无关,A错;B项恰恰表示了当达到化学平衡时的情况:各组成成分的浓度不再变化,B对;C项假设开始投入2 mol X、4 mol Y进行反应,当有1 mol X和2 mol Y反应生成2 mol Z时,X、Y、Z的浓度之比为1∶2∶2,但并不一定是达到平衡时的状态,C错;D项中消耗X与生成Z均为正反应速率,没有表达正、逆反应速率的关系,D错。
答案:B 不能把平衡时反应混合物组成不变误认为相等或等于化学计量数之比。2.例2中的可逆反应:(1)若容器内压强保持不变,该可逆反应是否达平衡状态?
(2)单位时间内消耗0.1 mol X同时消耗0.2 mol Z,该可逆反应是否达平衡状态?解析:(1)由于该反应为气体物质的量减小的反应,从正向建立平衡的过程中,容器内总压强是不断减小的,只有达平衡状态时,压强才保持不变,故该反应已平衡。
(2)消耗X表示正反应,消耗Z表示逆反应,当单位时间内消耗0.2 mol Z时,应同时生成0.1 mol X,即单位时间内消耗X和生成X的量相同,v正=v逆,反应已达平衡。
答案:(1)达平衡状态 (2)达平衡状态巩固训练区解析:化学平衡是动态平衡,18O2的加入定会与SO2结合生成含18O的SO3,同时含18O的SO3又会分解得到SO2和O2,使SO2、O2中也含有18O,因此18O存在于SO2、O2、SO3这三种物质中。
答案:D2.下列关于化学平衡状态的说法中正确的是( )
A.改变外界条件不能改变化学反应的平衡状态
B.当可逆反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当可逆反应达到平衡状态时,该反应立刻停止不再进行
D.当可逆反应达到化学平衡状态时,反应物和生成物的浓度一定相等解析:化学平衡是一定条件下的平衡,当条件改变时,平衡就会被破坏,即平衡就会发生移动,直至达到新条件下的新平衡,则A错;化学平衡状态是可逆反应所能进行到的最大限度,反过来说,如果一个可逆反应在一定条件下进行到了最大限度,该可逆反应也就达到了化学平衡状态,则B正确;可逆反应达到了化学平衡状态时,反应并没有真正停止,而是v(正)=v(逆)≠0的动态平衡,则C错;当可逆反应达到化学平衡状态时,反应混合物中各组分浓度保持不变,并不一定相等,则D错。
答案:B解析:A选项中,速率之比等于系数之比,应为1∶2;B选项出现的净速率在中学没出现过,但根据平均速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程,而逆反应速率是增大的过程;D选项是平衡的特征,正确。
答案:BD4.某可逆反应在t1时刻达平衡状态,t2时刻改变影响平衡的某一条件后在t3时刻建立新的化学平衡(如图所示),下列说法正确的是( )
A.t2时刻之后,化学平衡未发生移动
B.从t2到t3,化学平衡向正反应方向移动
C.从t2到t3,化学平衡向逆反应方向移动
D.从t2到t3,化学平衡是否移动无法判断解析:在原化学平衡的基础上,t2时刻v正≠v逆,化学平衡一定发生移动,又由于t2时刻v逆>v正,故该化学平衡向逆反应方向移动。
答案:C
