元素周期表的应用 课件1
图片预览










文档简介
课件112张PPT。第3节 元素周期表的应用
第1课时
认识同周期元素性质的递变规律自主预习区1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律。
3.了解原子结构、元素性质及该元素在周期表中的位置三者之间的关系。
4.初步学会运用元素周期表。1.实验探究
(1)置换氢能力比较
①钠、镁与水反应的比较
两种金属置换出水中的氢的难易程度为___________,失电子能力的强弱顺序为__________。一、钠、镁、铝三种元素原子失电子能力比较[填一填] Na>MgNa>Mg(2)镁、铝氢氧化物性质的比较
Al(OH)3为两性氢氧化物,Mg(OH)2为中强碱,碱性___________________________,故Mg的失电子能力强。
2.钠、镁、铝失电子能力的比较
钠、镁、铝失电子能力由强到弱的顺序依次为:_________________。Mg(OH)2>Al(OH)3Na>Mg>Al(1)镁与冷水几乎不反应,与热水较缓慢地反应。
(2)金属元素原子失电子能力可以通过单质与水、酸置换氢的能力及元素最高价氧化物对应水化物的碱性进行比较。
(3)原子失电子能力越强,元素的金属性越强。[记一记] 1.判断下列说法是否正确:
(1)金属元素原子失电子数越多,原子失电子能力越强( )
(2)碱性:NaOH>Mg(OH)2>Al(OH)3( )
(3)原子半径:r(Na)(4)还原性:Na>Mg>Al( )
(5)金属性:Na>Mg>Al( )
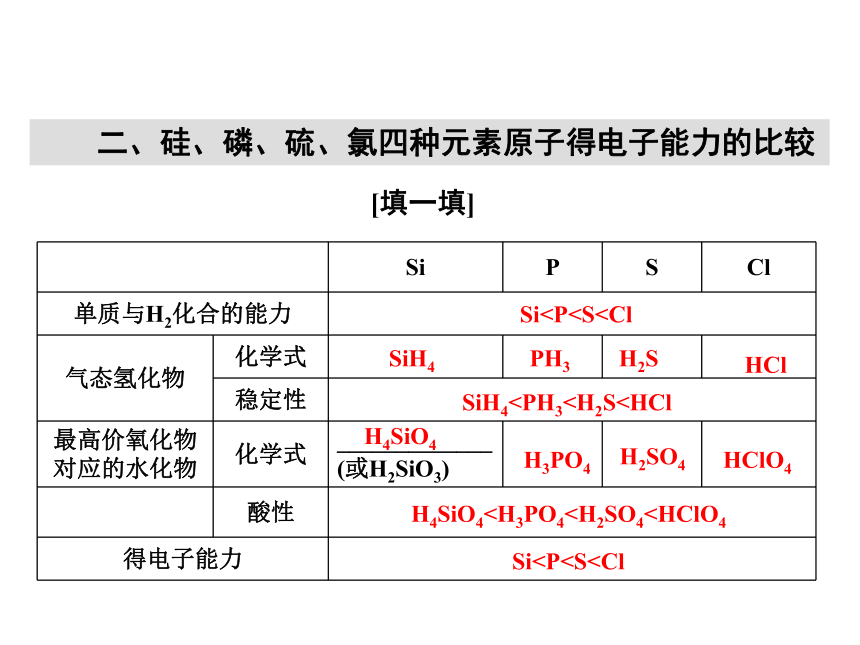
答案:(1)× (2)√ (3)× (4)√ (5)√[练一练] 二、硅、磷、硫、氯四种元素原子得电子能力的比较[填一填] Si(2)Si、P、S、Cl最高价氧化物依次为SiO2、P2O5、SO3、Cl2O7,均属于酸性氧化物。
(3)Si元素最高价氧化物对应水化物为H4SiO4或H2SiO3。
(4)原子得电子能力越强,元素非金属性越强。[记一记] [练一练] 1.规律
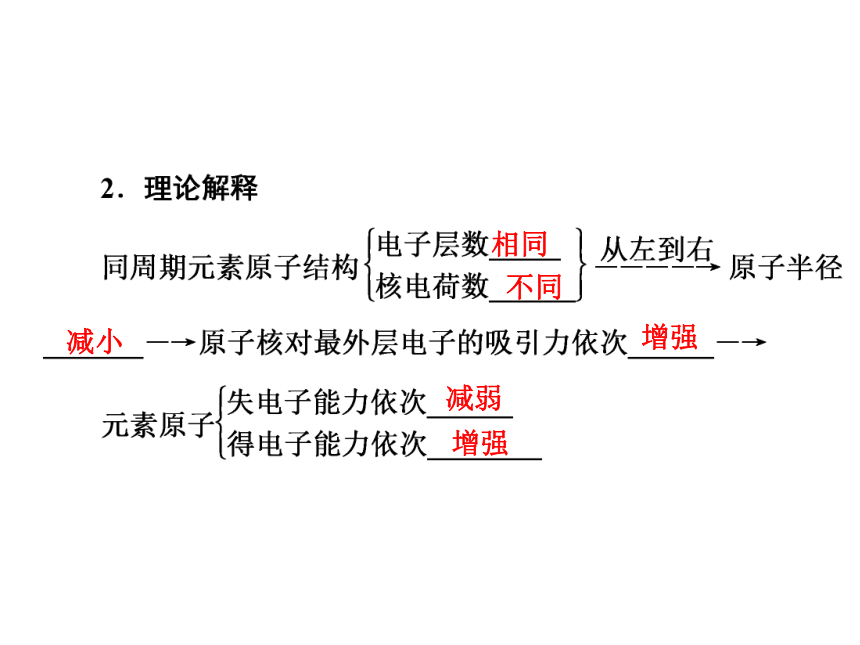
同周期由左到右,元素原子得电子能力______,失电子能力_______。三、同周期元素原子得失电子能力的变化规律[填一填] 增强减弱相同 不同 减小 增强 减弱 增强 3.(1)“ⅠA族金属元素是同周期中金属性最强的元素”这种说法对吗?
(2)从原子结构的角度说明金属性钠大于镁的原因。
答案:(1)对。
(2)由于Na、Mg原子核外电子层数相同,又由于核电荷数钠的小于镁的,故金属性钠大于镁。[练一练] 互动探究区一、同周期元素的原子结构与性质的递变规律 同周期的三种短周期元素X、Y、Z,它们的最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则下列判断正确的是(双选)( )
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序增大
D.元素的最低负化合价的绝对值按X、Y、Z顺序增大点拨:解答本题应抓住以下两点:
(1)根据最高价氧化物对应水化物的化学式标出中心元素的化合价。
(2)根据最高化合价确定X、Y、Z在元素周期表中的位置。 O、F两元素常见化合价无正价,最高价≠最外层电子数,也无最高价氧化物及其水化物。 1.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:WB.原子最外层电子数:WC.单质的氧化能力:WD.元素的最高化合价:W答案:B1.最高价氧化物的水化物的碱性愈强,金属性则愈强。
2.单质与水或酸反应置换氢的难易,愈易则金属性愈强。
3.单质与盐溶液的置换反应,强置换弱。
4.根据元素阳离子的氧化性强弱,阳离子氧化性越强,则元素金属性越弱。如氧化性Na+<Cu2+,则金属性Na>Cu。二、验证元素金属性强弱的事实 下列叙述中,X金属肯定比Y金属活动性强的是( )
A.X原子的最外层电子数比Y原子的最外层电子数少
B.X原子的电子层数比Y原子的电子层数多
C.1 mol X从酸中置换H+生成的氢气比1 mol Y从酸中置换H+生成的氢气多
D.常温时,X能从水中置换出氢气, 而Y不能 主族金属元素阳离子的氧化性强弱可以用于比较对应元素的金属性,但对过渡金属元素,一般不适用。2.对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOHB.原子半径:NaC.单质的还原性:NaD.离子半径:Na+>Mg2+>Al3+解析:第三周期金属元素原子半径Na>Mg>Al,离子半径Na+>Mg2+>Al3+,金属活动性Na>Mg>Al,最高价氧化物对应水化物碱性:NaOH>Mg(OH)2>Al(OH)3。
答案:D1.跟氢气形成气态氢化物的难易程度,愈易反应,非金属性愈强。
2.气态氢化物的稳定性,稳定性愈高,非金属性愈强。
3.最高价氧化物水化物的酸性强弱,酸性愈强则非金属性愈强。
4.置换反应,强置换弱。三、验证元素非金属性强弱的事实5.与同一种金属反应后金属价态的变化。
例如:Fe与Cl2、S分别反应生成FeCl3、FeS,说明非金属性Cl>S。
6.元素阴离子还原性强弱,还原性愈强则非金属性愈弱。 X、Y为同一短周期元素,如果X的原子半径大于Y的原子半径,则下列判断不正确的是( )
A.若X、Y均为金属元素,则X失电子的能力强于Y
B.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强
C.若X、Y均为非金属元素, 则Y的气态氢化物比X的气态氢化物稳定
D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y的强于X的点拨: 3.下列所述变化规律正确的是( )
A.Na、Mg、Al还原性依次增强
B.HCl、PH3、H2S稳定性依次减弱
C.Al(OH)3、Mg(OH)2、NaOH碱性依次减弱
D.S2-、Cl-、K+、Ca2+的离子半径依次减小巩固训练区1.下列元素的单质中,最易跟氢气反应生成氢化物的是( )
A.硼 B.氮
C.氟 D.碳
解析:同周期从左到右元素的非金属性增强,氟是最活泼的非金属元素。
答案:C2.下列四种氢氧化物中碱性最强的是( )
A.Mg(OH)2 B.Al(OH)3
C.NaOH D.Fe(OH)3
解析:由于碱性与元素的金属性有关系,金属性越强,对应的最高价氧化物的水化物的碱性就越强,对于钠、镁、铝三种金属来说,位于同一周期,从左到右金属性逐渐减弱,所以NaOH的碱性最强,而由金属活动性顺序表可知,铁的金属性不如钠的金属性强,所以碱性最强的是NaOH。
答案:C3.按C、N、O、F的顺序,元素的性质表现为递增的是( )
A.元素的金属性 B.原子失电子的能力
C.原子得电子的能力 D.单质的还原性
解析:C、N、O、F位于同一周期,从左到右元素的非金属性逐渐增强,原子得电子能力逐渐增强,失电子能力逐渐减弱,单质的氧化性逐渐增强,还原性逐渐减弱。
答案:CA.HXO4>H2YO4>HZO4 B.HZO4>HXO4>H2YO4
C.HZO4>H2YO4>HXO4 D.H2YO4>HZO4>HXO4
解析:由题中提供的方程式可知:Z2可置换出X2,即非金属性Z>X,而X能使变价金属Cu显+2价,Y仅使Cu显-1价,证明非金属性X>Y。结合题干则它们的最高价氧化物对应的水化物的酸性强弱顺序为:HZO4>HXO4>H2YO4。
答案:B5.A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:
A____________、C____________、D____________;
(2)A、E两元素最高价氧化物对应水化物相互反应的化学方程式____________________________________________;
(3)比较C、D最高价氧化物对应水化物的酸性_________。解析:A、B、E三元素最高价氧化物对应的水化物为酸或碱,两两皆能反应,必有一种是两性物质Al(OH)3,另两种为强酸、强碱,碱是NaOH,又A、B、E三原子最外层电子数之和为11,且原子序数依次增大,可推出E原子最外层7个电子,短周期元素中只有Cl符合要求,两两反应的三种物质是NaOH、Al(OH)3、HClO4,C、D原子序数小于17,大于13,推出分别为Si和P,非金属性Si答案:(1)Na Si P
(2)NaOH+HClO4===NaClO4+H2O
(3)H3PO4>H2SiO3第2课时 预测同主族元素的性质自主预习区1.以第ⅠA族、第ⅦA族元素为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.能根据同主族中熟悉元素的性质特点预测不熟悉元素的性质。
4.了解元素周期表中各个区域元素的应用。一、预测同主族元素的性质[填一填] 7 减弱 +7 -1 HX HXO4 化合 由易到难 由强到弱 由强到弱 由弱到强 1 +1 ROH 化合 (2)递变性(从Li―→Cs)
①原子半径:____________;
②原子失电子能力:____________;
③单质与水反应剧烈程度:_______________;
④与氧气反应的剧烈程度:_______;
⑤最高价氧化物的水化物的碱性:________。由小到大由弱到强变得更剧烈变强变强3.结论及解释
(1)结论:同主族元素性质既具有____性又有________性。
(2)解释:相似递变(1)熟记卤族元素、碱金属元素的名称及元素符号。
(2)卤素单质的化学性质与Cl2的化学性质相似;与金属、非金属、水、碱反应(F2除外)。
(3)碱金属单质的化学性质与钠的化学性质相似:与水、氧气等反应。[记一记] 1.(1)写出K、Br2分别与水反应的化学方程式:
____________________、____________________。
(2)写出下列元素最高价氧化物对应水化物的化学式。
Cs________________,Br________________。
(3)下列比较正确的是( )
A.原子半径:r(Na)>r(Cs) B.还原性:Na+>K+
C.氧化性:F2>Br2 D.稳定性:HI>HCl[练一练] 1.在________________________的交界处寻找半导体材料。
2.在____________中寻找优良的催化剂。
3.对________区域研究,生产新型农药等。
4._________新元素的性质。二、元素周期律和元素周期表的具体应用[填一填] 金属元素和非金属元素过渡元素非金属预测2.(1)镭是元素周期表中ⅡA族元素,下列关于镭的叙述不正确的是( )
A.镭比钙的金属性更强 B.在化合物中呈+2价
C.碳酸盐难溶于水 D.氢氧化镭呈两性
(2)自然界存在的元素中,非金属性最强的是________,金属性最强的是________。
答案:(1)D (2)F Cs[练一练] 互动探究区一、元素周期表中元素性质的变化规律解析:
答案:C解析:F、Cl、Br、I位于同一主族,原子序数逐渐增大,所以根据同一主族元素性质的递变规律可知,氢化物稳定性的强弱顺序是:HF>HCl>HBr>HI,A正确;Na与S位于同一周期,从左到右原子半径逐渐变小,所以Na>S,而S和O位于同一主族,从上到下原子半径逐渐增大,所以S>O,B正确;Li、Na、K位于同一主族,且均为金属,从上到下金属性逐渐增强,所以碱性强弱KOH>NaOH>LiOH,C正确;F2、Cl2、Br2的氧化性逐渐减弱,所以对应离子的还原性依次增强,D不正确。
答案:D1.“位、构、性”三者关系解读
(1)元素的原子结构与元素在周期表中位置的关系
核内质子数=原子序数;核外电子层数=周期序数;最外层电子数=主族序数。二、原子结构、元素在周期表中的位置与元素性质的关系2.“位、构、性”三者关系的应用
利用元素的原子结构、元素在周期表中的位置、元素的性质三者关系,可以比较或推断某些元素的性质,如:
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应水化物的酸碱性、氢化物的稳定性等。
(2)比较同周期元素及其化合物的性质。
(3)比较不同周期、不同主族元素的性质时,要找出参照物。
(4)推断一些未学过的元素的某些性质。2.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强巩固训练区3.如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
A.N元素为第1周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱5.(1)在短周期元素中(用化学式填空):
①与水反应最剧烈的金属单质是________。
②元素的气态氢化物最稳定的是________。
③元素的最高价氧化物对应的水化物中碱性最强的是________。
④元素的最高价氧化物对应的水化物中酸性最强的是________。
(2)短周期元素中,原子半径最大的非金属元素的原子是________。
答案:(1)①Na ②HF ③NaOH ④HClO4 (2)Si专题归纳区元素推断题是物质结构部分的重要题型,遇到此类题型时同学们往往会感觉到束手无策,其实,对这种类型的题只要能抓住“题眼”,便可顺利解答,常见“题眼”归纳如下:
(1)原子核内无中子的元素:H。
(2)最外层电子数等于最内层电子数的短周期元素:Be、Mg。元素推断“题眼”串串烧(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数是次外层2倍的元素:C。
(5)最外层电子数是次外层3倍的元素:O。
(6)最外层电子数是次外层一半的元素:Li、Si。
(7)族序数等于周期序数的元素:H、Be、Al。
(8)族序数等于周期序数两倍的元素:C、S。
(9)族序数等于周期序数3倍的元素:O。
(10)周期序数是族序数2倍的元素:Li。(11)周期序数是族序数3倍的元素:Na。
(12)最高正价与最低负价代数和为零的短周期元素:C、Si。
(13)最高正价是最低负价绝对值3倍的短周期元素:S。
(14)原子半径最小的元素:H,其次是F。
(15)短周期元素中,其离子半径最大的元素:P。
(16)最高正价不等于族序数的元素:O、F。 X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期;M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:
X____________,Y____________,M____________。(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应:_______________________。
(3)Y与Z相比,非金属性较强的元素是________,可以证明该结论的实验是(用离子方程式表示)_________________。(4)其单质是最轻的金属;单质保存在石蜡中;没有过氧化物的碱金属。(Li)
(5)焰色反应为黄色。(Na)
(6)其单质具有与强酸、强碱反应的性质。(Al)
(7)水中的富营养元素。(N或P)
(8)其单质为淡黄色的粉末,易溶于二硫化碳,用于除去洒落的汞。(S)
(9)其最高价氧化物的固体,可用于人工降雨。(C)2.常见短周期元素构成的单质和化合物的物理性质和含量
(1)地壳中质量分数最大的元素是O,其次是Si。
(2)地壳中质量分数最大的金属元素。(Al)
(3)其单质是人工制得的纯度最高的元素。(Si)
(4)其单质是天然物质中硬度最大的元素。(C)
(5)其气态氢化物最易溶于水的元素。(N)
(6)其氢化物沸点最高的非金属元素。(O)(7)常温下,其单质是有色气体的元素。(F或Cl)
(8)所形成化合物种类最多的元素。(C)
(9)在空气中,其最高价氧化物的含量增加会导致“温室效应”的元素。(C)
(10)其单质是最易液化的气体的元素。(Cl)元素化合物的有关考题,构成材料常常是一些“陌生”的物质,给解题带来了一定的困惑。解答这类信息题的常用方法是“原型类比,由此及彼”。元素周期律信息题的解题方法 根据周期律对角线规则,金属Be和Al单质及其化合物的性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应的离子方程式(有Na2BeO2生成):______________________________;
(2)Be(OH)2与Mg(OH)2可用试剂________鉴别,其离子方程式为____________________________。1.砷为第4周期ⅤA族元素,试推测砷可能具有的性质是( )
A.砷在通常状况下为气体
B.砷的最高正化合价为+3价
C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定3.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定
答案:D4.X、Y、Z、W为四种短周期的主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为WD.Y、Z两元素的简单离子的半径Y>Z5.核电荷数小于18的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。
请回答:
(1)X元素的名称是________;Y元素的名称是________;Z元素的名称是________。
(2)XZ3化合物的化学式是________。
(3)分别写出X、Y的最高价含氧酸的化学式:________、________。解析:先考虑Y元素:①如果Y元素的电子层数为1,则最外层电子数为2,是He元素,不合理;②如果Y元素的电子层数为2,则最外层电子数为4,是C元素;③如果Y元素的电子层数为3,则最外层电子数为6,是S元素。根据X、Y、Z的原子序数序数依次减小,可知X的电子层数也等于3,与题目给出的三种元素原子核外电子层数之和等于5不符。所以,Y元素为C,电子层数为2。可以推定,X的电子层数为2,Z的电子层数为1,所以Z为H元素。X能与Z形成XZ3,则X为N元素,XZ3为NH3。
答案:(1)氮 碳 氢 (2)NH3 (3)HNO3 H2CO36.现有A、B、C、D四种元素。
①A的核电荷数大于4,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成化合物B2A3,该化合物既能溶于强酸,又能溶于强碱;
③C+与B3+电子层结构相同;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色。试回答:
(1)A、B、C、D各是什么元素(元素符号):
A________,B________,C________,D________。
(2)B的离子结构示意图为________。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的化学方程式:
与盐酸反应_____________________________________,
与氢氧化钠反应__________________________________。
(4)比较A、B、C三种元素形成的简单离子的半径大小:
离子半径:____________________________________。解析:根据①中的信息可以判断A元素为O;根据信息②可知化合物B2O3为两性氧化物,故元素B为Al;根据信息③可推知元素C为Na;根据信息④、⑤推知元素D为I。
第1课时
认识同周期元素性质的递变规律自主预习区1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律。
3.了解原子结构、元素性质及该元素在周期表中的位置三者之间的关系。
4.初步学会运用元素周期表。1.实验探究
(1)置换氢能力比较
①钠、镁与水反应的比较
两种金属置换出水中的氢的难易程度为___________,失电子能力的强弱顺序为__________。一、钠、镁、铝三种元素原子失电子能力比较[填一填] Na>MgNa>Mg(2)镁、铝氢氧化物性质的比较
Al(OH)3为两性氢氧化物,Mg(OH)2为中强碱,碱性___________________________,故Mg的失电子能力强。
2.钠、镁、铝失电子能力的比较
钠、镁、铝失电子能力由强到弱的顺序依次为:_________________。Mg(OH)2>Al(OH)3Na>Mg>Al(1)镁与冷水几乎不反应,与热水较缓慢地反应。
(2)金属元素原子失电子能力可以通过单质与水、酸置换氢的能力及元素最高价氧化物对应水化物的碱性进行比较。
(3)原子失电子能力越强,元素的金属性越强。[记一记] 1.判断下列说法是否正确:
(1)金属元素原子失电子数越多,原子失电子能力越强( )
(2)碱性:NaOH>Mg(OH)2>Al(OH)3( )
(3)原子半径:r(Na)
(5)金属性:Na>Mg>Al( )
答案:(1)× (2)√ (3)× (4)√ (5)√[练一练] 二、硅、磷、硫、氯四种元素原子得电子能力的比较[填一填] Si
(3)Si元素最高价氧化物对应水化物为H4SiO4或H2SiO3。
(4)原子得电子能力越强,元素非金属性越强。[记一记] [练一练] 1.规律
同周期由左到右,元素原子得电子能力______,失电子能力_______。三、同周期元素原子得失电子能力的变化规律[填一填] 增强减弱相同 不同 减小 增强 减弱 增强 3.(1)“ⅠA族金属元素是同周期中金属性最强的元素”这种说法对吗?
(2)从原子结构的角度说明金属性钠大于镁的原因。
答案:(1)对。
(2)由于Na、Mg原子核外电子层数相同,又由于核电荷数钠的小于镁的,故金属性钠大于镁。[练一练] 互动探究区一、同周期元素的原子结构与性质的递变规律 同周期的三种短周期元素X、Y、Z,它们的最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则下列判断正确的是(双选)( )
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序增大
D.元素的最低负化合价的绝对值按X、Y、Z顺序增大点拨:解答本题应抓住以下两点:
(1)根据最高价氧化物对应水化物的化学式标出中心元素的化合价。
(2)根据最高化合价确定X、Y、Z在元素周期表中的位置。 O、F两元素常见化合价无正价,最高价≠最外层电子数,也无最高价氧化物及其水化物。 1.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:W
2.单质与水或酸反应置换氢的难易,愈易则金属性愈强。
3.单质与盐溶液的置换反应,强置换弱。
4.根据元素阳离子的氧化性强弱,阳离子氧化性越强,则元素金属性越弱。如氧化性Na+<Cu2+,则金属性Na>Cu。二、验证元素金属性强弱的事实 下列叙述中,X金属肯定比Y金属活动性强的是( )
A.X原子的最外层电子数比Y原子的最外层电子数少
B.X原子的电子层数比Y原子的电子层数多
C.1 mol X从酸中置换H+生成的氢气比1 mol Y从酸中置换H+生成的氢气多
D.常温时,X能从水中置换出氢气, 而Y不能 主族金属元素阳离子的氧化性强弱可以用于比较对应元素的金属性,但对过渡金属元素,一般不适用。2.对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH
答案:D1.跟氢气形成气态氢化物的难易程度,愈易反应,非金属性愈强。
2.气态氢化物的稳定性,稳定性愈高,非金属性愈强。
3.最高价氧化物水化物的酸性强弱,酸性愈强则非金属性愈强。
4.置换反应,强置换弱。三、验证元素非金属性强弱的事实5.与同一种金属反应后金属价态的变化。
例如:Fe与Cl2、S分别反应生成FeCl3、FeS,说明非金属性Cl>S。
6.元素阴离子还原性强弱,还原性愈强则非金属性愈弱。 X、Y为同一短周期元素,如果X的原子半径大于Y的原子半径,则下列判断不正确的是( )
A.若X、Y均为金属元素,则X失电子的能力强于Y
B.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强
C.若X、Y均为非金属元素, 则Y的气态氢化物比X的气态氢化物稳定
D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y的强于X的点拨: 3.下列所述变化规律正确的是( )
A.Na、Mg、Al还原性依次增强
B.HCl、PH3、H2S稳定性依次减弱
C.Al(OH)3、Mg(OH)2、NaOH碱性依次减弱
D.S2-、Cl-、K+、Ca2+的离子半径依次减小巩固训练区1.下列元素的单质中,最易跟氢气反应生成氢化物的是( )
A.硼 B.氮
C.氟 D.碳
解析:同周期从左到右元素的非金属性增强,氟是最活泼的非金属元素。
答案:C2.下列四种氢氧化物中碱性最强的是( )
A.Mg(OH)2 B.Al(OH)3
C.NaOH D.Fe(OH)3
解析:由于碱性与元素的金属性有关系,金属性越强,对应的最高价氧化物的水化物的碱性就越强,对于钠、镁、铝三种金属来说,位于同一周期,从左到右金属性逐渐减弱,所以NaOH的碱性最强,而由金属活动性顺序表可知,铁的金属性不如钠的金属性强,所以碱性最强的是NaOH。
答案:C3.按C、N、O、F的顺序,元素的性质表现为递增的是( )
A.元素的金属性 B.原子失电子的能力
C.原子得电子的能力 D.单质的还原性
解析:C、N、O、F位于同一周期,从左到右元素的非金属性逐渐增强,原子得电子能力逐渐增强,失电子能力逐渐减弱,单质的氧化性逐渐增强,还原性逐渐减弱。
答案:CA.HXO4>H2YO4>HZO4 B.HZO4>HXO4>H2YO4
C.HZO4>H2YO4>HXO4 D.H2YO4>HZO4>HXO4
解析:由题中提供的方程式可知:Z2可置换出X2,即非金属性Z>X,而X能使变价金属Cu显+2价,Y仅使Cu显-1价,证明非金属性X>Y。结合题干则它们的最高价氧化物对应的水化物的酸性强弱顺序为:HZO4>HXO4>H2YO4。
答案:B5.A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:
A____________、C____________、D____________;
(2)A、E两元素最高价氧化物对应水化物相互反应的化学方程式____________________________________________;
(3)比较C、D最高价氧化物对应水化物的酸性_________。解析:A、B、E三元素最高价氧化物对应的水化物为酸或碱,两两皆能反应,必有一种是两性物质Al(OH)3,另两种为强酸、强碱,碱是NaOH,又A、B、E三原子最外层电子数之和为11,且原子序数依次增大,可推出E原子最外层7个电子,短周期元素中只有Cl符合要求,两两反应的三种物质是NaOH、Al(OH)3、HClO4,C、D原子序数小于17,大于13,推出分别为Si和P,非金属性Si
(2)NaOH+HClO4===NaClO4+H2O
(3)H3PO4>H2SiO3第2课时 预测同主族元素的性质自主预习区1.以第ⅠA族、第ⅦA族元素为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.能根据同主族中熟悉元素的性质特点预测不熟悉元素的性质。
4.了解元素周期表中各个区域元素的应用。一、预测同主族元素的性质[填一填] 7 减弱 +7 -1 HX HXO4 化合 由易到难 由强到弱 由强到弱 由弱到强 1 +1 ROH 化合 (2)递变性(从Li―→Cs)
①原子半径:____________;
②原子失电子能力:____________;
③单质与水反应剧烈程度:_______________;
④与氧气反应的剧烈程度:_______;
⑤最高价氧化物的水化物的碱性:________。由小到大由弱到强变得更剧烈变强变强3.结论及解释
(1)结论:同主族元素性质既具有____性又有________性。
(2)解释:相似递变(1)熟记卤族元素、碱金属元素的名称及元素符号。
(2)卤素单质的化学性质与Cl2的化学性质相似;与金属、非金属、水、碱反应(F2除外)。
(3)碱金属单质的化学性质与钠的化学性质相似:与水、氧气等反应。[记一记] 1.(1)写出K、Br2分别与水反应的化学方程式:
____________________、____________________。
(2)写出下列元素最高价氧化物对应水化物的化学式。
Cs________________,Br________________。
(3)下列比较正确的是( )
A.原子半径:r(Na)>r(Cs) B.还原性:Na+>K+
C.氧化性:F2>Br2 D.稳定性:HI>HCl[练一练] 1.在________________________的交界处寻找半导体材料。
2.在____________中寻找优良的催化剂。
3.对________区域研究,生产新型农药等。
4._________新元素的性质。二、元素周期律和元素周期表的具体应用[填一填] 金属元素和非金属元素过渡元素非金属预测2.(1)镭是元素周期表中ⅡA族元素,下列关于镭的叙述不正确的是( )
A.镭比钙的金属性更强 B.在化合物中呈+2价
C.碳酸盐难溶于水 D.氢氧化镭呈两性
(2)自然界存在的元素中,非金属性最强的是________,金属性最强的是________。
答案:(1)D (2)F Cs[练一练] 互动探究区一、元素周期表中元素性质的变化规律解析:
答案:C解析:F、Cl、Br、I位于同一主族,原子序数逐渐增大,所以根据同一主族元素性质的递变规律可知,氢化物稳定性的强弱顺序是:HF>HCl>HBr>HI,A正确;Na与S位于同一周期,从左到右原子半径逐渐变小,所以Na>S,而S和O位于同一主族,从上到下原子半径逐渐增大,所以S>O,B正确;Li、Na、K位于同一主族,且均为金属,从上到下金属性逐渐增强,所以碱性强弱KOH>NaOH>LiOH,C正确;F2、Cl2、Br2的氧化性逐渐减弱,所以对应离子的还原性依次增强,D不正确。
答案:D1.“位、构、性”三者关系解读
(1)元素的原子结构与元素在周期表中位置的关系
核内质子数=原子序数;核外电子层数=周期序数;最外层电子数=主族序数。二、原子结构、元素在周期表中的位置与元素性质的关系2.“位、构、性”三者关系的应用
利用元素的原子结构、元素在周期表中的位置、元素的性质三者关系,可以比较或推断某些元素的性质,如:
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应水化物的酸碱性、氢化物的稳定性等。
(2)比较同周期元素及其化合物的性质。
(3)比较不同周期、不同主族元素的性质时,要找出参照物。
(4)推断一些未学过的元素的某些性质。2.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强巩固训练区3.如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
A.N元素为第1周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱5.(1)在短周期元素中(用化学式填空):
①与水反应最剧烈的金属单质是________。
②元素的气态氢化物最稳定的是________。
③元素的最高价氧化物对应的水化物中碱性最强的是________。
④元素的最高价氧化物对应的水化物中酸性最强的是________。
(2)短周期元素中,原子半径最大的非金属元素的原子是________。
答案:(1)①Na ②HF ③NaOH ④HClO4 (2)Si专题归纳区元素推断题是物质结构部分的重要题型,遇到此类题型时同学们往往会感觉到束手无策,其实,对这种类型的题只要能抓住“题眼”,便可顺利解答,常见“题眼”归纳如下:
(1)原子核内无中子的元素:H。
(2)最外层电子数等于最内层电子数的短周期元素:Be、Mg。元素推断“题眼”串串烧(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数是次外层2倍的元素:C。
(5)最外层电子数是次外层3倍的元素:O。
(6)最外层电子数是次外层一半的元素:Li、Si。
(7)族序数等于周期序数的元素:H、Be、Al。
(8)族序数等于周期序数两倍的元素:C、S。
(9)族序数等于周期序数3倍的元素:O。
(10)周期序数是族序数2倍的元素:Li。(11)周期序数是族序数3倍的元素:Na。
(12)最高正价与最低负价代数和为零的短周期元素:C、Si。
(13)最高正价是最低负价绝对值3倍的短周期元素:S。
(14)原子半径最小的元素:H,其次是F。
(15)短周期元素中,其离子半径最大的元素:P。
(16)最高正价不等于族序数的元素:O、F。 X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期;M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:
X____________,Y____________,M____________。(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应:_______________________。
(3)Y与Z相比,非金属性较强的元素是________,可以证明该结论的实验是(用离子方程式表示)_________________。(4)其单质是最轻的金属;单质保存在石蜡中;没有过氧化物的碱金属。(Li)
(5)焰色反应为黄色。(Na)
(6)其单质具有与强酸、强碱反应的性质。(Al)
(7)水中的富营养元素。(N或P)
(8)其单质为淡黄色的粉末,易溶于二硫化碳,用于除去洒落的汞。(S)
(9)其最高价氧化物的固体,可用于人工降雨。(C)2.常见短周期元素构成的单质和化合物的物理性质和含量
(1)地壳中质量分数最大的元素是O,其次是Si。
(2)地壳中质量分数最大的金属元素。(Al)
(3)其单质是人工制得的纯度最高的元素。(Si)
(4)其单质是天然物质中硬度最大的元素。(C)
(5)其气态氢化物最易溶于水的元素。(N)
(6)其氢化物沸点最高的非金属元素。(O)(7)常温下,其单质是有色气体的元素。(F或Cl)
(8)所形成化合物种类最多的元素。(C)
(9)在空气中,其最高价氧化物的含量增加会导致“温室效应”的元素。(C)
(10)其单质是最易液化的气体的元素。(Cl)元素化合物的有关考题,构成材料常常是一些“陌生”的物质,给解题带来了一定的困惑。解答这类信息题的常用方法是“原型类比,由此及彼”。元素周期律信息题的解题方法 根据周期律对角线规则,金属Be和Al单质及其化合物的性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应的离子方程式(有Na2BeO2生成):______________________________;
(2)Be(OH)2与Mg(OH)2可用试剂________鉴别,其离子方程式为____________________________。1.砷为第4周期ⅤA族元素,试推测砷可能具有的性质是( )
A.砷在通常状况下为气体
B.砷的最高正化合价为+3价
C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定3.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定
答案:D4.X、Y、Z、W为四种短周期的主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W
请回答:
(1)X元素的名称是________;Y元素的名称是________;Z元素的名称是________。
(2)XZ3化合物的化学式是________。
(3)分别写出X、Y的最高价含氧酸的化学式:________、________。解析:先考虑Y元素:①如果Y元素的电子层数为1,则最外层电子数为2,是He元素,不合理;②如果Y元素的电子层数为2,则最外层电子数为4,是C元素;③如果Y元素的电子层数为3,则最外层电子数为6,是S元素。根据X、Y、Z的原子序数序数依次减小,可知X的电子层数也等于3,与题目给出的三种元素原子核外电子层数之和等于5不符。所以,Y元素为C,电子层数为2。可以推定,X的电子层数为2,Z的电子层数为1,所以Z为H元素。X能与Z形成XZ3,则X为N元素,XZ3为NH3。
答案:(1)氮 碳 氢 (2)NH3 (3)HNO3 H2CO36.现有A、B、C、D四种元素。
①A的核电荷数大于4,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成化合物B2A3,该化合物既能溶于强酸,又能溶于强碱;
③C+与B3+电子层结构相同;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色。试回答:
(1)A、B、C、D各是什么元素(元素符号):
A________,B________,C________,D________。
(2)B的离子结构示意图为________。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的化学方程式:
与盐酸反应_____________________________________,
与氢氧化钠反应__________________________________。
(4)比较A、B、C三种元素形成的简单离子的半径大小:
离子半径:____________________________________。解析:根据①中的信息可以判断A元素为O;根据信息②可知化合物B2O3为两性氧化物,故元素B为Al;根据信息③可推知元素C为Na;根据信息④、⑤推知元素D为I。
