原子结构与元素周期律 复习课件
图片预览









文档简介
课件34张PPT。第一章章末归纳整合请分别用一句话表达下列关键词:
提示 质量数 核素 同位素 元素周期律
质量数:人们将原子核中质子数和中子数之和称为质量数。
核素:人们把具有一定数目质子和一定数目中子的一种原子称为核素。
同位素:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。
元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。1.元素、核素、同位素的比较
提示
2.核外电子排布规律
提示 (1)遵循能量最低原理,由近及远,能量由低到高排布在不同的电子层上。
(2)每层最多容纳的电子数为2n2(n代表电子层数)。
(3)电子一般总是尽先排在能量最低的电子层里,即最先排在K层,当K层排满后,再排L层,依次类推。
(4)最外层电子数不超过8个(或2个),次外层不超过18个,倒数第3层不超过32个。3.常见的10e-与18e-微粒
提示 4.原子结构与元素性质的关系
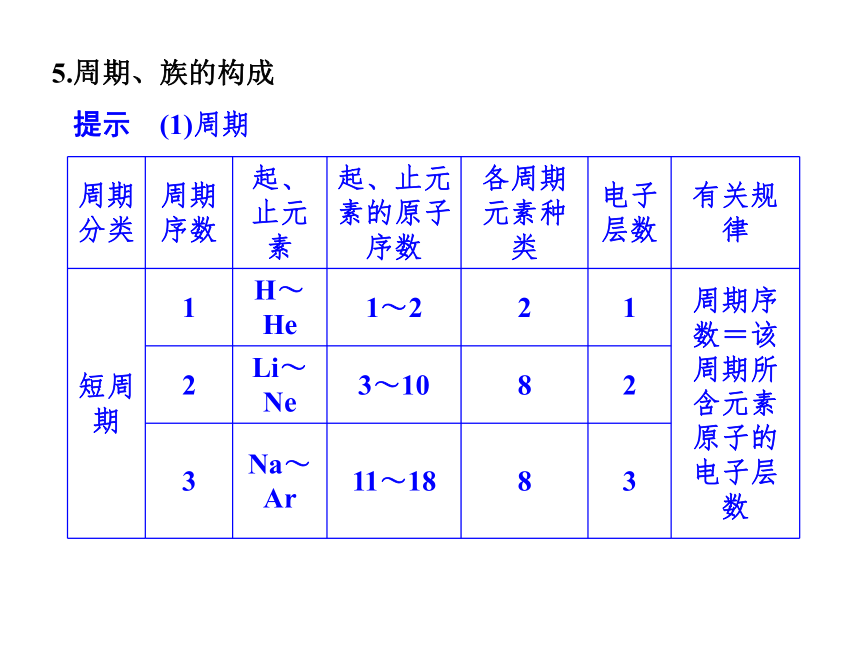
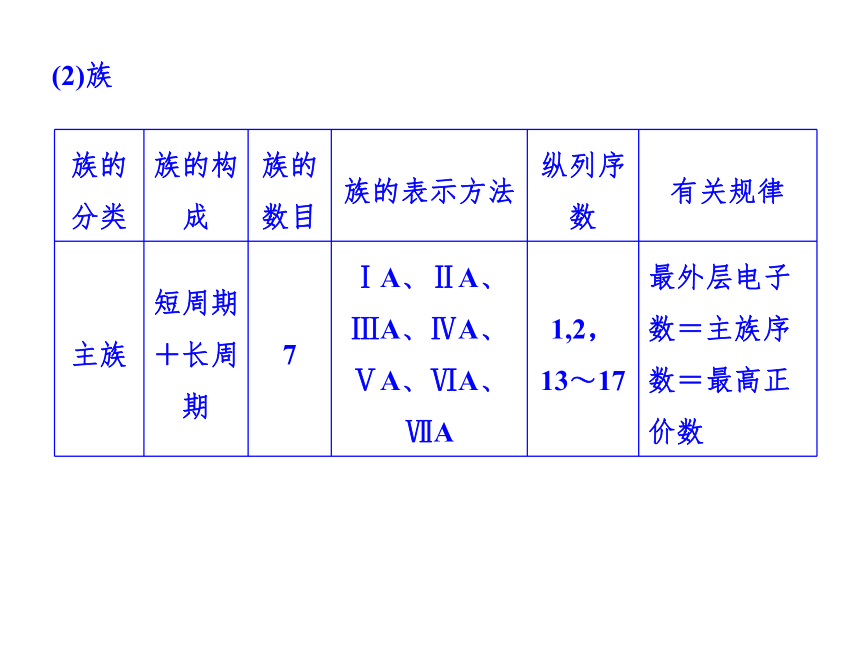
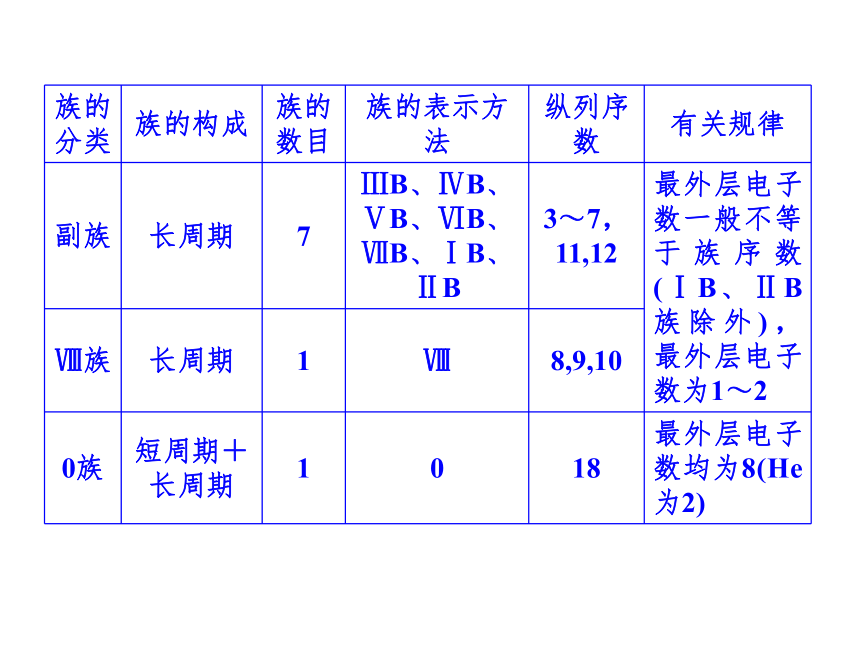
提示 5.周期、族的构成
提示 (1)周期(2)族6.元素周期表中特殊位置的元素
提示 (1)族序数等于周期序数的元素:H、Be、Al。
(2)族序数是周期序数2倍的元素:C、S;族序数是周期序数3倍的元素:O。
(3)周期序数是族序数2倍的元素:Li;周期序数是族序数3倍的元素:Na。
(4)最高正化合价不等于族序数的元素:O、F。
(5)最高正价与最低负价代数和为0的元素:C、Si。
(6)最高正价是最低负价绝对值3倍的元素:S。
(7)同主族的两种元素,原子序数为2倍关系的是S和O。1.同主族、邻周期元素的原子序数差规律
提示 除第ⅠA、ⅡA族外,同族上下两相邻元素原子序数的差值,与下面元素所在周期的元素种数相同。第ⅠA、ⅡA族则与上面元素所在周期的元素种数相同。如下表:
如已知A、B是同族相邻元素,A、B所在周期分别有m、n种元素,A的原子序数是x,若A、B在第ⅦA族,当A在B的上面时,B的原子序数为(x+n);当B在A的上面时,B的原子序数为(x-m)。若A、B在第ⅡA族,当A在B的上面时,B的原子序数为(x+m),当B在A的上面时,B的原子序数为(x-n)。2.元素金属性、非金属性强弱比较的一般方法
提示 3.同周期同主族元素性质的递变规律
提示 4.用以推断“位—构—性”三者关系的常用规律和结论
提示 (1)原子序数=族序数=周期序数的元素是氢。
(2)最外层电子数大于或等于3(小于8)的元素一定是主族元素。
(3)元素周期表中金属性最强的元素(Fr)位于周期表的最左下角,非金属性最强的元素(F)位于最右上角(稀有气体元素除外)。
(4)有负化合价的元素一定是非金属元素,没有正价的主族元素只有氟。没有负价的元素是金属元素和稀有气体元素。(5)周期序数和主族序数相等的元素位于金属元素与非金属元素分界线左下侧且靠近分界线,是所处周期的最末一种金属元素(氢除外)。
(6)最高正价和最低负价代数和为0的元素是氢和ⅣA族元素。
(7)没有非金属的主族为ⅡA族,完全以双原子分子形成单质的主族为ⅦA族。
(8)同周期ⅡA族和ⅢA族元素原子序数的差值可以是1或11或25。(9)同主族相邻两周期元素原子序数的差值算法是:若ⅠA、ⅡA两主族,则差值等于上面周期所含元素种数,若ⅢA~ⅦA(包括0族)各主族,则差值等于下面周期所含元素种数。
(10)与稀有气体原子核外电子层结构相同的阴、阳离子对应的元素中,阴离子与稀有气体同周期,阳离子处于稀有气体下一周期。
(11)对角线法则,即处于周期表中左上至右下对角线上的元素性质相似。
5.研究元素周期律和元素周期表的重要意义?
提示 (1)科学预言方面的意义在于为新元素的发现及预测它们的原子结构和性质提供了线索。
(2)对工农业生产的指导意义在于在周期表中一定的区域内寻找新的物质。
①在金属元素和非金属元素的交界处寻找半导体材料。
②在过渡元素中寻找优良的催化剂。
(3)对探矿有指导意义的地球化学元素的分布与它们在元素周期表中的位置关系:
①相对原子质量较小的元素在地壳中含量较多。
②原子序数为偶数的元素在地壳中含量较多。
③处于地球表面的元素多数呈现高价态。
④碱金属一般是强烈的亲石元素,主要富集于岩石圈。
学科思想培养一
元素推断题的思维模型和解答技巧
元素推断题主要考查元素周期表中“位、构、性”的关系及学生利用物质结构和性质进行综合推断的能力。该类题目综合性强,难度较大,所占分值较高。学生需要掌握短周期所有元素的结构特点、它们在元素周期表中的位置和性质以及掌握它们形成的化合物的性质,在此基础上综合分析,得到答案。一、思维模型
1.元素推断题的思维模型2.根据原子序数推断元素在周期表中位置的思维模型二、解答技巧
1.牢记元素周期表的结构(能区分长短周期、主副族、每周
期的元素数目等)是求解的基础,一定要“心中有表”。
2.稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同:①与He原子电子层结构相同的离子有H-、Li+、Be2+;②与Ne原子电子层结构相同的离子有F-、O2-、Na+、Mg2+、Al3+;③与Ar原子电子层结构相同的离子有Cl-、S2-、K+、Ca2+。3.短周期元素的原子结构的特殊性
①原子核中无中子的原子:H;②最外层有1个电子的原子:H、Li、Na;③最外层有2个电子的原子:Be、Mg、He;④最外层电子数等于次外层电子数的原子:Be、Ar;⑤最外层电子数是次外层电子数2倍的原子:C;⑥最外层电子数是次外层电子数3倍的原子:O;⑦最外层电子数是次外层电子数4倍的原子:Ne;⑧电子层数与最外层电子数相等的原子:H、Be、Al;⑨核外电子总数为最外层电子数2倍的原子:Be;⑩次外层电子数是最外层电子数2倍的原子:Si、Li;?内层电子数是最外层电子数2倍的原子:Li、P。
注意 元素推断题要把握以下几个要点:
①熟记元素的符号,直接导出;
②掌握几种关系,列式导出;
③利用排布规律,逐层导出;
④弄清带电原因,分析导出;
⑤抓住元素特征,综合导出;
⑥根据量的关系,计算导出。【例1】(原创题)W、X、Y、Z是原子序数依次增大的同一短
周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______________________。
(2)W与Y可形成化合物W2Y,该化合物的化学式为_______________________________________________。
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:____________________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__________________________________________。
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:________>________>________>________。解析 因为这四种元素为同一短周期元素,W和X为金属元素,且各自的最高价氧化物对应的水化物可以反应生成盐和水,所以应考虑到Al(OH)3的两性,则W为Na,X为Al,Na与Y形成Na2Y,说明Y为-2价,即Y为S,则Z为Cl。
【例2】短周期元素X、Y、Z、
W、Q在元素周期表中的
相对位置如图所示。下列
说法正确的是 ( )。
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
解析 根据X、Y、Z、W、Q在周期表中的位置,易推得五种元素分别为N、O、Al、S、Cl。X、Z的最高正化合价分别为5、3,二者之和为8,A项正确;核外电子层数越多,半径越大,B项错误;O2-和Al3+的核外电子数与电子层数相同,C项错误;H2SO4的酸性弱于HClO4的酸性,D项错误。
答案 A
提示 质量数 核素 同位素 元素周期律
质量数:人们将原子核中质子数和中子数之和称为质量数。
核素:人们把具有一定数目质子和一定数目中子的一种原子称为核素。
同位素:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。
元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。1.元素、核素、同位素的比较
提示
2.核外电子排布规律
提示 (1)遵循能量最低原理,由近及远,能量由低到高排布在不同的电子层上。
(2)每层最多容纳的电子数为2n2(n代表电子层数)。
(3)电子一般总是尽先排在能量最低的电子层里,即最先排在K层,当K层排满后,再排L层,依次类推。
(4)最外层电子数不超过8个(或2个),次外层不超过18个,倒数第3层不超过32个。3.常见的10e-与18e-微粒
提示 4.原子结构与元素性质的关系
提示 5.周期、族的构成
提示 (1)周期(2)族6.元素周期表中特殊位置的元素
提示 (1)族序数等于周期序数的元素:H、Be、Al。
(2)族序数是周期序数2倍的元素:C、S;族序数是周期序数3倍的元素:O。
(3)周期序数是族序数2倍的元素:Li;周期序数是族序数3倍的元素:Na。
(4)最高正化合价不等于族序数的元素:O、F。
(5)最高正价与最低负价代数和为0的元素:C、Si。
(6)最高正价是最低负价绝对值3倍的元素:S。
(7)同主族的两种元素,原子序数为2倍关系的是S和O。1.同主族、邻周期元素的原子序数差规律
提示 除第ⅠA、ⅡA族外,同族上下两相邻元素原子序数的差值,与下面元素所在周期的元素种数相同。第ⅠA、ⅡA族则与上面元素所在周期的元素种数相同。如下表:
如已知A、B是同族相邻元素,A、B所在周期分别有m、n种元素,A的原子序数是x,若A、B在第ⅦA族,当A在B的上面时,B的原子序数为(x+n);当B在A的上面时,B的原子序数为(x-m)。若A、B在第ⅡA族,当A在B的上面时,B的原子序数为(x+m),当B在A的上面时,B的原子序数为(x-n)。2.元素金属性、非金属性强弱比较的一般方法
提示 3.同周期同主族元素性质的递变规律
提示 4.用以推断“位—构—性”三者关系的常用规律和结论
提示 (1)原子序数=族序数=周期序数的元素是氢。
(2)最外层电子数大于或等于3(小于8)的元素一定是主族元素。
(3)元素周期表中金属性最强的元素(Fr)位于周期表的最左下角,非金属性最强的元素(F)位于最右上角(稀有气体元素除外)。
(4)有负化合价的元素一定是非金属元素,没有正价的主族元素只有氟。没有负价的元素是金属元素和稀有气体元素。(5)周期序数和主族序数相等的元素位于金属元素与非金属元素分界线左下侧且靠近分界线,是所处周期的最末一种金属元素(氢除外)。
(6)最高正价和最低负价代数和为0的元素是氢和ⅣA族元素。
(7)没有非金属的主族为ⅡA族,完全以双原子分子形成单质的主族为ⅦA族。
(8)同周期ⅡA族和ⅢA族元素原子序数的差值可以是1或11或25。(9)同主族相邻两周期元素原子序数的差值算法是:若ⅠA、ⅡA两主族,则差值等于上面周期所含元素种数,若ⅢA~ⅦA(包括0族)各主族,则差值等于下面周期所含元素种数。
(10)与稀有气体原子核外电子层结构相同的阴、阳离子对应的元素中,阴离子与稀有气体同周期,阳离子处于稀有气体下一周期。
(11)对角线法则,即处于周期表中左上至右下对角线上的元素性质相似。
5.研究元素周期律和元素周期表的重要意义?
提示 (1)科学预言方面的意义在于为新元素的发现及预测它们的原子结构和性质提供了线索。
(2)对工农业生产的指导意义在于在周期表中一定的区域内寻找新的物质。
①在金属元素和非金属元素的交界处寻找半导体材料。
②在过渡元素中寻找优良的催化剂。
(3)对探矿有指导意义的地球化学元素的分布与它们在元素周期表中的位置关系:
①相对原子质量较小的元素在地壳中含量较多。
②原子序数为偶数的元素在地壳中含量较多。
③处于地球表面的元素多数呈现高价态。
④碱金属一般是强烈的亲石元素,主要富集于岩石圈。
学科思想培养一
元素推断题的思维模型和解答技巧
元素推断题主要考查元素周期表中“位、构、性”的关系及学生利用物质结构和性质进行综合推断的能力。该类题目综合性强,难度较大,所占分值较高。学生需要掌握短周期所有元素的结构特点、它们在元素周期表中的位置和性质以及掌握它们形成的化合物的性质,在此基础上综合分析,得到答案。一、思维模型
1.元素推断题的思维模型2.根据原子序数推断元素在周期表中位置的思维模型二、解答技巧
1.牢记元素周期表的结构(能区分长短周期、主副族、每周
期的元素数目等)是求解的基础,一定要“心中有表”。
2.稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同:①与He原子电子层结构相同的离子有H-、Li+、Be2+;②与Ne原子电子层结构相同的离子有F-、O2-、Na+、Mg2+、Al3+;③与Ar原子电子层结构相同的离子有Cl-、S2-、K+、Ca2+。3.短周期元素的原子结构的特殊性
①原子核中无中子的原子:H;②最外层有1个电子的原子:H、Li、Na;③最外层有2个电子的原子:Be、Mg、He;④最外层电子数等于次外层电子数的原子:Be、Ar;⑤最外层电子数是次外层电子数2倍的原子:C;⑥最外层电子数是次外层电子数3倍的原子:O;⑦最外层电子数是次外层电子数4倍的原子:Ne;⑧电子层数与最外层电子数相等的原子:H、Be、Al;⑨核外电子总数为最外层电子数2倍的原子:Be;⑩次外层电子数是最外层电子数2倍的原子:Si、Li;?内层电子数是最外层电子数2倍的原子:Li、P。
注意 元素推断题要把握以下几个要点:
①熟记元素的符号,直接导出;
②掌握几种关系,列式导出;
③利用排布规律,逐层导出;
④弄清带电原因,分析导出;
⑤抓住元素特征,综合导出;
⑥根据量的关系,计算导出。【例1】(原创题)W、X、Y、Z是原子序数依次增大的同一短
周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______________________。
(2)W与Y可形成化合物W2Y,该化合物的化学式为_______________________________________________。
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:____________________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__________________________________________。
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:________>________>________>________。解析 因为这四种元素为同一短周期元素,W和X为金属元素,且各自的最高价氧化物对应的水化物可以反应生成盐和水,所以应考虑到Al(OH)3的两性,则W为Na,X为Al,Na与Y形成Na2Y,说明Y为-2价,即Y为S,则Z为Cl。
【例2】短周期元素X、Y、Z、
W、Q在元素周期表中的
相对位置如图所示。下列
说法正确的是 ( )。
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
解析 根据X、Y、Z、W、Q在周期表中的位置,易推得五种元素分别为N、O、Al、S、Cl。X、Z的最高正化合价分别为5、3,二者之和为8,A项正确;核外电子层数越多,半径越大,B项错误;O2-和Al3+的核外电子数与电子层数相同,C项错误;H2SO4的酸性弱于HClO4的酸性,D项错误。
答案 A
