3.4 二氧化碳 第2课时(课件 16张PPT)
文档属性
| 名称 | 3.4 二氧化碳 第2课时(课件 16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 22.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-05-23 20:10:58 | ||
图片预览




文档简介
(共16张PPT)
1
新课导入
1. 回顾实验室制取氧气的原理(化学方程式)
2. 回顾二氧化碳的性质(化学方程式)
3.4.2 二氧化碳
【核心概念】
1.物质的结构与性质
【学习内容与要求】
1.2 空气与水是重要的物质
⑤学会二氧化碳的实验室制法。
【教学目标】
1.科学观念:了解实验室中制取二氧化碳的反应原理;了解实验室中制取气体的思路和方法。
2.科学思维:树立多角度、多层次地观察和分析问题的意识;初步确立实验室制取气体的一般思路的方法。
3.探究实践:探究实验室制取二氧化碳的装置,并利用设计的装置制取二氧化碳。
4.态度责任:增强学生对化学实验的好奇心和探究欲,激发学习化学的兴趣;培养学生勤于思考、严谨求实、勇于作出创新、大胆实践的科学精神。
2
核心概念与素养
3
新知探究
1.1 原理
任务一:了解实验室中制取二氧化碳的反应原理
实验室常用大理石(或石灰石,主要成分为碳酸钙)与稀盐酸反应来制取二氧化碳气体。根据所给资料,尝试写出化学方程式
大理石
稀盐酸
主要成分是CaCO3,是固体。
稀盐酸是HCl气体的水溶液。
CaCO3 + 2HCl CaCl2 + H2O + CO2
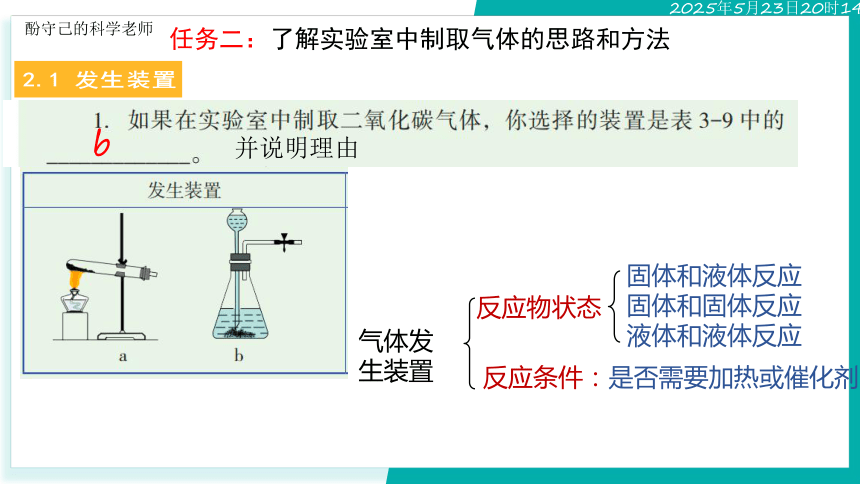
2.1 发生装置
任务二:了解实验室中制取气体的思路和方法
并说明理由
b
气体发生装置
反应物状态
反应条件:是否需要加热或催化剂
固体和液体反应
固体和固体反应
液体和液体反应
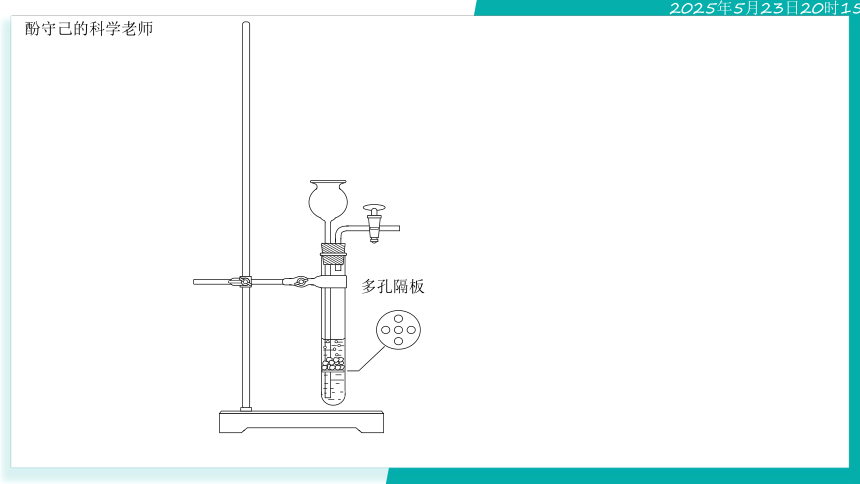
多孔隔板
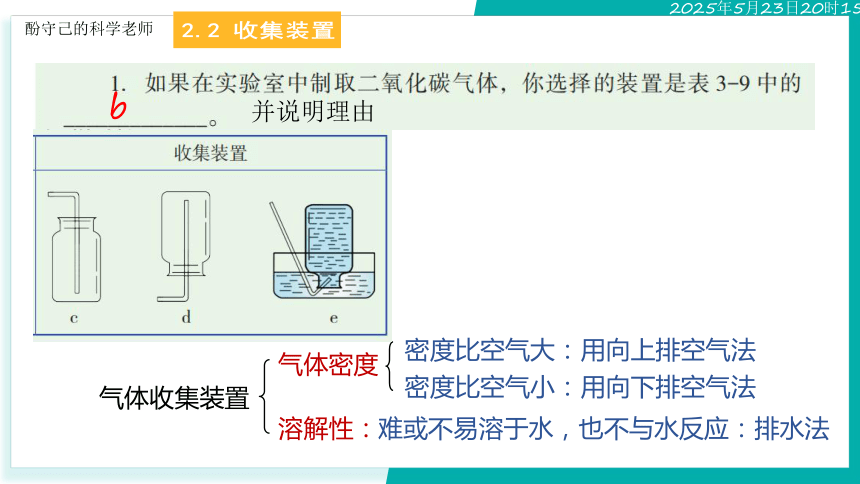
2.2 收集装置
并说明理由
b
气体收集装置
气体密度
密度比空气小:用向下排空气法
溶解性:
密度比空气大:用向上排空气法
难或不易溶于水,也不与水反应:排水法
2.3 制取气体
如图是实验室制取二氧化碳的实验装置图,需要对哪部分进行气密性的检查?说明理由并阐述气密性检查的方法
用止水夹夹夹住导管(橡皮管),往长颈漏斗中倒水直至长颈漏斗末端浸没在水中后,继续加水,若长颈漏斗中的液面不再下降,说明气密性良好。
检查此气体发生装置的气密性还有其他方法吗?
打开弹簧夹
长颈漏斗末端浸没在水中
抽气
产生气泡
打开弹簧夹
长颈漏斗末端浸没在水中
充气
产生水柱
4.下列所示装置的气密性检查中,漏气的是( )
A.装置①,把手移开后,导管中水面高于
烧杯内水面
B.装置②,长颈漏斗内液面高度保持不变
C.装置③,长导管内形成一段水柱
D.装置④,上下移动a管时,a、b两端液面仍相平
D
3.实验室制取二氧化碳:
(1)如图组装好制取二氧化碳的简易装置,检查装置的气密性。
(2)在锥形瓶中加入几小块大理石,塞紧带有长颈漏斗和导管的橡皮塞。
制取CO2的装置
(3)把气体导管插入集气瓶中,导管口应处在接近集气瓶的瓶底处。
(4)通过长颈漏斗加入适量的稀盐酸,锥形瓶中立刻有气体产生。
(5)片刻后,把燃着的火柴放到集气瓶口的上方,如果火柴很快熄灭说明集气瓶中已经收集满二氧化碳气体,盖好毛玻璃片,将集气瓶口向上放在桌子上备用。
“查密” → “装药” → “集气” → “验满”。
4.试验二氧化碳性质。
(1)把一支短蜡烛固定在烧杯中的铁皮架上,点燃。拿起集满二氧化碳的集气瓶,向烧杯中缓 缓倾倒二氧化碳,观察到的现象是 ________________。
CO2灭火
蜡烛火焰熄灭了
(2)取一支试管,注入少量澄清石灰水,通入二氧化碳,观察到的现象是 ____________________。
澄清石灰水变浑浊了
(3)另取一支试管,加入2毫升蒸馏水,滴入1-2滴石蕊试液,为___________色,通入二氧化碳气体,溶液颜色变为___________色。
CO2与澄清石灰水反应
紫
红
1.图是某学生设计的实验室制取并收集二氧化碳气体的装置图。指出图中的错误之处,并说明原因。
错误的制取CO2装置
漏斗管口没有伸到液面以下
气体要从管口逸出
导管口没有伸到集气瓶底
不能将集气瓶内的空气排尽
2.实验室制取CO2,如选用石灰石(或大理石)为原料,则为什么不能选用稀硫酸?
因为生成的硫酸钙是微溶性物质,它包裹在大理石表面,使酸液不能与大理石接触,从而使反应中止。
3.实验室制取二氧化碳时,若使用石灰石或大理石粉末,是否可以
不可以。实验室制取CO2,如选用石灰石(或大理石)粉末为原料,则反应物间的接触面积较大,会出反应速度过快的现象。
活动
Na2CO3 +H2SO4 = Na2SO4 +CO2↑+ H2O
参照如图所示,制作一个简易酸碱灭火器
Na2CO3 + 2HCl= 2NaCl + CO2 ↑+ H2O
NaHCO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
1
新课导入
1. 回顾实验室制取氧气的原理(化学方程式)
2. 回顾二氧化碳的性质(化学方程式)
3.4.2 二氧化碳
【核心概念】
1.物质的结构与性质
【学习内容与要求】
1.2 空气与水是重要的物质
⑤学会二氧化碳的实验室制法。
【教学目标】
1.科学观念:了解实验室中制取二氧化碳的反应原理;了解实验室中制取气体的思路和方法。
2.科学思维:树立多角度、多层次地观察和分析问题的意识;初步确立实验室制取气体的一般思路的方法。
3.探究实践:探究实验室制取二氧化碳的装置,并利用设计的装置制取二氧化碳。
4.态度责任:增强学生对化学实验的好奇心和探究欲,激发学习化学的兴趣;培养学生勤于思考、严谨求实、勇于作出创新、大胆实践的科学精神。
2
核心概念与素养
3
新知探究
1.1 原理
任务一:了解实验室中制取二氧化碳的反应原理
实验室常用大理石(或石灰石,主要成分为碳酸钙)与稀盐酸反应来制取二氧化碳气体。根据所给资料,尝试写出化学方程式
大理石
稀盐酸
主要成分是CaCO3,是固体。
稀盐酸是HCl气体的水溶液。
CaCO3 + 2HCl CaCl2 + H2O + CO2
2.1 发生装置
任务二:了解实验室中制取气体的思路和方法
并说明理由
b
气体发生装置
反应物状态
反应条件:是否需要加热或催化剂
固体和液体反应
固体和固体反应
液体和液体反应
多孔隔板
2.2 收集装置
并说明理由
b
气体收集装置
气体密度
密度比空气小:用向下排空气法
溶解性:
密度比空气大:用向上排空气法
难或不易溶于水,也不与水反应:排水法
2.3 制取气体
如图是实验室制取二氧化碳的实验装置图,需要对哪部分进行气密性的检查?说明理由并阐述气密性检查的方法
用止水夹夹夹住导管(橡皮管),往长颈漏斗中倒水直至长颈漏斗末端浸没在水中后,继续加水,若长颈漏斗中的液面不再下降,说明气密性良好。
检查此气体发生装置的气密性还有其他方法吗?
打开弹簧夹
长颈漏斗末端浸没在水中
抽气
产生气泡
打开弹簧夹
长颈漏斗末端浸没在水中
充气
产生水柱
4.下列所示装置的气密性检查中,漏气的是( )
A.装置①,把手移开后,导管中水面高于
烧杯内水面
B.装置②,长颈漏斗内液面高度保持不变
C.装置③,长导管内形成一段水柱
D.装置④,上下移动a管时,a、b两端液面仍相平
D
3.实验室制取二氧化碳:
(1)如图组装好制取二氧化碳的简易装置,检查装置的气密性。
(2)在锥形瓶中加入几小块大理石,塞紧带有长颈漏斗和导管的橡皮塞。
制取CO2的装置
(3)把气体导管插入集气瓶中,导管口应处在接近集气瓶的瓶底处。
(4)通过长颈漏斗加入适量的稀盐酸,锥形瓶中立刻有气体产生。
(5)片刻后,把燃着的火柴放到集气瓶口的上方,如果火柴很快熄灭说明集气瓶中已经收集满二氧化碳气体,盖好毛玻璃片,将集气瓶口向上放在桌子上备用。
“查密” → “装药” → “集气” → “验满”。
4.试验二氧化碳性质。
(1)把一支短蜡烛固定在烧杯中的铁皮架上,点燃。拿起集满二氧化碳的集气瓶,向烧杯中缓 缓倾倒二氧化碳,观察到的现象是 ________________。
CO2灭火
蜡烛火焰熄灭了
(2)取一支试管,注入少量澄清石灰水,通入二氧化碳,观察到的现象是 ____________________。
澄清石灰水变浑浊了
(3)另取一支试管,加入2毫升蒸馏水,滴入1-2滴石蕊试液,为___________色,通入二氧化碳气体,溶液颜色变为___________色。
CO2与澄清石灰水反应
紫
红
1.图是某学生设计的实验室制取并收集二氧化碳气体的装置图。指出图中的错误之处,并说明原因。
错误的制取CO2装置
漏斗管口没有伸到液面以下
气体要从管口逸出
导管口没有伸到集气瓶底
不能将集气瓶内的空气排尽
2.实验室制取CO2,如选用石灰石(或大理石)为原料,则为什么不能选用稀硫酸?
因为生成的硫酸钙是微溶性物质,它包裹在大理石表面,使酸液不能与大理石接触,从而使反应中止。
3.实验室制取二氧化碳时,若使用石灰石或大理石粉末,是否可以
不可以。实验室制取CO2,如选用石灰石(或大理石)粉末为原料,则反应物间的接触面积较大,会出反应速度过快的现象。
活动
Na2CO3 +H2SO4 = Na2SO4 +CO2↑+ H2O
参照如图所示,制作一个简易酸碱灭火器
Na2CO3 + 2HCl= 2NaCl + CO2 ↑+ H2O
NaHCO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
