鲁科版高中化学必修2:3.3 饮食中的有机化合物——乙醇课件 (共21张PPT)
文档属性
| 名称 | 鲁科版高中化学必修2:3.3 饮食中的有机化合物——乙醇课件 (共21张PPT) |
|
|
| 格式 | ppt | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-10 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
——乙醇
杜康像
何以解忧,
唯有杜康
欢时-----人生得意须尽欢,莫使金樽空对月。(李白)
离时-----劝君更尽一杯酒,西出阳关无故人。(王维)
悲时-----醉卧沙场君莫笑,古来征战几人回? (王翰)
愁时-----抽刀断水水更流,举杯消愁愁更愁。 (李白)
感知生活
学习目标:
1、认识乙醇的组成、结构
2、掌握乙醇的主要物理性质、化学性质
和应用
3、激发学习兴趣、培养动手能力、提高
科学素养
4、了解学习有机物的一般程序
下列应用体现乙醇的哪些性质
(1)碘酒
(2)“酒香不怕巷子深”“开坛十里香”
(3)高烧病人擦拭酒精降温
(4)洗发时,在水中加入适量啤酒,油污一洗即净,头发清爽
(5)用完酒精灯,及时盖上灯帽
(6)在过滤器中洗涤CuSO4等可溶于水的晶体
能溶解某些无机物
挥发性
挥发性
能溶解有机物
挥发性
CuSO4在乙醇中溶解度小于在水中溶解度
考考你
乙醇的物理性质
【动手探究】
1、根据燃烧法已测定乙醇的分子式为C2H6O 2、请同学们根据有机物中“碳四键、氢一键、氧两键” 的结构特点用球棍模型拼插出符合该分子式的所有可能结构。
3、进行结构的比较。
【小组动手探究——乙醇的结构】
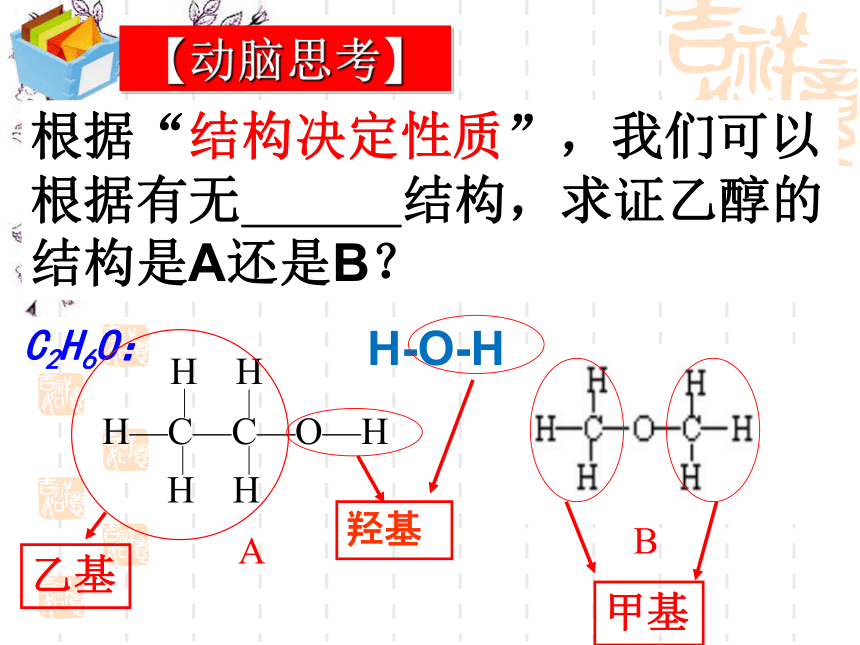
【动脑思考】
根据“结构决定性质”,我们可以根据有无 结构,求证乙醇的结构是A还是B?
H—C—C—O—H
H H
H H
A
B
C2H6O:
乙基
羟基
H-O-H
甲基
拓展探究:对比钠与乙醇和水的反应
钠与水 钠与乙醇
操作
步骤 向50ml小烧杯中加入适量水,用镊子取绿豆粒大小一块钠,用滤纸吸干表面的煤油,将钠投入到水中,并盖上表面皿。 向试管中加入2mL无水乙醇,用镊子取绿豆粒大小一块钠,用滤纸吸干表面的煤油,将钠投入到乙醇中
现象
钠沉在液面下,
表面有气泡缓和产生体积逐渐减小,最后消失
钠浮在水面上,
熔成闪亮的小球,
钠迅速游动,
发出嘶嘶的响声
? 水
结构式
分析:
H―O―H
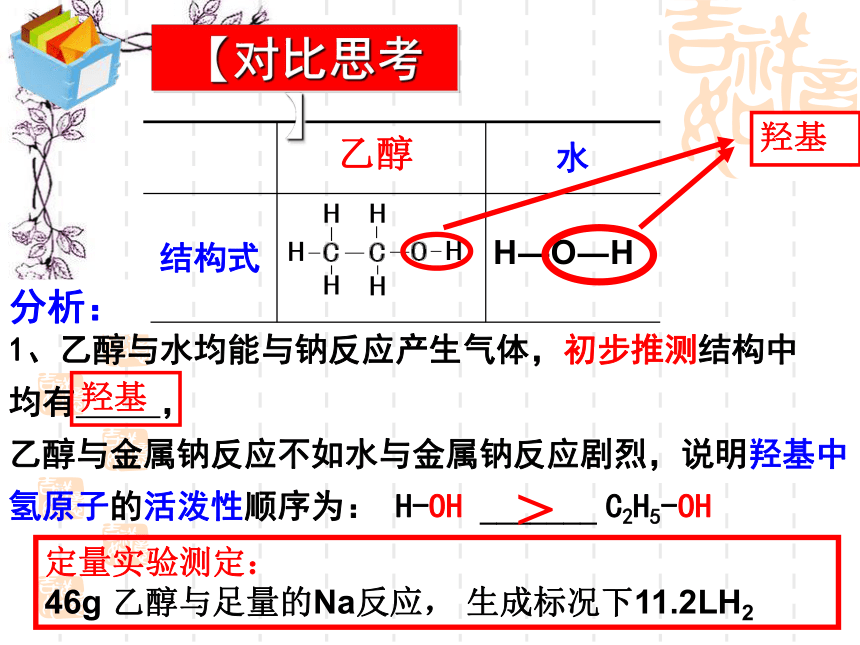
【对比思考】
1、乙醇与水均能与钠反应产生气体,初步推测结构中
均有 ,
乙醇与金属钠反应不如水与金属钠反应剧烈,说明羟基中氢原子的活泼性顺序为: H-OH _______ C2H5-OH
>
羟基
羟基
乙醇
定量实验测定:
46g 乙醇与足量的Na反应, 生成标况下11.2LH2
1、书写乙醇的分子式、结构式、
结构简式
2、分析乙醇和钠反应时断键的位置,
并完成相关化学反应方程式
3、由方程式分析醇与Na反应中
-OH、Na、H2之间的比例关系
【交流研讨】
CH3CH2OH + Na → CH3CH2ONa + H2↑
乙醇钠
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
乙醇的化学性质
——置换反应
1、乙醇与钠的反应
焊接银器、铜器时,表面会生成黑色的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜、银会光亮如初。这是什么原理呢?
实验步骤 实验现象 原因或结论
1.取2~3mL无水乙醇于试管中
2.将铜丝在酒精灯外焰上灼烧至红热 铜丝颜色:
3.趁热将铜丝插入乙醇中 铜丝颜色:
4.重复2、3步操作3~4次后闻试管中液体气味
【实验探究二】
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
铜丝
变黑
2Cu + O2 2CuO
△
又变红
产生刺激性气味
Δ
C2H5OH+ CuO + Cu
乙醛
+ H2O
总反应方程式:
醛基
2、乙醇的催化氧化
乙醇的化学性质
Cu
2
2
2
2
2
CH3CH
O
2CO2 +3H2O
C2H5OH + 3 O2
点燃
3、乙醇燃烧
乙醇的化学性质
彻底氧化
乙 醇
饮 料
化工原料
溶 剂
医 药
燃料
乙醇的用途
溶剂
作溶剂——香水等
作工业原料——制乙酸等
工业制取乙酸
作消毒剂 —— 医用酒精等
消毒剂(体积分数75%的乙醇溶液)
制酒精型饮料 —— 白酒、啤酒、红酒等
饮料
酒精燃料飞机
酒精火锅
含酒精:3% - 5%
含酒精:6% - 20%
含酒精:38% - 65%
75%
95%
含酒精:8% - 15%
你究竟知什么?
感知生活
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
CH3CH2OH
CH3CHO
硫酸酸化CrO3
Cr2(SO4)3
与活泼金属反应键 断裂
CH3CH2OH 燃烧键 断裂
在Cu或Ag催化下和O2反应键 断裂
C—C—O—H
H
H
H
H
H
①
②
③
④
⑤
①
① ③
全部
归纳总结
一、乙醇的分子结构和物理性质
二、乙醇的化学性质(写出方程式)
三、乙醇的用途
——乙醇
杜康像
何以解忧,
唯有杜康
欢时-----人生得意须尽欢,莫使金樽空对月。(李白)
离时-----劝君更尽一杯酒,西出阳关无故人。(王维)
悲时-----醉卧沙场君莫笑,古来征战几人回? (王翰)
愁时-----抽刀断水水更流,举杯消愁愁更愁。 (李白)
感知生活
学习目标:
1、认识乙醇的组成、结构
2、掌握乙醇的主要物理性质、化学性质
和应用
3、激发学习兴趣、培养动手能力、提高
科学素养
4、了解学习有机物的一般程序
下列应用体现乙醇的哪些性质
(1)碘酒
(2)“酒香不怕巷子深”“开坛十里香”
(3)高烧病人擦拭酒精降温
(4)洗发时,在水中加入适量啤酒,油污一洗即净,头发清爽
(5)用完酒精灯,及时盖上灯帽
(6)在过滤器中洗涤CuSO4等可溶于水的晶体
能溶解某些无机物
挥发性
挥发性
能溶解有机物
挥发性
CuSO4在乙醇中溶解度小于在水中溶解度
考考你
乙醇的物理性质
【动手探究】
1、根据燃烧法已测定乙醇的分子式为C2H6O 2、请同学们根据有机物中“碳四键、氢一键、氧两键” 的结构特点用球棍模型拼插出符合该分子式的所有可能结构。
3、进行结构的比较。
【小组动手探究——乙醇的结构】
【动脑思考】
根据“结构决定性质”,我们可以根据有无 结构,求证乙醇的结构是A还是B?
H—C—C—O—H
H H
H H
A
B
C2H6O:
乙基
羟基
H-O-H
甲基
拓展探究:对比钠与乙醇和水的反应
钠与水 钠与乙醇
操作
步骤 向50ml小烧杯中加入适量水,用镊子取绿豆粒大小一块钠,用滤纸吸干表面的煤油,将钠投入到水中,并盖上表面皿。 向试管中加入2mL无水乙醇,用镊子取绿豆粒大小一块钠,用滤纸吸干表面的煤油,将钠投入到乙醇中
现象
钠沉在液面下,
表面有气泡缓和产生体积逐渐减小,最后消失
钠浮在水面上,
熔成闪亮的小球,
钠迅速游动,
发出嘶嘶的响声
? 水
结构式
分析:
H―O―H
【对比思考】
1、乙醇与水均能与钠反应产生气体,初步推测结构中
均有 ,
乙醇与金属钠反应不如水与金属钠反应剧烈,说明羟基中氢原子的活泼性顺序为: H-OH _______ C2H5-OH
>
羟基
羟基
乙醇
定量实验测定:
46g 乙醇与足量的Na反应, 生成标况下11.2LH2
1、书写乙醇的分子式、结构式、
结构简式
2、分析乙醇和钠反应时断键的位置,
并完成相关化学反应方程式
3、由方程式分析醇与Na反应中
-OH、Na、H2之间的比例关系
【交流研讨】
CH3CH2OH + Na → CH3CH2ONa + H2↑
乙醇钠
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
乙醇的化学性质
——置换反应
1、乙醇与钠的反应
焊接银器、铜器时,表面会生成黑色的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜、银会光亮如初。这是什么原理呢?
实验步骤 实验现象 原因或结论
1.取2~3mL无水乙醇于试管中
2.将铜丝在酒精灯外焰上灼烧至红热 铜丝颜色:
3.趁热将铜丝插入乙醇中 铜丝颜色:
4.重复2、3步操作3~4次后闻试管中液体气味
【实验探究二】
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
铜丝
变黑
2Cu + O2 2CuO
△
又变红
产生刺激性气味
Δ
C2H5OH+ CuO + Cu
乙醛
+ H2O
总反应方程式:
醛基
2、乙醇的催化氧化
乙醇的化学性质
Cu
2
2
2
2
2
CH3CH
O
2CO2 +3H2O
C2H5OH + 3 O2
点燃
3、乙醇燃烧
乙醇的化学性质
彻底氧化
乙 醇
饮 料
化工原料
溶 剂
医 药
燃料
乙醇的用途
溶剂
作溶剂——香水等
作工业原料——制乙酸等
工业制取乙酸
作消毒剂 —— 医用酒精等
消毒剂(体积分数75%的乙醇溶液)
制酒精型饮料 —— 白酒、啤酒、红酒等
饮料
酒精燃料飞机
酒精火锅
含酒精:3% - 5%
含酒精:6% - 20%
含酒精:38% - 65%
75%
95%
含酒精:8% - 15%
你究竟知什么?
感知生活
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
CH3CH2OH
CH3CHO
硫酸酸化CrO3
Cr2(SO4)3
与活泼金属反应键 断裂
CH3CH2OH 燃烧键 断裂
在Cu或Ag催化下和O2反应键 断裂
C—C—O—H
H
H
H
H
H
①
②
③
④
⑤
①
① ③
全部
归纳总结
一、乙醇的分子结构和物理性质
二、乙醇的化学性质(写出方程式)
三、乙醇的用途
