1.1化工生产过程中的基本问题 课件 (5)
文档属性
| 名称 | 1.1化工生产过程中的基本问题 课件 (5) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-11 22:17:09 | ||
图片预览











文档简介
课件30张PPT。走进化学工业化工生产过程中的基本问题课题一化工生产基本过程:(1)确定化学反应原理
(2)选择原料
(3)选择设备和工艺流程
(4)三废处理(环境保护)
(5)能源的利用(综合经济利益)
(6)其它问题(如厂址,成本,反应条件等问题)硫酸(1)物理性质:硫酸是一种无色,难挥发,易溶于水的油状液体。
浓硫酸溶于水时会放出大量的热。因此,稀释硫酸时应该把______倒到______中,并_____.
(2)化学性质:
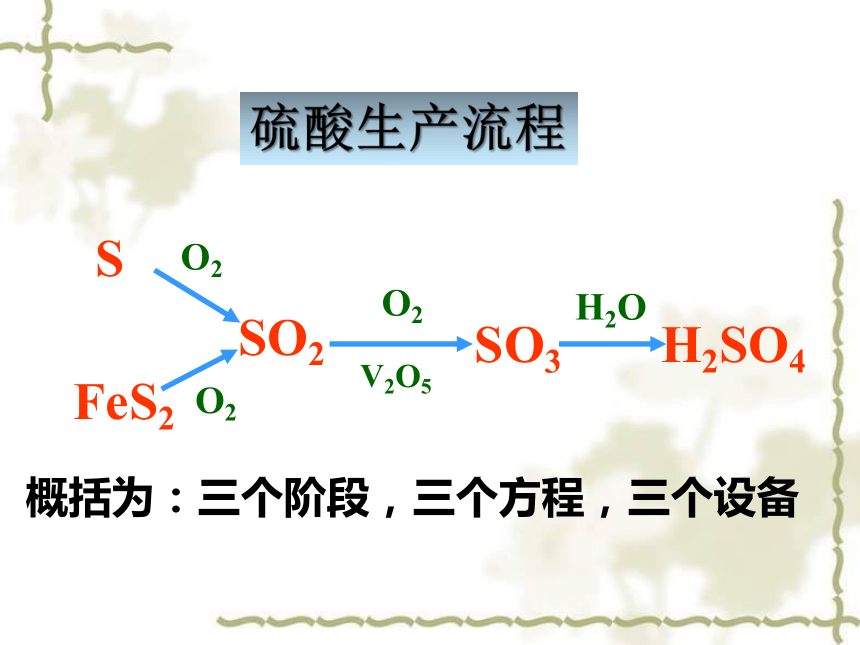
浓硫酸具有酸性,______性,______性和______性.浓硫酸水不断搅拌吸水脱水强氧化硫酸工业生产的原理思考:1. 自然界中硫元素的存在形式?2. 这些物质要经过哪些中间产物才能变成硫酸?一、依据化学原理确定生产过程火山口硫黄 黄铁矿
(愚人金)H2SO4SO3SO2SFeS2H2OO2O2O2V2O5概括为:三个阶段,三个方程,三个设备硫酸生产流程硫酸生产反应式硫酸工业生产的原理第一步:第二步:第三步:(造气)(催化氧化)(吸收)工业中通常用98%的硫酸溶液代替水来吸收SO3均为放热反应硫酸生产反应式二、生产原料的选择硫黄or黄铁矿?需考虑哪些因素?P5思考与交流:98.3%H2SO4SO2 O2SO2
O2SO2 O2硫酸工业生产的三个主要设备造气催化氧化吸收4FeS2 + 11O2 == 2Fe2O3 + 8SO2高温主要反应:主要设备:沸腾炉1 .SO2的制取和净化接 触 法 制 硫 酸炉
气SO2 O2 N2 水蒸气 砷和硒的化合物矿尘使催化剂中毒对设备和生产有不良影响净化措施:除尘洗涤干燥废渣的利用:
炼铁、制造水泥、制砖、提炼贵重金属黄铁矿空气炉渣炉气2 . SO2 氧化成SO3接触室 (热交换器)400-500℃ V2O5主要反应:主要设备:接 触 法 制 硫 酸二氧化硫与氧气是在催化剂的表面上
接触时起反应的,接触室和接触法的
名称由此而得。接触室低温的
SO2 、O2思考:接触室中热交换器的作用是什么?从接触室出来的气体成分是什么? 热交换器的作用是在SO2接触氧化时,用放出的热来预热即将进入接触室发生反应的SO2 和空气,这样可以充分利用热能,节约燃料。SO3、
SO2 、 O2高温
SO2 、O23 . SO3的吸收和硫酸的生成吸收塔SO3(g) + H2O(l) = H2SO4(l) 为什么不用H2O来吸收SO3?SO3与H2O化合时,放出大量热。
易形成酸雾,不利于SO3的吸收。
98%的浓硫酸吸收的产物叫发烟硫酸。主要反应:主要设备:接 触 法 制 硫 酸98.3%H2SO498.3%H2SO4SO2 O2SO2
O2SO2 O2硫酸工业生产的三个主要设备硫酸工业流程沸腾炉 接触室 吸收塔尾气回收应选择温度:(1)400~5000C
思考与交流(表1-1):
温度升高,SO2的转化率_____
降低低温时化学反应速率变慢,催化剂的活性不高,400~5000C催化剂活性较高三、生产中反应条件的控制硫酸工业生产的适宜条件: T思考与交流(表1-2):
1、压强的增大,SO2的转化率_____
2、是否压强越高越好 ?提高工业生产中往往还要考虑成本和能量消耗等问题硫酸工业生产的适宜条件: 应选择压强(2)常压成本和能量消耗高P(1)400~5000C
(2)常压
(3)适当过量的空气
硫酸工业生产的适宜条件: 1. 如何处理尾气中的SO2?工业:实验室:SO2+2NaOH==Na2SO3+H2O四、生产中三废的处理石灰乳或氨水SO2 + 2NH3·H2O == (NH4)2SO3 +H2O
(NH4)2SO3 + H2SO4 == (NH4)2SO4 + SO2 ↑+ H2O练一练:能用于测定硫酸尾气中SO2含量的是_______
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液2. 污水处理3. 废渣的利用石灰乳Ca(OH)2
石灰石CaCO3
生石灰CaO废渣:分离后循环利用,剩下的作铺路用的
沥青或用于制砖炉渣:Fe2O3、SiO2、硅酸盐、少量贵重金属能量的充分利用硫酸生产过程中的三个化学反应都是放热反应,可以充分利用这些反应放出的热能(工厂里把它们叫做“废热”)以降低生产成本。五、能量的充分利用能量的充分利用硫酸生产过程中的三个化学反应都是放热反应,可以充分利用这些反应放出的热能(工厂里把它们叫做“废热”)以降低生产成本。在沸腾炉旁设置“废热”锅炉,产生蒸汽来发电;在接触室中设热交换装置。据测算,生产1t硫酸约需消耗100kW·h的电能,而相应量反应物在生产过程中放出的反应热相当于200kW·h的电能。小结:(本节课重点)1. 工业上接触法制硫酸概括为“五个三” :
三种原料:
三个反应:
三个生产过程:
三个主要设备:
硫酸工业生产的三个适宜条件:
2. 硫酸生产中的废气及废液的处理方法.硫磺(或黄铁矿),空气,和水
造气,催化氧化,吸收沸 腾 炉,接 触 室,吸收塔(1)低温(400~5000C)
(2)常压
(3)适当过量的空气(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
(2)在400 ℃~500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用_________吸收SO3;
(2)选择原料
(3)选择设备和工艺流程
(4)三废处理(环境保护)
(5)能源的利用(综合经济利益)
(6)其它问题(如厂址,成本,反应条件等问题)硫酸(1)物理性质:硫酸是一种无色,难挥发,易溶于水的油状液体。
浓硫酸溶于水时会放出大量的热。因此,稀释硫酸时应该把______倒到______中,并_____.
(2)化学性质:
浓硫酸具有酸性,______性,______性和______性.浓硫酸水不断搅拌吸水脱水强氧化硫酸工业生产的原理思考:1. 自然界中硫元素的存在形式?2. 这些物质要经过哪些中间产物才能变成硫酸?一、依据化学原理确定生产过程火山口硫黄 黄铁矿
(愚人金)H2SO4SO3SO2SFeS2H2OO2O2O2V2O5概括为:三个阶段,三个方程,三个设备硫酸生产流程硫酸生产反应式硫酸工业生产的原理第一步:第二步:第三步:(造气)(催化氧化)(吸收)工业中通常用98%的硫酸溶液代替水来吸收SO3均为放热反应硫酸生产反应式二、生产原料的选择硫黄or黄铁矿?需考虑哪些因素?P5思考与交流:98.3%H2SO4SO2 O2SO2
O2SO2 O2硫酸工业生产的三个主要设备造气催化氧化吸收4FeS2 + 11O2 == 2Fe2O3 + 8SO2高温主要反应:主要设备:沸腾炉1 .SO2的制取和净化接 触 法 制 硫 酸炉
气SO2 O2 N2 水蒸气 砷和硒的化合物矿尘使催化剂中毒对设备和生产有不良影响净化措施:除尘洗涤干燥废渣的利用:
炼铁、制造水泥、制砖、提炼贵重金属黄铁矿空气炉渣炉气2 . SO2 氧化成SO3接触室 (热交换器)400-500℃ V2O5主要反应:主要设备:接 触 法 制 硫 酸二氧化硫与氧气是在催化剂的表面上
接触时起反应的,接触室和接触法的
名称由此而得。接触室低温的
SO2 、O2思考:接触室中热交换器的作用是什么?从接触室出来的气体成分是什么? 热交换器的作用是在SO2接触氧化时,用放出的热来预热即将进入接触室发生反应的SO2 和空气,这样可以充分利用热能,节约燃料。SO3、
SO2 、 O2高温
SO2 、O23 . SO3的吸收和硫酸的生成吸收塔SO3(g) + H2O(l) = H2SO4(l) 为什么不用H2O来吸收SO3?SO3与H2O化合时,放出大量热。
易形成酸雾,不利于SO3的吸收。
98%的浓硫酸吸收的产物叫发烟硫酸。主要反应:主要设备:接 触 法 制 硫 酸98.3%H2SO498.3%H2SO4SO2 O2SO2
O2SO2 O2硫酸工业生产的三个主要设备硫酸工业流程沸腾炉 接触室 吸收塔尾气回收应选择温度:(1)400~5000C
思考与交流(表1-1):
温度升高,SO2的转化率_____
降低低温时化学反应速率变慢,催化剂的活性不高,400~5000C催化剂活性较高三、生产中反应条件的控制硫酸工业生产的适宜条件: T思考与交流(表1-2):
1、压强的增大,SO2的转化率_____
2、是否压强越高越好 ?提高工业生产中往往还要考虑成本和能量消耗等问题硫酸工业生产的适宜条件: 应选择压强(2)常压成本和能量消耗高P(1)400~5000C
(2)常压
(3)适当过量的空气
硫酸工业生产的适宜条件: 1. 如何处理尾气中的SO2?工业:实验室:SO2+2NaOH==Na2SO3+H2O四、生产中三废的处理石灰乳或氨水SO2 + 2NH3·H2O == (NH4)2SO3 +H2O
(NH4)2SO3 + H2SO4 == (NH4)2SO4 + SO2 ↑+ H2O练一练:能用于测定硫酸尾气中SO2含量的是_______
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液2. 污水处理3. 废渣的利用石灰乳Ca(OH)2
石灰石CaCO3
生石灰CaO废渣:分离后循环利用,剩下的作铺路用的
沥青或用于制砖炉渣:Fe2O3、SiO2、硅酸盐、少量贵重金属能量的充分利用硫酸生产过程中的三个化学反应都是放热反应,可以充分利用这些反应放出的热能(工厂里把它们叫做“废热”)以降低生产成本。五、能量的充分利用能量的充分利用硫酸生产过程中的三个化学反应都是放热反应,可以充分利用这些反应放出的热能(工厂里把它们叫做“废热”)以降低生产成本。在沸腾炉旁设置“废热”锅炉,产生蒸汽来发电;在接触室中设热交换装置。据测算,生产1t硫酸约需消耗100kW·h的电能,而相应量反应物在生产过程中放出的反应热相当于200kW·h的电能。小结:(本节课重点)1. 工业上接触法制硫酸概括为“五个三” :
三种原料:
三个反应:
三个生产过程:
三个主要设备:
硫酸工业生产的三个适宜条件:
2. 硫酸生产中的废气及废液的处理方法.硫磺(或黄铁矿),空气,和水
造气,催化氧化,吸收沸 腾 炉,接 触 室,吸收塔(1)低温(400~5000C)
(2)常压
(3)适当过量的空气(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
(2)在400 ℃~500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用_________吸收SO3;
