2.1 获取洁净的水 课件 (5)
文档属性
| 名称 | 2.1 获取洁净的水 课件 (5) |  | |
| 格式 | zip | ||
| 文件大小 | 694.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-11 22:37:21 | ||
图片预览








文档简介
课件25张PPT。第二章 化学与资源开发利用第一节 获取洁净的水 水净化的原因:天然水在自然循环过程中与大气和土壤不断地接触,必然会混入很多种杂质。这些杂质有的悬浮在水中,有的溶解在水中,还有的以胶状粒子分散在水中。为了获得符合不同标准(指工业生产或生活方面)的水,必须对水进行处理,以除掉水中的一些杂质。天然水的净化取大约150ml河水于烧杯中,加1/5药匙的明矾[ KAI(SO4)2 ],用玻璃棒搅拌,然后静置,观察现象。.混凝法:
原理:加入一种混凝剂(如:明矾、铁盐、亚铁盐),使水中细 小的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去明矾混凝除杂原理KAI(SO4)2 = K+ + AI3+ + 2SO42-
Al3+ + 3H2O Al(OH)3 + 3H+1、明矾、铁盐或亚铁盐为什么能净化水? 分别写出明矾、铁盐净化水的离子反应方程式 。
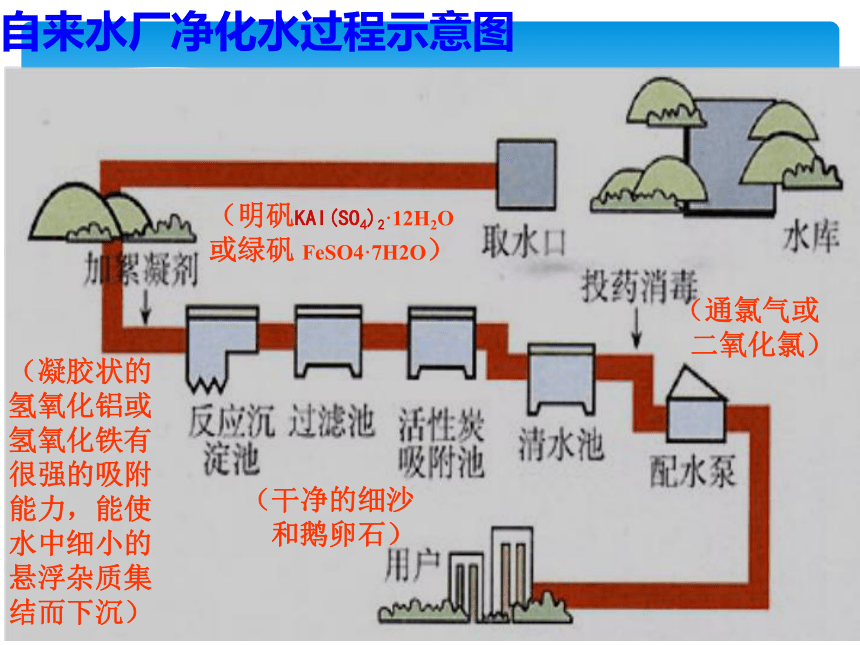
2、为什么亚铁盐的净化效果没有铁盐的效果好?◇家庭中杀灭水中细菌的方法有:加热、消毒剂、紫外线等水的杀菌消毒◇城市饮用水杀菌:广泛采用液氯自来水厂净化水过程示意图(明矾KAI(SO4)2·12H2O 或绿矾 FeSO4·7H2O)(凝胶状的
氢氧化铝或
氢氧化铁有
很强的吸附
能力,能使
水中细小的
悬浮杂质集
结而下沉)(干净的细沙
和鹅卵石)(通氯气或
二氧化氯)(1)、硬水和软水的定义:硬水:含有较多可溶性钙、镁离子化合物的水。软水:不含或含较少可溶性钙、镁离子化合物的水。肥皂水法:泡沫少,有大量浮渣有大量泡沫,无浮渣可用肥皂水来区别硬水和软水;硬水浪费肥皂(2)、硬水和软水的鉴别方法:暂时硬度:水的硬度是由钙、镁离子的碳酸氢盐所引起的硬度。 永久硬度:水的硬度由钙、镁的硫酸盐、氯化物等所引起的硬度2、化学软化法加热法:蒸发皿底部有白色固体蒸发皿底部无或很少固体可用蒸发法区别硬水和软水;硬水加热可形成水垢 所以水垢的主要成分是CaCO3和Mg(OH)2,可以用稀盐酸洗,但是为了防止腐蚀设备,需要加入合适的缓蚀剂。蒸馏水 暂时硬水 永久硬水煮沸蒸馏水和永久硬水暂时硬水永久硬水肥皂水蒸馏水如何区分蒸馏水,暂时硬水和永久硬水?(3)、硬水的危害:(4)、硬水软化的方法: 生活中常用①加热煮沸的方法降低水的硬度,实验室常用蒸馏的方法得到蒸馏水以降低水的硬度。
在工业上常用②药剂法和③离子交换法来得到软水。①、既浪费肥皂又洗不干净衣服。
②、锅炉里结水垢有爆炸危险。蒸馏法把水加热蒸馏,除去水中的钙镁离子,同时除去
其他杂质蒸馏装置图药品:Ca(OH)2溶液、 NaOH 溶液、
饱和Na2CO3 溶液、肥皂水。离子交换法碳质离子交换剂 离子交换树脂
——磺化煤(黑色颗粒,不溶于酸碱)
碳质离子交换剂:磺化煤 NaR 烟煤和褐煤用发烟硫或
浓硫酸处理后的产物 钠离子可以交换水中的钙镁离子交换
2NaR+Ca2+=CaR2+2Na+
2NaR+Mg2+=MgR2+2Na+
离子交换柱交换过程再生 交换并非是无止境的。
当交换后的水不再符合软水的标准时,
磺化煤就失效了,需要
再生: 用8%~10%的食盐水浸泡
磺化煤交换剂。
CaR2+2Na+=2NaR+Ca2+
MgR2+2Na+=2NaR+Mg2+
再生过程是交换过程的逆过程。水质变化水质变化:
原水硬度降低
阴离子基本不变
钠离子数目大大增加
磺化煤缺点:不耐热,交换容量小,再生剂消耗大。
交换容量和原水硬度以及再生水平有关,影响因素较多。离子交换树脂 优点:质量高,占地小,设备简单,操
作方便。离子交换树脂离子交换树脂性状:透明或半透明,颜色有黄色,白色
等,形状 有交换膜,球状,柱状等用途:纯水制取(H型+OH型)硬水软化,
原料提纯,有机合成等。缺点:原水硬度和碱度高时,经济效益不
好。具有永久硬度的水:水的硬度是由钙、镁的硫酸盐或氯化物所引起的,常用软化方法为药剂法和离子交换法。
a.药剂法:把纯碱、生石灰等试剂加入到硬水中,与Ca2+、Mg2+反应形成沉淀,分离。
b.离子交换法: 用离子交换剂除去硬水中的Ca2+、Mg2+。如用离子交换树脂软化水的过程为:
2NaR+Ca2+===CaR2+2Na+,
2NaR+Mg2+===MgR2+2Na+。而离子交换树脂的再生(用离子方程式表示)为:
CaR2+2Na+===2NaR+Ca2+。本节小结:
一、天然水的净化
混凝法原理
二、硬水的软化
1.加热法
2.药剂法
3.离子交换法
作业设计:
[活动]用混凝法净化一杯井水
原理:加入一种混凝剂(如:明矾、铁盐、亚铁盐),使水中细 小的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去明矾混凝除杂原理KAI(SO4)2 = K+ + AI3+ + 2SO42-
Al3+ + 3H2O Al(OH)3 + 3H+1、明矾、铁盐或亚铁盐为什么能净化水? 分别写出明矾、铁盐净化水的离子反应方程式 。
2、为什么亚铁盐的净化效果没有铁盐的效果好?◇家庭中杀灭水中细菌的方法有:加热、消毒剂、紫外线等水的杀菌消毒◇城市饮用水杀菌:广泛采用液氯自来水厂净化水过程示意图(明矾KAI(SO4)2·12H2O 或绿矾 FeSO4·7H2O)(凝胶状的
氢氧化铝或
氢氧化铁有
很强的吸附
能力,能使
水中细小的
悬浮杂质集
结而下沉)(干净的细沙
和鹅卵石)(通氯气或
二氧化氯)(1)、硬水和软水的定义:硬水:含有较多可溶性钙、镁离子化合物的水。软水:不含或含较少可溶性钙、镁离子化合物的水。肥皂水法:泡沫少,有大量浮渣有大量泡沫,无浮渣可用肥皂水来区别硬水和软水;硬水浪费肥皂(2)、硬水和软水的鉴别方法:暂时硬度:水的硬度是由钙、镁离子的碳酸氢盐所引起的硬度。 永久硬度:水的硬度由钙、镁的硫酸盐、氯化物等所引起的硬度2、化学软化法加热法:蒸发皿底部有白色固体蒸发皿底部无或很少固体可用蒸发法区别硬水和软水;硬水加热可形成水垢 所以水垢的主要成分是CaCO3和Mg(OH)2,可以用稀盐酸洗,但是为了防止腐蚀设备,需要加入合适的缓蚀剂。蒸馏水 暂时硬水 永久硬水煮沸蒸馏水和永久硬水暂时硬水永久硬水肥皂水蒸馏水如何区分蒸馏水,暂时硬水和永久硬水?(3)、硬水的危害:(4)、硬水软化的方法: 生活中常用①加热煮沸的方法降低水的硬度,实验室常用蒸馏的方法得到蒸馏水以降低水的硬度。
在工业上常用②药剂法和③离子交换法来得到软水。①、既浪费肥皂又洗不干净衣服。
②、锅炉里结水垢有爆炸危险。蒸馏法把水加热蒸馏,除去水中的钙镁离子,同时除去
其他杂质蒸馏装置图药品:Ca(OH)2溶液、 NaOH 溶液、
饱和Na2CO3 溶液、肥皂水。离子交换法碳质离子交换剂 离子交换树脂
——磺化煤(黑色颗粒,不溶于酸碱)
碳质离子交换剂:磺化煤 NaR 烟煤和褐煤用发烟硫或
浓硫酸处理后的产物 钠离子可以交换水中的钙镁离子交换
2NaR+Ca2+=CaR2+2Na+
2NaR+Mg2+=MgR2+2Na+
离子交换柱交换过程再生 交换并非是无止境的。
当交换后的水不再符合软水的标准时,
磺化煤就失效了,需要
再生: 用8%~10%的食盐水浸泡
磺化煤交换剂。
CaR2+2Na+=2NaR+Ca2+
MgR2+2Na+=2NaR+Mg2+
再生过程是交换过程的逆过程。水质变化水质变化:
原水硬度降低
阴离子基本不变
钠离子数目大大增加
磺化煤缺点:不耐热,交换容量小,再生剂消耗大。
交换容量和原水硬度以及再生水平有关,影响因素较多。离子交换树脂 优点:质量高,占地小,设备简单,操
作方便。离子交换树脂离子交换树脂性状:透明或半透明,颜色有黄色,白色
等,形状 有交换膜,球状,柱状等用途:纯水制取(H型+OH型)硬水软化,
原料提纯,有机合成等。缺点:原水硬度和碱度高时,经济效益不
好。具有永久硬度的水:水的硬度是由钙、镁的硫酸盐或氯化物所引起的,常用软化方法为药剂法和离子交换法。
a.药剂法:把纯碱、生石灰等试剂加入到硬水中,与Ca2+、Mg2+反应形成沉淀,分离。
b.离子交换法: 用离子交换剂除去硬水中的Ca2+、Mg2+。如用离子交换树脂软化水的过程为:
2NaR+Ca2+===CaR2+2Na+,
2NaR+Mg2+===MgR2+2Na+。而离子交换树脂的再生(用离子方程式表示)为:
CaR2+2Na+===2NaR+Ca2+。本节小结:
一、天然水的净化
混凝法原理
二、硬水的软化
1.加热法
2.药剂法
3.离子交换法
作业设计:
[活动]用混凝法净化一杯井水
