九年级化学(沪教版)同步练习:6.2溶液组成的表示
文档属性
| 名称 | 九年级化学(沪教版)同步练习:6.2溶液组成的表示 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-15 00:00:00 | ||
图片预览



文档简介
第一课时
1(改编)关于溶质、溶剂有以下几种说法,其中你认为正确的是( )
①溶质只能是固体
②溶剂一定是水 ③一种溶液中只含有一种溶质
④溶质是以分子或离子的形式存在于溶液中
A.①②③
B.②③
C.④
D.全部
2从50
g
20%的硝酸钾溶液中取出25
g溶液后,剩余硝酸钾溶液中溶质的质量分数是( )
A.40%
B.20%
C.15%
D.10%
3把20
g食盐水放在蒸发皿内,加热蒸干后,得到食盐4
g,则其溶剂的质量是( )
A.24
g
B.4
g
C.20
g
D.16
g
4台州是个滨海城市,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐,在这过程中( )
A.水的质量不变
B.氯化钠的质量不变
C.氯化钠的质量分数始终不变
D.氯化钠的质量分数变小
5(原创)研究表明,超临界二氧化碳驱油技术可以在水驱油提高采收率的基础上,再提高10%~20%。超临界二氧化碳具有黏度低、流动性好、扩散性强、对某些物质有较强的溶解能力,且比重是水的0.6~0.8倍。由此可见,超临界二氧化碳也可以作( )
A.溶剂
B.溶质
C.催化剂
D.还原剂
6(原创)写出下列反应的化学方程式,并写出反应后所得溶液中溶质的化学式。
(1)碳酸钙与一定质量分数的稀盐酸恰好完全反应
化学方程式____________________________,反应后所得溶液的溶质是____________。
(2)铁溶于稀盐酸
化学方程式____________________________,反应后所得溶液的溶质是____________。
(3)铁放入硫酸铜溶液中,溶液变成浅绿色
化学方程式____________________________,反应后所得溶液的溶质是____________。
我综合 我发展
7
将10
g某物质溶解于90
g水中形成溶液,所得的溶液中溶质质量分数是( )
A一定等于10%
B.一定大于10%
C.一定小于10%
D.三种情况均有可能
8将一瓶80
g
10%的NaCl溶液分为2等份,每份溶液中溶质的质量分数为________________________________________________________________________;
若将其中的一份溶质质量分数减小一半,应加水__________
g;若将另一份溶液中的溶质质量分数增大一倍,应加入NaCl
________________
g。
9
日常生活中我们要科学地节约用水。现有一件刚用洗涤剂洗过的衣服,“拧干”后湿衣服上残留的溶液为100
g,其中含洗涤剂的质量分数为1%。则湿衣服上残留的洗涤剂质量为______
g。现用2
700
g清水对这件衣服进行漂洗,有以下两种漂洗方法(假设每次“拧干”后湿衣服仍残留100
g溶液):
方法1:用2
700
g清水一次漂洗,“拧干”后残留在衣服上的洗涤剂质量为(用分数表示,下同)________
g。
方法2:用2
700
g清水均分成质量相等的三份(每份900
g)分三次漂洗。
第一次,用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。
第二次,再用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。
第三次,再用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。由以上计算分析,用相同质量的水漂洗衣服,是一次效果好,还是将水等分成三份,分三次漂洗效果好?____________________________。
第二课时
我夯基 我达标
1
现配制溶质质量分数为5%的NaCl溶液100
g,下列操作错误的图示是( )
2在化学实验中,我们经常需要取用一定量的药品。若需取用48
g蒸馏水,下列最合适的仪器是( )
A.
100
mL的量筒
B.托盘天平
C.50
mL的量筒
D.50
mL的烧杯
3高锰酸钾具有强氧化性,其溶液可以用来消毒杀菌。要配制1
000
g
0.5%的高锰酸钾溶液,下述方法正确的是( )
A.称取0.5
g高锰酸钾,溶于100
g水中
B.称取0.5
g高锰酸钾,溶于1
000
g
水中
C.称取5
g高锰酸钾,溶于995
g
水中
D.称取50
g高锰酸钾,溶于950
g水中
4将100
g
10%的某固体物质M的溶液,分别进行下述操作,所得溶液中溶质的质量分数最小的是( )
A.
蒸发掉10
g水,无晶体析出
B.
加入10
g
10%的M的溶液
C.
加入10
g固体M,并使之完全溶解
D.
加入10
g水
5
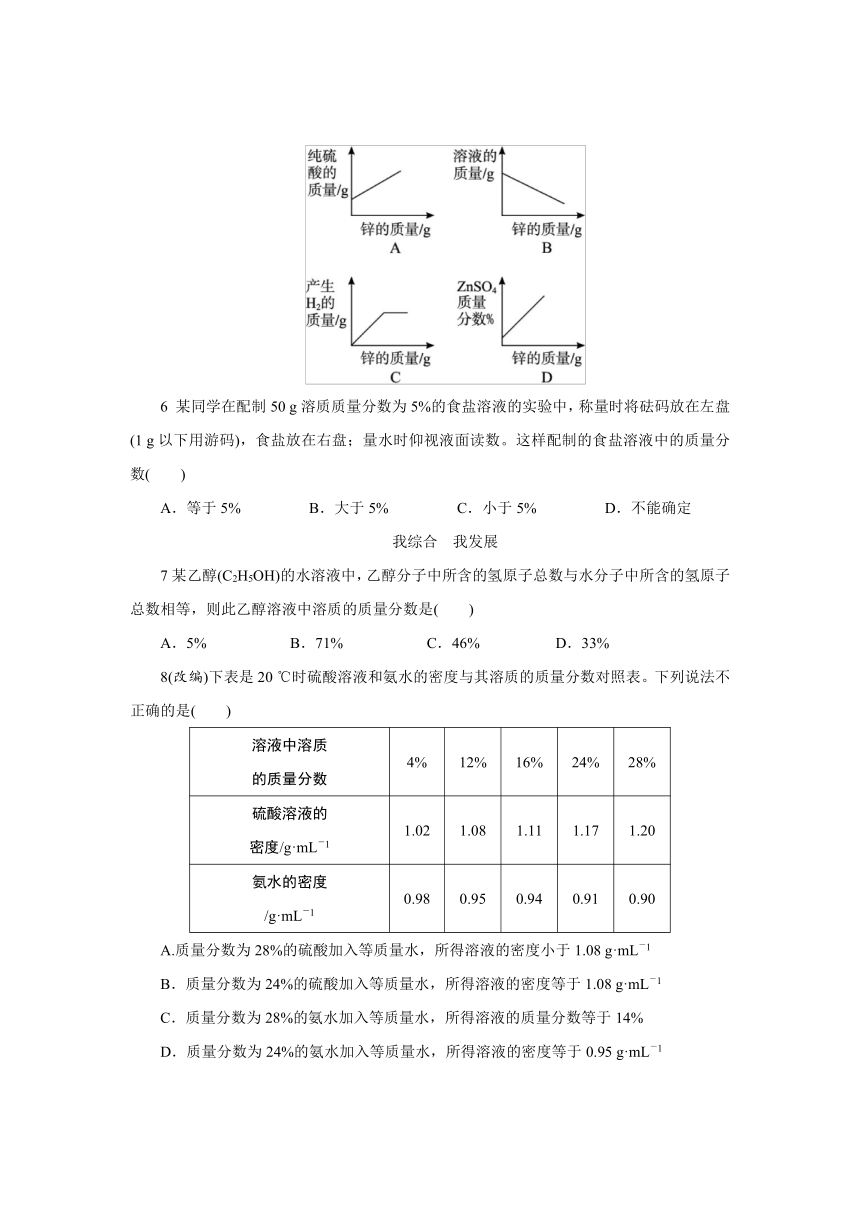
在一定量的稀硫酸中加入足量的锌粒,下列图像中正确的是( )
6
某同学在配制50
g溶质质量分数为5%的食盐溶液的实验中,称量时将砝码放在左盘(1
g以下用游码),食盐放在右盘;量水时仰视液面读数。这样配制的食盐溶液中的质量分数( )
A.等于5%
B.大于5%
C.小于5%
D.不能确定
我综合 我发展
7某乙醇(C2H5OH)的水溶液中,乙醇分子中所含的氢原子总数与水分子中所含的氢原子总数相等,则此乙醇溶液中溶质的质量分数是( )
A.5%
B.71%
C.46%
D.33%
8(改编)下表是20
℃时硫酸溶液和氨水的密度与其溶质的质量分数对照表。下列说法不正确的是( )
溶液中溶质的质量分数
4%
12%
16%
24%
28%
硫酸溶液的密度/g·mL-1
1.02
1.08
1.11
1.17
1.20
氨水的密度/g·mL-1
0.98
0.95
0.94
0.91
0.90
A.质量分数为28%的硫酸加入等质量水,所得溶液的密度小于1.08
g·mL-1
B.质量分数为24%的硫酸加入等质量水,所得溶液的密度等于1.08
g·mL-1
C.质量分数为28%的氨水加入等质量水,所得溶液的质量分数等于14%
D.质量分数为24%的氨水加入等质量水,所得溶液的密度等于0.95
g·mL-1
9100
g某硫酸溶液恰好与13
g锌完全反应,试计算所得溶液中溶质的质量分数。
10将5
g固体氢氧化钠完全溶解在50
g溶质质量分数为12%的氢氧化钠溶液中。
(1)求所得溶液的溶质质量分数;
(2)为测算某盐酸的溶质质量分数,现取10
g上述所得的氢氧化钠溶液与18.25
g此盐酸混合,恰好完全反应。求此盐酸的溶质质量分数。(NaOH+HCl===NaCl+H2O)
参考答案
第一课时
1解析:溶质可以是固体、液体、气体,故①不正确;常用的溶剂是水,而酒精、汽油等也可以作溶剂,故②错误;一种溶液中可以有一种或多种溶质,故③错误。
答案:C
2解析:本题重点考查溶液的特征,由于溶液是均一稳定的混合物,各部分的性质都相同,因此,取出部分溶液的浓度与剩余溶液的浓度相同。
答案:B
3答案:D
4解析:随着水的蒸发,溶剂质量减少,海水中氯化钠的质量分数逐渐变大,但氯化钠的质量不会发生改变。
答案:B
5解析:超临界二氧化碳“对某些物质有较强的溶解能力”,由此可见,超临界二氧化碳也可以作为溶剂来使用。
答案:A
6答案:(1)CaCO3+2HCl===CaCl2+H2O+CO2↑ CaCl2
(2)Fe+2HCl===FeCl2+H2↑ FeCl2
(3)Fe+CuSO4===FeSO4+Cu
FeSO4
7解析:10
g
的氯化钠溶解在90
g
水中,可形成10%
的氯化钠溶液;而10
g
SO2溶解在90
g
水中,SO2会与水反应生成H2SO3,即溶质的质量增加,溶剂质量减少,因此所得溶液中溶质的质量分数大于10%
;而10
g
CuSO4·5H2O溶解在90
g
水中,由于CuSO4·5H2O中的结晶水会以溶剂的形式存在于溶液中,因此所得溶液中溶质的质量分数小于10%。
答案:D
8解析:由于溶液是均一稳定的混合物,溶液中各部分的性质是相同的,所以将溶液分成两等份,溶质的质量分数不变。若要使溶液的溶质质量分数减小一半,稀释前后溶液中溶质的质量相等。可设加入的水的质量为x,则40
g×10%=(x+40
g)×5%
,解之可得,x=40
g。同样,若增大一倍,可设加入的食盐质量是y,则40
g×10%+y=(40
g+y)×20%,解之可得,y=5
g。
答案:10% 40 5
9解析:加2
700
g水漂洗,则溶液的总质量=2
700
g+100
g=2
800
g
此时溶质质量分数=×100%
“拧干”后剩余洗涤剂质量为:100g
××100%=
g。
对于方法二,可用此方法依次解出答案。
答案:1 1/28 1/10 1/100 1/1
000 将水分成三份,分三次漂洗效果好
第二课时
1答案:A
2答案:C
3解析:配制1
000
g
0.5%的高锰酸钾溶液,需要高锰酸钾的质量是1
000
g×0.5%=5
g;水的质量是1
000
g-5
g=995
g
。
答案:C
4解析:蒸发溶剂或者是增加溶质都会使溶液中溶质的质量分数增大,因此A、C不符合要求。而加入同溶质同质量分数的溶液,无论加入的溶液质量是多少,混合后的溶液中溶质质量分数不变,因此B不符合题意。
答案:D
5解析:向稀硫酸中加入足量的锌粒,纯H2SO4的质量逐渐减小,待反应完毕后,质量成为0,因此A错误。反应过程中溶液的质量逐渐增大,当反应完毕后,溶液的质量不再发生改变,故B错误。而生成氢气和硫酸锌的质量变化情况与溶液质量变化情况类似,因此C正确,而D错误。
答案:C
6解析:计算可得,“配制50
g溶质质量分数为5%的食盐溶液”需要食盐是50
g×5%=2.5
g
,需要水的质量是47.5
g
。在称量时砝码放在左盘,食盐放在右盘,则所称取的食盐的实际质量是2
g-0.5
g=1.5
g;量取水时仰视读数,则量取的实际体积就大于47.5
mL。错误的操作就造成了溶剂的量增加,而溶质的质量减少,因此,配制的食盐溶液的质量分数要小于5%。
答案:C
7解析:由题意可知,一个乙醇分子中含有6个氢原子,则所对应的水分子中也应该是6个氢原子,因此溶液可以看作是n个乙醇分子对应3n个水分子构成的。因此溶液的质量应该是46n+3n×18=100n,溶液中溶质的质量分数是46n/100n×100%=46%。
答案:C
8解析:由表格中的数据可知,浓硫酸的密度随溶质质量分数的增大而增大,氨水的密度随溶质质量分数的增大而减小。质量分数为28%的硫酸加入等质量水,则加水后的溶质的质量分数变成14%,必大于12%的硫酸的密度,即大于1.08
g·mL-1,故A错误。若24%的硫酸溶液加入等质量的水,则溶质质量分数等于12%,密度应是1.08
g·mL-1,故B正确。同理,C、D的说法也是正确的。
答案:A
9解析:“反应后所得溶液是ZnSO4溶液,要求出ZnSO4溶液中溶质的质量分数,要先根据13
g锌求得生成的硫酸锌的质量,再根据反应前总质量-生成的氢气的质量,即可求得反应后溶液的质量,最后求得溶液中溶质的质量分数。
答案:设生成的硫酸锌的质量为x,氢气的质量为y。
Zn+H2SO4===ZnSO4+H2↑
65
161
2
13
g
x
y
65/161=13
g/x 65/2=13
g/y
x=32.2
g y=0.4
g
反应后所得溶液的质量为100
g+13
g-0.4
g=112.6
g
反应后所得溶液中溶质的质量分数为32.2
g/112.6
g×100%=28.6%
答:100
g某硫酸溶液恰好与13
g锌完全反应,反应后所得溶液中溶质的质量分数为28.6%。
10解析:将5
g氢氧化钠溶解在50
g
12%
的氢氧化钠溶液中,混合后的溶液中溶质质量等于混合前溶液中溶质质量与新增加的溶质质量之和。利用第(1)中所求得的结果计算出参加反应的氢氧化钠的质量,从而求得参与反应的HCl的质量以及该盐酸的溶质质量分数。
答案:(1)(5
g+50
g×12%)/(50
g+5
g)×100%=20%
(2)参与反应的NaOH的质量为10
g×20%=2
g
设盐酸中溶质的质量是x,则
NaOH+HCl===NaCl+H2O
40
36.5
2
g
x
40∶36.5=2
g∶x
x=1.825
g
则该盐酸中溶质的质量分数是1.825
g/18.25
g×100%=10%
答:略
1(改编)关于溶质、溶剂有以下几种说法,其中你认为正确的是( )
①溶质只能是固体
②溶剂一定是水 ③一种溶液中只含有一种溶质
④溶质是以分子或离子的形式存在于溶液中
A.①②③
B.②③
C.④
D.全部
2从50
g
20%的硝酸钾溶液中取出25
g溶液后,剩余硝酸钾溶液中溶质的质量分数是( )
A.40%
B.20%
C.15%
D.10%
3把20
g食盐水放在蒸发皿内,加热蒸干后,得到食盐4
g,则其溶剂的质量是( )
A.24
g
B.4
g
C.20
g
D.16
g
4台州是个滨海城市,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐,在这过程中( )
A.水的质量不变
B.氯化钠的质量不变
C.氯化钠的质量分数始终不变
D.氯化钠的质量分数变小
5(原创)研究表明,超临界二氧化碳驱油技术可以在水驱油提高采收率的基础上,再提高10%~20%。超临界二氧化碳具有黏度低、流动性好、扩散性强、对某些物质有较强的溶解能力,且比重是水的0.6~0.8倍。由此可见,超临界二氧化碳也可以作( )
A.溶剂
B.溶质
C.催化剂
D.还原剂
6(原创)写出下列反应的化学方程式,并写出反应后所得溶液中溶质的化学式。
(1)碳酸钙与一定质量分数的稀盐酸恰好完全反应
化学方程式____________________________,反应后所得溶液的溶质是____________。
(2)铁溶于稀盐酸
化学方程式____________________________,反应后所得溶液的溶质是____________。
(3)铁放入硫酸铜溶液中,溶液变成浅绿色
化学方程式____________________________,反应后所得溶液的溶质是____________。
我综合 我发展
7
将10
g某物质溶解于90
g水中形成溶液,所得的溶液中溶质质量分数是( )
A一定等于10%
B.一定大于10%
C.一定小于10%
D.三种情况均有可能
8将一瓶80
g
10%的NaCl溶液分为2等份,每份溶液中溶质的质量分数为________________________________________________________________________;
若将其中的一份溶质质量分数减小一半,应加水__________
g;若将另一份溶液中的溶质质量分数增大一倍,应加入NaCl
________________
g。
9
日常生活中我们要科学地节约用水。现有一件刚用洗涤剂洗过的衣服,“拧干”后湿衣服上残留的溶液为100
g,其中含洗涤剂的质量分数为1%。则湿衣服上残留的洗涤剂质量为______
g。现用2
700
g清水对这件衣服进行漂洗,有以下两种漂洗方法(假设每次“拧干”后湿衣服仍残留100
g溶液):
方法1:用2
700
g清水一次漂洗,“拧干”后残留在衣服上的洗涤剂质量为(用分数表示,下同)________
g。
方法2:用2
700
g清水均分成质量相等的三份(每份900
g)分三次漂洗。
第一次,用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。
第二次,再用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。
第三次,再用900
g清水漂洗,“拧干”后残留在衣服上的洗涤剂质量为________
g。由以上计算分析,用相同质量的水漂洗衣服,是一次效果好,还是将水等分成三份,分三次漂洗效果好?____________________________。
第二课时
我夯基 我达标
1
现配制溶质质量分数为5%的NaCl溶液100
g,下列操作错误的图示是( )
2在化学实验中,我们经常需要取用一定量的药品。若需取用48
g蒸馏水,下列最合适的仪器是( )
A.
100
mL的量筒
B.托盘天平
C.50
mL的量筒
D.50
mL的烧杯
3高锰酸钾具有强氧化性,其溶液可以用来消毒杀菌。要配制1
000
g
0.5%的高锰酸钾溶液,下述方法正确的是( )
A.称取0.5
g高锰酸钾,溶于100
g水中
B.称取0.5
g高锰酸钾,溶于1
000
g
水中
C.称取5
g高锰酸钾,溶于995
g
水中
D.称取50
g高锰酸钾,溶于950
g水中
4将100
g
10%的某固体物质M的溶液,分别进行下述操作,所得溶液中溶质的质量分数最小的是( )
A.
蒸发掉10
g水,无晶体析出
B.
加入10
g
10%的M的溶液
C.
加入10
g固体M,并使之完全溶解
D.
加入10
g水
5
在一定量的稀硫酸中加入足量的锌粒,下列图像中正确的是( )
6
某同学在配制50
g溶质质量分数为5%的食盐溶液的实验中,称量时将砝码放在左盘(1
g以下用游码),食盐放在右盘;量水时仰视液面读数。这样配制的食盐溶液中的质量分数( )
A.等于5%
B.大于5%
C.小于5%
D.不能确定
我综合 我发展
7某乙醇(C2H5OH)的水溶液中,乙醇分子中所含的氢原子总数与水分子中所含的氢原子总数相等,则此乙醇溶液中溶质的质量分数是( )
A.5%
B.71%
C.46%
D.33%
8(改编)下表是20
℃时硫酸溶液和氨水的密度与其溶质的质量分数对照表。下列说法不正确的是( )
溶液中溶质的质量分数
4%
12%
16%
24%
28%
硫酸溶液的密度/g·mL-1
1.02
1.08
1.11
1.17
1.20
氨水的密度/g·mL-1
0.98
0.95
0.94
0.91
0.90
A.质量分数为28%的硫酸加入等质量水,所得溶液的密度小于1.08
g·mL-1
B.质量分数为24%的硫酸加入等质量水,所得溶液的密度等于1.08
g·mL-1
C.质量分数为28%的氨水加入等质量水,所得溶液的质量分数等于14%
D.质量分数为24%的氨水加入等质量水,所得溶液的密度等于0.95
g·mL-1
9100
g某硫酸溶液恰好与13
g锌完全反应,试计算所得溶液中溶质的质量分数。
10将5
g固体氢氧化钠完全溶解在50
g溶质质量分数为12%的氢氧化钠溶液中。
(1)求所得溶液的溶质质量分数;
(2)为测算某盐酸的溶质质量分数,现取10
g上述所得的氢氧化钠溶液与18.25
g此盐酸混合,恰好完全反应。求此盐酸的溶质质量分数。(NaOH+HCl===NaCl+H2O)
参考答案
第一课时
1解析:溶质可以是固体、液体、气体,故①不正确;常用的溶剂是水,而酒精、汽油等也可以作溶剂,故②错误;一种溶液中可以有一种或多种溶质,故③错误。
答案:C
2解析:本题重点考查溶液的特征,由于溶液是均一稳定的混合物,各部分的性质都相同,因此,取出部分溶液的浓度与剩余溶液的浓度相同。
答案:B
3答案:D
4解析:随着水的蒸发,溶剂质量减少,海水中氯化钠的质量分数逐渐变大,但氯化钠的质量不会发生改变。
答案:B
5解析:超临界二氧化碳“对某些物质有较强的溶解能力”,由此可见,超临界二氧化碳也可以作为溶剂来使用。
答案:A
6答案:(1)CaCO3+2HCl===CaCl2+H2O+CO2↑ CaCl2
(2)Fe+2HCl===FeCl2+H2↑ FeCl2
(3)Fe+CuSO4===FeSO4+Cu
FeSO4
7解析:10
g
的氯化钠溶解在90
g
水中,可形成10%
的氯化钠溶液;而10
g
SO2溶解在90
g
水中,SO2会与水反应生成H2SO3,即溶质的质量增加,溶剂质量减少,因此所得溶液中溶质的质量分数大于10%
;而10
g
CuSO4·5H2O溶解在90
g
水中,由于CuSO4·5H2O中的结晶水会以溶剂的形式存在于溶液中,因此所得溶液中溶质的质量分数小于10%。
答案:D
8解析:由于溶液是均一稳定的混合物,溶液中各部分的性质是相同的,所以将溶液分成两等份,溶质的质量分数不变。若要使溶液的溶质质量分数减小一半,稀释前后溶液中溶质的质量相等。可设加入的水的质量为x,则40
g×10%=(x+40
g)×5%
,解之可得,x=40
g。同样,若增大一倍,可设加入的食盐质量是y,则40
g×10%+y=(40
g+y)×20%,解之可得,y=5
g。
答案:10% 40 5
9解析:加2
700
g水漂洗,则溶液的总质量=2
700
g+100
g=2
800
g
此时溶质质量分数=×100%
“拧干”后剩余洗涤剂质量为:100g
××100%=
g。
对于方法二,可用此方法依次解出答案。
答案:1 1/28 1/10 1/100 1/1
000 将水分成三份,分三次漂洗效果好
第二课时
1答案:A
2答案:C
3解析:配制1
000
g
0.5%的高锰酸钾溶液,需要高锰酸钾的质量是1
000
g×0.5%=5
g;水的质量是1
000
g-5
g=995
g
。
答案:C
4解析:蒸发溶剂或者是增加溶质都会使溶液中溶质的质量分数增大,因此A、C不符合要求。而加入同溶质同质量分数的溶液,无论加入的溶液质量是多少,混合后的溶液中溶质质量分数不变,因此B不符合题意。
答案:D
5解析:向稀硫酸中加入足量的锌粒,纯H2SO4的质量逐渐减小,待反应完毕后,质量成为0,因此A错误。反应过程中溶液的质量逐渐增大,当反应完毕后,溶液的质量不再发生改变,故B错误。而生成氢气和硫酸锌的质量变化情况与溶液质量变化情况类似,因此C正确,而D错误。
答案:C
6解析:计算可得,“配制50
g溶质质量分数为5%的食盐溶液”需要食盐是50
g×5%=2.5
g
,需要水的质量是47.5
g
。在称量时砝码放在左盘,食盐放在右盘,则所称取的食盐的实际质量是2
g-0.5
g=1.5
g;量取水时仰视读数,则量取的实际体积就大于47.5
mL。错误的操作就造成了溶剂的量增加,而溶质的质量减少,因此,配制的食盐溶液的质量分数要小于5%。
答案:C
7解析:由题意可知,一个乙醇分子中含有6个氢原子,则所对应的水分子中也应该是6个氢原子,因此溶液可以看作是n个乙醇分子对应3n个水分子构成的。因此溶液的质量应该是46n+3n×18=100n,溶液中溶质的质量分数是46n/100n×100%=46%。
答案:C
8解析:由表格中的数据可知,浓硫酸的密度随溶质质量分数的增大而增大,氨水的密度随溶质质量分数的增大而减小。质量分数为28%的硫酸加入等质量水,则加水后的溶质的质量分数变成14%,必大于12%的硫酸的密度,即大于1.08
g·mL-1,故A错误。若24%的硫酸溶液加入等质量的水,则溶质质量分数等于12%,密度应是1.08
g·mL-1,故B正确。同理,C、D的说法也是正确的。
答案:A
9解析:“反应后所得溶液是ZnSO4溶液,要求出ZnSO4溶液中溶质的质量分数,要先根据13
g锌求得生成的硫酸锌的质量,再根据反应前总质量-生成的氢气的质量,即可求得反应后溶液的质量,最后求得溶液中溶质的质量分数。
答案:设生成的硫酸锌的质量为x,氢气的质量为y。
Zn+H2SO4===ZnSO4+H2↑
65
161
2
13
g
x
y
65/161=13
g/x 65/2=13
g/y
x=32.2
g y=0.4
g
反应后所得溶液的质量为100
g+13
g-0.4
g=112.6
g
反应后所得溶液中溶质的质量分数为32.2
g/112.6
g×100%=28.6%
答:100
g某硫酸溶液恰好与13
g锌完全反应,反应后所得溶液中溶质的质量分数为28.6%。
10解析:将5
g氢氧化钠溶解在50
g
12%
的氢氧化钠溶液中,混合后的溶液中溶质质量等于混合前溶液中溶质质量与新增加的溶质质量之和。利用第(1)中所求得的结果计算出参加反应的氢氧化钠的质量,从而求得参与反应的HCl的质量以及该盐酸的溶质质量分数。
答案:(1)(5
g+50
g×12%)/(50
g+5
g)×100%=20%
(2)参与反应的NaOH的质量为10
g×20%=2
g
设盐酸中溶质的质量是x,则
NaOH+HCl===NaCl+H2O
40
36.5
2
g
x
40∶36.5=2
g∶x
x=1.825
g
则该盐酸中溶质的质量分数是1.825
g/18.25
g×100%=10%
答:略
