空气与氧气(空气中氧气含量测定实验的探究)
文档属性
| 名称 | 空气与氧气(空气中氧气含量测定实验的探究) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2016-11-20 00:00:00 | ||
图片预览




文档简介
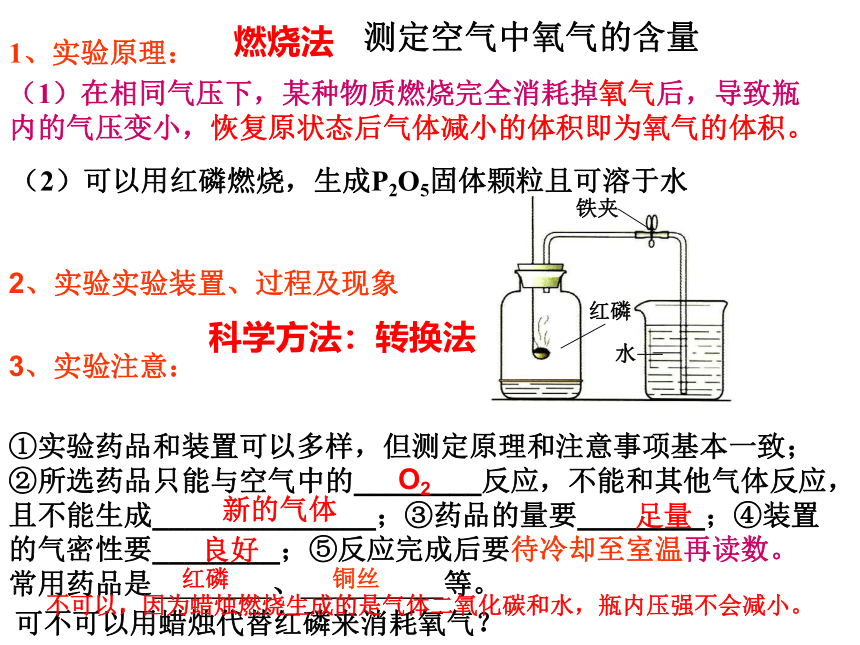
课件20张PPT。 空气中氧气含量测定实验 的探究1、实验原理:(1)在相同气压下,某种物质燃烧完全消耗掉氧气后,导致瓶内的气压变小,恢复原状态后气体减小的体积即为氧气的体积。(2)可以用红磷燃烧,生成P2O5固体颗粒且可溶于水测定空气中氧气的含量2、实验实验装置、过程及现象①实验药品和装置可以多样,但测定原理和注意事项基本一致;②所选药品只能与空气中的________反应,不能和其他气体反应,且不能生成______________;③药品的量要________;④装置的气密性要________;⑤反应完成后要待冷却至室温再读数。
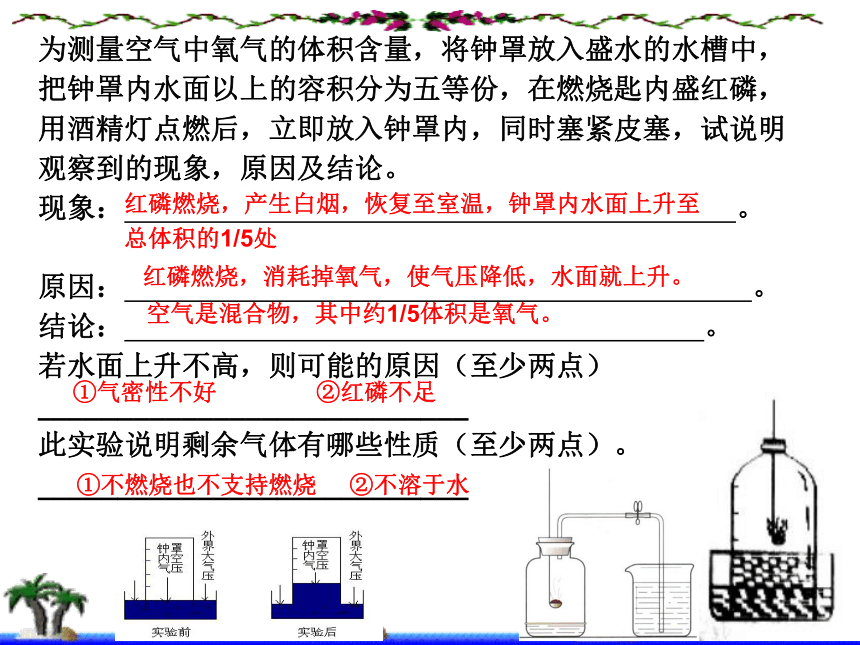
常用药品是 、 等。 O2 新的气体 足量 良好 3、实验注意:红磷 铜丝 燃烧法科学方法:转换法可不可以用蜡烛代替红磷来消耗氧气?不可以,因为蜡烛燃烧生成的是气体二氧化碳和水,瓶内压强不会减小。为测量空气中氧气的体积含量,将钟罩放入盛水的水槽中,把钟罩内水面以上的容积分为五等份,在燃烧匙内盛红磷,用酒精灯点燃后,立即放入钟罩内,同时塞紧皮塞,试说明观察到的现象,原因及结论。
现象: 。
原因: 。
结论: 。
若水面上升不高,则可能的原因(至少两点)
___________________________
此实验说明剩余气体有哪些性质(至少两点)。
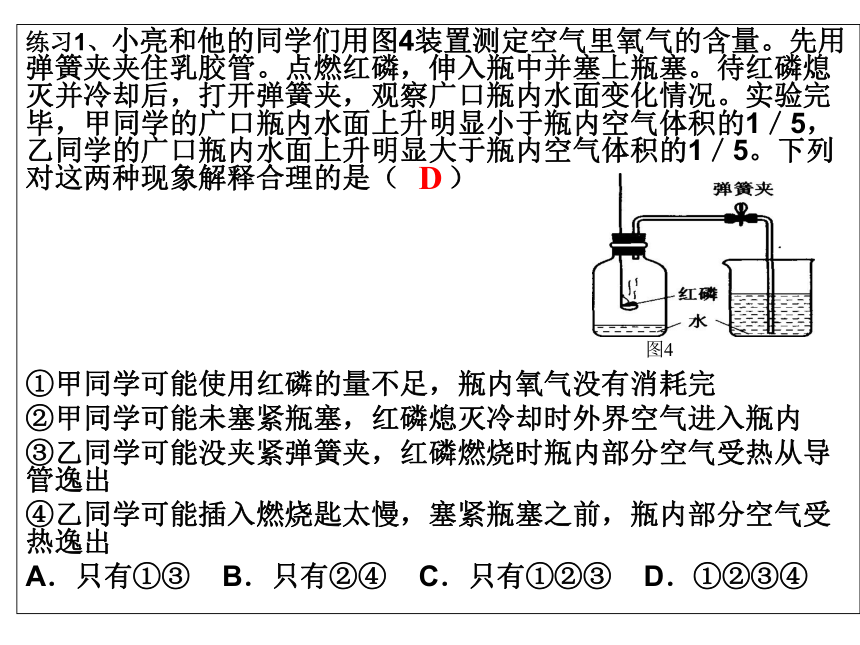
___________________________红磷燃烧,产生白烟,恢复至室温,钟罩内水面上升至总体积的1/5处红磷燃烧,消耗掉氧气,使气压降低,水面就上升。空气是混合物,其中约1/5体积是氧气。①气密性不好 ②红磷不足①不燃烧也不支持燃烧 ②不溶于水练习1、小亮和他的同学们用图4装置测定空气里氧气的含量。先用弹簧夹夹住乳胶管。点燃红磷,伸入瓶中并塞上瓶塞。待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是( )
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A.只有①③ B.只有②④ C.只有①②③ D.①②③④D
图4空气中氧气含量测定实验考什么?1、药品、器材的选择
2、关键步骤
3、关键操作及原因解释
4、关键现象的观察和记录
5、实验思想方法(控制变量法、转换法、如何重复实验---)
6、实验数据的分析处理
7、结论及应用
8、异常现象的解释
9、误差分析
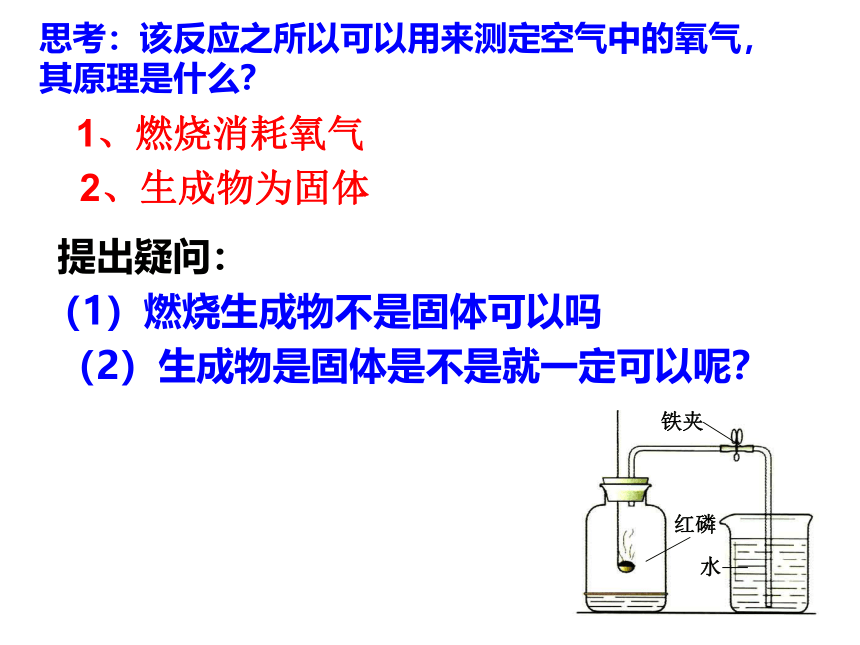
10、实验改进及评价思考:该反应之所以可以用来测定空气中的氧气,其原理是什么?1、燃烧消耗氧气2、生成物为固体 (1)燃烧生成物不是固体可以吗提出疑问:(2)生成物是固体是不是就一定可以呢?影响测定结果的因素:红磷的用量
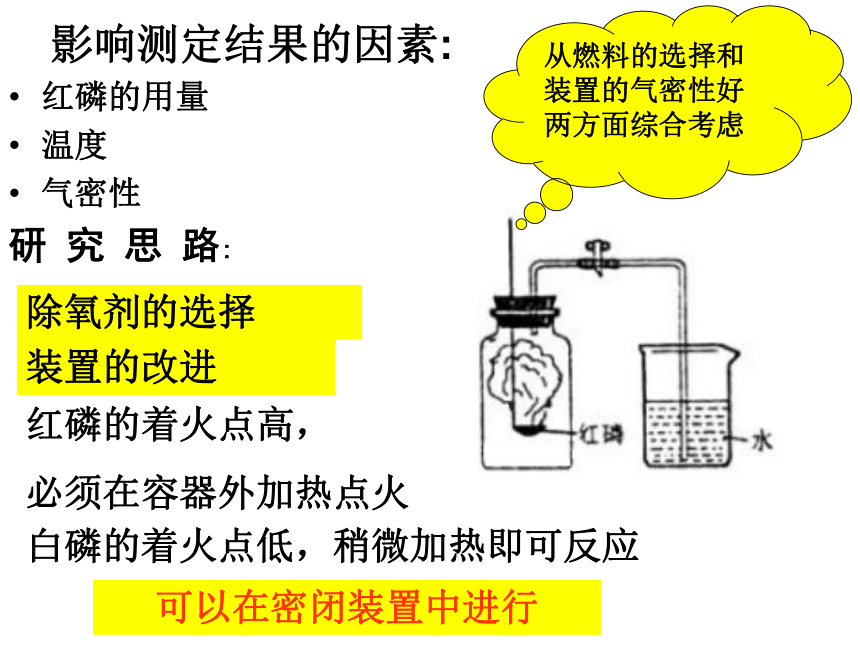
温度
气密性
研 究 思 路:除氧剂的选择装置的改进从燃料的选择和装置的气密性好两方面综合考虑白磷的着火点低,稍微加热即可反应红磷的着火点高,
必须在容器外加热点火可以在密闭装置中进行再探究一、对燃烧生成物不是固体的进行探究常见的物质有:木炭、蜡烛、硫磺,请同学们就这几个物质讨论分析,是否可以用于测定氧气含量,如可以如何设计实验。以硫磺作为实验对象,演示实验。S + O2=SO2点燃反应生成气体
需要用碱性溶液来吸收选择除氧剂碳C + O2= CO2点燃燃烧后会生成气态二氧化碳
需要用碱性液体对二氧化碳进行吸收若碳过量的话,碳与氧气反应会生成一氧化碳选择除氧剂蜡烛蜡烛 +氧气→二氧化碳 + 水点燃燃烧后会生成气态二氧化碳
所以我们需要用碱性液体对二氧化碳进行吸收事先在容器内加入10ml的氢氧化钠溶液选择除氧剂再探究二、对燃烧生成物是固体的进行探究可供选择的物质有:铁丝,铝箔补充的物质有:白磷,化学性质与红磷相似,燃烧生成P2O5;镁条,可直接在空气中燃烧,生成物也是固体讨论分析:上述物质可否用来测定氧气含量?镁条实验演示根据实验现象思考:燃烧生成固体的,还需要考虑什么因素?选择除氧剂镁2Mg + O2= 2MgO点燃3Mg + N2= Mg3N2点燃2Mg + CO2= 2MgO + C点燃选择除氧剂铁3Fe + O2= Fe3O4点燃铁在空气中缓慢氧化变成铁锈反应在纯氧中进行
选择除氧剂铜、 钠、钾2Cu+O2=2CuO
4Na +O2=2Na2O
4K +O2=2K2O加热将铜、钠、钾预先放在试管中,塞紧塞子后加热。
实验装置要密闭选择除氧剂空气中氧气含量测定试剂总结C、S可以代替红磷(集气瓶底部必须放入氢氧化钠溶液吸收生成的SO2、CO2)
Fe不能代替红磷(Fe在空气中不能燃烧)
Mg不能代替红磷( Mg会与其他气体反应)小结:选择什么药品用来测定空气中氧气的含量,要综合考虑那些因素?1、要能和氧气发生燃烧2、生成物最好是固体,如果是气体要能被吸收。3、不能和空气中的其他成分发生反应分析装置的容量小,受热气体容易膨胀,导致误差偏大 反应过程中当氧气的浓度下降到不 能支持可燃物燃烧时,反应也就终止了,导致结果偏小。
实验装置的再设计请你选用上述可以用的药品,设计一个更好的装置,并简单说明设计的理由。讨论分析:上述选用的装置用哪些不足之处?请指出来。不需要加热,节约能源,装置密封,误差小。 一些测定氧气含量的装置,说出它的优缺点 图3 图2、图3的优点:
。实验的改进及评价足量白磷
电阻丝空气中氧气含量测定仪器总结空气中氧气含量测定实验的原料选择和装置设计探究青铜峡市第四中学 闫淑梅使反应物充分反应20.7% 节能、 装置简单、气密性好等实验数据的分析处理实验改进及评价空气中氧气含量测定实验考什么?1、药品、器材的选择
2、关键步骤
3、关键操作及原因解释
4、关键现象的观察和记录
5、实验思想方法(控制变量法、转换法、如何重复实验---)
6、实验数据的分析处理
7、结论及应用
8、异常现象的解释
9、误差分析
10、实验改进及评价本节课你学到了什么?你的收获?
常用药品是 、 等。 O2 新的气体 足量 良好 3、实验注意:红磷 铜丝 燃烧法科学方法:转换法可不可以用蜡烛代替红磷来消耗氧气?不可以,因为蜡烛燃烧生成的是气体二氧化碳和水,瓶内压强不会减小。为测量空气中氧气的体积含量,将钟罩放入盛水的水槽中,把钟罩内水面以上的容积分为五等份,在燃烧匙内盛红磷,用酒精灯点燃后,立即放入钟罩内,同时塞紧皮塞,试说明观察到的现象,原因及结论。
现象: 。
原因: 。
结论: 。
若水面上升不高,则可能的原因(至少两点)
___________________________
此实验说明剩余气体有哪些性质(至少两点)。
___________________________红磷燃烧,产生白烟,恢复至室温,钟罩内水面上升至总体积的1/5处红磷燃烧,消耗掉氧气,使气压降低,水面就上升。空气是混合物,其中约1/5体积是氧气。①气密性不好 ②红磷不足①不燃烧也不支持燃烧 ②不溶于水练习1、小亮和他的同学们用图4装置测定空气里氧气的含量。先用弹簧夹夹住乳胶管。点燃红磷,伸入瓶中并塞上瓶塞。待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是( )
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A.只有①③ B.只有②④ C.只有①②③ D.①②③④D
图4空气中氧气含量测定实验考什么?1、药品、器材的选择
2、关键步骤
3、关键操作及原因解释
4、关键现象的观察和记录
5、实验思想方法(控制变量法、转换法、如何重复实验---)
6、实验数据的分析处理
7、结论及应用
8、异常现象的解释
9、误差分析
10、实验改进及评价思考:该反应之所以可以用来测定空气中的氧气,其原理是什么?1、燃烧消耗氧气2、生成物为固体 (1)燃烧生成物不是固体可以吗提出疑问:(2)生成物是固体是不是就一定可以呢?影响测定结果的因素:红磷的用量
温度
气密性
研 究 思 路:除氧剂的选择装置的改进从燃料的选择和装置的气密性好两方面综合考虑白磷的着火点低,稍微加热即可反应红磷的着火点高,
必须在容器外加热点火可以在密闭装置中进行再探究一、对燃烧生成物不是固体的进行探究常见的物质有:木炭、蜡烛、硫磺,请同学们就这几个物质讨论分析,是否可以用于测定氧气含量,如可以如何设计实验。以硫磺作为实验对象,演示实验。S + O2=SO2点燃反应生成气体
需要用碱性溶液来吸收选择除氧剂碳C + O2= CO2点燃燃烧后会生成气态二氧化碳
需要用碱性液体对二氧化碳进行吸收若碳过量的话,碳与氧气反应会生成一氧化碳选择除氧剂蜡烛蜡烛 +氧气→二氧化碳 + 水点燃燃烧后会生成气态二氧化碳
所以我们需要用碱性液体对二氧化碳进行吸收事先在容器内加入10ml的氢氧化钠溶液选择除氧剂再探究二、对燃烧生成物是固体的进行探究可供选择的物质有:铁丝,铝箔补充的物质有:白磷,化学性质与红磷相似,燃烧生成P2O5;镁条,可直接在空气中燃烧,生成物也是固体讨论分析:上述物质可否用来测定氧气含量?镁条实验演示根据实验现象思考:燃烧生成固体的,还需要考虑什么因素?选择除氧剂镁2Mg + O2= 2MgO点燃3Mg + N2= Mg3N2点燃2Mg + CO2= 2MgO + C点燃选择除氧剂铁3Fe + O2= Fe3O4点燃铁在空气中缓慢氧化变成铁锈反应在纯氧中进行
选择除氧剂铜、 钠、钾2Cu+O2=2CuO
4Na +O2=2Na2O
4K +O2=2K2O加热将铜、钠、钾预先放在试管中,塞紧塞子后加热。
实验装置要密闭选择除氧剂空气中氧气含量测定试剂总结C、S可以代替红磷(集气瓶底部必须放入氢氧化钠溶液吸收生成的SO2、CO2)
Fe不能代替红磷(Fe在空气中不能燃烧)
Mg不能代替红磷( Mg会与其他气体反应)小结:选择什么药品用来测定空气中氧气的含量,要综合考虑那些因素?1、要能和氧气发生燃烧2、生成物最好是固体,如果是气体要能被吸收。3、不能和空气中的其他成分发生反应分析装置的容量小,受热气体容易膨胀,导致误差偏大 反应过程中当氧气的浓度下降到不 能支持可燃物燃烧时,反应也就终止了,导致结果偏小。
实验装置的再设计请你选用上述可以用的药品,设计一个更好的装置,并简单说明设计的理由。讨论分析:上述选用的装置用哪些不足之处?请指出来。不需要加热,节约能源,装置密封,误差小。 一些测定氧气含量的装置,说出它的优缺点 图3 图2、图3的优点:
。实验的改进及评价足量白磷
电阻丝空气中氧气含量测定仪器总结空气中氧气含量测定实验的原料选择和装置设计探究青铜峡市第四中学 闫淑梅使反应物充分反应20.7% 节能、 装置简单、气密性好等实验数据的分析处理实验改进及评价空气中氧气含量测定实验考什么?1、药品、器材的选择
2、关键步骤
3、关键操作及原因解释
4、关键现象的观察和记录
5、实验思想方法(控制变量法、转换法、如何重复实验---)
6、实验数据的分析处理
7、结论及应用
8、异常现象的解释
9、误差分析
10、实验改进及评价本节课你学到了什么?你的收获?
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
