1.1化工生产过程中的基本问题 学案(含答案) (2)
文档属性
| 名称 | 1.1化工生产过程中的基本问题 学案(含答案) (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 39.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-06 00:00:00 | ||
图片预览


文档简介
1.1化工生产过程中的基本问题
学案
【学习目标】
1.依据化学反应原理知识,了解生产硫酸的基本流程。
2.了解硫酸工业生产中原料、厂址和规模的选择。
3.了解硫酸生产过程中反应条件的控制。
4.了解化学科学实验与化工生产的区别。
【重点难点】
1.化工生产过程中的基本问题。
2.工业制硫酸的生产原理。
课前预习
【情景材料】化工生产过程比较复杂,但一些最基本的问题是相似的,例如,任何化工生产都涉及到传质(物料的流动)、传热(能员的传导)、传动(动力的传输)和化学反应器等。根据课程标准的要求,将化学反应原理、反应发生的条件、原料的选择、三废的处理和能量的利用等作为化工生产过程中的基本问题,结合一些典型产品的生产过程,使学生对化工生产的基本过程有一个初步的认识。
【预习内容】
根据教材有关内容填写下列空白:
依据化学反应原理确定生产过程
1.工业制备硫酸,要从以下几个方面考虑
(1)采用的原料应该是自然界中的含___________物质,如_____________、_______________。
(2)生产过程中,要先使硫元素转化成_______________,再把_____________转化成
________________,再与水反应制得___________________。
2.工业制硫酸主要分______________、_________________
、__________________
个阶段
(1)以S为原料制备SO2
化学反应方程式
______________________
,(属_____________
反应)
(2)利用催化氧化反庇将SO2氧化成SO3
化学反应方程式__________________,(属______________反应)
(3)三氧化硫转化成硫酸
化学反应方程式_______________,(属_________________反应)
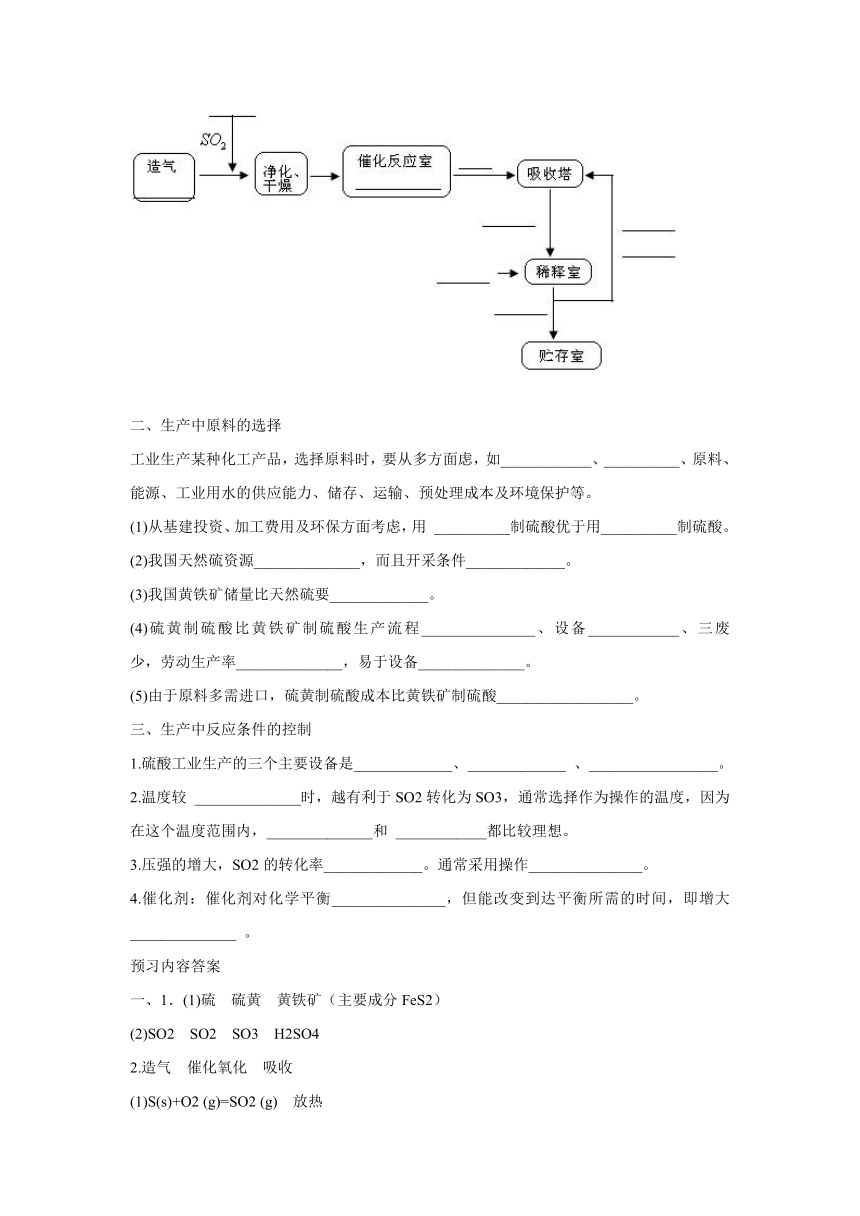
3.工业制硫酸主要生产流程
二、生产中原料的选择
工业生产某种化工产品,选择原料时,要从多方面虑,如____________、__________、原料、能源、工业用水的供应能力、储存、运输、预处理成本及环境保护等。
(1)从基建投资、加工费用及环保方面考虑,用
__________制硫酸优于用__________制硫酸。
(2)我国天然硫资源______________,而且开采条件_____________。
(3)我国黄铁矿储量比天然硫要_____________。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程_______________、设备____________、三废
少,劳动生产率______________,易于设备______________。
(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸__________________。
三、生产中反应条件的控制
1.硫酸工业生产的三个主要设备是_____________、_____________
、_________________。
2.温度较
______________时,越有利于SO2转化为SO3,通常选择作为操作的温度,因为在这个温度范围内,______________和
____________都比较理想。
3.压强的增大,SO2的转化率_____________。通常采用操作_______________。
4.催化剂:催化剂对化学平衡_______________,但能改变到达平衡所需的时间,即增大
______________
。
预习内容答案
一、1.(1)硫
硫黄
黄铁矿(主要成分FeS2)
(2)SO2
SO2
SO3
H2SO4
2.造气
催化氧化
吸收
(1)S(s)+O2
(g)=SO2
(g)
放热
(2)2SO2
(g)+
O2
(g)
2SO3(g)
放热
(3)SO3(g)+H2O(l)=H2SO4(1)
放热
3.空气
制SO2
400~500℃
常压、催化剂
SO3
发烟硫酸
水
98%硫酸
98%硫酸
二、化学反应原理
厂址选择
(1)硫黄
黄铁矿
(2)缺乏
比较复杂
(3)大
(4)短
简单
治理量
高
大型化
(5)高
三、1.沸腾炉
接触室
吸收塔
2.低
400~500℃
反应速率
二氧化硫的转化率
3.变化不大
常压
4.没有影响
化学反应速率
课堂互动
【问题探究1】对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。请结合课本写出关于工业制硫酸的反应原理和过程?
【教师点拨】掌握七个“三”,即“三阶段”、“三原料”、“三反应”、“三设备”、“三杂质”、“三净化”、“三原理”。
分析解答:化工生产是以化学反应原理为依据,以实验室研究为基础的。任何生产的完成都要符合化学反应规律。
【即学即练1】在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
1.B【解析】本题考查化工生产中的技术处理问题。可从化学反应速率、化学平衡移动及实际生产三个方面考虑各种操作条件的原因。矿石粉碎是为了提高反应速率,并不是因为大块的硫铁矿不能燃烧;用浓硫酸吸收SO3是为了防止水与其形成酸雾;使用催化剂可以提高反应速率,但不能提高SO2的转化率;从沸腾炉出来的炉气需净化,因为炉气中杂质会使催化剂中毒。
【问题探究2】阅读P6表1-1,结合二氧化硫催化氧化的反应特点:是否温度越低越有利于SO2
转化为SO3
?阅读P6表1-2,分析随压强的增大,SO2的转化率怎么改变?是否压强越高越好
【教师点拨】反应方程式2SO2(g)+O2(g)
2SO3(g),属放热的可逆反应,气体体积减少的反应,从化学平衡的角度解释。工业生产中压强的选择,往往还要考虑成本和能量消耗等问题。
分析解答:根据外界条件对化学反应速率和化学平衡影响的规律,选择化工生产的适宜条件时,既要注意外界条件对二者影响的一致性,又要注意对二者影响的矛盾性;既要注意温度、催化剂对化学反应速率影响的一致性,又要注意催化剂的活性对温度的限制;既要注意理论生产,又要注意实际可能性。
【即学即练2】已知,在硫酸工业中,
①SO2转化为SO3的反应为:2SO2
+
O2
2SO3
△H<0。
②经测定,在常压下上述反应的平衡混合气体中,SO2的体积分数为91%。
③催化剂V2O5的催化效率f与温度T有如图所示的关系。
④经除尘除杂后的SO2气体的温度约为200℃,反应后SO3气体温度约为600℃。
请根据以上信息,选择SO2催化氧化的适宜条件。
2.SO2氧化过程的适宜条件为:①氧气或空气适当过量;②常压;③450℃~500℃;
④使用热交换器。
【解析】由①及化学平衡原理,加压有利于SO2的转化,但由②知,常压下SO2的转化率已很高,因转化率的上升空间较小,故不必再来取加压措施,以省掉加压泵的开支和降低接触室的造价。观察催化剂的催化效率与温度关系图知,450℃以后催化效率基本不变,升温有利于提高反应速率,但不利于SO2转化,故反应温度控制在450℃~500℃为宜。除尘后SO2温度低,不利于SO2氧化反应的进行,生成的SO3温度高,不利于SO3的吸收,解决这一问题的方法是使用热交换器。
【问题探究3】二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)
1.请用平衡移动原理来解释:为什么降低温度和增大压强有利于提高转化率?
2.如果其他条件不变,分别改变下列条件,将对化学平衡有什么影响?
(1)增大O2的浓度;(2)减小SO3的浓度。
【教师点拨】如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就向能减弱这种改变的方向移动。催化剂能同等程度地增加正反应速率和逆反应速率,因此对化学平衡没有影响,但能改变到达平衡所需的时间。
分析解答:①浓度对化学平衡的影响,增大生成物的浓度或减小反应物的浓度时,平衡向逆反应方向移动。
②在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
(2)压强对化学平衡的影响,一般规律:对于有气体参加且反应前后气体体积不相等的可逆反应,在其他条件不变的情况下,若增大压强(即相当于缩小容器的体积),则平衡向气体总体积减小的方向移动,若减小压强(即增大容器的体积),则平衡向气体总体积增大的方向移动。
【即学即练3】有关接触法制硫酸的叙述不正确的是(
)。
A.硫黄和硫铁矿均可作为生产原料
B.将矿石粉碎,是为了提高反应速率
C.反应中通入过量的空气是为了提高FeS2和和SO2的转化率
D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸
3.D【解析】A项,理论上,可转化成SO2的任何含硫物质均可作为硫酸的生产原料,(如S、FeS、FeS2、H2S等),但在生产实践中,应选取那些储量大、矿质品位高、资源丰富、便于开采和加工的矿物作为化工原料,综合分析,A正确。B项,生产中对矿石进行粉碎,既可增大原料之间的相对接触面积(增大反应速率),又可提高原料的利用率(转化率),故B正确。C项,从硫酸生产的三个反应看(FeS2→SO2→SO3→H2SO4,有两个反应要耗用氧气,故生产中可采用通入过量空气的方法来提高FeS2和SO2的转化率,故C正确。D项,在吸收塔中,是用98%的浓硫酸吸收SO3的,所得到发烟硫酸,可用水或稀硫酸稀释,制得各种浓度的硫酸,故D错误。
学案
【学习目标】
1.依据化学反应原理知识,了解生产硫酸的基本流程。
2.了解硫酸工业生产中原料、厂址和规模的选择。
3.了解硫酸生产过程中反应条件的控制。
4.了解化学科学实验与化工生产的区别。
【重点难点】
1.化工生产过程中的基本问题。
2.工业制硫酸的生产原理。
课前预习
【情景材料】化工生产过程比较复杂,但一些最基本的问题是相似的,例如,任何化工生产都涉及到传质(物料的流动)、传热(能员的传导)、传动(动力的传输)和化学反应器等。根据课程标准的要求,将化学反应原理、反应发生的条件、原料的选择、三废的处理和能量的利用等作为化工生产过程中的基本问题,结合一些典型产品的生产过程,使学生对化工生产的基本过程有一个初步的认识。
【预习内容】
根据教材有关内容填写下列空白:
依据化学反应原理确定生产过程
1.工业制备硫酸,要从以下几个方面考虑
(1)采用的原料应该是自然界中的含___________物质,如_____________、_______________。
(2)生产过程中,要先使硫元素转化成_______________,再把_____________转化成
________________,再与水反应制得___________________。
2.工业制硫酸主要分______________、_________________
、__________________
个阶段
(1)以S为原料制备SO2
化学反应方程式
______________________
,(属_____________
反应)
(2)利用催化氧化反庇将SO2氧化成SO3
化学反应方程式__________________,(属______________反应)
(3)三氧化硫转化成硫酸
化学反应方程式_______________,(属_________________反应)
3.工业制硫酸主要生产流程
二、生产中原料的选择
工业生产某种化工产品,选择原料时,要从多方面虑,如____________、__________、原料、能源、工业用水的供应能力、储存、运输、预处理成本及环境保护等。
(1)从基建投资、加工费用及环保方面考虑,用
__________制硫酸优于用__________制硫酸。
(2)我国天然硫资源______________,而且开采条件_____________。
(3)我国黄铁矿储量比天然硫要_____________。
(4)硫黄制硫酸比黄铁矿制硫酸生产流程_______________、设备____________、三废
少,劳动生产率______________,易于设备______________。
(5)由于原料多需进口,硫黄制硫酸成本比黄铁矿制硫酸__________________。
三、生产中反应条件的控制
1.硫酸工业生产的三个主要设备是_____________、_____________
、_________________。
2.温度较
______________时,越有利于SO2转化为SO3,通常选择作为操作的温度,因为在这个温度范围内,______________和
____________都比较理想。
3.压强的增大,SO2的转化率_____________。通常采用操作_______________。
4.催化剂:催化剂对化学平衡_______________,但能改变到达平衡所需的时间,即增大
______________
。
预习内容答案
一、1.(1)硫
硫黄
黄铁矿(主要成分FeS2)
(2)SO2
SO2
SO3
H2SO4
2.造气
催化氧化
吸收
(1)S(s)+O2
(g)=SO2
(g)
放热
(2)2SO2
(g)+
O2
(g)
2SO3(g)
放热
(3)SO3(g)+H2O(l)=H2SO4(1)
放热
3.空气
制SO2
400~500℃
常压、催化剂
SO3
发烟硫酸
水
98%硫酸
98%硫酸
二、化学反应原理
厂址选择
(1)硫黄
黄铁矿
(2)缺乏
比较复杂
(3)大
(4)短
简单
治理量
高
大型化
(5)高
三、1.沸腾炉
接触室
吸收塔
2.低
400~500℃
反应速率
二氧化硫的转化率
3.变化不大
常压
4.没有影响
化学反应速率
课堂互动
【问题探究1】对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。请结合课本写出关于工业制硫酸的反应原理和过程?
【教师点拨】掌握七个“三”,即“三阶段”、“三原料”、“三反应”、“三设备”、“三杂质”、“三净化”、“三原理”。
分析解答:化工生产是以化学反应原理为依据,以实验室研究为基础的。任何生产的完成都要符合化学反应规律。
【即学即练1】在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
1.B【解析】本题考查化工生产中的技术处理问题。可从化学反应速率、化学平衡移动及实际生产三个方面考虑各种操作条件的原因。矿石粉碎是为了提高反应速率,并不是因为大块的硫铁矿不能燃烧;用浓硫酸吸收SO3是为了防止水与其形成酸雾;使用催化剂可以提高反应速率,但不能提高SO2的转化率;从沸腾炉出来的炉气需净化,因为炉气中杂质会使催化剂中毒。
【问题探究2】阅读P6表1-1,结合二氧化硫催化氧化的反应特点:是否温度越低越有利于SO2
转化为SO3
?阅读P6表1-2,分析随压强的增大,SO2的转化率怎么改变?是否压强越高越好
【教师点拨】反应方程式2SO2(g)+O2(g)
2SO3(g),属放热的可逆反应,气体体积减少的反应,从化学平衡的角度解释。工业生产中压强的选择,往往还要考虑成本和能量消耗等问题。
分析解答:根据外界条件对化学反应速率和化学平衡影响的规律,选择化工生产的适宜条件时,既要注意外界条件对二者影响的一致性,又要注意对二者影响的矛盾性;既要注意温度、催化剂对化学反应速率影响的一致性,又要注意催化剂的活性对温度的限制;既要注意理论生产,又要注意实际可能性。
【即学即练2】已知,在硫酸工业中,
①SO2转化为SO3的反应为:2SO2
+
O2
2SO3
△H<0。
②经测定,在常压下上述反应的平衡混合气体中,SO2的体积分数为91%。
③催化剂V2O5的催化效率f与温度T有如图所示的关系。
④经除尘除杂后的SO2气体的温度约为200℃,反应后SO3气体温度约为600℃。
请根据以上信息,选择SO2催化氧化的适宜条件。
2.SO2氧化过程的适宜条件为:①氧气或空气适当过量;②常压;③450℃~500℃;
④使用热交换器。
【解析】由①及化学平衡原理,加压有利于SO2的转化,但由②知,常压下SO2的转化率已很高,因转化率的上升空间较小,故不必再来取加压措施,以省掉加压泵的开支和降低接触室的造价。观察催化剂的催化效率与温度关系图知,450℃以后催化效率基本不变,升温有利于提高反应速率,但不利于SO2转化,故反应温度控制在450℃~500℃为宜。除尘后SO2温度低,不利于SO2氧化反应的进行,生成的SO3温度高,不利于SO3的吸收,解决这一问题的方法是使用热交换器。
【问题探究3】二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)
1.请用平衡移动原理来解释:为什么降低温度和增大压强有利于提高转化率?
2.如果其他条件不变,分别改变下列条件,将对化学平衡有什么影响?
(1)增大O2的浓度;(2)减小SO3的浓度。
【教师点拨】如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就向能减弱这种改变的方向移动。催化剂能同等程度地增加正反应速率和逆反应速率,因此对化学平衡没有影响,但能改变到达平衡所需的时间。
分析解答:①浓度对化学平衡的影响,增大生成物的浓度或减小反应物的浓度时,平衡向逆反应方向移动。
②在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
(2)压强对化学平衡的影响,一般规律:对于有气体参加且反应前后气体体积不相等的可逆反应,在其他条件不变的情况下,若增大压强(即相当于缩小容器的体积),则平衡向气体总体积减小的方向移动,若减小压强(即增大容器的体积),则平衡向气体总体积增大的方向移动。
【即学即练3】有关接触法制硫酸的叙述不正确的是(
)。
A.硫黄和硫铁矿均可作为生产原料
B.将矿石粉碎,是为了提高反应速率
C.反应中通入过量的空气是为了提高FeS2和和SO2的转化率
D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸
3.D【解析】A项,理论上,可转化成SO2的任何含硫物质均可作为硫酸的生产原料,(如S、FeS、FeS2、H2S等),但在生产实践中,应选取那些储量大、矿质品位高、资源丰富、便于开采和加工的矿物作为化工原料,综合分析,A正确。B项,生产中对矿石进行粉碎,既可增大原料之间的相对接触面积(增大反应速率),又可提高原料的利用率(转化率),故B正确。C项,从硫酸生产的三个反应看(FeS2→SO2→SO3→H2SO4,有两个反应要耗用氧气,故生产中可采用通入过量空气的方法来提高FeS2和SO2的转化率,故C正确。D项,在吸收塔中,是用98%的浓硫酸吸收SO3的,所得到发烟硫酸,可用水或稀硫酸稀释,制得各种浓度的硫酸,故D错误。
