2016-2017学年高一化学必修2学案:(鲁科版)第1章-第3节元素周期表的应用-第2课时 含解析
文档属性
| 名称 | 2016-2017学年高一化学必修2学案:(鲁科版)第1章-第3节元素周期表的应用-第2课时 含解析 |
|
|
| 格式 | zip | ||
| 文件大小 | 337.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-14 00:00:00 | ||
图片预览




文档简介
第2课时 预测同主族元素的性质
1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。 重点
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.掌握由同主族元素的性质特点预测不熟悉元素的性质。 难点
4.了解元素周期表的应用。
同 主 族 元 素 的 性 质
基础·初探]
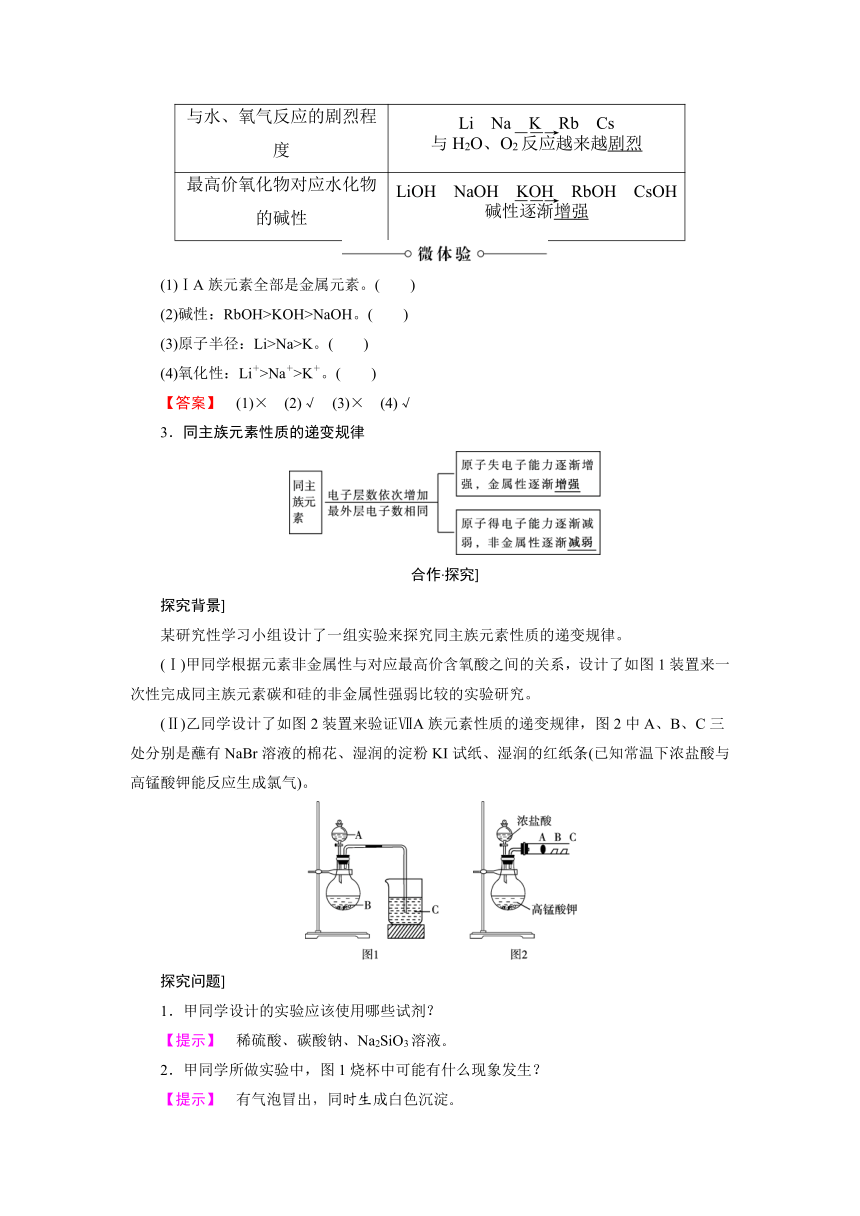
1.卤族元素原子结构和性质的相似性和递变性
(1)相似性
元素 F Cl Br I
原子结构示意图
最外层电子数 均为7
最高化合价 0 均为+7
最低化合价 均为-1
气态氢化物 HF HCl HBr HI
最高价氧化物的水化物 无 HClO4(强酸) HBrO4(强酸) HIO4(强酸)
(2)单质的物理性质及递变性
单质物理性质 F2 Cl2 Br2 I2
颜色 浅黄绿色 黄绿色 深红棕色 紫黑色
状态 气体 气体 液体 固体
密度 逐渐增大
熔、沸点 逐渐升高
(3)结构及化学性质的递变性
结构及性质 规律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
最高价氧化物对应水化物的酸性
(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大。( )
(2)卤素单质都是有色物质。( )
(3)HCl、HBr、HI的还原性依次减弱。( )
(4)卤族元素的单质越活泼,其熔点和沸点就越高。( )
【答案】 (1)× (2)√ (3)× (4)×
2.碱金属元素原子结构和性质的相似性与递变性
(1)相似性
①原子的最外电子层都有1个电子。
②最高化合价均为+1价。
③都是活泼的金属元素,单质都能与氧气、水等物质发生反应。
④最高价氧化物对应的水化物一般具有很强的碱性。
(2)递变性
结构及性质 规律
原子半径
单质的还原性
与水、氧气反应的剧烈程度
最高价氧化物对应水化物的碱性
(1)ⅠA族元素全部是金属元素。( )
(2)碱性:RbOH>KOH>NaOH。( )
(3)原子半径:Li>Na>K。( )
(4)氧化性:Li+>Na+>K+。( )
【答案】 (1)× (2)√ (3)× (4)√
3.同主族元素性质的递变规律
合作·探究]
探究背景]
某研究性学习小组设计了一组实验来探究同主族元素性质的递变规律。
(Ⅰ)甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳和硅的非金属性强弱比较的实验研究。
(Ⅱ)乙同学设计了如图2装置来验证ⅦA族元素性质的递变规律,图2中A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸条(已知常温下浓盐酸与高锰酸钾能反应生成氯气)。
探究问题]
1.甲同学设计的实验应该使用哪些试剂?
【提示】 稀硫酸、碳酸钠、Na2SiO3溶液。
2.甲同学所做实验中,图1烧杯中可能有什么现象发生?
【提示】 有气泡冒出,同时生成白色沉淀。
3.乙同学所做实验中,图2中B处有什么实验现象?
【提示】 湿润的淀粉碘化钾试纸变蓝。
4.试写出图2中A处发生反应的离子方程式。
【提示】 Cl2+2Br-===2Cl-+Br2。
5.通过上述实验可得出同主族元素性质有何递变规律?
【提示】 同主族元素从上到下,元素非金属性逐渐减弱。
核心·突破]
元素周期表中元素性质的变化规律
同周期(从左到右) 同主族(从上到下)
原子半径 逐渐减小 逐渐增大
主要化合价 +1→+7-4→-1 相似(最高正价一般相同)
元素原子的失电子能力 逐渐减弱 逐渐增强
元素原子的得电子能力 逐渐增强 逐渐减弱
单质 氧化性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
离子 阳离子的氧化性 逐渐增强 逐渐减弱
阴离子的还原性 逐渐减弱 逐渐增强
气态氢化物 稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
最高价氧化物对应的水化物 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
题组·冲关]
题组1 卤素性质变化规律
1.下列关于ⅦA族元素的说法中不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.F-、Cl-、Br-、I-的还原性逐渐增强
C.HF、HCl、HBr、HI的热稳定性逐渐减弱
D.HF、HCl、HBr、HI水溶液的酸性逐渐减弱
【解析】 从F到I原子半径逐渐增大,单质的氧化性逐渐减弱,则其对应阴离子的还原性逐渐增强,故A、B两项均正确;从F到I,其气态氢化物的热稳定性逐渐减弱,C项正确;F-半径较小,与H结合稳定,HF在水中难以电离出H+,为弱酸,故酸性强弱关系为HF【答案】 D
2.X、Y是元素周期表ⅦA族中的两种元素,X的非金属性比Y强。则下列叙述中正确的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.X的氢化物水溶液的酸性一定比Y的氢化物的水溶液的酸性强
【解析】 同一主族,自上而下,金属性逐渐增强,非金属性逐渐减弱。不要混淆最高价含氧酸的酸性与氢化物水溶液的酸性,如酸性:HF【答案】 C
3.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A.与H2化合能力:At2>I2
B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹能从NaCl溶液中置换出氯单质
【解析】 从F2到At2,元素的非金属性逐渐减弱,与H2化合能力逐渐减弱,A项不正确;由F2到I2,单质的颜色依次加深,I2是紫黑色固体,则砹为黑色固体,B项不正确;卤族元素的原子,最外层上都有7个电子,C项正确;因氧化性Cl2>At2,所以At2不能从溶液中置换出Cl2,D项不正确。
【答案】 C
题组2 碱金属元素性质变化规律
4.下列各组比较不正确的是( )
A.铯与水的反应现象比钠剧烈
B.还原性:K>Na>Li
C.熔点:Li>Na>K
D.碱性:LiOH>NaOH>KOH
【解析】 铯的活动性比钠强,与水反应比钠更剧烈,甚至会爆炸,A项正确;随着电子层数增多,碱金属的金属性逐渐增强,单质的还原性依次增强,即还原性:K>Na>Li,B项正确;碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs,C项正确;从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物碱性依次增强,即碱性:LiOH【答案】 D
5.(2016·沧州高一检测)关于锂的结构和性质的判断,错误的是( )
①与水反应比钠剧烈 ②原子半径比钠小 ③氧化物暴露于空气易吸收二氧化碳 ④阳离子最外层电子数和钠离子相同 ⑤其单质是强还原剂
A.只有① B.①和④
C.②和③ D.③和⑤
【解析】 Li与Na位于同一主族,但原子序数比Na的小,原子半径比Na的小,金属性比Na的弱,与水反应不如Na剧烈,①错,②对;Li2O是碱性氧化物,能与CO2反应,③对;Li+最外层有2个电子,Na+最外层有8个电子,④错;碱金属元素的单质都是很强的还原剂,⑤对。
【答案】 B
6.某主族元素原子R的第五电子层上只有一个电子。下列描述正确的是( )
A.其单质在常温下与水的反应不如钠剧烈
B.其原子半径比钾离子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解
【解析】 由主族元素原子R的第五电子层上只有一个电子可知:R位于周期表第5周期ⅠA族,为Rb(铷)。由同主族元素性质递变规律可知,Rb的金属性强于Na,故其与水的反应比Na更剧烈;RbOH的碱性强于NaOH,因NaOH可使Al(OH)3溶解,则RbOH也一定能使Al(OH)3溶解;Rb、K同主族,且Rb比K多一个电子层,则Rb的原子半径比K的原子半径大;又Na2CO3、K2CO3均易溶于水,可类推出Rb2CO3也应易溶于水。
【答案】 C
题组3 同周期、同主族元素性质递变规律
7.下列说法正确的是( )
A.同主族元素的原子序数越大非金属性越强
B.同周期主族元素的原子序数越大半径越大
C.同周期主族元素的原子序数越大越易失电子
D.同主族元素的原子序数越大金属性越强
【解析】 同周期元素从左到右、原子半径逐渐减小,失电子能力逐渐减弱,B、C均错,同主族元素从上到下金属性增强,非金属性减弱,A项错误,D正确。
【答案】 D
8.下列各组物质性质的比较中正确的是( )
A.酸性:H3PO4>H2SO4>HClO4
B.碱性:Mg(OH)2>Ca(OH)2>KOH
C.热稳定性:H2S>H2O>HF
D.氧化性:F2>Cl2>Br2>I2
【解析】 元素非金属性Cl>S>P,则酸性HClO4>H2SO4>H3PO4,A不正确;元素金属性K>Ca>Mg,则碱性KOH>Ca(OH)2>Mg(OH)2,B不正确;元素非金属性F>O>S,则热稳定性:HF>H2O>H2S,C不正确;元素非金属性F>Cl>Br>I,则氧化性F2>Cl2>Br2>I2。
【答案】 D
9.(2016·浙江高考有改动)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:XW
C.化合物Z2Y和ZWY3不能与水反应
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
【解析】 短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X是C,由题意推知Y的核电荷数是8,则Y是O,Z的单质在氧气中燃烧生成的化合物可与水发生氧化还原反应,则Z是Na,W-最外层为8电子结构,且X、Y、Z、W的原子序数依次增大,则W是Cl。X与Y形成的化合物有CO、CO2,但CO不与NaOH反应,A项错误;原子半径大小:C>O,Na>Cl,B项错误;化合物Na2O能与水反应,C项错误;O3、Cl2、ClO2等有强氧化性的物质可作水的消毒剂,D项正确。
【答案】 D
元 素 周 期 表 的 应 用
基础·初探]
1.利用元素周期表寻找新材料
(1)在金属元素和非金属元素的交界处寻找半导体材料。
(2)在过渡金属元素中寻找优良的催化剂,并通过加入少量稀土元素改善其性能。
(3)在ⅣB到ⅥB族的过渡金属元素中寻找耐高温、耐腐蚀的材料,用以制造火箭、导弹、宇宙飞船等。
(4)利用元素周期表,还可以寻找合适的超导材料、磁性材料等。
2.利用元素周期表指导探矿
(1)相对原子质量较小的元素在地壳中含量较多;相对原子质量较大的元素在地壳中含量较少。
(2)原子序数是偶数的元素在地壳中含量较多,原子序数是奇数的元素在地壳中含量较少。
(3)地球表面的元素多数呈现高价态,处于岩层深处的元素多数呈现低价态。
(4)碱金属一般是强烈的亲石元素,主要富集于岩石圈。
利用元素周期表寻找新材料的依据是什么?
【提示】 根据在元素周期表中位置靠近的元素具有相似的性质这一规律,可以利用元素周期表寻找新材料。
核心·突破]
1.元素“位、构、性”之间的关系
(1)元素的原子结构与元素在周期表中位置的关系
结构→位置
(2)元素的原子结构与元素性质的关系:
(3)元素性质与元素在周期表中位置的关系:
位置
↓
性质→
2.元素“位、构、性”关系的应用
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应的水化物的酸碱性、氢化物的稳定性等。
(2)比较同周期元素及其化合物的性质。
(3)比较不同周期、不同主族元素的性质时,要找出参照物。
(4)推断一些未学过的元素的某些性质。
【温馨提醒】
1.“位、构、性”关系及规律只适用于主族元素,不适用于副族元素。
2.酸性比较应是最高价氧化物对应的水化物,而低价、中间价的含氧酸或无氧酸不遵循此规律。
题组·冲关]
题组1 元素“位、构、性”之间的关系
1.(2016·广州高一检测)如图所示的表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC
D.A、B、C、D的单质常温下均不导电
【解析】 由A、B、C、D在元素周期表中的位置可以得到四种元素分别为C、N、O、P。在同一主族中,随着原子序数的增加原子半径逐渐增大,故D>B,A错误;氢化物的稳定性与非金属性有关,非金属性越强氢化物的稳定性就越强,在同一周期中,随着原子序数的增加非金属性逐渐增强,所以氢化物的稳定性逐渐增强,即氢化物稳定性为C>B>A,B错误;C与O可以形成CO离子,C正确;C形成的石墨单质在常温下可以导电,D错误。
【答案】 C
2.(2016·全国丙卷)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:WB.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:WD.最高价氧化物的水化物的酸性:Y>Z
【解析】 四种短周期主族元素的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;Z与X(Na)形成的离子化合物的水溶液呈中性,则Z为Cl元素;因W与X的简单离子电子层结构相同,且W与Y同族,则W可能为N(或O)元素、Y可能为P(或S)元素。A项,Na+与N3-(或O2-)电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:Na+Y。D项,最高价氧化物对应的水化物中HClO4是最强的无机酸。
【答案】 B
3.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
【解析】 X、Y、Z、W、Q分别为N、O、Al、S、Cl。A项,X(N)的最高正价为+5价,Z(Al)的最高正价为+3价,X(N)、Z(Al)的最高正价之和为8,A项正确;B项,原子半径rZ(Al)>rX(N),B项错误;C项,Y2-为O2-,Z3+为Al3+,它们的核外电子数和电子层数均相同,C项错误;D项,元素W的最高价氧化物对应的水化物为H2SO4,其酸性比Q的最高价氧化物对应的水化物(HClO4)弱,D项错误。
【答案】 A
题组2 无机推断
4.现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如下表:
元素 性质或原子结构
A 原子核内只有一个质子
B 单质是空气中含量最多的气体
X 原子的最外层电子数是次外层电子数的3倍
Y 短周期元素中原子半径最大的元素(稀有气体除外)
Z 最高正化合价与最低负化合价的代数和为6
(1)X、Y、Z的元素名称分别为____________、____________、____________。
(2)X、Y、Z形成的简单离子半径由大到小的顺序为__________________________
______________________________________________ (用r表示半径)。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为________>
____ (填化学式)。
(4)A、B两元素形成的高中化学常见化合物的水溶液显______性。
(5)Z单质与水反应的离子方程式为__________________________________________
________________________________________________________________________。
【答案】 (1)氧 钠 氯
(2)r(Cl-)>r(O2-)>r(Na+)
(3)HCl PH3 (4)碱
(5)Cl2+H2O===H++Cl-+HClO
5.A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是(填名称)A________,B________,C________,D________。
(2)这四种元素中能形成的气态氢化物的稳定性由大到小的顺序是________________(填化学式)。
(3)A与B形成的三原子分子的化学式是________,B与D形成的原子个数之比为1∶1的化合物的化学式是____________。
(4)A元素的某氧化物与D元素的某氧化物反应生成单质的化学方程式是
________________________________________________________________________。
【解析】 A、B处于同一周期且r(A)>r(B),故A的原子序数比B的小;A、C同主族且r(C)>r(A),故C在A的下一周期,又r(D)>r(C),故D与C同周期且原子序数D比C小。根据C原子最外层电子数是D原子最外层电子数的4倍可知,C为第3周期ⅣA族的硅,D为第3周期ⅠA族的钠,则A为碳,又C原子核内的质子数等于A、B原子核内的质子数之和,推知B为氧。
【答案】 (1)碳 氧 硅 钠 (2)H2O>CH4>SiH4
(3)CO2 Na2O2 (4)2CO2+2Na2O2===2Na2CO3+O2
1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。 重点
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.掌握由同主族元素的性质特点预测不熟悉元素的性质。 难点
4.了解元素周期表的应用。
同 主 族 元 素 的 性 质
基础·初探]
1.卤族元素原子结构和性质的相似性和递变性
(1)相似性
元素 F Cl Br I
原子结构示意图
最外层电子数 均为7
最高化合价 0 均为+7
最低化合价 均为-1
气态氢化物 HF HCl HBr HI
最高价氧化物的水化物 无 HClO4(强酸) HBrO4(强酸) HIO4(强酸)
(2)单质的物理性质及递变性
单质物理性质 F2 Cl2 Br2 I2
颜色 浅黄绿色 黄绿色 深红棕色 紫黑色
状态 气体 气体 液体 固体
密度 逐渐增大
熔、沸点 逐渐升高
(3)结构及化学性质的递变性
结构及性质 规律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
最高价氧化物对应水化物的酸性
(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大。( )
(2)卤素单质都是有色物质。( )
(3)HCl、HBr、HI的还原性依次减弱。( )
(4)卤族元素的单质越活泼,其熔点和沸点就越高。( )
【答案】 (1)× (2)√ (3)× (4)×
2.碱金属元素原子结构和性质的相似性与递变性
(1)相似性
①原子的最外电子层都有1个电子。
②最高化合价均为+1价。
③都是活泼的金属元素,单质都能与氧气、水等物质发生反应。
④最高价氧化物对应的水化物一般具有很强的碱性。
(2)递变性
结构及性质 规律
原子半径
单质的还原性
与水、氧气反应的剧烈程度
最高价氧化物对应水化物的碱性
(1)ⅠA族元素全部是金属元素。( )
(2)碱性:RbOH>KOH>NaOH。( )
(3)原子半径:Li>Na>K。( )
(4)氧化性:Li+>Na+>K+。( )
【答案】 (1)× (2)√ (3)× (4)√
3.同主族元素性质的递变规律
合作·探究]
探究背景]
某研究性学习小组设计了一组实验来探究同主族元素性质的递变规律。
(Ⅰ)甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳和硅的非金属性强弱比较的实验研究。
(Ⅱ)乙同学设计了如图2装置来验证ⅦA族元素性质的递变规律,图2中A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸条(已知常温下浓盐酸与高锰酸钾能反应生成氯气)。
探究问题]
1.甲同学设计的实验应该使用哪些试剂?
【提示】 稀硫酸、碳酸钠、Na2SiO3溶液。
2.甲同学所做实验中,图1烧杯中可能有什么现象发生?
【提示】 有气泡冒出,同时生成白色沉淀。
3.乙同学所做实验中,图2中B处有什么实验现象?
【提示】 湿润的淀粉碘化钾试纸变蓝。
4.试写出图2中A处发生反应的离子方程式。
【提示】 Cl2+2Br-===2Cl-+Br2。
5.通过上述实验可得出同主族元素性质有何递变规律?
【提示】 同主族元素从上到下,元素非金属性逐渐减弱。
核心·突破]
元素周期表中元素性质的变化规律
同周期(从左到右) 同主族(从上到下)
原子半径 逐渐减小 逐渐增大
主要化合价 +1→+7-4→-1 相似(最高正价一般相同)
元素原子的失电子能力 逐渐减弱 逐渐增强
元素原子的得电子能力 逐渐增强 逐渐减弱
单质 氧化性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
离子 阳离子的氧化性 逐渐增强 逐渐减弱
阴离子的还原性 逐渐减弱 逐渐增强
气态氢化物 稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
最高价氧化物对应的水化物 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
题组·冲关]
题组1 卤素性质变化规律
1.下列关于ⅦA族元素的说法中不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.F-、Cl-、Br-、I-的还原性逐渐增强
C.HF、HCl、HBr、HI的热稳定性逐渐减弱
D.HF、HCl、HBr、HI水溶液的酸性逐渐减弱
【解析】 从F到I原子半径逐渐增大,单质的氧化性逐渐减弱,则其对应阴离子的还原性逐渐增强,故A、B两项均正确;从F到I,其气态氢化物的热稳定性逐渐减弱,C项正确;F-半径较小,与H结合稳定,HF在水中难以电离出H+,为弱酸,故酸性强弱关系为HF
2.X、Y是元素周期表ⅦA族中的两种元素,X的非金属性比Y强。则下列叙述中正确的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.X的氢化物水溶液的酸性一定比Y的氢化物的水溶液的酸性强
【解析】 同一主族,自上而下,金属性逐渐增强,非金属性逐渐减弱。不要混淆最高价含氧酸的酸性与氢化物水溶液的酸性,如酸性:HF
3.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A.与H2化合能力:At2>I2
B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹能从NaCl溶液中置换出氯单质
【解析】 从F2到At2,元素的非金属性逐渐减弱,与H2化合能力逐渐减弱,A项不正确;由F2到I2,单质的颜色依次加深,I2是紫黑色固体,则砹为黑色固体,B项不正确;卤族元素的原子,最外层上都有7个电子,C项正确;因氧化性Cl2>At2,所以At2不能从溶液中置换出Cl2,D项不正确。
【答案】 C
题组2 碱金属元素性质变化规律
4.下列各组比较不正确的是( )
A.铯与水的反应现象比钠剧烈
B.还原性:K>Na>Li
C.熔点:Li>Na>K
D.碱性:LiOH>NaOH>KOH
【解析】 铯的活动性比钠强,与水反应比钠更剧烈,甚至会爆炸,A项正确;随着电子层数增多,碱金属的金属性逐渐增强,单质的还原性依次增强,即还原性:K>Na>Li,B项正确;碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs,C项正确;从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物碱性依次增强,即碱性:LiOH
5.(2016·沧州高一检测)关于锂的结构和性质的判断,错误的是( )
①与水反应比钠剧烈 ②原子半径比钠小 ③氧化物暴露于空气易吸收二氧化碳 ④阳离子最外层电子数和钠离子相同 ⑤其单质是强还原剂
A.只有① B.①和④
C.②和③ D.③和⑤
【解析】 Li与Na位于同一主族,但原子序数比Na的小,原子半径比Na的小,金属性比Na的弱,与水反应不如Na剧烈,①错,②对;Li2O是碱性氧化物,能与CO2反应,③对;Li+最外层有2个电子,Na+最外层有8个电子,④错;碱金属元素的单质都是很强的还原剂,⑤对。
【答案】 B
6.某主族元素原子R的第五电子层上只有一个电子。下列描述正确的是( )
A.其单质在常温下与水的反应不如钠剧烈
B.其原子半径比钾离子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解
【解析】 由主族元素原子R的第五电子层上只有一个电子可知:R位于周期表第5周期ⅠA族,为Rb(铷)。由同主族元素性质递变规律可知,Rb的金属性强于Na,故其与水的反应比Na更剧烈;RbOH的碱性强于NaOH,因NaOH可使Al(OH)3溶解,则RbOH也一定能使Al(OH)3溶解;Rb、K同主族,且Rb比K多一个电子层,则Rb的原子半径比K的原子半径大;又Na2CO3、K2CO3均易溶于水,可类推出Rb2CO3也应易溶于水。
【答案】 C
题组3 同周期、同主族元素性质递变规律
7.下列说法正确的是( )
A.同主族元素的原子序数越大非金属性越强
B.同周期主族元素的原子序数越大半径越大
C.同周期主族元素的原子序数越大越易失电子
D.同主族元素的原子序数越大金属性越强
【解析】 同周期元素从左到右、原子半径逐渐减小,失电子能力逐渐减弱,B、C均错,同主族元素从上到下金属性增强,非金属性减弱,A项错误,D正确。
【答案】 D
8.下列各组物质性质的比较中正确的是( )
A.酸性:H3PO4>H2SO4>HClO4
B.碱性:Mg(OH)2>Ca(OH)2>KOH
C.热稳定性:H2S>H2O>HF
D.氧化性:F2>Cl2>Br2>I2
【解析】 元素非金属性Cl>S>P,则酸性HClO4>H2SO4>H3PO4,A不正确;元素金属性K>Ca>Mg,则碱性KOH>Ca(OH)2>Mg(OH)2,B不正确;元素非金属性F>O>S,则热稳定性:HF>H2O>H2S,C不正确;元素非金属性F>Cl>Br>I,则氧化性F2>Cl2>Br2>I2。
【答案】 D
9.(2016·浙江高考有改动)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X
C.化合物Z2Y和ZWY3不能与水反应
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
【解析】 短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X是C,由题意推知Y的核电荷数是8,则Y是O,Z的单质在氧气中燃烧生成的化合物可与水发生氧化还原反应,则Z是Na,W-最外层为8电子结构,且X、Y、Z、W的原子序数依次增大,则W是Cl。X与Y形成的化合物有CO、CO2,但CO不与NaOH反应,A项错误;原子半径大小:C>O,Na>Cl,B项错误;化合物Na2O能与水反应,C项错误;O3、Cl2、ClO2等有强氧化性的物质可作水的消毒剂,D项正确。
【答案】 D
元 素 周 期 表 的 应 用
基础·初探]
1.利用元素周期表寻找新材料
(1)在金属元素和非金属元素的交界处寻找半导体材料。
(2)在过渡金属元素中寻找优良的催化剂,并通过加入少量稀土元素改善其性能。
(3)在ⅣB到ⅥB族的过渡金属元素中寻找耐高温、耐腐蚀的材料,用以制造火箭、导弹、宇宙飞船等。
(4)利用元素周期表,还可以寻找合适的超导材料、磁性材料等。
2.利用元素周期表指导探矿
(1)相对原子质量较小的元素在地壳中含量较多;相对原子质量较大的元素在地壳中含量较少。
(2)原子序数是偶数的元素在地壳中含量较多,原子序数是奇数的元素在地壳中含量较少。
(3)地球表面的元素多数呈现高价态,处于岩层深处的元素多数呈现低价态。
(4)碱金属一般是强烈的亲石元素,主要富集于岩石圈。
利用元素周期表寻找新材料的依据是什么?
【提示】 根据在元素周期表中位置靠近的元素具有相似的性质这一规律,可以利用元素周期表寻找新材料。
核心·突破]
1.元素“位、构、性”之间的关系
(1)元素的原子结构与元素在周期表中位置的关系
结构→位置
(2)元素的原子结构与元素性质的关系:
(3)元素性质与元素在周期表中位置的关系:
位置
↓
性质→
2.元素“位、构、性”关系的应用
(1)比较同主族元素的金属性、非金属性、最高价氧化物对应的水化物的酸碱性、氢化物的稳定性等。
(2)比较同周期元素及其化合物的性质。
(3)比较不同周期、不同主族元素的性质时,要找出参照物。
(4)推断一些未学过的元素的某些性质。
【温馨提醒】
1.“位、构、性”关系及规律只适用于主族元素,不适用于副族元素。
2.酸性比较应是最高价氧化物对应的水化物,而低价、中间价的含氧酸或无氧酸不遵循此规律。
题组·冲关]
题组1 元素“位、构、性”之间的关系
1.(2016·广州高一检测)如图所示的表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC
D.A、B、C、D的单质常温下均不导电
【解析】 由A、B、C、D在元素周期表中的位置可以得到四种元素分别为C、N、O、P。在同一主族中,随着原子序数的增加原子半径逐渐增大,故D>B,A错误;氢化物的稳定性与非金属性有关,非金属性越强氢化物的稳定性就越强,在同一周期中,随着原子序数的增加非金属性逐渐增强,所以氢化物的稳定性逐渐增强,即氢化物稳定性为C>B>A,B错误;C与O可以形成CO离子,C正确;C形成的石墨单质在常温下可以导电,D错误。
【答案】 C
2.(2016·全国丙卷)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W
C.气态氢化物的热稳定性:W
【解析】 四种短周期主族元素的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;Z与X(Na)形成的离子化合物的水溶液呈中性,则Z为Cl元素;因W与X的简单离子电子层结构相同,且W与Y同族,则W可能为N(或O)元素、Y可能为P(或S)元素。A项,Na+与N3-(或O2-)电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:Na+
【答案】 B
3.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
【解析】 X、Y、Z、W、Q分别为N、O、Al、S、Cl。A项,X(N)的最高正价为+5价,Z(Al)的最高正价为+3价,X(N)、Z(Al)的最高正价之和为8,A项正确;B项,原子半径rZ(Al)>rX(N),B项错误;C项,Y2-为O2-,Z3+为Al3+,它们的核外电子数和电子层数均相同,C项错误;D项,元素W的最高价氧化物对应的水化物为H2SO4,其酸性比Q的最高价氧化物对应的水化物(HClO4)弱,D项错误。
【答案】 A
题组2 无机推断
4.现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如下表:
元素 性质或原子结构
A 原子核内只有一个质子
B 单质是空气中含量最多的气体
X 原子的最外层电子数是次外层电子数的3倍
Y 短周期元素中原子半径最大的元素(稀有气体除外)
Z 最高正化合价与最低负化合价的代数和为6
(1)X、Y、Z的元素名称分别为____________、____________、____________。
(2)X、Y、Z形成的简单离子半径由大到小的顺序为__________________________
______________________________________________ (用r表示半径)。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为________>
____ (填化学式)。
(4)A、B两元素形成的高中化学常见化合物的水溶液显______性。
(5)Z单质与水反应的离子方程式为__________________________________________
________________________________________________________________________。
【答案】 (1)氧 钠 氯
(2)r(Cl-)>r(O2-)>r(Na+)
(3)HCl PH3 (4)碱
(5)Cl2+H2O===H++Cl-+HClO
5.A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是(填名称)A________,B________,C________,D________。
(2)这四种元素中能形成的气态氢化物的稳定性由大到小的顺序是________________(填化学式)。
(3)A与B形成的三原子分子的化学式是________,B与D形成的原子个数之比为1∶1的化合物的化学式是____________。
(4)A元素的某氧化物与D元素的某氧化物反应生成单质的化学方程式是
________________________________________________________________________。
【解析】 A、B处于同一周期且r(A)>r(B),故A的原子序数比B的小;A、C同主族且r(C)>r(A),故C在A的下一周期,又r(D)>r(C),故D与C同周期且原子序数D比C小。根据C原子最外层电子数是D原子最外层电子数的4倍可知,C为第3周期ⅣA族的硅,D为第3周期ⅠA族的钠,则A为碳,又C原子核内的质子数等于A、B原子核内的质子数之和,推知B为氧。
【答案】 (1)碳 氧 硅 钠 (2)H2O>CH4>SiH4
(3)CO2 Na2O2 (4)2CO2+2Na2O2===2Na2CO3+O2
