【课堂新坐标】2016-2017学年高中化学鲁教版必修2-模块综合测评 (1份打包)
文档属性
| 名称 | 【课堂新坐标】2016-2017学年高中化学鲁教版必修2-模块综合测评 (1份打包) |  | |
| 格式 | zip | ||
| 文件大小 | 350.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-21 07:21:28 | ||
图片预览


文档简介
模块综合测评
(时间45分钟,满分100分)
一、选择题(本题包括12小题,每小题4分,共计48分)
1.下列化学用语使用正确的是( )
A.含有6个质子和7个中子的碳原子:C
【解析】 A项,应为C;B项,应为,C项,应为CH2===CHCH3。
【答案】 D
2.鉴别戊烷、戊烯、乙酸溶液和乙醇溶液,可选用的最佳试剂是( )
A.溴水
B.金属钠、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
【解析】 遇石蕊试液变红的是乙酸溶液;与溴水反应使溴水退色的是戊烯;乙醇和戊烷虽都不能与溴水反应,但戊烷与溴水溶液分层,橙红色在上层;不分层的是乙醇。
【答案】 C
3.镭(Ra)位于周期表的第7周期第ⅡA族。下列关于镭的性质的描述不正确的是( )
A.在化合物中呈+2价
B.单质能与水反应产生氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水
【解析】 根据第ⅡA族Mg、Ca等性质,以及Ra的金属性比Mg、Ca更强可推测出Ra及其化合物的性质。
【答案】 C
4.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
A.它们的原子序数:A>B>C
B.它们的原子半径:C>B>A
C.离子半径:A2->C->B2+
D.原子最外层上的电子数:C>A>B
【解析】 它们的原子半径应是B>A>C。
【答案】 B
5.下列说法错误的是( )
A.含有共价键的化合物不一定是共价化合物
B.在共价化合物中一定含有共价键
C.溶于水能导电的化合物一定是离子化合物
D.离子化合物中不一定都含有金属元素
【解析】 A项正确,如NaOH;B项正确;C项不正确,如HCl;D项正确,如NH4Cl。
【答案】 C
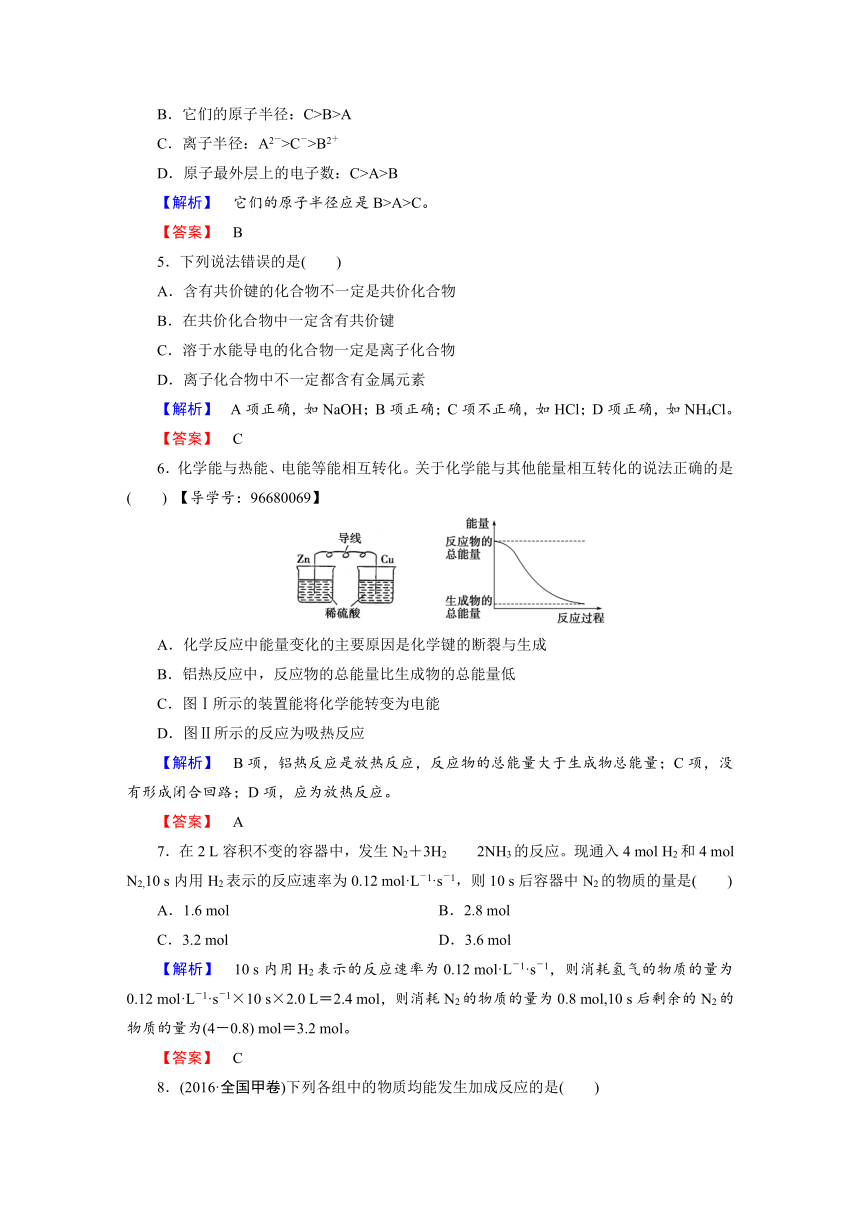
6.化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
【导学号:96680069】
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
【解析】 B项,铝热反应是放热反应,反应物的总能量大于生成物总能量;C项,没有形成闭合回路;D项,应为放热反应。
【答案】 A
7.在2
L容积不变的容器中,发生N2+3H2??2NH3的反应。现通入4
mol
H2和4
mol
N2,10
s内用H2表示的反应速率为0.12
mol·L-1·s-1,则10
s后容器中N2的物质的量是( )
A.1.6
mol
B.2.8
mol
C.3.2
mol
D.3.6
mol
【解析】 10
s内用H2表示的反应速率为0.12
mol·L-1·s-1,则消耗氢气的物质的量为0.12
mol·L-1·s-1×10
s×2.0
L=2.4
mol,则消耗N2的物质的量为0.8
mol,10
s后剩余的N2的物质的量为(4-0.8)
mol=3.2
mol。
【答案】 C
8.(2016·全国甲卷)下列各组中的物质均能发生加成反应的是( )
A.乙烯和乙醇
B.苯和氯乙烯
C.乙酸和溴乙烷
D.丙烯和丙烷
【解析】 A项中,乙烯中有键,能发生加成反应,乙醇中没有不饱和键,不能发生加成反应。B项中,苯和氯乙烯都含有不饱和键,都能发生加成反应。C项中,乙酸和溴乙烷都不能发生加成反应。D项中,丙烯中含有键,能发生加成反应,丙烷中没有不饱和键,不能发生加成反应。
【答案】 B
9.(2016·泰安高一检测)某有机物的结构简式如下图,该物质不应有的化学性质是( )
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液退色;④可跟NaHCO3溶液反应;⑤可跟NaOH溶液反应;⑥1
mol该有机物与Na反应生成2
mol
H2
A.①③
B.②⑥
C.④⑤
D.⑥
【解析】 该有机物易燃烧,含有碳碳双键可与Br2加成,可使酸性KMnO4溶液退色,含有—COOH可与NaHCO3反应,可与NaOH反应。1
mol该有机物含1
mol—COOH和1
mol—OH,与钠反应生成1
mol
H2。
【答案】 D
10.对于以下反应:A(s)+3B(g)??2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是( )
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
【解析】 方程式两边气体物质的化学计量数之和相等,所以无论反应是否平衡,容器的体积均不改变,A项中的说法不能说明反应达到平衡状态;B项中的D的反应速率没有明确是生成速率还是消耗速率,因此,也不能说明反应一定达到平衡状态;平衡时B、C、D的分子个数之比不一定等于3∶2∶1,D项中的说法也不能说明反应达到平衡状态。
【答案】 C
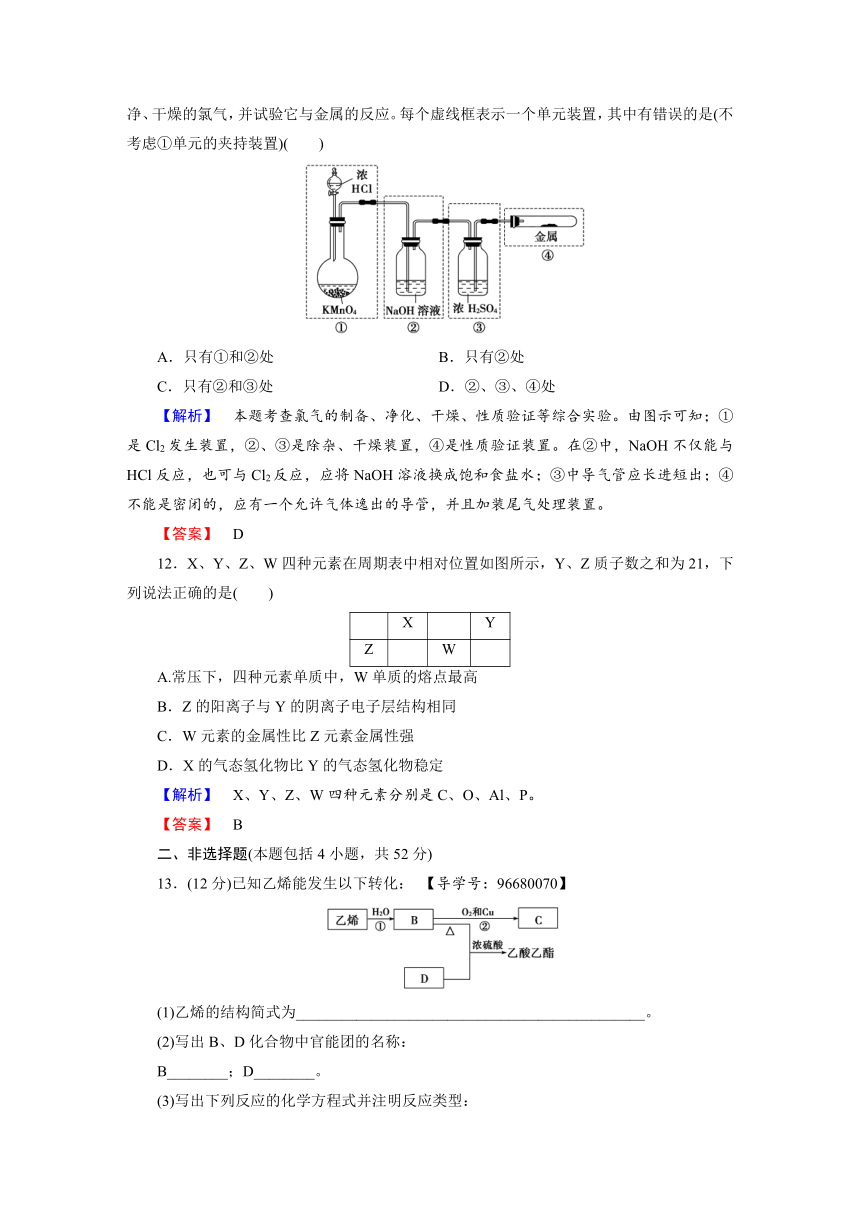
11.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元的夹持装置)( )
A.只有①和②处
B.只有②处
C.只有②和③处
D.②、③、④处
【解析】 本题考查氯气的制备、净化、干燥、性质验证等综合实验。由图示可知;①是Cl2发生装置,②、③是除杂、干燥装置,④是性质验证装置。在②中,NaOH不仅能与HCl反应,也可与Cl2反应,应将NaOH溶液换成饱和食盐水;③中导气管应长进短出;④不能是密闭的,应有一个允许气体逸出的导管,并且加装尾气处理装置。
【答案】 D
12.X、Y、Z、W四种元素在周期表中相对位置如图所示,Y、Z质子数之和为21,下列说法正确的是( )
X
Y
Z
W
A.常压下,四种元素单质中,W单质的熔点最高
B.Z的阳离子与Y的阴离子电子层结构相同
C.W元素的金属性比Z元素金属性强
D.X的气态氢化物比Y的气态氢化物稳定
【解析】 X、Y、Z、W四种元素分别是C、O、Al、P。
【答案】 B
二、非选择题(本题包括4小题,共52分)
13.(12分)已知乙烯能发生以下转化:
【导学号:96680070】
(1)乙烯的结构简式为______________________________________________。
(2)写出B、D化合物中官能团的名称:
B________;D________。
(3)写出下列反应的化学方程式并注明反应类型:
①________________________________________________________________________;
反应类型________。
②________________________________________________________________________;
反应类型________。
【解析】 乙烯和水发生加成反应生成B(乙醇),乙醇催化氧化生成C(乙醛),乙醇和D(乙酸)发生酯化反应生成乙酸乙酯。
【答案】 (1)CH2===CH2 (2)羟基 羧基
(3)①CH2===CH2+H2OCH3CH2OH 加成反应
②2CH3CH2OH+O22CH3CHO+2H2O 氧化反应
14.(16分)短周期元素A、B、C、D、E的原子序数依次增大,
A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图________________。C、D、E的简单离子半径由小到大的顺序________________。(用离子符号表示)。
(2)写出元素E在周期表中的位置________。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是___________。
(4)D2C2与H2O反应的化学方程式是________________,D2C2与CuSO4溶液反应的现象是________________。
(5)由元素A、B、C按原子个数比4∶2∶3形成的化合物含有的化学键类型:________,写出其电离方程式:________________。
【解析】 A元素阳离子的原子核外没有电子,所以A是H元素;B是空气中含量最多的元素,所以B是N元素;C元素原子最外层电子数是其电子层数的三倍,则C只能是2层电子,最外层6个电子,则C是O元素;C与D可形成两种常见的离子化合物,则D是Na元素;工业上常用电解C与E的化合物来制备E单质,工业常电解氧化铝来制备铝单质,所以E是Al元素。
(1)Na的原子结构示意图为氧离子、钠离子与铝离子的核外电子排布相同,核电荷数越少,半径越大,所以C、D、E的简单离子半径由小到大的顺序是Al3+(2)Al元素位于元素周期表的第三周期,ⅢA族。
(3)A和B的单质合成一种常见气体,该气体是氨气,检验氨气的方法是用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在。
(4)过氧化钠与H2O反应的化学方程式是2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与水反应的产物又与CuSO4溶液反应,所以有气体放出,同时溶液中产生蓝色沉淀。
(5)由元素H、N、O按原子个数比4∶2∶3形成的化合物是硝酸铵,硝酸铵是强电解质,完全电离,电离方程式为NH4NO3===NH+NO。
【答案】 (1)
Al3+(3)用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在
(4)2Na2O2+2H2O===4NaOH+O2↑ 产生蓝色沉淀并有气泡放出 (5)离子键和共价键 NH4NO3===NH+NO
15.(11分)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验序号
锌的质量/g
锌的状态
c(H2SO4)
/mol·L-1
V(H2SO4)
/mL
反应前溶液的温度/℃
添加剂
1
0.65
粒状
0.5
50
20
无
2
0.65
粉末
0.5
50
20
无
3
0.65
粒状
0.5
50
20
2滴CuSO4溶液
4
0.65
粉末
0.8
50
20
无
5
0.65
粉末
0.8
50
35
2滴CuSO4溶液
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
①在OA、AB、BC三段中反应速率最快的是______,原因是______________________
________________________________________________________________________。
②2~4
min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________。
【答案】 (1)锌完全消失所需的时间 5
(2)固体反应物的表面积 (是否形成)原电池
(3)①AB 反应放热,使温度升高,反应速率加快
②0.06
mol·L-1·min-1
16.(13分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应,其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。
【导学号:96680071】
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是________________________________
________________________________________________________________________。
(2)装置E的作用是________________,橡胶管k的作用是_____________________
________________________________________________________________________。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是
________________________________________________________________________。
(4)装置F中试管内发生反应的化学方程式____________________________________
________________________________________________________________________。
(5)接入D装置的两根导管左边较长、右边较短,目的是________________________。
(6)整套装置从左向右的连接顺序是(j)接( ),( )接(f),(g)接( ),( )接( ),( )接(a)。
【解析】 A为氯气的发生装置,E装置用于除去氯气中的氯化氢,B装置为氯气的干燥装置,F装置为氨气的发生装置,C装置为氨气的干燥装置,D装置为两种气体的反应装置。(1)连接好装置后,必需进行的一步实验操作是检查装置的气密性;(2)装置E的作用是除去氯气中的氯化氢,橡胶管k的作用是使分液漏斗中的盐酸顺利流下;(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是在G连接导管直接通入盛有烧碱的烧杯中;(4)装置F中试管内发生反应的化学方程式2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑;(5)由于氨气的密度小,氯气的密度大,密度小的氨气从长管进入向上扩散,密度大的氯气从短管进入向下扩散,接入D装置的两根导管左边较长、右边较短,目的是使密度大的氯气与密度小的氨气较快地均匀混合;(6)整套装置从左向右的连接顺序是(j)接(d),(e)接(f),(g)接(b),(c)接(h),(i)接(a)。
【答案】 (1)检查装置的气密性
(2)除去氯气中的氯化氢 使分液漏斗中的盐酸顺利流下
(3)在G连接导管直接通入盛有烧碱的烧杯中
(4)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
(5)使密度大的氯气与密度小的氨气较快地均匀混合
(6)d e b c h i
(时间45分钟,满分100分)
一、选择题(本题包括12小题,每小题4分,共计48分)
1.下列化学用语使用正确的是( )
A.含有6个质子和7个中子的碳原子:C
【解析】 A项,应为C;B项,应为,C项,应为CH2===CHCH3。
【答案】 D
2.鉴别戊烷、戊烯、乙酸溶液和乙醇溶液,可选用的最佳试剂是( )
A.溴水
B.金属钠、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
【解析】 遇石蕊试液变红的是乙酸溶液;与溴水反应使溴水退色的是戊烯;乙醇和戊烷虽都不能与溴水反应,但戊烷与溴水溶液分层,橙红色在上层;不分层的是乙醇。
【答案】 C
3.镭(Ra)位于周期表的第7周期第ⅡA族。下列关于镭的性质的描述不正确的是( )
A.在化合物中呈+2价
B.单质能与水反应产生氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水
【解析】 根据第ⅡA族Mg、Ca等性质,以及Ra的金属性比Mg、Ca更强可推测出Ra及其化合物的性质。
【答案】 C
4.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
A.它们的原子序数:A>B>C
B.它们的原子半径:C>B>A
C.离子半径:A2->C->B2+
D.原子最外层上的电子数:C>A>B
【解析】 它们的原子半径应是B>A>C。
【答案】 B
5.下列说法错误的是( )
A.含有共价键的化合物不一定是共价化合物
B.在共价化合物中一定含有共价键
C.溶于水能导电的化合物一定是离子化合物
D.离子化合物中不一定都含有金属元素
【解析】 A项正确,如NaOH;B项正确;C项不正确,如HCl;D项正确,如NH4Cl。
【答案】 C
6.化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
【导学号:96680069】
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
【解析】 B项,铝热反应是放热反应,反应物的总能量大于生成物总能量;C项,没有形成闭合回路;D项,应为放热反应。
【答案】 A
7.在2
L容积不变的容器中,发生N2+3H2??2NH3的反应。现通入4
mol
H2和4
mol
N2,10
s内用H2表示的反应速率为0.12
mol·L-1·s-1,则10
s后容器中N2的物质的量是( )
A.1.6
mol
B.2.8
mol
C.3.2
mol
D.3.6
mol
【解析】 10
s内用H2表示的反应速率为0.12
mol·L-1·s-1,则消耗氢气的物质的量为0.12
mol·L-1·s-1×10
s×2.0
L=2.4
mol,则消耗N2的物质的量为0.8
mol,10
s后剩余的N2的物质的量为(4-0.8)
mol=3.2
mol。
【答案】 C
8.(2016·全国甲卷)下列各组中的物质均能发生加成反应的是( )
A.乙烯和乙醇
B.苯和氯乙烯
C.乙酸和溴乙烷
D.丙烯和丙烷
【解析】 A项中,乙烯中有键,能发生加成反应,乙醇中没有不饱和键,不能发生加成反应。B项中,苯和氯乙烯都含有不饱和键,都能发生加成反应。C项中,乙酸和溴乙烷都不能发生加成反应。D项中,丙烯中含有键,能发生加成反应,丙烷中没有不饱和键,不能发生加成反应。
【答案】 B
9.(2016·泰安高一检测)某有机物的结构简式如下图,该物质不应有的化学性质是( )
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液退色;④可跟NaHCO3溶液反应;⑤可跟NaOH溶液反应;⑥1
mol该有机物与Na反应生成2
mol
H2
A.①③
B.②⑥
C.④⑤
D.⑥
【解析】 该有机物易燃烧,含有碳碳双键可与Br2加成,可使酸性KMnO4溶液退色,含有—COOH可与NaHCO3反应,可与NaOH反应。1
mol该有机物含1
mol—COOH和1
mol—OH,与钠反应生成1
mol
H2。
【答案】 D
10.对于以下反应:A(s)+3B(g)??2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是( )
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
【解析】 方程式两边气体物质的化学计量数之和相等,所以无论反应是否平衡,容器的体积均不改变,A项中的说法不能说明反应达到平衡状态;B项中的D的反应速率没有明确是生成速率还是消耗速率,因此,也不能说明反应一定达到平衡状态;平衡时B、C、D的分子个数之比不一定等于3∶2∶1,D项中的说法也不能说明反应达到平衡状态。
【答案】 C
11.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元的夹持装置)( )
A.只有①和②处
B.只有②处
C.只有②和③处
D.②、③、④处
【解析】 本题考查氯气的制备、净化、干燥、性质验证等综合实验。由图示可知;①是Cl2发生装置,②、③是除杂、干燥装置,④是性质验证装置。在②中,NaOH不仅能与HCl反应,也可与Cl2反应,应将NaOH溶液换成饱和食盐水;③中导气管应长进短出;④不能是密闭的,应有一个允许气体逸出的导管,并且加装尾气处理装置。
【答案】 D
12.X、Y、Z、W四种元素在周期表中相对位置如图所示,Y、Z质子数之和为21,下列说法正确的是( )
X
Y
Z
W
A.常压下,四种元素单质中,W单质的熔点最高
B.Z的阳离子与Y的阴离子电子层结构相同
C.W元素的金属性比Z元素金属性强
D.X的气态氢化物比Y的气态氢化物稳定
【解析】 X、Y、Z、W四种元素分别是C、O、Al、P。
【答案】 B
二、非选择题(本题包括4小题,共52分)
13.(12分)已知乙烯能发生以下转化:
【导学号:96680070】
(1)乙烯的结构简式为______________________________________________。
(2)写出B、D化合物中官能团的名称:
B________;D________。
(3)写出下列反应的化学方程式并注明反应类型:
①________________________________________________________________________;
反应类型________。
②________________________________________________________________________;
反应类型________。
【解析】 乙烯和水发生加成反应生成B(乙醇),乙醇催化氧化生成C(乙醛),乙醇和D(乙酸)发生酯化反应生成乙酸乙酯。
【答案】 (1)CH2===CH2 (2)羟基 羧基
(3)①CH2===CH2+H2OCH3CH2OH 加成反应
②2CH3CH2OH+O22CH3CHO+2H2O 氧化反应
14.(16分)短周期元素A、B、C、D、E的原子序数依次增大,
A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图________________。C、D、E的简单离子半径由小到大的顺序________________。(用离子符号表示)。
(2)写出元素E在周期表中的位置________。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是___________。
(4)D2C2与H2O反应的化学方程式是________________,D2C2与CuSO4溶液反应的现象是________________。
(5)由元素A、B、C按原子个数比4∶2∶3形成的化合物含有的化学键类型:________,写出其电离方程式:________________。
【解析】 A元素阳离子的原子核外没有电子,所以A是H元素;B是空气中含量最多的元素,所以B是N元素;C元素原子最外层电子数是其电子层数的三倍,则C只能是2层电子,最外层6个电子,则C是O元素;C与D可形成两种常见的离子化合物,则D是Na元素;工业上常用电解C与E的化合物来制备E单质,工业常电解氧化铝来制备铝单质,所以E是Al元素。
(1)Na的原子结构示意图为氧离子、钠离子与铝离子的核外电子排布相同,核电荷数越少,半径越大,所以C、D、E的简单离子半径由小到大的顺序是Al3+
(3)A和B的单质合成一种常见气体,该气体是氨气,检验氨气的方法是用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在。
(4)过氧化钠与H2O反应的化学方程式是2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与水反应的产物又与CuSO4溶液反应,所以有气体放出,同时溶液中产生蓝色沉淀。
(5)由元素H、N、O按原子个数比4∶2∶3形成的化合物是硝酸铵,硝酸铵是强电解质,完全电离,电离方程式为NH4NO3===NH+NO。
【答案】 (1)
Al3+
(4)2Na2O2+2H2O===4NaOH+O2↑ 产生蓝色沉淀并有气泡放出 (5)离子键和共价键 NH4NO3===NH+NO
15.(11分)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验序号
锌的质量/g
锌的状态
c(H2SO4)
/mol·L-1
V(H2SO4)
/mL
反应前溶液的温度/℃
添加剂
1
0.65
粒状
0.5
50
20
无
2
0.65
粉末
0.5
50
20
无
3
0.65
粒状
0.5
50
20
2滴CuSO4溶液
4
0.65
粉末
0.8
50
20
无
5
0.65
粉末
0.8
50
35
2滴CuSO4溶液
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。
①在OA、AB、BC三段中反应速率最快的是______,原因是______________________
________________________________________________________________________。
②2~4
min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________。
【答案】 (1)锌完全消失所需的时间 5
(2)固体反应物的表面积 (是否形成)原电池
(3)①AB 反应放热,使温度升高,反应速率加快
②0.06
mol·L-1·min-1
16.(13分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应,其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。
【导学号:96680071】
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是________________________________
________________________________________________________________________。
(2)装置E的作用是________________,橡胶管k的作用是_____________________
________________________________________________________________________。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是
________________________________________________________________________。
(4)装置F中试管内发生反应的化学方程式____________________________________
________________________________________________________________________。
(5)接入D装置的两根导管左边较长、右边较短,目的是________________________。
(6)整套装置从左向右的连接顺序是(j)接( ),( )接(f),(g)接( ),( )接( ),( )接(a)。
【解析】 A为氯气的发生装置,E装置用于除去氯气中的氯化氢,B装置为氯气的干燥装置,F装置为氨气的发生装置,C装置为氨气的干燥装置,D装置为两种气体的反应装置。(1)连接好装置后,必需进行的一步实验操作是检查装置的气密性;(2)装置E的作用是除去氯气中的氯化氢,橡胶管k的作用是使分液漏斗中的盐酸顺利流下;(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是在G连接导管直接通入盛有烧碱的烧杯中;(4)装置F中试管内发生反应的化学方程式2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑;(5)由于氨气的密度小,氯气的密度大,密度小的氨气从长管进入向上扩散,密度大的氯气从短管进入向下扩散,接入D装置的两根导管左边较长、右边较短,目的是使密度大的氯气与密度小的氨气较快地均匀混合;(6)整套装置从左向右的连接顺序是(j)接(d),(e)接(f),(g)接(b),(c)接(h),(i)接(a)。
【答案】 (1)检查装置的气密性
(2)除去氯气中的氯化氢 使分液漏斗中的盐酸顺利流下
(3)在G连接导管直接通入盛有烧碱的烧杯中
(4)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
(5)使密度大的氯气与密度小的氨气较快地均匀混合
(6)d e b c h i
