第7章 常见碱的复习 课件(11张PPT)
文档属性
| 名称 | 第7章 常见碱的复习 课件(11张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 95.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-19 00:00:00 | ||
图片预览


文档简介
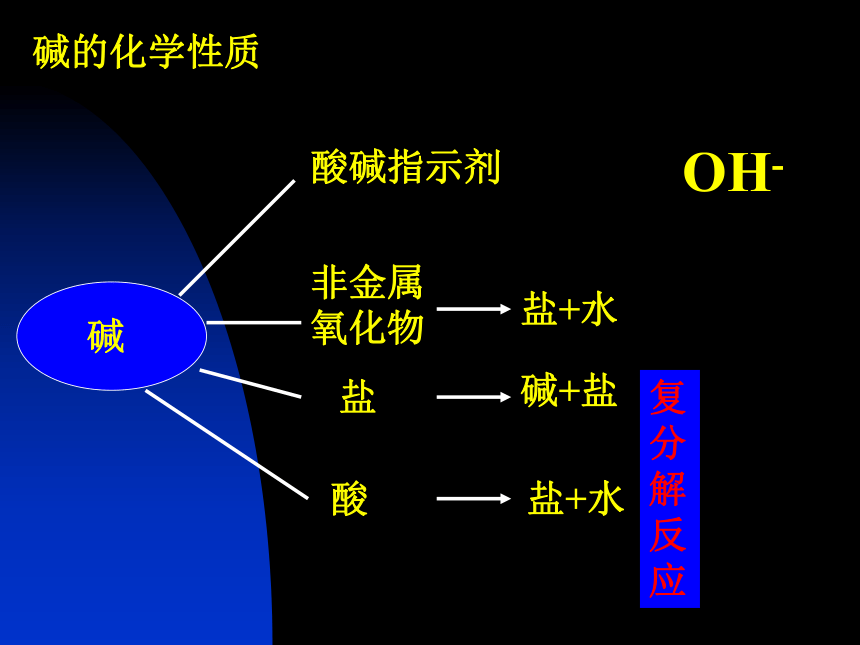
课件11张PPT。第七单元 应用广泛的酸碱盐复习课 常见的碱归纳总结:
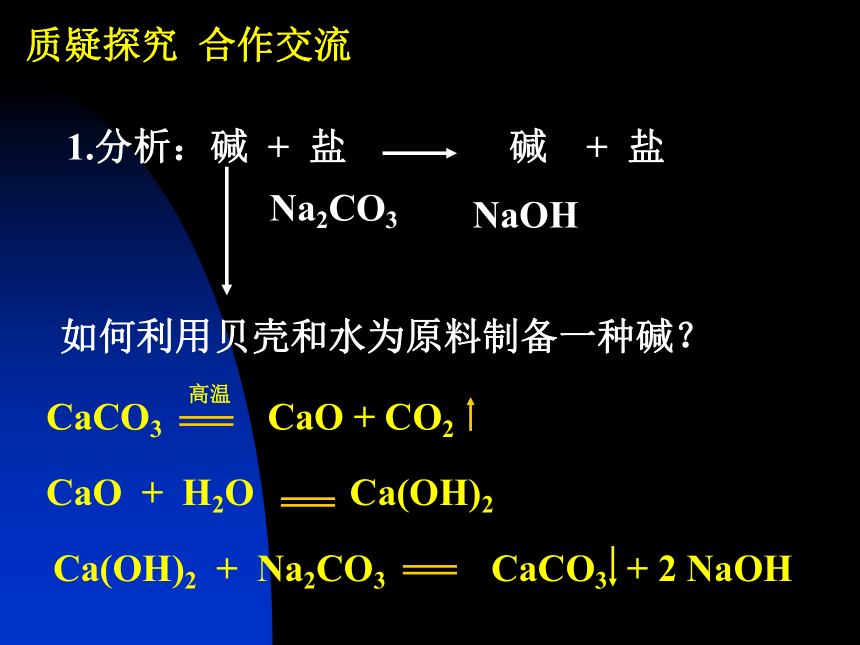
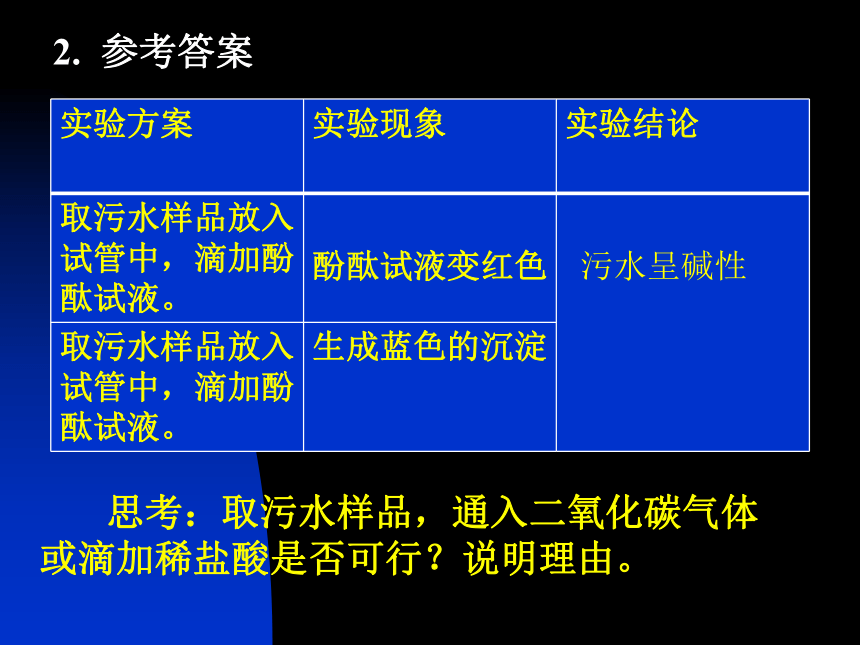
碱有哪些相似的化学性质?碱的化学性质复分解反应OH-质疑探究 合作交流NaOHNa2CO32. 参考答案 思考:取污水样品,通入二氧化碳气体或滴加稀盐酸是否可行?说明理由。3. 分析:怎样证明物质发生了反应?A、B两个实验的现象分别是什么?出现这两种现象的原因是什么?还有什么原因也能使容器内压强变小?如何排除水对实验的干扰?用什么药品可以证明生成了新的物质Na2CO3?
从而说明二氧化碳和氢氧化钠发生了反应? ①氢氧化钠溶液与CO2发生反应,使容器内气压降低
②CO2能溶于水,也能使容器内气压降低;
将氢氧化钠溶液换成等体积的水,重复实验,观察现象。
③稀盐酸
有气泡产生(或加氯化钙溶液 有沉淀生成 其他合理答案均可)
④A 氢氧化钠有腐蚀性,易伤到手4. 分析:提出猜想:
⑴ Na2CO3 ⑵NaOH ⑶Na2CO3 和NaOH验证猜想:
⑴ 白色粉末中还可能含有NaOH 。
⑵ Na2CO3溶液也呈碱性。Na2CO3 酚酞(或硫酸铜溶液);变红色(或生成蓝色的沉淀)。会生成氢氧化钠,干扰实验。课堂检测: 1.分析:A和E特殊的原因是只能和一种物质反应,而且A可以转化生成E。B、C、D都可以和两种物质反应,其中C可以和另外的两种物质反应。Fe O2 CO2 CuSO4 NaOH21122O2CO2Fe NaOH
CuSO4 剧烈燃烧,火星四射,生成一种黑色固体,放出大量的热;CO2 + 2NaOH = Na2CO3 + H2O(1)Ca(OH)2微溶于水,其溶液质量分数不可能为10%;
(2)无色酚酞、NaCl
NaCl溶液呈中性,不能使无色酚酞试液变红色
(3)[进行实验]甲(或乙)
实验步骤:氯化钙溶液(或稀盐酸)
实验现象:产生白色沉淀(或有气泡冒出)
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
(或Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
[实验反思](1)石灰水
(2)A、B2.参考答案
碱有哪些相似的化学性质?碱的化学性质复分解反应OH-质疑探究 合作交流NaOHNa2CO32. 参考答案 思考:取污水样品,通入二氧化碳气体或滴加稀盐酸是否可行?说明理由。3. 分析:怎样证明物质发生了反应?A、B两个实验的现象分别是什么?出现这两种现象的原因是什么?还有什么原因也能使容器内压强变小?如何排除水对实验的干扰?用什么药品可以证明生成了新的物质Na2CO3?
从而说明二氧化碳和氢氧化钠发生了反应? ①氢氧化钠溶液与CO2发生反应,使容器内气压降低
②CO2能溶于水,也能使容器内气压降低;
将氢氧化钠溶液换成等体积的水,重复实验,观察现象。
③稀盐酸
有气泡产生(或加氯化钙溶液 有沉淀生成 其他合理答案均可)
④A 氢氧化钠有腐蚀性,易伤到手4. 分析:提出猜想:
⑴ Na2CO3 ⑵NaOH ⑶Na2CO3 和NaOH验证猜想:
⑴ 白色粉末中还可能含有NaOH 。
⑵ Na2CO3溶液也呈碱性。Na2CO3 酚酞(或硫酸铜溶液);变红色(或生成蓝色的沉淀)。会生成氢氧化钠,干扰实验。课堂检测: 1.分析:A和E特殊的原因是只能和一种物质反应,而且A可以转化生成E。B、C、D都可以和两种物质反应,其中C可以和另外的两种物质反应。Fe O2 CO2 CuSO4 NaOH21122O2CO2Fe NaOH
CuSO4 剧烈燃烧,火星四射,生成一种黑色固体,放出大量的热;CO2 + 2NaOH = Na2CO3 + H2O(1)Ca(OH)2微溶于水,其溶液质量分数不可能为10%;
(2)无色酚酞、NaCl
NaCl溶液呈中性,不能使无色酚酞试液变红色
(3)[进行实验]甲(或乙)
实验步骤:氯化钙溶液(或稀盐酸)
实验现象:产生白色沉淀(或有气泡冒出)
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
(或Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
[实验反思](1)石灰水
(2)A、B2.参考答案
