表示物质的符号[下学期]
图片预览











文档简介
课件62张PPT。复习:物质、元素、分子、原子的区别与联系 微观粒子
(讲种类、讲个数) 宏观概念
(只讲种类、不讲个数)第6节 表示物质的符号引入:元素可以用元素符号来表示,那么由元素组成的物质是否可用元素符号来表示呢?一、化学式1、化学式是用元素符号来表示物质组成的式子12、化学式的确定依据先通过实验确定物质的组成,然后按国际通用规则书写指出:一种纯净物只有一个化学式13、化学式的写法和读法
(1)单质
金属单质:铁 铝
固态非金属单质:硫 磷
稀有气体:氖气 氦气氧气 氢气用元素符号表示气体单质:练习:写出P30单质的化学式(2)化合物A、氧化物MgO CuO CO2 SO2 Fe3O4P2O5 MnO2写法:氧在后读法氧化某或几氧化几某1
H2O
HCl
H2S
B、氢化物写法氢在前读法某化氢不过也有例外的喔!!!NH3(氨气)
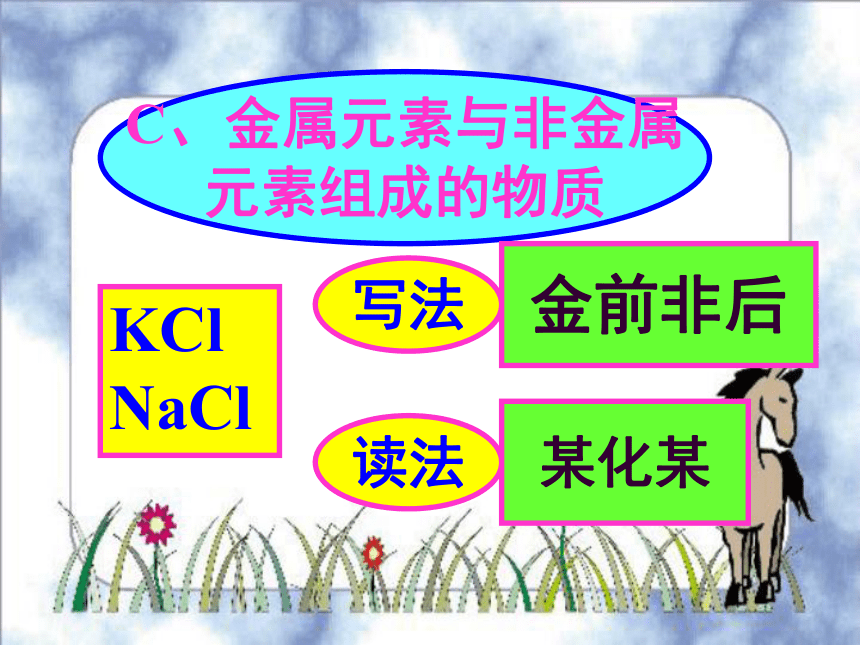
CH4(甲烷)1C、金属元素与非金属
元素组成的物质KCl NaCl写法金前非后读法某化某1下列化学式是否正确,若有错请更正。
氮气—N
氖气—Ne2
氧化镁—MgO
二氧化锰—MNO2
硫化钠—SNa2√N2NeMnO2Na2S化合物的化学式的表示,举例Fe3O4CO2MgOCuOP2O5FeCl3MgCl2ZnSKClO3KMnO4 四氧化三铁二氧化碳氧化镁氧化铜五氧化二磷三氯化铁二氯化镁硫化锌氯酸钾高锰酸钾碳酸钙CaCO3NaOH氢氧化钠1适用于由两种元素组成的物质1复习1.什么是化学式?2.单质、氧化物、金属元素与非金属元素组成的物质的化学式的书写及读法有何规律?3.元素符号表示什么含义?1单质:
X—金属、稀有气体、固态非金属
X2 — N2、O2、H2等气态非金属金前非后,由后往前读做某化某氧化物:氧在后,
一般读做氧化某,1元素符号表示一种元素;该元素的一个原子若要表示“n”个原子,则在元素符号前面加上“n”我们学习了化学式,你知道化学式又有什么含义吗?14、化学式表示的意义例:分析化学式“H2O” 表示的意义H2O①水②水是由氢氧两种元素组成③一个水分子④每个水分子是由2个氢原子1个氧原子构成1化学式表示的意义:一种物质该物质的组成元素该物质的一个分子该物质的分子构成宏观微观写出下列化学式表示的含义CO2 P2O5 NH3CO2二氧化碳二氧化碳由碳元素和氧元素组成一个二氧化 碳分子一个二氧化碳分子由一个碳原子和两个氧原子构成1P2O5五氧化二磷五氧化二磷由磷元素和氧元素组成一个五氧化二磷分子一个五氧化二磷分子由两个磷原子和五个氧原子构成1NH3氨气氨气由氮元素和氢元素组成一个氨分子一个氨分子由一个氮原子和三个氢原子构成1H2O思考:怎样表示2个水分子?2注意:当化学式前面出现数字时,它只能表示微观含义指出下列符号表示的意义氧元素、一个氧原子2个氧原子氧气、一个氧分子2个氧分子二氧化碳一个二氧化碳分子O2OO2CO22CO22O22个二氧化碳分子指出下列符号中“2”表示的意义2OO2CO22CO22O22个氧原子每个氧分子由2个氧原子构成2个氧分子2个二氧化碳分子1个二氧化碳分子中有2个氧原子1二、离子的符号复习:
离子是______的原子或原子团,带正电的离子是____离子,带负电的离子是____离子设问离子用符号怎么表示呢?1、离子符号的表示方法:在元素符号或原子团符号的右上角标出该离子所带的电荷数1如钠离子:Na+ 氯离子:Cl-离子和原子有何不同?它们之间有何联系?钠原子和钠离子是否属于同种元素?原子:核电荷数=质子数=核外电子数
不显电性
离子:核电荷数=质子数≠核外电子数
显电性
通过得失电子相互转化,
因为钠原子和钠离子质子数相同,所以属于同种元素思考1 金属原子易失电子形成阳离子、
非金属原子易得电子形成阴离子。 阳离子、阴离子由于所带电荷电性相反,相互吸引而形成离子化合物。1离子的符号 离子符号是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数 。Na+Cl-带一个单位正电荷的钠离子带一个单位负电荷的氯离子S2-带2个单位负电荷的硫离子1带电原子团 由2种以上元素原子组成的
离子称为某某根离子,这就是带
电原子团 。SO42-CO32-OH-思考离子的组成是否只有一种元素组成呢?1常见带电原子团1 元素之间相互化合时,其原子个数比都有确定的数值,如不是这个数目之比,就不能形成稳定的化合物。 元素化合价是元素在形成化合物时表现出的一种性质,化合价是书写化学式的重要依据,因此学好化合价是掌握化学式这个化学用语的关键问题。再来看一些化合物的化学式其原子个数比: 2:1 1:1 1:1 1:2化合物化学式:Na2S NaCl MgS MgCl21认识化合价:化合价的概念: 一种元素一定数目的原子与另一种元素一定数目的原子相互化合的性质叫化合价12、化合价的表示方法:O Mg+2-2标在元素符号的正上方 左符号右数目标在元素符号的右上角 左数目右符号Al、O、MgAl3+、O2-、Mg2++3-2+2同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反1 化合价的表示方法、读法及与离子的区别化合价表示 : Na Al S Cl O+1+3-2-2-1离子符号 : Na+ Al3+ S2- Cl- O2-+3价的铁(元素)Fe3+ 读做:带3个正电荷的铁离子—简称铁离子同种元素(或原子团)的化合价和离子的电荷,
通常数值相等,位置不同,正负号写法不同。12、常见元素的化合价 1元素化合价的一般规律1、氢元素化合价通常显+1价,氧元素通常显-2价; 2、金属元素的化合价为正价; 3、非金属与氢或金属化合时显负价,与氧元素化
合时显正价; 4、有的一种元素可以有几种化合价 5、单质中元素的化合价为零 6、化合物中各元素化合价的代数和为零 1常见元素的化合价 (背!!)
K Na Ag H 正一价(贾纳迎亲)
Ca Mg Cu、Ba Zn 正二价(盖美铜背心)
氯负一氧负二铝正三
铁有正二和正三
硫有负二正六四1(2)、化合价的一般规律填空: 在化合物中:
①、氢通常显 ;氧通常显 ; ②、金属常显 ;非金属常显 ;
在非金属氧化物里,
非金属显 ,氧显 ,
单质中:元素的化合价 。 ③、化合价原则
在化合物中:
元素正、负化合价的代数和 ,+1价-2价正价负价为 0为0正价负价1Ca(OH)2 CaCO3氢氧根碳酸根不是一种物质,它不能独立存在常见的原子团和化合价OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
PO4 磷酸根 NH4 铵根-1-1-2-3 -2+1原子团:1根据元素化合价书写化合物的化学式 例:写出氧化铝的化学式。(1)写出组成化合物的元素符号,一般正左负右。(2)在符号上方标出相应的化合价。(3)用交叉法写化学式(交叉法:去正负号,约简,上数交叉下移,1不写)。(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O(+3)×2 + (-2)×3 = 6 – 6 = 0Al2 O31 根据化合价,书写化学式(确定原子个数)例题: 1) 已知 Cu 、 Cl ; S 、O写出它们的化学式
2)已知Al 、 SO4 ; Ca 、OH写出其化学式+2 -1 +6 -2+3 -2+2 -1方法:正价前,负价后;
交叉约简找个数。初中只有CH4、 NH3例外CuCl2SO3Al2 (SO4)3Ca(OH)21根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜1、写出有关元素符号
2、标出有关元素的化合价
3、根据化合物中元素化合价
代数和为零的原则,求出
化学式中,各元素的原子
个数。
4、验证所写化学式是否正确。Fe O+3 -2 23验证:(+3)×2 +(-2)×3 = 0Al SO4Cu O+3 - 223( )验证:(+3)×2 + (-2)×3 = 0+2 -2验证:(+2) +(-2)= 0返回1例2、求化合物HnROn+2中,元素R的化合价。
解: HnROn+2(+1)×n + x + (-2)×(n+2) =0X = +(n+4)+1x-21化合价的应用:根据化学式,求某元素的可变化合价:例1、求下列化合物中Mn的化合价
KMnO4 K2MnO4 MnO2解: KMnO4 +1x-2(+1) + x + (-2)×4 = 0X = +7原则:正、负化合价的代数和为零。+6+41
许多元素的原子在不同的条件下,形成可变化合价如:CO (一氧化碳) CO2(二氧化碳)
Fe2O3 (氧化铁 ) FeO(氧化亚铁)
+2+4+3+2关于可变化合价:1练习: 写出下列元素氧化物的化学式:K Ca Al C P S Cl+1 +2 +3 +4 +5 +4 +7K2OCaO Al2O3 CO2 P2O5 SO2 Cl2O71练习书写下列物质的化学式:氯化钙_____________
碳酸钾_____________
硝酸钡_____________CaCl2k2CO3Ba (NO)21小结:
1、用元素符号表示物质组成的式子叫化学式。
2、化学式表示一种物质,表示物质的元素组成,以及组成元素的原子个数比。
3、化学上用化合价表示元素原子之间相互化合的数目。
4、化合物各元素正负化合价的代数和为零。
5、熟记常见元素或原子团的化合价。
1铝离子 ,氧离子 ,
化合价为正二价的镁元素 ,
化合价为负二价的硫元素 ,
二氧化碳中的碳元素为正四价 。 Al3+O2- Mg+2S-2CO2+4练习1化学式中各数字的含义:2P2O5两个五氧化二磷分子(表示分子个数)每个五氧化二磷分子中有两个磷原子
(表示每个分子中某原子的个数)每个氢分子是由两个氢原子构成的前面的2:表示两个氢分子,后面的2:同上表示两个氢原子前面的2:表示两个水分子,
后面的2:表示每个水分子中有两个氢原子。1练习标出下列物质中带点元素的化合价:HCl HClO HClO3
HClO4 HnRO2n+1 .....-1+1+5+7+(3n+2)(+1)× n+x+(-2) ×(2n+1)=0x= +(3n+2)1 根据化合价法则,判断化学式的正、误:
ZnO2 AlO FeSO4 FH K(OH)
氧化锌 氧化铝 硫酸亚铁 氟化氢 氢氧化钾练习7:判断下列化学式是否正确、将错的改正。
氧化铁 硫酸铝 氢氧化铁 硫化钾 氧化钠
FeO AlSO4 Fe(OH)2 K2S NaOFe2O3 ZnO+2 -2Al O+3 -2HF+1-1KOH+1-1Al2(SO4)3Fe(OH)3Na2O+3 –2 +3 -2 +3 –1 +1 -2231通符晓义3SO4+62-“2”“3”“4”“6”一个硫酸根离子带2个单位的负电荷;3个硫酸根离子;一个硫酸根离子中有4个氧原子;硫酸根离子中硫元素的化合价为+6价;1关于“2H3PO4”中数字,下列说法不正确的是( )
A、“3”表示氢元素的个数
B、“4”表示每个磷酸分子中含有氧原子的个数
C、“2”表示磷酸分子的个数
D、 “3”表示每个磷酸分子中含有氢原子的个数A练习1明辩是非1、一种元素只能表现出一种化合价。2、铁单质中,铁元素既可以是+2价,也可 以是+3价。3、在硝酸铵里,氮元素表现出两种化合价。4、KMnO4和K2MnO4中锰元素的化合价相同。5、水中氢气的化合价为零。××××√1化合价直通车1、某元素 R的氧化物分子中,R与O的原子 个数比为2∶3,则R的化合价是( )。A、+2价 B、+3价 C、-2价 D、-3价 由氧化物中的元素的原子个数比,可确定其化学式为R2O3。根据在化合物中正、负化合价代数和为零的原则及隐含信息氧元素的化合价为-2价 ,可推算出R的化合价应是+3价 。B1 2、已知铝的化合价为+3价,硫酸根的化合
价为-2价,则硫酸铝的化学式为 。写符氢金前,非金后正价前,负价后读前写后,读后写前三原则标价约简交叉AlSO4写符Al SO4+3-2Al2(SO4)3Al2(SO4)313、在①N2,②NH4HCO3,③ NO2 ,④NO,
⑤HNO3中,氮元素化合价由低到高的排列
顺序是 。N2、NH4HCO3、 NO2 、NO、HNO3+5+4+2-30NH4HCO3 、 N2 、 NO 、 NO2 、HNO31温故知新氧化钠氧化钾水氧化锌氧化钡氧化铜氧化铁氧化亚铁氧化镁氧化钙四氧化三铁氧化铝1温故知新氯化钠氯化钾氯化氢氯化锌氯化钡氯化铜氯化铁氯化铵氯化亚铁氯化钙氯化镁氯化铝1温故知新硫酸钠硫酸钾硫酸硫酸锌硫酸钡硫酸铜硫酸铁硫酸铵硫酸亚铁硫酸钙硫酸镁硫酸铝1温故知新碳酸钠碳酸钾碳酸碳酸锌碳酸钡碳酸铜碳酸铁碳酸铵碳酸亚铁碳酸钙碳酸镁碳酸铝1温故知新硫酸钠硫酸钾亚硫酸硫酸锌硫酸钡硫酸铜硫酸铁硫酸铵硫酸亚铁硫酸钙硫酸镁硫酸铝1温故知新碳酸氢钠碳酸氢钾碳酸氢铵碳酸氢钙硫酸氢钠硫酸氢钾硫酸氢铵硫酸氢钙1温故知新氢氧化钠氢氧化钾氢氧化钠氢氧化钙氢氧化镁氢氧化锌氢氧化钡氢氧化铜氢氧化铁1
(讲种类、讲个数) 宏观概念
(只讲种类、不讲个数)第6节 表示物质的符号引入:元素可以用元素符号来表示,那么由元素组成的物质是否可用元素符号来表示呢?一、化学式1、化学式是用元素符号来表示物质组成的式子12、化学式的确定依据先通过实验确定物质的组成,然后按国际通用规则书写指出:一种纯净物只有一个化学式13、化学式的写法和读法
(1)单质
金属单质:铁 铝
固态非金属单质:硫 磷
稀有气体:氖气 氦气氧气 氢气用元素符号表示气体单质:练习:写出P30单质的化学式(2)化合物A、氧化物MgO CuO CO2 SO2 Fe3O4P2O5 MnO2写法:氧在后读法氧化某或几氧化几某1
H2O
HCl
H2S
B、氢化物写法氢在前读法某化氢不过也有例外的喔!!!NH3(氨气)
CH4(甲烷)1C、金属元素与非金属
元素组成的物质KCl NaCl写法金前非后读法某化某1下列化学式是否正确,若有错请更正。
氮气—N
氖气—Ne2
氧化镁—MgO
二氧化锰—MNO2
硫化钠—SNa2√N2NeMnO2Na2S化合物的化学式的表示,举例Fe3O4CO2MgOCuOP2O5FeCl3MgCl2ZnSKClO3KMnO4 四氧化三铁二氧化碳氧化镁氧化铜五氧化二磷三氯化铁二氯化镁硫化锌氯酸钾高锰酸钾碳酸钙CaCO3NaOH氢氧化钠1适用于由两种元素组成的物质1复习1.什么是化学式?2.单质、氧化物、金属元素与非金属元素组成的物质的化学式的书写及读法有何规律?3.元素符号表示什么含义?1单质:
X—金属、稀有气体、固态非金属
X2 — N2、O2、H2等气态非金属金前非后,由后往前读做某化某氧化物:氧在后,
一般读做氧化某,1元素符号表示一种元素;该元素的一个原子若要表示“n”个原子,则在元素符号前面加上“n”我们学习了化学式,你知道化学式又有什么含义吗?14、化学式表示的意义例:分析化学式“H2O” 表示的意义H2O①水②水是由氢氧两种元素组成③一个水分子④每个水分子是由2个氢原子1个氧原子构成1化学式表示的意义:一种物质该物质的组成元素该物质的一个分子该物质的分子构成宏观微观写出下列化学式表示的含义CO2 P2O5 NH3CO2二氧化碳二氧化碳由碳元素和氧元素组成一个二氧化 碳分子一个二氧化碳分子由一个碳原子和两个氧原子构成1P2O5五氧化二磷五氧化二磷由磷元素和氧元素组成一个五氧化二磷分子一个五氧化二磷分子由两个磷原子和五个氧原子构成1NH3氨气氨气由氮元素和氢元素组成一个氨分子一个氨分子由一个氮原子和三个氢原子构成1H2O思考:怎样表示2个水分子?2注意:当化学式前面出现数字时,它只能表示微观含义指出下列符号表示的意义氧元素、一个氧原子2个氧原子氧气、一个氧分子2个氧分子二氧化碳一个二氧化碳分子O2OO2CO22CO22O22个二氧化碳分子指出下列符号中“2”表示的意义2OO2CO22CO22O22个氧原子每个氧分子由2个氧原子构成2个氧分子2个二氧化碳分子1个二氧化碳分子中有2个氧原子1二、离子的符号复习:
离子是______的原子或原子团,带正电的离子是____离子,带负电的离子是____离子设问离子用符号怎么表示呢?1、离子符号的表示方法:在元素符号或原子团符号的右上角标出该离子所带的电荷数1如钠离子:Na+ 氯离子:Cl-离子和原子有何不同?它们之间有何联系?钠原子和钠离子是否属于同种元素?原子:核电荷数=质子数=核外电子数
不显电性
离子:核电荷数=质子数≠核外电子数
显电性
通过得失电子相互转化,
因为钠原子和钠离子质子数相同,所以属于同种元素思考1 金属原子易失电子形成阳离子、
非金属原子易得电子形成阴离子。 阳离子、阴离子由于所带电荷电性相反,相互吸引而形成离子化合物。1离子的符号 离子符号是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数 。Na+Cl-带一个单位正电荷的钠离子带一个单位负电荷的氯离子S2-带2个单位负电荷的硫离子1带电原子团 由2种以上元素原子组成的
离子称为某某根离子,这就是带
电原子团 。SO42-CO32-OH-思考离子的组成是否只有一种元素组成呢?1常见带电原子团1 元素之间相互化合时,其原子个数比都有确定的数值,如不是这个数目之比,就不能形成稳定的化合物。 元素化合价是元素在形成化合物时表现出的一种性质,化合价是书写化学式的重要依据,因此学好化合价是掌握化学式这个化学用语的关键问题。再来看一些化合物的化学式其原子个数比: 2:1 1:1 1:1 1:2化合物化学式:Na2S NaCl MgS MgCl21认识化合价:化合价的概念: 一种元素一定数目的原子与另一种元素一定数目的原子相互化合的性质叫化合价12、化合价的表示方法:O Mg+2-2标在元素符号的正上方 左符号右数目标在元素符号的右上角 左数目右符号Al、O、MgAl3+、O2-、Mg2++3-2+2同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反1 化合价的表示方法、读法及与离子的区别化合价表示 : Na Al S Cl O+1+3-2-2-1离子符号 : Na+ Al3+ S2- Cl- O2-+3价的铁(元素)Fe3+ 读做:带3个正电荷的铁离子—简称铁离子同种元素(或原子团)的化合价和离子的电荷,
通常数值相等,位置不同,正负号写法不同。12、常见元素的化合价 1元素化合价的一般规律1、氢元素化合价通常显+1价,氧元素通常显-2价; 2、金属元素的化合价为正价; 3、非金属与氢或金属化合时显负价,与氧元素化
合时显正价; 4、有的一种元素可以有几种化合价 5、单质中元素的化合价为零 6、化合物中各元素化合价的代数和为零 1常见元素的化合价 (背!!)
K Na Ag H 正一价(贾纳迎亲)
Ca Mg Cu、Ba Zn 正二价(盖美铜背心)
氯负一氧负二铝正三
铁有正二和正三
硫有负二正六四1(2)、化合价的一般规律填空: 在化合物中:
①、氢通常显 ;氧通常显 ; ②、金属常显 ;非金属常显 ;
在非金属氧化物里,
非金属显 ,氧显 ,
单质中:元素的化合价 。 ③、化合价原则
在化合物中:
元素正、负化合价的代数和 ,+1价-2价正价负价为 0为0正价负价1Ca(OH)2 CaCO3氢氧根碳酸根不是一种物质,它不能独立存在常见的原子团和化合价OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
PO4 磷酸根 NH4 铵根-1-1-2-3 -2+1原子团:1根据元素化合价书写化合物的化学式 例:写出氧化铝的化学式。(1)写出组成化合物的元素符号,一般正左负右。(2)在符号上方标出相应的化合价。(3)用交叉法写化学式(交叉法:去正负号,约简,上数交叉下移,1不写)。(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O(+3)×2 + (-2)×3 = 6 – 6 = 0Al2 O31 根据化合价,书写化学式(确定原子个数)例题: 1) 已知 Cu 、 Cl ; S 、O写出它们的化学式
2)已知Al 、 SO4 ; Ca 、OH写出其化学式+2 -1 +6 -2+3 -2+2 -1方法:正价前,负价后;
交叉约简找个数。初中只有CH4、 NH3例外CuCl2SO3Al2 (SO4)3Ca(OH)21根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜1、写出有关元素符号
2、标出有关元素的化合价
3、根据化合物中元素化合价
代数和为零的原则,求出
化学式中,各元素的原子
个数。
4、验证所写化学式是否正确。Fe O+3 -2 23验证:(+3)×2 +(-2)×3 = 0Al SO4Cu O+3 - 223( )验证:(+3)×2 + (-2)×3 = 0+2 -2验证:(+2) +(-2)= 0返回1例2、求化合物HnROn+2中,元素R的化合价。
解: HnROn+2(+1)×n + x + (-2)×(n+2) =0X = +(n+4)+1x-21化合价的应用:根据化学式,求某元素的可变化合价:例1、求下列化合物中Mn的化合价
KMnO4 K2MnO4 MnO2解: KMnO4 +1x-2(+1) + x + (-2)×4 = 0X = +7原则:正、负化合价的代数和为零。+6+41
许多元素的原子在不同的条件下,形成可变化合价如:CO (一氧化碳) CO2(二氧化碳)
Fe2O3 (氧化铁 ) FeO(氧化亚铁)
+2+4+3+2关于可变化合价:1练习: 写出下列元素氧化物的化学式:K Ca Al C P S Cl+1 +2 +3 +4 +5 +4 +7K2OCaO Al2O3 CO2 P2O5 SO2 Cl2O71练习书写下列物质的化学式:氯化钙_____________
碳酸钾_____________
硝酸钡_____________CaCl2k2CO3Ba (NO)21小结:
1、用元素符号表示物质组成的式子叫化学式。
2、化学式表示一种物质,表示物质的元素组成,以及组成元素的原子个数比。
3、化学上用化合价表示元素原子之间相互化合的数目。
4、化合物各元素正负化合价的代数和为零。
5、熟记常见元素或原子团的化合价。
1铝离子 ,氧离子 ,
化合价为正二价的镁元素 ,
化合价为负二价的硫元素 ,
二氧化碳中的碳元素为正四价 。 Al3+O2- Mg+2S-2CO2+4练习1化学式中各数字的含义:2P2O5两个五氧化二磷分子(表示分子个数)每个五氧化二磷分子中有两个磷原子
(表示每个分子中某原子的个数)每个氢分子是由两个氢原子构成的前面的2:表示两个氢分子,后面的2:同上表示两个氢原子前面的2:表示两个水分子,
后面的2:表示每个水分子中有两个氢原子。1练习标出下列物质中带点元素的化合价:HCl HClO HClO3
HClO4 HnRO2n+1 .....-1+1+5+7+(3n+2)(+1)× n+x+(-2) ×(2n+1)=0x= +(3n+2)1 根据化合价法则,判断化学式的正、误:
ZnO2 AlO FeSO4 FH K(OH)
氧化锌 氧化铝 硫酸亚铁 氟化氢 氢氧化钾练习7:判断下列化学式是否正确、将错的改正。
氧化铁 硫酸铝 氢氧化铁 硫化钾 氧化钠
FeO AlSO4 Fe(OH)2 K2S NaOFe2O3 ZnO+2 -2Al O+3 -2HF+1-1KOH+1-1Al2(SO4)3Fe(OH)3Na2O+3 –2 +3 -2 +3 –1 +1 -2231通符晓义3SO4+62-“2”“3”“4”“6”一个硫酸根离子带2个单位的负电荷;3个硫酸根离子;一个硫酸根离子中有4个氧原子;硫酸根离子中硫元素的化合价为+6价;1关于“2H3PO4”中数字,下列说法不正确的是( )
A、“3”表示氢元素的个数
B、“4”表示每个磷酸分子中含有氧原子的个数
C、“2”表示磷酸分子的个数
D、 “3”表示每个磷酸分子中含有氢原子的个数A练习1明辩是非1、一种元素只能表现出一种化合价。2、铁单质中,铁元素既可以是+2价,也可 以是+3价。3、在硝酸铵里,氮元素表现出两种化合价。4、KMnO4和K2MnO4中锰元素的化合价相同。5、水中氢气的化合价为零。××××√1化合价直通车1、某元素 R的氧化物分子中,R与O的原子 个数比为2∶3,则R的化合价是( )。A、+2价 B、+3价 C、-2价 D、-3价 由氧化物中的元素的原子个数比,可确定其化学式为R2O3。根据在化合物中正、负化合价代数和为零的原则及隐含信息氧元素的化合价为-2价 ,可推算出R的化合价应是+3价 。B1 2、已知铝的化合价为+3价,硫酸根的化合
价为-2价,则硫酸铝的化学式为 。写符氢金前,非金后正价前,负价后读前写后,读后写前三原则标价约简交叉AlSO4写符Al SO4+3-2Al2(SO4)3Al2(SO4)313、在①N2,②NH4HCO3,③ NO2 ,④NO,
⑤HNO3中,氮元素化合价由低到高的排列
顺序是 。N2、NH4HCO3、 NO2 、NO、HNO3+5+4+2-30NH4HCO3 、 N2 、 NO 、 NO2 、HNO31温故知新氧化钠氧化钾水氧化锌氧化钡氧化铜氧化铁氧化亚铁氧化镁氧化钙四氧化三铁氧化铝1温故知新氯化钠氯化钾氯化氢氯化锌氯化钡氯化铜氯化铁氯化铵氯化亚铁氯化钙氯化镁氯化铝1温故知新硫酸钠硫酸钾硫酸硫酸锌硫酸钡硫酸铜硫酸铁硫酸铵硫酸亚铁硫酸钙硫酸镁硫酸铝1温故知新碳酸钠碳酸钾碳酸碳酸锌碳酸钡碳酸铜碳酸铁碳酸铵碳酸亚铁碳酸钙碳酸镁碳酸铝1温故知新硫酸钠硫酸钾亚硫酸硫酸锌硫酸钡硫酸铜硫酸铁硫酸铵硫酸亚铁硫酸钙硫酸镁硫酸铝1温故知新碳酸氢钠碳酸氢钾碳酸氢铵碳酸氢钙硫酸氢钠硫酸氢钾硫酸氢铵硫酸氢钙1温故知新氢氧化钠氢氧化钾氢氧化钠氢氧化钙氢氧化镁氢氧化锌氢氧化钡氢氧化铜氢氧化铁1
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
