第七节元素符号表示的量/第1课时[下学期]
文档属性
| 名称 | 第七节元素符号表示的量/第1课时[下学期] |
|
|
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-03-13 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
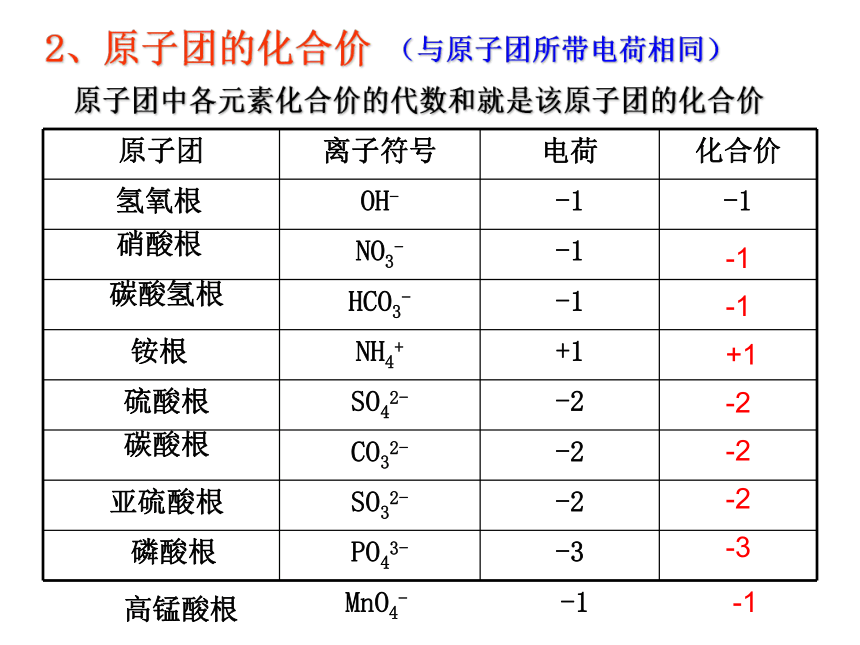
2、原子团的化合价
原子团 离子符号 电荷 化合价
OH- -1 -1
NO3- -1
HCO3- -1
NH4+ +1
SO42- -2
CO32- -2
SO32- -2
PO43- -3
(与原子团所带电荷相同)
MnO4-
氢氧根
硝酸根
碳酸氢根
铵根
硫酸根
碳酸根
亚硫酸根
磷酸根
高锰酸根
-1
-1
-1
+1
-2
-2
-2
-3
-1
原子团中各元素化合价的代数和就是该原子团的化合价
3、化合价的一般规律:
(1)在化合物里氢元素通常显___价、氧元素___价。
(2)金属元素在化合物中通常显___价。
(3)非金属元素跟氧化合时常显___价,跟氢化合时常显___价。
(4)单质里元素的化合价为___。
(5)在化合物里,元素正负化合价的代数和为___。
(6)同一元素在不同的化合物里,可能显示____的化合价,如 SO2 CO2;有些元素在不同的化合物里可显示 ____(填“相同”或“不同”)的化合价,如SO2,SO3 ;有些元素在相同的化合物里可显示_____的化合价,如NH4NO3。
-2 -2
-3 +5
+4 +6
+1
-2
正
正
负
零
零
相同
不同
不同
4、根据元素化合价书写化合物的化学式
例:写出氧化铝的化学式。
(1)写出组成化合物的元素符号,一般正左负右。
(2)在符号上方标出相应的化合价。
(3)用交叉法写化学式。
(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O
3
2
-
+
(+3)×2 + (-2)×3 = 6 – 6 = 0
2
3
比较符号“Na+”与“Na”的异同点?
2、Na+带电符号在元素符号右上角、化合价标在元素符号正上方;
+1
1、Na+表示钠离子,Na表示钠元素显+1价;
+1
3、Na+带1个单位正电荷“1”必须省略,Na,+1价中的“1”不能省略。
+1
(3).化学式为H2SO4的硫酸是由下列什么组成或构成的 ( )
A.氢原子、硫原子、氧原子
B.氢分子、硫原子、4个氧原子
C.氢元素、硫元素、氧元素
D.2个氢原子、1个SO4原子
C
(4)写出下列物质的化学式或名称。
物质名称 化学式 物质名称 化学式
五氧化二氮 四氯化碳
氧化镁 一氧化二氮
磷酸钡 氢氧化钙
一氧化氮 碳酸氢铵
(5)在化学式为HNO3和H2CO3的1个分子中,具有相同的 ( )
A.氢元素和氧元素
B.氧原子个数
C.氢原子和氧原子
D.氢原子和氧原子个数
B
(6).下列物质里,氮元素的化合价为零的是( )
A.NH3 B.N2
C.HNO3 D.N2O5
(3).下列物质的化学式正确的是 ( )
A.氯化钠Na2Cl B.氧化铁FeO
C.氧化钡OBa D.硫酸铝Al2(SO4)3
B
D
(7).下列化合物中,所含原子团的化合价最高的是( )
A.KMnO4 B.ZnSO4
C.Fe(NO3)2 D.(NH4)2S
(8).若磷酸根(PO4)的化合价为-3价,下列化学式正确的是 ( )
A.Ca(H2PO4)2
B.Ca(HPO4)2
C.CaH2PO4
D.Ca2 HPO4
课后练习。
D
A
第 7 节
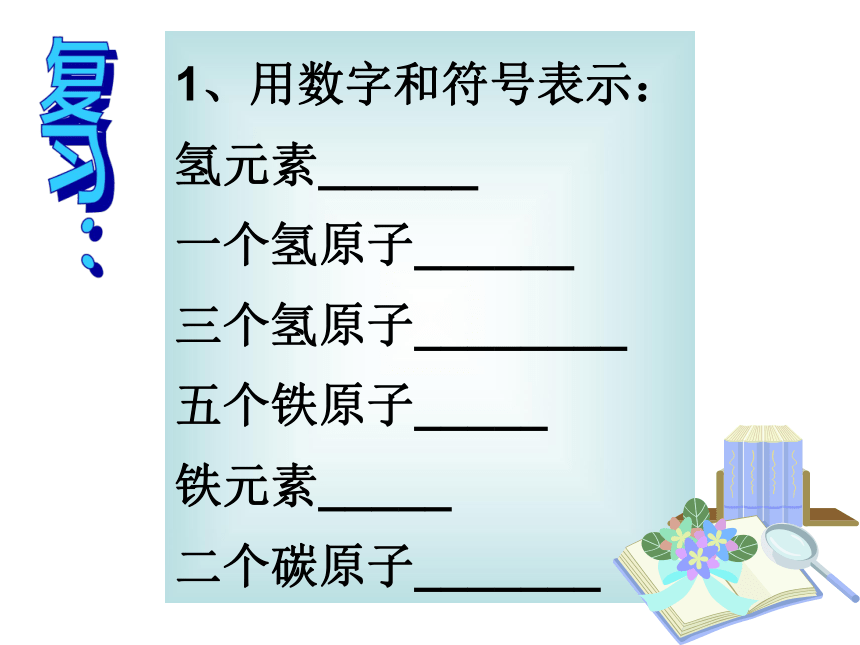
1、用数字和符号表示:
氢元素______
一个氢原子______
三个氢原子________
五个铁原子_____
铁元素_____
二个碳原子_______
看到 “ C”能想到什么?
你能求出什么量?
一个氢原子的质量:1.674×10-27千克
一个碳—12原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克
一个甲烷分子和一个足球烯C60分子的质量分别是多少?
谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
国际上规定:采用相对原子质量来表示
原子的质量关系。
一、相对原子质量
探讨:如何求相对原子质量?
1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克
2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。
碳原子
碳原子的1/12
录象
以C-12质量的1/12作为标准,其它原子的质量跟它相比所得的比值,叫做这种原子的相对原子质量。
例如:1个碳—12原子质量=1.993×10-26千克,则1个碳—12原子质量的1/12=1.993×10- 26×1/12
=1.661×10-27千克,
1个氧原子的质量=2.657×10-26千克
则1个氧原子的相对原子质量=2.657×10-26千克/1.661×10-27千克≈16
2.657×10-26千克
氧的相对原子质量=
氢的相对原子质量=
碳的相对原子质量=
1.661×10-27千克
1.674×10-27千克
=16
1.661×10-27千克
1.993×10-26千克
=1
1.661×10-27千克
=12
求出氧、氢、碳的相对原子质量
一个氢原子的质量:1.674×10-27千克
一个碳—12原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克
我们要用到某原子的相对质量,是否都需要进行计算?
1、从元素周期表(附录5)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cl__________
请查出1~18号元素的相对原子质量
获得什么启发?
相对原子质量 = 质子数 + 中子数
小结:通过上述知识,我们可以得出,求任何一个原子的相对原子质量有以下三种方法:
1、计算
2、 查表
3、 相对原子质量=质子数+中子数。
练习
1、说出下列符号所代表的含义:
(1)H2O
(2)SO2
表示水;
表示一个水分子;
表示水由氢和氧元素组成;
表示一个水分子由2个氢原子和1个氧
原子构成;
练习
2、根据元素的相对原子质量,计算下列符号所代表的量。
2H 3O
5N 2S
2
48
70
64
相对分子质量:一个分子中各原子的
相对原子质量总和
二、相对分子质量
原子质量可以用相对原子质量表示,分子质量也可以用相对分子质量表示。
2、计算方法:
化合物的相对分子质量=各原子相对原子质量×原子个数+ ……
例:求二氧化碳、硫酸的相对分子质量
步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和
求二氧化碳、硫酸的相对分子质量
CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:1×2 + 32 + 16×4 = 98
已知:C—12 O—16 H—1 N—14 Ca—40 S—32
求出下列相对分子质量:
CH4_____ H2O_____ Ca(OH)2_____
CO(NH2)2_____ (NH4)2SO4______
3H2O_____ 4CO2_____ 5Mg(OH)2_____
相对原子质量和相对分子质量有没有单位?
什么物质的相对分子质量最小?
化学式表示什么?
(1)
(2)
(3)
(4)
(5)
碳原子
氧原子
氧原子
氧元素
碳元素
CO2气体
相对分子质量为:
12+2× 16=44
二氧化碳分子
CO2
(1)表示该种物质(二氧化碳气体)
(2)表示该物质的一个分子的构成(CO2分子由碳原子和氧原子构成)
(3)表示这种物质的组成(二氧化碳由碳元素和氧元素组成)
(4)表示该物质的一个分子(一个二氧化碳分子)
(5)表示该物质的相对分子质量
练习(1)填下表。
原子名称 质子数 电子数 中子数 相对原子质量
氢原子 1 0
钠原子 11 23
磷原子 15 31
1
1
11
12
15
16
(2)若碳—12原子的质量为a克,A原子的质量力b克,则A原子的相对原子质量为 ( )
A. B. C. D.
(3)说出下列符号所表达的意义。
H
S
Na
氢元素 、 1个氢原子 、 氢的相对原子质量为1 。
硫 、 硫元素 、 1个硫原子 、 硫的相对原子质量为32 。
金属钠 、 钠元素 、 1个钠原子 、 钠的相对原子质量为23 。
A
(4)下列关于相对原子质量的说法,正确的是( )
A.国际单位中原子相对质量的单位是千克
B.相对原子质量是一个比值
C.相对原子质量就是一个原子的实际质量
D.相对质量的单位是克
(5)关于相对分子质量的说法,正确的是 ( )
A.分子质量 B.各原子质量之和
C.以克为单位 D.相对原子质量的总和
B
D
(6)计算下列物质的相对分子质量。
Fe2(SO4)3:
(NH4)2CO3:
(Ca(NO3)2:
2H2O:
CuSO4·5H2O
56×2+(32+16×4)×3=400 。
(14+4)×2+12+16×3=96 。
40+(14+16×3)×2=164 。
2×(1×2+16)=36
250
2、原子团的化合价
原子团 离子符号 电荷 化合价
OH- -1 -1
NO3- -1
HCO3- -1
NH4+ +1
SO42- -2
CO32- -2
SO32- -2
PO43- -3
(与原子团所带电荷相同)
MnO4-
氢氧根
硝酸根
碳酸氢根
铵根
硫酸根
碳酸根
亚硫酸根
磷酸根
高锰酸根
-1
-1
-1
+1
-2
-2
-2
-3
-1
原子团中各元素化合价的代数和就是该原子团的化合价
3、化合价的一般规律:
(1)在化合物里氢元素通常显___价、氧元素___价。
(2)金属元素在化合物中通常显___价。
(3)非金属元素跟氧化合时常显___价,跟氢化合时常显___价。
(4)单质里元素的化合价为___。
(5)在化合物里,元素正负化合价的代数和为___。
(6)同一元素在不同的化合物里,可能显示____的化合价,如 SO2 CO2;有些元素在不同的化合物里可显示 ____(填“相同”或“不同”)的化合价,如SO2,SO3 ;有些元素在相同的化合物里可显示_____的化合价,如NH4NO3。
-2 -2
-3 +5
+4 +6
+1
-2
正
正
负
零
零
相同
不同
不同
4、根据元素化合价书写化合物的化学式
例:写出氧化铝的化学式。
(1)写出组成化合物的元素符号,一般正左负右。
(2)在符号上方标出相应的化合价。
(3)用交叉法写化学式。
(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O
3
2
-
+
(+3)×2 + (-2)×3 = 6 – 6 = 0
2
3
比较符号“Na+”与“Na”的异同点?
2、Na+带电符号在元素符号右上角、化合价标在元素符号正上方;
+1
1、Na+表示钠离子,Na表示钠元素显+1价;
+1
3、Na+带1个单位正电荷“1”必须省略,Na,+1价中的“1”不能省略。
+1
(3).化学式为H2SO4的硫酸是由下列什么组成或构成的 ( )
A.氢原子、硫原子、氧原子
B.氢分子、硫原子、4个氧原子
C.氢元素、硫元素、氧元素
D.2个氢原子、1个SO4原子
C
(4)写出下列物质的化学式或名称。
物质名称 化学式 物质名称 化学式
五氧化二氮 四氯化碳
氧化镁 一氧化二氮
磷酸钡 氢氧化钙
一氧化氮 碳酸氢铵
(5)在化学式为HNO3和H2CO3的1个分子中,具有相同的 ( )
A.氢元素和氧元素
B.氧原子个数
C.氢原子和氧原子
D.氢原子和氧原子个数
B
(6).下列物质里,氮元素的化合价为零的是( )
A.NH3 B.N2
C.HNO3 D.N2O5
(3).下列物质的化学式正确的是 ( )
A.氯化钠Na2Cl B.氧化铁FeO
C.氧化钡OBa D.硫酸铝Al2(SO4)3
B
D
(7).下列化合物中,所含原子团的化合价最高的是( )
A.KMnO4 B.ZnSO4
C.Fe(NO3)2 D.(NH4)2S
(8).若磷酸根(PO4)的化合价为-3价,下列化学式正确的是 ( )
A.Ca(H2PO4)2
B.Ca(HPO4)2
C.CaH2PO4
D.Ca2 HPO4
课后练习。
D
A
第 7 节
1、用数字和符号表示:
氢元素______
一个氢原子______
三个氢原子________
五个铁原子_____
铁元素_____
二个碳原子_______
看到 “ C”能想到什么?
你能求出什么量?
一个氢原子的质量:1.674×10-27千克
一个碳—12原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克
一个甲烷分子和一个足球烯C60分子的质量分别是多少?
谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
国际上规定:采用相对原子质量来表示
原子的质量关系。
一、相对原子质量
探讨:如何求相对原子质量?
1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克
2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。
碳原子
碳原子的1/12
录象
以C-12质量的1/12作为标准,其它原子的质量跟它相比所得的比值,叫做这种原子的相对原子质量。
例如:1个碳—12原子质量=1.993×10-26千克,则1个碳—12原子质量的1/12=1.993×10- 26×1/12
=1.661×10-27千克,
1个氧原子的质量=2.657×10-26千克
则1个氧原子的相对原子质量=2.657×10-26千克/1.661×10-27千克≈16
2.657×10-26千克
氧的相对原子质量=
氢的相对原子质量=
碳的相对原子质量=
1.661×10-27千克
1.674×10-27千克
=16
1.661×10-27千克
1.993×10-26千克
=1
1.661×10-27千克
=12
求出氧、氢、碳的相对原子质量
一个氢原子的质量:1.674×10-27千克
一个碳—12原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克
我们要用到某原子的相对质量,是否都需要进行计算?
1、从元素周期表(附录5)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cl__________
请查出1~18号元素的相对原子质量
获得什么启发?
相对原子质量 = 质子数 + 中子数
小结:通过上述知识,我们可以得出,求任何一个原子的相对原子质量有以下三种方法:
1、计算
2、 查表
3、 相对原子质量=质子数+中子数。
练习
1、说出下列符号所代表的含义:
(1)H2O
(2)SO2
表示水;
表示一个水分子;
表示水由氢和氧元素组成;
表示一个水分子由2个氢原子和1个氧
原子构成;
练习
2、根据元素的相对原子质量,计算下列符号所代表的量。
2H 3O
5N 2S
2
48
70
64
相对分子质量:一个分子中各原子的
相对原子质量总和
二、相对分子质量
原子质量可以用相对原子质量表示,分子质量也可以用相对分子质量表示。
2、计算方法:
化合物的相对分子质量=各原子相对原子质量×原子个数+ ……
例:求二氧化碳、硫酸的相对分子质量
步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和
求二氧化碳、硫酸的相对分子质量
CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:1×2 + 32 + 16×4 = 98
已知:C—12 O—16 H—1 N—14 Ca—40 S—32
求出下列相对分子质量:
CH4_____ H2O_____ Ca(OH)2_____
CO(NH2)2_____ (NH4)2SO4______
3H2O_____ 4CO2_____ 5Mg(OH)2_____
相对原子质量和相对分子质量有没有单位?
什么物质的相对分子质量最小?
化学式表示什么?
(1)
(2)
(3)
(4)
(5)
碳原子
氧原子
氧原子
氧元素
碳元素
CO2气体
相对分子质量为:
12+2× 16=44
二氧化碳分子
CO2
(1)表示该种物质(二氧化碳气体)
(2)表示该物质的一个分子的构成(CO2分子由碳原子和氧原子构成)
(3)表示这种物质的组成(二氧化碳由碳元素和氧元素组成)
(4)表示该物质的一个分子(一个二氧化碳分子)
(5)表示该物质的相对分子质量
练习(1)填下表。
原子名称 质子数 电子数 中子数 相对原子质量
氢原子 1 0
钠原子 11 23
磷原子 15 31
1
1
11
12
15
16
(2)若碳—12原子的质量为a克,A原子的质量力b克,则A原子的相对原子质量为 ( )
A. B. C. D.
(3)说出下列符号所表达的意义。
H
S
Na
氢元素 、 1个氢原子 、 氢的相对原子质量为1 。
硫 、 硫元素 、 1个硫原子 、 硫的相对原子质量为32 。
金属钠 、 钠元素 、 1个钠原子 、 钠的相对原子质量为23 。
A
(4)下列关于相对原子质量的说法,正确的是( )
A.国际单位中原子相对质量的单位是千克
B.相对原子质量是一个比值
C.相对原子质量就是一个原子的实际质量
D.相对质量的单位是克
(5)关于相对分子质量的说法,正确的是 ( )
A.分子质量 B.各原子质量之和
C.以克为单位 D.相对原子质量的总和
B
D
(6)计算下列物质的相对分子质量。
Fe2(SO4)3:
(NH4)2CO3:
(Ca(NO3)2:
2H2O:
CuSO4·5H2O
56×2+(32+16×4)×3=400 。
(14+4)×2+12+16×3=96 。
40+(14+16×3)×2=164 。
2×(1×2+16)=36
250
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
