1.3原子结构的模型[下学期]
图片预览








文档简介
课件47张PPT。第三节原子结构模型一.原子结构模型的建立与修正原子的发现道尔顿近代原子学说
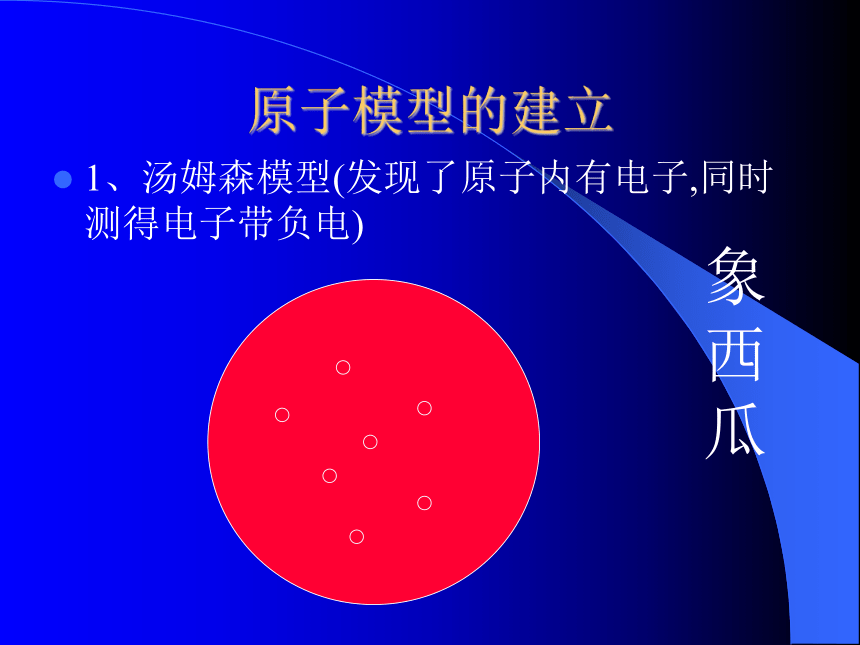
实心球体 原子模型的建立1、汤姆森模型(发现了原子内有电子,同时测得电子带负电)象西瓜
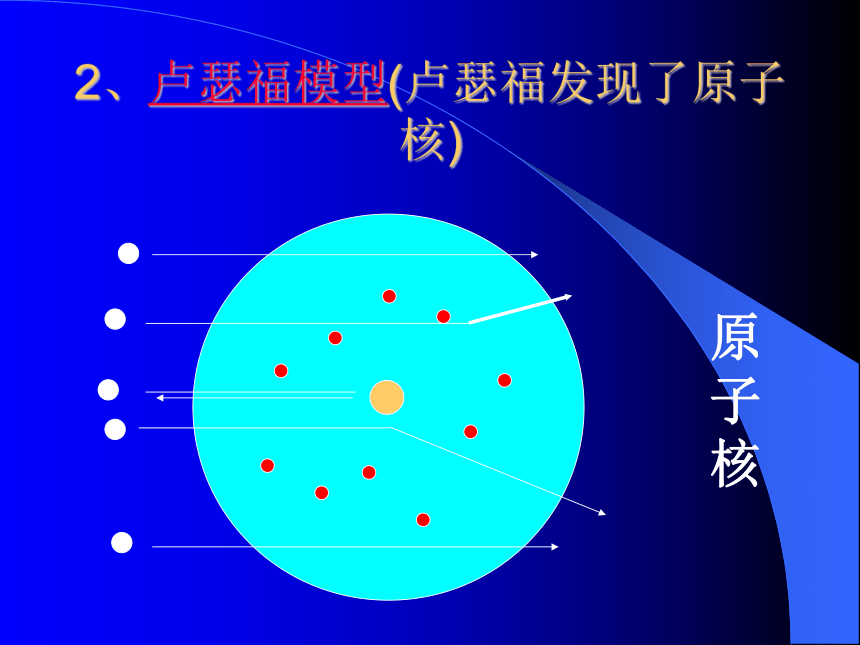
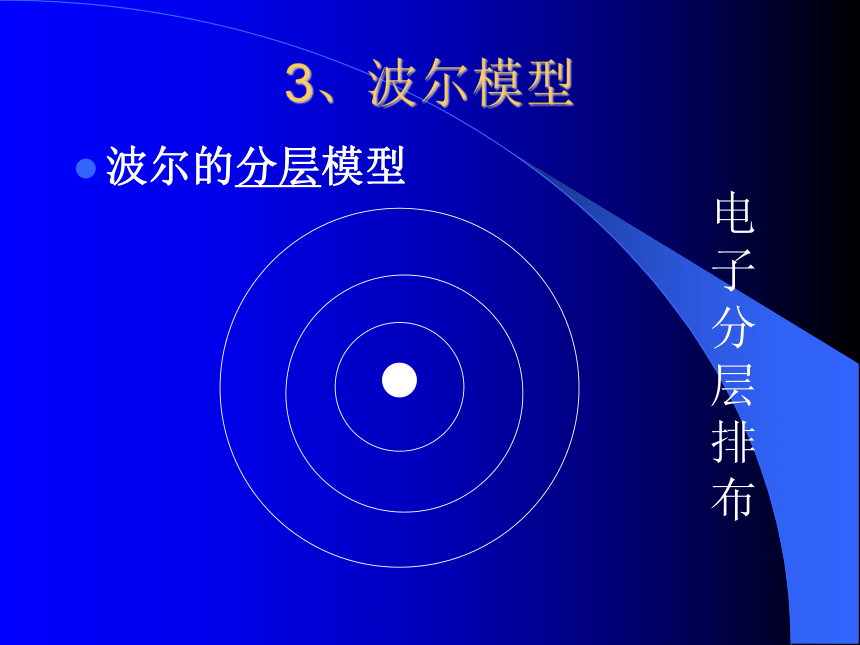
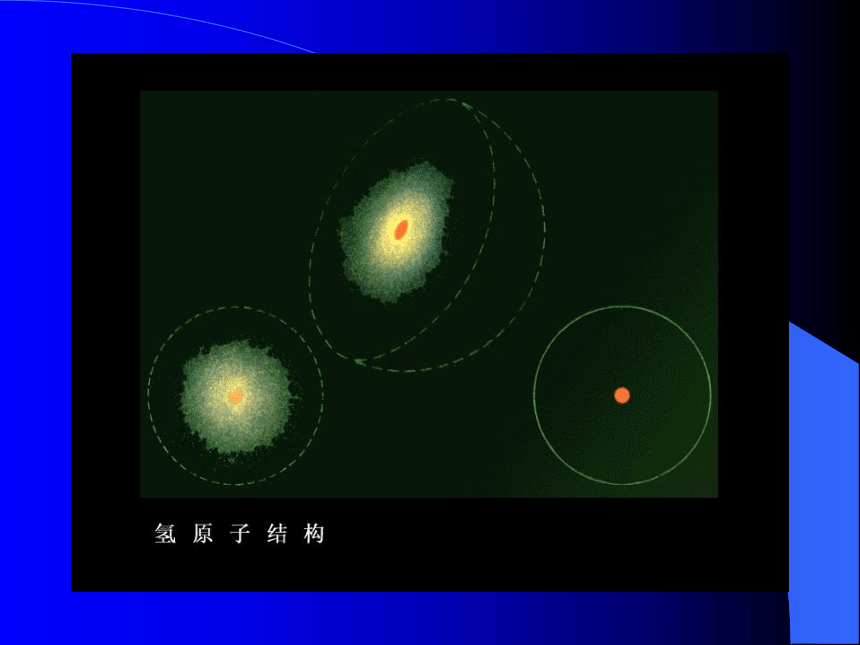
2、卢瑟福模型(卢瑟福发现了原子核)原子核3、波尔模型波尔的分层模型电子分层排布电子云原子的结构 原子核(带正电)
原子
核外电子(带负电)
一个电子带一个单位负电荷二、揭开原子核的秘密原子核的结构
原子核
质子中子质子:一个质子带一个单位正电荷。中子:不带电。
核外电子(带负电)
原子
(不带电) 原子核 质子 (带正电)
中子 (不带电)
质子和中子由夸克构成
在原子中, 原子核与核外电子所带电荷电量相等,电性相反,因此原子显电中性 .1、核电荷数:原子核所带的 电荷数
核电荷数=质子数=电子数
2 、原子核中不一定有中子
(氢原子核中只有一个质子,没 有中子)小结:填表原子的质量主要集中在原子核上。
原子得失电子后可以认为其质量不变
3、比较原子中质子、中子和电子的质量大小
质子质量为: 1.6726×10-27kg
中子质量为:1.6748×10-27kg
电子质量为: 9.1176×10-31kg大约 为质子或中子的1/1864
补充:核外电子排布的初步知识 一、核外电子的分层排布 核外电子的能量不同,决定了核外
电子的分层排布2019-3-3电子层 一 二 三 四 五 六 七
K L M N O P Q 核外电子的能量 依次增大 离核距离 依次增大 能量低的电子在离核近的电子层运动,能量高的电子在离核远的电子层运动2019-3-3核外电子排布主要遵循的原则
1、电子首先排布在能量最低的电子层,
然后由里往外排;2、每层最多容纳的电子数为2 n2个
(n为电子层数)3、最外层不超过8个电子2019-3-3二、原子结构示意图 用原子结构示意图表示核外电子排布(以钠原子为例)
Na 2 8 1
+11弧线表示电子层最外层电子数核内质子数原子核2019-3-3三、元素与同位素1、元素:具有相同核电荷数
(即质子数)的一类原子的总称。①目前已发现的元素有一百余种②地壳中含量占前四位的元素:
氧48.46%,硅26.30%,铝
7.73%,铁4.75%
2019-3-31.一种元素与另一种元素的本质区别是( )
A.核外电子数不同
B.中子数不同
C.质子数不同
D.原子的质量不同练习C氧元素的三种原子的原子核的差异:
8个质子
8个中子8个质子
9个中子8个质子
10个中子2.同位素——原子的“孪生兄弟”原子中核内质子数相同,中子数不相同的同类原子统称为同位素原子。同位素的表示方法
8O
17质子数+中子数质子数质子数与中子数之和也可称为原子的质量数或写为:17O 或O-17
氢元素的三种同位素:
普通氢 氕:H ( 1H )
重氢 氘:D ( 1H )
超重氢 氚:T ( 1H )132大多数元素都有同位素原子;
同位素原子的质量不同,化学 性质基本相同;
同位素原子在工业、农业、医疗、国防等方面有着广泛的应用四、离子各类元素的原子结构特点 1、稀有气体元素 原子的最外层有8个电子(最外层是第一层时有2个电子),是一种相对稳定的结构,化学性质稳定。
+22HeNe+102 82019-3-3 2、金属元素 原子的最外层电子数一般少于4,在化学反应中易失去电子,形成相对稳定的电子层结构2 8 1Mg2 8 22 82 82019-3-3 3、非金属元素 原子的最外层电子数一般多于或等于4,在化学反应中易得到电子,形成相对稳定的电子层结构2019-3-3实验:金属钠在氯气中燃烧实验现象:金属钠燃烧,发出黄色火焰,生成白烟。
反应的文字表达式:钠+氯气 → 氯化钠点燃—+氯原子
氯离子钠原子钠离子得1e-失 1e-静电作用氯化钠反应的微观解释:离子:带电的原子或原子团。
1、阳离子
原子或原子团失去电子——质子数大于电子数——带正电——阳离子。
阳离子:H+、Na+、Mg2+、Al3+、NH4+
2. 阴离子
原子或原子团得到电子——质子数小于电子数——带负电——阴离子。
阴离子:F-、O2-、S2-、Cl-、SO42-
3.离子也是构成物质的一种微粒.
阴阳离子通过静电作用结合在一起.在离子构成的物质中,由阴阳离子保持物质的化学性质.如氯化钠由钠离子和氯离子
构成,则保持氯化钠化学性质
的是钠离子和氯离子 4、离子跟原子的比较 区 微粒 原子 离 子
别与
联系
结构电性表示法相互转
化关系核内质子数= 核内质子数> 核内质子数< 核外电子数 核外电子数 核外电子数不带电 带正电 带负电用元素符号
表示:Na S用离子符号
表示:Na+ 用离子符号
表示:S2-阳离子 原子 阴离子得电子 得电子
失电子 失电子阳离子 阴离子2019-3-3 (1)核电荷数(质子数)决定元素种类(2)最外层电子数决定元素的化学性质(3)质子数与核外电子数的异同决定
微粒是原子,还是离子(4)质子数与中子数决定原子质量小结:2019-3-31.下列关于原子的说法不正确的是( )
A.构成物质的一种微粒
B.化学变化中的最小微粒
C.化学反应中可以再分
D.由原子核和核外电子构成的C2.在电解水这一变化中,没有变化的粒子是( )
A.水分子 B.水原子
C.氢原子和氧原子 D.以上都不是C3.下列关于原子的说法中,正确的是( )
A.原子不显电性,说明原子内的质子数等于 中子数
B.同种原子内的质子数相同
C.含有相同中子数的原子,一定是同一种类的原子
D.原子是最小的微粒B4.在二氧化碳中含有( )
A.氢氧两种元素 B.氧分子
C.三个原子 D.两个氧元素
5.A 、B两原子核电荷数相同,中子数不同,它们是( );若中子数相同,核电荷数不同,则它们是( ),若A 、B两个简单的微粒质子数相同,核外电子数不同,则它们可能是( ) A同位素原子不同元素的原子同种元素的原子和离子或同种元素的两种离子5.原子变成离子后,一定会发生变化的
是( )
A.质量 B.中子数
C.质子数 D.核外电子数
6.下列微粒中,质子数比电子数多的是( )
A.阳离子 B.阴离子
C.分子 D.原子DA
实心球体 原子模型的建立1、汤姆森模型(发现了原子内有电子,同时测得电子带负电)象西瓜
2、卢瑟福模型(卢瑟福发现了原子核)原子核3、波尔模型波尔的分层模型电子分层排布电子云原子的结构 原子核(带正电)
原子
核外电子(带负电)
一个电子带一个单位负电荷二、揭开原子核的秘密原子核的结构
原子核
质子中子质子:一个质子带一个单位正电荷。中子:不带电。
核外电子(带负电)
原子
(不带电) 原子核 质子 (带正电)
中子 (不带电)
质子和中子由夸克构成
在原子中, 原子核与核外电子所带电荷电量相等,电性相反,因此原子显电中性 .1、核电荷数:原子核所带的 电荷数
核电荷数=质子数=电子数
2 、原子核中不一定有中子
(氢原子核中只有一个质子,没 有中子)小结:填表原子的质量主要集中在原子核上。
原子得失电子后可以认为其质量不变
3、比较原子中质子、中子和电子的质量大小
质子质量为: 1.6726×10-27kg
中子质量为:1.6748×10-27kg
电子质量为: 9.1176×10-31kg大约 为质子或中子的1/1864
补充:核外电子排布的初步知识 一、核外电子的分层排布 核外电子的能量不同,决定了核外
电子的分层排布2019-3-3电子层 一 二 三 四 五 六 七
K L M N O P Q 核外电子的能量 依次增大 离核距离 依次增大 能量低的电子在离核近的电子层运动,能量高的电子在离核远的电子层运动2019-3-3核外电子排布主要遵循的原则
1、电子首先排布在能量最低的电子层,
然后由里往外排;2、每层最多容纳的电子数为2 n2个
(n为电子层数)3、最外层不超过8个电子2019-3-3二、原子结构示意图 用原子结构示意图表示核外电子排布(以钠原子为例)
Na 2 8 1
+11弧线表示电子层最外层电子数核内质子数原子核2019-3-3三、元素与同位素1、元素:具有相同核电荷数
(即质子数)的一类原子的总称。①目前已发现的元素有一百余种②地壳中含量占前四位的元素:
氧48.46%,硅26.30%,铝
7.73%,铁4.75%
2019-3-31.一种元素与另一种元素的本质区别是( )
A.核外电子数不同
B.中子数不同
C.质子数不同
D.原子的质量不同练习C氧元素的三种原子的原子核的差异:
8个质子
8个中子8个质子
9个中子8个质子
10个中子2.同位素——原子的“孪生兄弟”原子中核内质子数相同,中子数不相同的同类原子统称为同位素原子。同位素的表示方法
8O
17质子数+中子数质子数质子数与中子数之和也可称为原子的质量数或写为:17O 或O-17
氢元素的三种同位素:
普通氢 氕:H ( 1H )
重氢 氘:D ( 1H )
超重氢 氚:T ( 1H )132大多数元素都有同位素原子;
同位素原子的质量不同,化学 性质基本相同;
同位素原子在工业、农业、医疗、国防等方面有着广泛的应用四、离子各类元素的原子结构特点 1、稀有气体元素 原子的最外层有8个电子(最外层是第一层时有2个电子),是一种相对稳定的结构,化学性质稳定。
+22HeNe+102 82019-3-3 2、金属元素 原子的最外层电子数一般少于4,在化学反应中易失去电子,形成相对稳定的电子层结构2 8 1Mg2 8 22 82 82019-3-3 3、非金属元素 原子的最外层电子数一般多于或等于4,在化学反应中易得到电子,形成相对稳定的电子层结构2019-3-3实验:金属钠在氯气中燃烧实验现象:金属钠燃烧,发出黄色火焰,生成白烟。
反应的文字表达式:钠+氯气 → 氯化钠点燃—+氯原子
氯离子钠原子钠离子得1e-失 1e-静电作用氯化钠反应的微观解释:离子:带电的原子或原子团。
1、阳离子
原子或原子团失去电子——质子数大于电子数——带正电——阳离子。
阳离子:H+、Na+、Mg2+、Al3+、NH4+
2. 阴离子
原子或原子团得到电子——质子数小于电子数——带负电——阴离子。
阴离子:F-、O2-、S2-、Cl-、SO42-
3.离子也是构成物质的一种微粒.
阴阳离子通过静电作用结合在一起.在离子构成的物质中,由阴阳离子保持物质的化学性质.如氯化钠由钠离子和氯离子
构成,则保持氯化钠化学性质
的是钠离子和氯离子 4、离子跟原子的比较 区 微粒 原子 离 子
别与
联系
结构电性表示法相互转
化关系核内质子数= 核内质子数> 核内质子数< 核外电子数 核外电子数 核外电子数不带电 带正电 带负电用元素符号
表示:Na S用离子符号
表示:Na+ 用离子符号
表示:S2-阳离子 原子 阴离子得电子 得电子
失电子 失电子阳离子 阴离子2019-3-3 (1)核电荷数(质子数)决定元素种类(2)最外层电子数决定元素的化学性质(3)质子数与核外电子数的异同决定
微粒是原子,还是离子(4)质子数与中子数决定原子质量小结:2019-3-31.下列关于原子的说法不正确的是( )
A.构成物质的一种微粒
B.化学变化中的最小微粒
C.化学反应中可以再分
D.由原子核和核外电子构成的C2.在电解水这一变化中,没有变化的粒子是( )
A.水分子 B.水原子
C.氢原子和氧原子 D.以上都不是C3.下列关于原子的说法中,正确的是( )
A.原子不显电性,说明原子内的质子数等于 中子数
B.同种原子内的质子数相同
C.含有相同中子数的原子,一定是同一种类的原子
D.原子是最小的微粒B4.在二氧化碳中含有( )
A.氢氧两种元素 B.氧分子
C.三个原子 D.两个氧元素
5.A 、B两原子核电荷数相同,中子数不同,它们是( );若中子数相同,核电荷数不同,则它们是( ),若A 、B两个简单的微粒质子数相同,核外电子数不同,则它们可能是( ) A同位素原子不同元素的原子同种元素的原子和离子或同种元素的两种离子5.原子变成离子后,一定会发生变化的
是( )
A.质量 B.中子数
C.质子数 D.核外电子数
6.下列微粒中,质子数比电子数多的是( )
A.阳离子 B.阴离子
C.分子 D.原子DA
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
