元素符号表示的量(第二三课时)[下学期]
文档属性
| 名称 | 元素符号表示的量(第二三课时)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 70.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2006-03-13 00:00:00 | ||
图片预览











文档简介
课件45张PPT。第7节 元素符号表示的量(2)1.如果碳-12原子的质量为M千克,X原子的质量为N千克,则X原子的相对原子质量为( )
M/12N B. 12M/N
C. N/12M D.12N/MD解题依据:变式1:已知1个碳-12原子的质量为m千克,某元素的1个原子的质量7m千克,则该元素的相对原子质量_____.84变式2:甲原子与乙原子的质量之比为x:y,而乙原子与12C原子的质量之比为n:m,则甲原子的相对原子质量为_______.2.某原子核内有n个中子,相对原子质量是N,该原子的核电荷数是________,原子核外的电子数是______.制造原子弹的原料为铀-235,这种铀原子的相对原子质量为_____,若其核电荷数为92,则其核内的中子数为_____,质子数为_____,核外电子数为______.N-n N-n 92 92143235课前复习想一想:1.相对原子质量是以什么为标准的?以一个C-12原子的质量的1/12作为标准2.相对分子质量是指什么?相对分子质量是指一个分子中各原子的
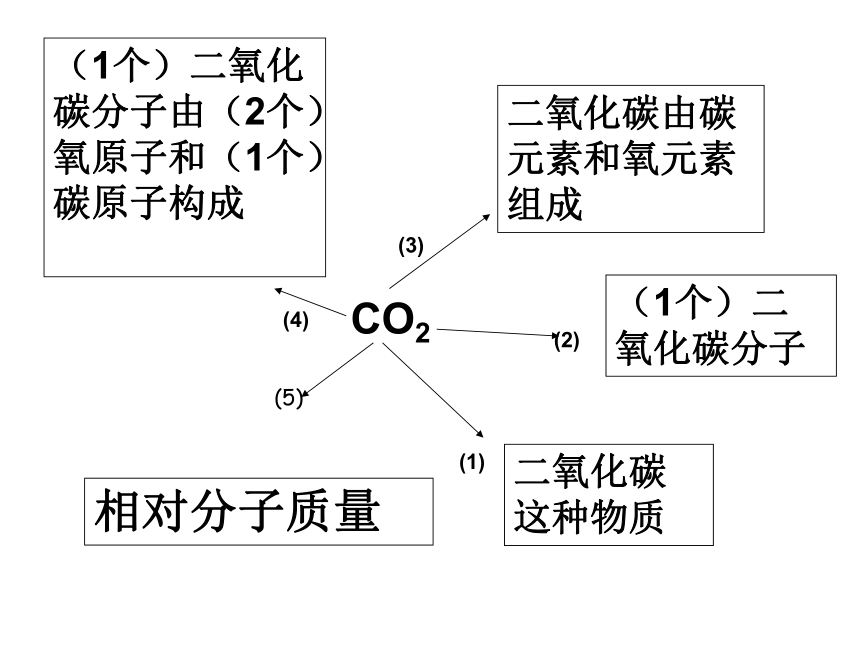
相对原子质量的总和3.化学式的意义:CO2二氧化碳这种物质(1个)二氧化碳分子二氧化碳由碳元素和氧元素组成(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成(1)(2)(3)(4)(5)相对分子质量求下列物质的相对分子质量:1.三氧化硫(SO3)的相对分子质量
2.氧化钙(CaO)的相对分子质量
=40 ×1+16 ×1=56=32×1+16 ×3=80
3.磷酸(H3PO4)的相对分子质量=1×3+31×1+16×4=984.五氧化二磷(P2O5)的相对分子质量=31 ×2+16 ×5=142(5)尿素CO(NH2)2的相对分子质量=14×1+16×1+(14×1+1×2)×2
=60(6)硫酸铜晶体(CuSO4.5H2O)的
相对分子质量=64×1+32×1+16×4+5(1×2+16)
=250根据化学式可以计算相对分子质量,
还可以有哪些计算呢?一、根据化学式还可以计算组成物质的
各元素的质量比例如:求水中氢元素和氧元素的质量比;解:H:O=(1 × 2):(16 × 1)=1:8练一练:1.求:SO2中硫元素和氧元素的质量比解:(32 ×1):(16 × 2)=2.求化肥碳酸氢氨(NH4HCO3)
的相对分子质量及各元素的质量比解:NH4HCO3的相对分子质量=14 × 1+1 × 5+12 × 1+16 × 3
=79N:H:C:O=(14 × 1):(1 × 5)
:(12 × 1):(16 × 3)=14:5:12:48(NH4)2CO32×14二、根据化学式还可以计算物质中
某一元素的质量分数例如:求化肥碳酸氨[(NH4)2CO3]
中氮元素的质量分数解: (NH4)2CO3的相对分子质量=96氮元素的质量分数=2N=96=29.2%结论:元素的质量分数=分子中该元素的原子个数
× 该元素相对原子质量相对分子质量×100%1.计算硝酸铵(NH4NO3)中氮元素的质量分数(NH4NO3)中氮元素的质量分数=
2NNH4NO3=2 × 1414 × 2+1 × 4+16 × 3=2880=35%2.氮肥是含氮元素的物质,如
碳酸氢铵( NH4HCO3 ),
尿素 [CO(NH2)2],
硫酸铵[( NH4 )2SO4],
硝酸铵( NH4NO3 ),
求各种化肥中的氮元素的质量分数.元素的相对原子质量:
H-1 C-12 N-14 O-16 S-323.下列化合物中,铁的质量分数最高的是( )
A. Fe2O3 B. Fe3O4
C. FeO D. FeS元素相对原子质量:
O-16 S-32 Fe-56引申:某病人尿检结果为:尿中含氮的质量分数约为0.95%.如果这些氮存在于尿素[CO(NH2)2] 中,则尿中尿素的质量分数为_________.结论:混合物中元素的质量分数=分子中该元素的原子个数
× 该元素相对原子质量相对分子质量×P%混合物中该物质的质量分数在化合物K2R2O7中含氧元素38.1%,则R的相对原子质 量为多少?复习一某病人尿检结果为:尿中含氮的质量分数约为0.95%.如果这些氮存在于尿素[CO(NH2)2] 中,则尿中尿素的质量分数为_________.复习二三、可以计算出一定质量的某物质中
元素的质量例1:计算36克水中氢元素和氧元素的质量解:氢元素的质量=36 × 2HH2O=36 ×218=4克氧元素的质量=36 ×H2OO=36 ×1618=32克一定质量的某物质中某元素的质量=
m物质×该元素的质量分数
(m元素=m物质×A%)1.计算50吨氧化铁(Fe2O3)里含铁多少吨?如果要生产20吨铁需要多少吨氧化铁?练一练引申:计算50吨含氧化铁80%铁矿石里含铁多少吨?如果要生产20吨铁需要多少吨铁矿石?磁铁矿的主要成分是四氧化三铁,100吨含四氧化三铁60%的磁铁矿含铁多少吨?
如果改用铁矿石(主要成分是氧化铁)来替代,请问和多少吨含氧化铁80%的铁矿石中含铁相当?同步练习P%P1%P2%例2: 如果CuO和Cu2O中所含的铜元素质量相等,则CuO和Cu2O的质量之比为多少? (Cu-64 O-16)想一想,你还能更简便的方法来解吗?相同质量的SO2和SO3中,氧元素的质量比是________.
变题1: 当SO2和SO3中氧元素质量相等时,则SO2和SO3的质量比为_______
变题2: nSO2和nSO3中,氧元素的质量比是________.
变题3: mSO2和nSO3中氧元素质量相等时,则m:n为_________变题4: 相同质量的SO2和SO3,其分子数之比为_________例3:人体缺钙易产生“骨质疏松症”.一体重为60千克的缺钙病人每天除从食物中获得钙质外,还需从药物中补充钙质0.5克,若医生确定此人每天至少吃“盖中盖”钙片6.25克,且知钙片中的有效成分为葡萄糖酸钙[(C6H11O7)2Ca].试求该钙片中葡萄糖酸钙的质量分数是多少? [(C6H11O7)2Ca ]的相对分子质量为430, (计算结果保留两位小数)
(C-12 H-1 O-16 Ca-40)某市场中硫酸铵和尿素两种化肥,每千克的售价分别为1.3元和1.8元,根据它们含氮的比例买哪种化肥更经济?讨论解:每千克硫酸铵中含氮元素的质量=1千克2N(NH4 )2SO4×=1千克×28132=0.212千克每千克尿素中含氮元素的质量=1千克×2NCO(NH2)2=1千克×2860=0.46千克对物质碳酸氢铵进行以下计算:
碳酸氢铵的相对分子质量
碳酸氢铵中各元素的质量比
碳酸氢铵中氢元素的质量分数
158克碳酸氢铵中氢元素的质量是多少?
1千克碳酸氢铵的含氢质量与多少千克水的含氢质量相等?
(C-12 N-14 H-1 O-16)课堂检测 解: 碳酸氢铵 : NH4HCO3
NH4HCO3的相对分子质量=14+1×5+12+16×3=79
N:H:C:O=14:5:12:48
H%=
mH=158克×6.32%=10克
x=0.567千克元素符号表示的量(三)综合应用
2.某元素的
质量分数= 1.元素的质量比=化学式中各原子的相对原子质量乘以其原子个数所得积的最简比3.化合物里含某元素的质量=
化合物的质量×化合物里某元素的质量分数 课前复习×100%=混合物质量×混合物中化合物的质量分数巩固练习填表262656161616121224231111101010888777666224111例题(1、2):见书P40例题3: “9.11事件发生不久,在美国又出现了炭疽病。次病是一种有炭疽热杆菌引发的急性传染病,致死率高达25%至60%。其化学式为C17H18N3O3 。它由___种元素组成,每个分子中含有___个原子,其相对分子质量是________,其中氧元素的质量分数是________,元素间的质量比是_________________________.
( C-12 H-1 N-14 O-16)4C:H:N:O= 34:7:3:815.4%31241例题4 某氮的氧化物里,氮元素和氧元素的质量比为7:20,则该氮的氧化物的化学式为( ) (N-14 O-16)
设氮的 氧化物的化学式为NxOy
所以化学式为N2O5 得由题意 得:练习:
1.某氧化物的化学式为NxOy ,其中氮元素和氧元素的质量比为7:4,此氧化物化学式中X与Y的比为_____,此化学式是________。(N-14 O-16)2.某碳氢化合物中,碳元素与氢元素的质量比为3:1,则其化学式中碳原子与氢原子的个数比是_________,此化学式是________。(C-12 H-1)引申:1.某碳、氢、氧组成的化合物中,碳、氢、氧三元素的质量比为6:1:8,则该化合物的碳.氢.氧的原子个数比是______。(C-12 H-1 O-16)练一练: 医药上用的阿斯匹林的组成里含4.5%的氢,35.5%的氧,60%的碳,其相对分子质量为180。阿斯匹林的化学式为CxHyOz ,那么x、y、z的比为_______。变式1:X、Y两元素的原子量比是2:1,在它们组成的化合物中,X与Y元素的质量比为2:3,试写出此化合物的化学式________。 练一练: X与Y两种元素的原子量之比为7:2,它们形成的一种化合物中X元素的质量分数为70%,则这种化合物的化学式可能是_________.变式2: 甲乙两种化合物都是由XY两种元素组成的,甲物质中含X元素为50%,乙物质中含X元素为40%,若甲的化学式为XY2 ,则乙的化学式为__________.练一练: 甲乙两种化合物都是由XY两种元素组成的,甲物质中X与Y元素的质量比为3:7 ,乙物质中X与Y元素的质量比为3:11 ,若甲的化学式为XY ,则乙的化学式为__________.变式3: 某金属元素M的氯化物的分子式是MClx,其相对分子量是m,M(OH)x的相对分子量是n。则M的化合价是多少?
(Cl-35.5 O-16 H-1)例题5 多少克四氧化三铁里的含铁量跟320g氧化铁里的含铁量相当?(Fe-56 O-16)
方法①设四氧化三铁的质量为x,则
x× ×100% = 320× ×100%
x =309.3(g)
方法②:按化学式的关系式解题: 2Fe3O4—3Fe2O3 464 480
x 320 464:x = 480:320 x=309.3(g)
答:四氧化三铁的质量为309.3g例题6 常温下,乙烷(C2H6)气体和酒精(C2H6O)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数是( )
(C-12 H-1 O-16)解析 混合物中,O%=a%则C、H%=(100—a)%, 由化学式C2H6、C2H6O可知混合物中 碳、氢元素的质量之比等于1:4, 所以C%= % 在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数为A%,该混合物中铁元素的质量分数为______
(Fe-56 S-32 O-16)你想试一试吗3.元素的质量比及质量分数计算
组成某物质的元素的质量等于该物质中此元素的所有原子的总和,即相对原子质量×原子个数。 举例
1.要使其中含相同质量的氧元素,则SO2和SO3 的质量比是________。
2.当SO2和SO3两种物质中硫元素的质量比是2:3时,这两种物质的质量比是_______;氧元素的质量比是________。
3.在课本例题计算化肥硝酸铵(NH4NO3)中氮元素的质量分数后,可以补充以下例题:为满足生产需要,要使每公顷地增加2 kg的氮元素,问在50公顷地上应施加硝酸铵肥料多少千克? 若改施碳酸氢铵(NH4HCO3),问需碳酸氢铵肥料多少千克?
4.经分析测得在2.5克的某铜矿中含有0.5克氧化铜,计算在这种铜矿中含铜元素的质量分数?(Cu-64 O-16)
5.黄铜矿(主要成分为CuFeS2 ),其中含硫的质量分数为32.16%,求其中含铁元素的质量分数。(Cu-64 Fe-56 S-32 )
M/12N B. 12M/N
C. N/12M D.12N/MD解题依据:变式1:已知1个碳-12原子的质量为m千克,某元素的1个原子的质量7m千克,则该元素的相对原子质量_____.84变式2:甲原子与乙原子的质量之比为x:y,而乙原子与12C原子的质量之比为n:m,则甲原子的相对原子质量为_______.2.某原子核内有n个中子,相对原子质量是N,该原子的核电荷数是________,原子核外的电子数是______.制造原子弹的原料为铀-235,这种铀原子的相对原子质量为_____,若其核电荷数为92,则其核内的中子数为_____,质子数为_____,核外电子数为______.N-n N-n 92 92143235课前复习想一想:1.相对原子质量是以什么为标准的?以一个C-12原子的质量的1/12作为标准2.相对分子质量是指什么?相对分子质量是指一个分子中各原子的
相对原子质量的总和3.化学式的意义:CO2二氧化碳这种物质(1个)二氧化碳分子二氧化碳由碳元素和氧元素组成(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成(1)(2)(3)(4)(5)相对分子质量求下列物质的相对分子质量:1.三氧化硫(SO3)的相对分子质量
2.氧化钙(CaO)的相对分子质量
=40 ×1+16 ×1=56=32×1+16 ×3=80
3.磷酸(H3PO4)的相对分子质量=1×3+31×1+16×4=984.五氧化二磷(P2O5)的相对分子质量=31 ×2+16 ×5=142(5)尿素CO(NH2)2的相对分子质量=14×1+16×1+(14×1+1×2)×2
=60(6)硫酸铜晶体(CuSO4.5H2O)的
相对分子质量=64×1+32×1+16×4+5(1×2+16)
=250根据化学式可以计算相对分子质量,
还可以有哪些计算呢?一、根据化学式还可以计算组成物质的
各元素的质量比例如:求水中氢元素和氧元素的质量比;解:H:O=(1 × 2):(16 × 1)=1:8练一练:1.求:SO2中硫元素和氧元素的质量比解:(32 ×1):(16 × 2)=2.求化肥碳酸氢氨(NH4HCO3)
的相对分子质量及各元素的质量比解:NH4HCO3的相对分子质量=14 × 1+1 × 5+12 × 1+16 × 3
=79N:H:C:O=(14 × 1):(1 × 5)
:(12 × 1):(16 × 3)=14:5:12:48(NH4)2CO32×14二、根据化学式还可以计算物质中
某一元素的质量分数例如:求化肥碳酸氨[(NH4)2CO3]
中氮元素的质量分数解: (NH4)2CO3的相对分子质量=96氮元素的质量分数=2N=96=29.2%结论:元素的质量分数=分子中该元素的原子个数
× 该元素相对原子质量相对分子质量×100%1.计算硝酸铵(NH4NO3)中氮元素的质量分数(NH4NO3)中氮元素的质量分数=
2NNH4NO3=2 × 1414 × 2+1 × 4+16 × 3=2880=35%2.氮肥是含氮元素的物质,如
碳酸氢铵( NH4HCO3 ),
尿素 [CO(NH2)2],
硫酸铵[( NH4 )2SO4],
硝酸铵( NH4NO3 ),
求各种化肥中的氮元素的质量分数.元素的相对原子质量:
H-1 C-12 N-14 O-16 S-323.下列化合物中,铁的质量分数最高的是( )
A. Fe2O3 B. Fe3O4
C. FeO D. FeS元素相对原子质量:
O-16 S-32 Fe-56引申:某病人尿检结果为:尿中含氮的质量分数约为0.95%.如果这些氮存在于尿素[CO(NH2)2] 中,则尿中尿素的质量分数为_________.结论:混合物中元素的质量分数=分子中该元素的原子个数
× 该元素相对原子质量相对分子质量×P%混合物中该物质的质量分数在化合物K2R2O7中含氧元素38.1%,则R的相对原子质 量为多少?复习一某病人尿检结果为:尿中含氮的质量分数约为0.95%.如果这些氮存在于尿素[CO(NH2)2] 中,则尿中尿素的质量分数为_________.复习二三、可以计算出一定质量的某物质中
元素的质量例1:计算36克水中氢元素和氧元素的质量解:氢元素的质量=36 × 2HH2O=36 ×218=4克氧元素的质量=36 ×H2OO=36 ×1618=32克一定质量的某物质中某元素的质量=
m物质×该元素的质量分数
(m元素=m物质×A%)1.计算50吨氧化铁(Fe2O3)里含铁多少吨?如果要生产20吨铁需要多少吨氧化铁?练一练引申:计算50吨含氧化铁80%铁矿石里含铁多少吨?如果要生产20吨铁需要多少吨铁矿石?磁铁矿的主要成分是四氧化三铁,100吨含四氧化三铁60%的磁铁矿含铁多少吨?
如果改用铁矿石(主要成分是氧化铁)来替代,请问和多少吨含氧化铁80%的铁矿石中含铁相当?同步练习P%P1%P2%例2: 如果CuO和Cu2O中所含的铜元素质量相等,则CuO和Cu2O的质量之比为多少? (Cu-64 O-16)想一想,你还能更简便的方法来解吗?相同质量的SO2和SO3中,氧元素的质量比是________.
变题1: 当SO2和SO3中氧元素质量相等时,则SO2和SO3的质量比为_______
变题2: nSO2和nSO3中,氧元素的质量比是________.
变题3: mSO2和nSO3中氧元素质量相等时,则m:n为_________变题4: 相同质量的SO2和SO3,其分子数之比为_________例3:人体缺钙易产生“骨质疏松症”.一体重为60千克的缺钙病人每天除从食物中获得钙质外,还需从药物中补充钙质0.5克,若医生确定此人每天至少吃“盖中盖”钙片6.25克,且知钙片中的有效成分为葡萄糖酸钙[(C6H11O7)2Ca].试求该钙片中葡萄糖酸钙的质量分数是多少? [(C6H11O7)2Ca ]的相对分子质量为430, (计算结果保留两位小数)
(C-12 H-1 O-16 Ca-40)某市场中硫酸铵和尿素两种化肥,每千克的售价分别为1.3元和1.8元,根据它们含氮的比例买哪种化肥更经济?讨论解:每千克硫酸铵中含氮元素的质量=1千克2N(NH4 )2SO4×=1千克×28132=0.212千克每千克尿素中含氮元素的质量=1千克×2NCO(NH2)2=1千克×2860=0.46千克对物质碳酸氢铵进行以下计算:
碳酸氢铵的相对分子质量
碳酸氢铵中各元素的质量比
碳酸氢铵中氢元素的质量分数
158克碳酸氢铵中氢元素的质量是多少?
1千克碳酸氢铵的含氢质量与多少千克水的含氢质量相等?
(C-12 N-14 H-1 O-16)课堂检测 解: 碳酸氢铵 : NH4HCO3
NH4HCO3的相对分子质量=14+1×5+12+16×3=79
N:H:C:O=14:5:12:48
H%=
mH=158克×6.32%=10克
x=0.567千克元素符号表示的量(三)综合应用
2.某元素的
质量分数= 1.元素的质量比=化学式中各原子的相对原子质量乘以其原子个数所得积的最简比3.化合物里含某元素的质量=
化合物的质量×化合物里某元素的质量分数 课前复习×100%=混合物质量×混合物中化合物的质量分数巩固练习填表262656161616121224231111101010888777666224111例题(1、2):见书P40例题3: “9.11事件发生不久,在美国又出现了炭疽病。次病是一种有炭疽热杆菌引发的急性传染病,致死率高达25%至60%。其化学式为C17H18N3O3 。它由___种元素组成,每个分子中含有___个原子,其相对分子质量是________,其中氧元素的质量分数是________,元素间的质量比是_________________________.
( C-12 H-1 N-14 O-16)4C:H:N:O= 34:7:3:815.4%31241例题4 某氮的氧化物里,氮元素和氧元素的质量比为7:20,则该氮的氧化物的化学式为( ) (N-14 O-16)
设氮的 氧化物的化学式为NxOy
所以化学式为N2O5 得由题意 得:练习:
1.某氧化物的化学式为NxOy ,其中氮元素和氧元素的质量比为7:4,此氧化物化学式中X与Y的比为_____,此化学式是________。(N-14 O-16)2.某碳氢化合物中,碳元素与氢元素的质量比为3:1,则其化学式中碳原子与氢原子的个数比是_________,此化学式是________。(C-12 H-1)引申:1.某碳、氢、氧组成的化合物中,碳、氢、氧三元素的质量比为6:1:8,则该化合物的碳.氢.氧的原子个数比是______。(C-12 H-1 O-16)练一练: 医药上用的阿斯匹林的组成里含4.5%的氢,35.5%的氧,60%的碳,其相对分子质量为180。阿斯匹林的化学式为CxHyOz ,那么x、y、z的比为_______。变式1:X、Y两元素的原子量比是2:1,在它们组成的化合物中,X与Y元素的质量比为2:3,试写出此化合物的化学式________。 练一练: X与Y两种元素的原子量之比为7:2,它们形成的一种化合物中X元素的质量分数为70%,则这种化合物的化学式可能是_________.变式2: 甲乙两种化合物都是由XY两种元素组成的,甲物质中含X元素为50%,乙物质中含X元素为40%,若甲的化学式为XY2 ,则乙的化学式为__________.练一练: 甲乙两种化合物都是由XY两种元素组成的,甲物质中X与Y元素的质量比为3:7 ,乙物质中X与Y元素的质量比为3:11 ,若甲的化学式为XY ,则乙的化学式为__________.变式3: 某金属元素M的氯化物的分子式是MClx,其相对分子量是m,M(OH)x的相对分子量是n。则M的化合价是多少?
(Cl-35.5 O-16 H-1)例题5 多少克四氧化三铁里的含铁量跟320g氧化铁里的含铁量相当?(Fe-56 O-16)
方法①设四氧化三铁的质量为x,则
x× ×100% = 320× ×100%
x =309.3(g)
方法②:按化学式的关系式解题: 2Fe3O4—3Fe2O3 464 480
x 320 464:x = 480:320 x=309.3(g)
答:四氧化三铁的质量为309.3g例题6 常温下,乙烷(C2H6)气体和酒精(C2H6O)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数是( )
(C-12 H-1 O-16)解析 混合物中,O%=a%则C、H%=(100—a)%, 由化学式C2H6、C2H6O可知混合物中 碳、氢元素的质量之比等于1:4, 所以C%= % 在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数为A%,该混合物中铁元素的质量分数为______
(Fe-56 S-32 O-16)你想试一试吗3.元素的质量比及质量分数计算
组成某物质的元素的质量等于该物质中此元素的所有原子的总和,即相对原子质量×原子个数。 举例
1.要使其中含相同质量的氧元素,则SO2和SO3 的质量比是________。
2.当SO2和SO3两种物质中硫元素的质量比是2:3时,这两种物质的质量比是_______;氧元素的质量比是________。
3.在课本例题计算化肥硝酸铵(NH4NO3)中氮元素的质量分数后,可以补充以下例题:为满足生产需要,要使每公顷地增加2 kg的氮元素,问在50公顷地上应施加硝酸铵肥料多少千克? 若改施碳酸氢铵(NH4HCO3),问需碳酸氢铵肥料多少千克?
4.经分析测得在2.5克的某铜矿中含有0.5克氧化铜,计算在这种铜矿中含铜元素的质量分数?(Cu-64 O-16)
5.黄铜矿(主要成分为CuFeS2 ),其中含硫的质量分数为32.16%,求其中含铁元素的质量分数。(Cu-64 Fe-56 S-32 )
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
