第二章空气与生命[下学期]
图片预览








文档简介
课件79张PPT。空气与生命第二章复习一、空气和氧气 其他成分1%
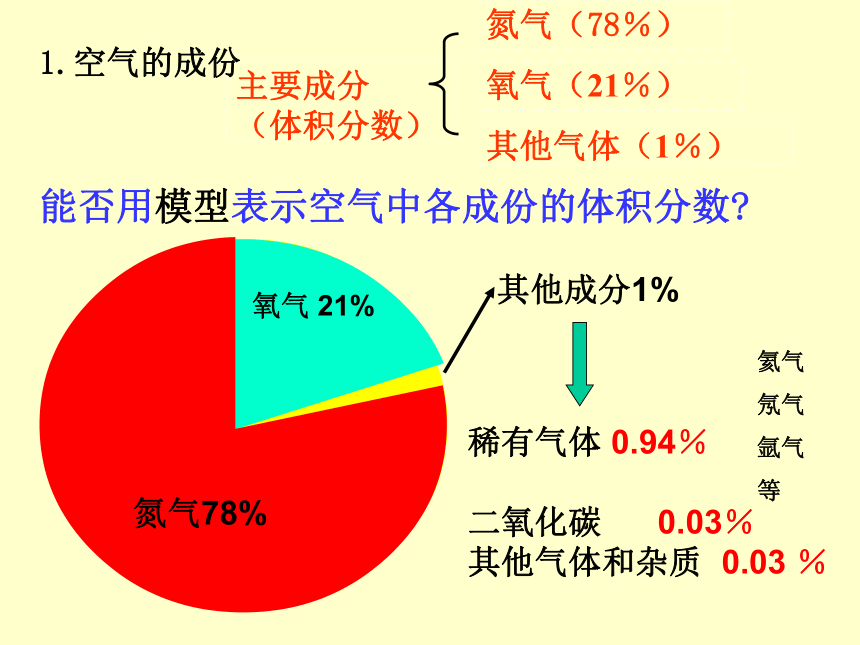
能否用模型表示空气中各成份的体积分数?1.空气的成份氦气
氖气
氩气
等稀有气体 0.94%
二氧化碳 0.03%
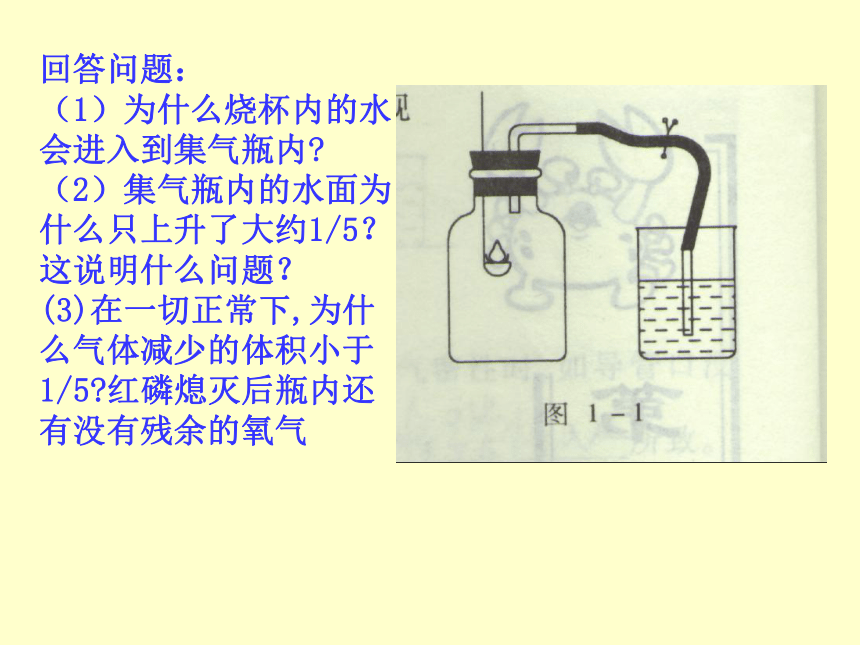
其他气体和杂质 0.03 %1、按图把装置连接,先在集气瓶内加入少量水,再把剩余的容积用记号划成5等份。2、点燃燃烧匙内的红磷,立即塞紧瓶塞,观察现象:
3、火焰熄灭后,振荡集气瓶,打开导管上的夹子,出现什么现象? ____________________________________________瓶内水位变化_______________ _______;消耗的气体跟余下的气体的体积比为______________________实验结论是:__________________________________磷燃烧,发出白光,冒出白烟水从烧杯倒吸入集气瓶内.水的体积约占瓶容积的1/51:4空气中氧气的体积分数约为1/5回答问题:
(1)为什么烧杯内的水会进入到集气瓶内?
(2)集气瓶内的水面为什么只上升了大约1/5?这说明什么问题?
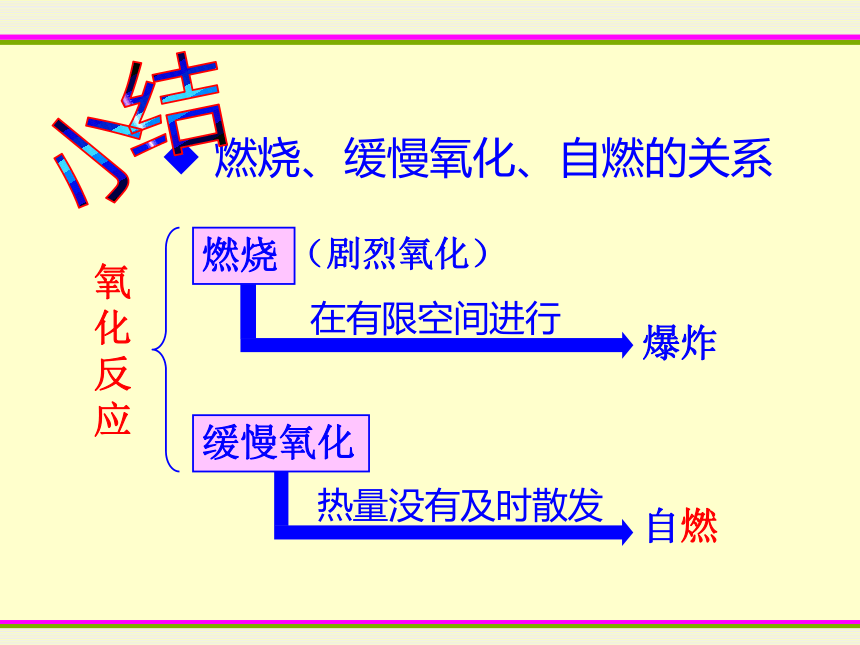
(3)在一切正常下,为什么气体减少的体积小于1/5?红磷熄灭后瓶内还有没有残余的氧气一、氧气的性质1、物理性质: 无色无味的气体,不易溶于水,密度比空气略大,液态与固态时为蓝色。2、化学性质:氧化反应:物质跟氧发生的反应具有氧化性氧化物:两种元素组成,有一种是氧元素的化合物铁制品生锈金鱼呼吸铜币生锈医疗急救缓慢氧化二、呼吸作用可燃物与空气中的氧气发生发光发热的剧烈氧化反应三、燃烧1、定义:2、可燃物燃烧的条件:必须与氧气接触必须达到可燃物的着火点 燃烧、缓慢氧化、自燃的关系氧化反应燃烧缓慢氧化(剧烈氧化)爆炸自燃小结空 气氧 气氮气: 78%物理性质:无色无味的气体,密度比空气略大,
不易溶于水,固氧液氧都是淡蓝色的。化学性质:比较活泼的气体,在氧化反应中提供氧
具有氧化性和助燃性,是常用的氧化剂稀有气体:0.94%其它气体和杂质: 0.03%二氧化碳: 0.03%一般情况下
无助燃性
粉尘空气的污染:(21%〕二氧化硫、二氧化氮、一氧化碳
有害气体:煤、石油燃烧
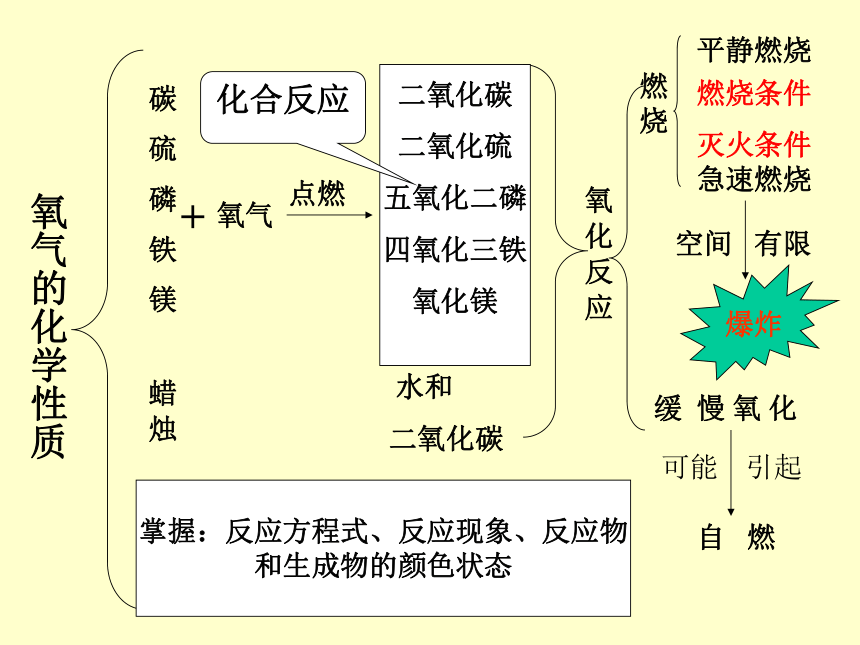
工厂废气汽车尾气用 途:供给呼吸 和 支持燃烧性质 决定 用途小结碳 硫 磷 铁 镁 蜡 烛+氧气点燃 水和
二氧化碳氧 化 反 应燃烧平静燃烧急速燃烧空间 有限缓 慢 氧 化自 燃二氧化碳
二氧化硫
五氧化二磷
四氧化三铁
氧化镁
化合反应燃烧条件
灭火条件
掌握:反应方程式、反应现象、反应物
和生成物的颜色状态可能 引起爆炸氧气的化学性质单质现象反应式镁耀眼的白光2Mg+O2==2MgO点燃铁剧烈燃烧火星四射,生成黑色的固体.3Fe+2O2===Fe3O4点燃硫空气中微弱的淡蓝色火焰,氧气中发出明亮的蓝紫色火焰,有刺激性气味的气体S+O2==SO2点燃磷空气中发红光,氧气中发白光,产生大量的白烟.4P+5O2==2P2O5点燃氢气2H2+O2==2H2O点燃燃烧,有水珠生成 物质在氧气中燃烧实验室制法工业制法原 理制取过程药品颜色、仪器名称、操作步骤、注意事项收集方法、验满方法、放置方法催化剂改变:其它物质的化学反应速率不变:本身的质量和化学性质根据:液态氧和液态氮的沸点不同变化:发生物理变化实验室制法 H2O2分解 用MnO2催化,不加热 2H2O2===2H2O+O2↑MnO2KMmO4分解
不用催化剂,加热 试管口要加棉花 2KMnO4 == K2MnO4+MnO2+O2↑实验注意:试管口略向下、均匀加热、
先将导管水中取出再撤酒精灯KClO3分解 用MnO2催化,
加热 试管口不加棉花 2KClO3 === 2KCl+3O2↑MnO2在实验室制取氧气时,通常采用 法进行收集,因为氧气 ;还可以用
收集,因为在相同条件下氧气
的密度比空气的 .最佳的收集方法
是 ,因为这样收集的氧气纯净.排空气法收集比排水法收集具有的优点是收集到的气体比较 。但验满需要用
_______________________________________________________________________________________ 。排水不易溶于水向上排空气法大排水法带火星的木条放在瓶口看是否复燃
干燥二、质量守衡和
根据化学方程式计算在化学变化过程中可能改变:分子数目三、化学方程式1.定义: 用化学式来表示化学反应的方程式。2.化学方程式的书写书写原则:依据客观事实遵循质量守恒定律写出反应物生成物的化学式
注明反应条件及生成物状态
配平(体现质量守恒定律)
等号代替短线书写步骤:配平方法: 最小公倍数法 4228349333配平方法: 奇数化偶法 FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O41128322215126配平下列化学方程式:2、 Fe2O3 + HCl —— FeCl3 + H2O3、 Fe2O3 + CO —— Fe + CO24、 C2H5OH + O2 —— CO2 + H2O高温练一练高温22263332332↑2写出下列反应的化学方程式:1、镁在氧气中燃烧,生成氧化镁2、电解水,生成氢气和氧气3、铝与稀硫酸反应,生成硫酸铝和氢气4、乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水表示反应物,生成物和反应条件。质:量:反应物与生成物间的质量比。(各物质的相对分子质量与化学计量数的乘积比)3.化学方程式的意义4、化学方程式的读法 在点燃的条件下,碳和氧气反应生成二氧化碳。 在点燃的条件下,每一个碳原子和一个氧分子反应,生成一个二氧化碳分子。宏观上:微观上:质量上: 在点燃的条件下,每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。 在点燃的条件下,碳和氧气反应生成二氧化碳的质量比为12∶32∶44 ( 3∶8∶11 )。1、某化合物在纯氧中燃烧,只生成二氧化碳和二氧化硫,则该化合物中一定含有 元素和 元素,可能还含有 元素。碳硫氧3、将24.5克氯酸钾和2克二氧化锰共热,待反应 不再有气体生成时,试管内剩余物为16.9克,则 反应后生成的氧气为 克,剩余物中有 和 ,它们的质量分别为 克和 克。9.6二氧化锰214.9氯化钾2、质量为4.6克的某化合物在纯氧中燃烧,生成8.8克二氧化碳和5.4克水,则该化合物中( )A、一定含有碳、氢元素,可能含有氧元素 B、一定含有碳、氢、氧元素 C、一定含有碳、氢元素,一定没有氧元素 D、条件不足无法确定B四、根据化学方程式计算例:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?解:设需要过氧化氢的质量为X6832X2克=X = 4.3克答:需要过氧化氢4.3克。写方程式写出已知量与要求量的相对分子质量与质量列比例式、计算做答设未知数
例2、把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
C6go28g3.将KClO3和MnO2的混合物共6.5g装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:
(1)制得O2多少克?
(2)4.58g固体中含有哪些物质?各多少克?解:(1)制得氧气质量6.5克-4.58克=1.92克(2)设4.58克固体中含有KCl X克149 96X 1.92克X=2.98克MnO2质量:4.58-2.98=1.6克答…三、二氧化碳性质和制取一、二氧化碳的实验室制法1、原理:CaCO3+2HCl=CaCl2+CO2↑+H2O3、实验装置:2、药品:大理石、盐酸5、验满方法:用燃烧的木条放在集气瓶口6、检验方法:将气体通入澄清石灰水4、收集方法:向上排空气法1、二氧化碳是 色 味的 。2、如图一所示,向烧杯里倾倒二氧化碳。观察火焰变化。3、如图二所示,在一个充满二氧化 碳的软塑料瓶里,迅速倒入少量水, 立即将瓶塞塞紧,振荡,观察有什么现象。4、向蓝色的石蕊试液中通入二氧化碳气体后, 显 色,若加热通入气体后的液体,显 色。无无气体红蓝无色无味的气体,密度比空气大,可溶于水二、二氧化碳的性质1、物理性质:2、化学性质:(1)既不能燃烧,也不支持燃烧;也不能 供给呼吸(2)与水的反应:CO2 + H2O = H2CO3(碳酸) 碳酸能使紫色石蕊试液变成红色(3)与石灰水的反应:CO2 + Ca(OH)2 = CaCO3 ↓ + H2O 人工降雨灭火工业原料致冷剂光合作用 CO2的用途温室效应温室效应,是指二氧化碳含量升高,增强大气对太阳光中红外线辐射的吸收,使地球表面温度上升。四、呼吸作用与光合作用生物是怎样呼吸的鼻腔呼吸系统鼻孔鼻喉咽气管左支气管左肺右支气管右肺一、呼吸系统呼吸道:肺:鼻、咽、喉、
气管、支气管、气体交换的场所(气体进出 肺的通道) 二、气体交换1、呼吸运动过程收缩收缩舒张舒张向上向外向下向内下降增大缩小上升变大变小2、气体交换:(依靠肋间外肌、膈肌的舒张与收缩来完成)肺泡是进行气体交换的主要场所动物的呼吸试管B的设置有 的作用。一段时间后,装置A、B中红色水滴分别有怎样的变化? 实验证明: 动物通过呼吸,得到氧气,排出二氧化碳对照A管水滴左移,B管水滴无明显变化碱石灰铁丝网指标蟑螂碱石灰铁丝网指标AB 把吸干外表水的豆芽装入塑料袋中,用夹子夹住橡皮管,不使外界空气进入,在暗处放置一个晚上。塑料袋内壁发生的现象: 将袋中气体通入澄清石灰水,可观察到: 用温度计测量豆芽温度可发现: 实验一内壁上出现水滴澄清石灰水变浑浊温度升高植物也会呼吸吗?实验二 取一大口塑料瓶,装入豆芽,盖紧瓶盖,在暗处放置一个晚上,然后打开瓶盖,将点燃的蜡烛放入瓶内,观察火焰的变化。植物和空气之间也存在气体交换(吸收氧气,放出二氧化碳),植物也会呼吸。 火焰很快熄灭光合作用普利斯特利的实验 在ABC三个钟罩内各放入一只活老鼠,A、C内放一盆绿色植物,将C遮光。三个装置均放到阳光下。 数十小时后,三只老鼠死了两只,剩一只还活着!想一想,死的为什么死了?活的为什么还活着? 想一想,这组实验说明了什么问题?它的实验原理是什么? 本实验说明,绿色植物在光照下能制造氧气。 探究光合作用需要 在光照条件下进行?二、植物制造淀粉的实验1、把盆栽的天竺葵(银边天竺葵)放在黑暗的地方一昼夜.第二天用两张大小相等的铝箔纸在叶片绿色部分的相同位置上下两面盖严,并用大头针固定然后放到阳光下照射.2、4小时后,去掉铝箔纸,将叶片摘下。3、把叶片放到盛有酒精的小烧杯中水浴加热,仔细观察叶片和酒精的颜色变化4、到叶片褪成黄色时,取出叶片并用清水洗净后,滴上碘酒。几分钟后,用清水冲掉叶片上的碘液,观察叶片的颜色是否发生变化问题讨论:1、为什么天竺葵要在暗处放置一昼夜(24小时)?利用呼吸作用来分解原来储存在植物体内的淀粉等有机物,消除淀粉对实验的影响。2、为什么要用铝箔纸在叶片的相同位置上下盖严?为了设置对比,证明绿叶光合作用需要光。3、为什么要水浴加热?酒精易燃,不能直接加热。4、酒精中漂洗的作用是什么?使叶片中的叶绿素褪去。实验现象 叶片照光的部分____,而遮光部分_______。显蓝色无蓝色实验结论 实验表明了绿叶在_______下能够制造_____。光淀粉说明光合作用的产物之一是淀粉,条件是光。检查淀粉光合作用 需要二氧化碳吗?探究检查淀粉照光2小时实验前先把整株植物放在黑暗处2-3天 圆圈内的叶片就没有水供应了 根据上面做的几个实验,你能总结出光合作用需要哪些原料,产物、场所和条件是什么吗?原料: 二氧化碳、水条件: 阳光场所: 叶绿体产物: 氧气、有机物 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物,并释放氧气的过程。一、光合作用1、概念:2、反应表示式:光合作用的意义(水中)二氧化碳生物(大气中)二氧化碳氧气有机物(能量)光合作用的意义 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物,并释放氧气的过程。一、光合作用1、概念:2、反应表示式:3、光合作用的意义:(2)一切生物的能量来源(1)一切生物的物质来源(3)稳定大气中氧气与二氧化碳的含量光合作用与呼吸作用之比较二氧化碳叶绿体光照氧气二氧化碳氧气活细胞内制造贮藏释放分解空气污染与保护 当空气中某些成分的含量超过了正常含量,或空气中进入了正常情况下不存在的成分或有毒有害物质,从而影响人的健康和生物的生长发育,或对各种物质以及对天气和气候产生不良的影响,这样的空气状态称为空气污染。 什么是空气污染? 空气有一定的自净能力,在一般情况下能保持清洁新鲜的状态。伦敦烟雾事件 自1952年以来,伦敦发生过12次大的烟雾事件,祸首是燃煤排放的粉尘和二氧化硫。烟雾逼迫所有飞机停飞,汽车白天开灯行驶,行人走路都困难,烟雾事件使呼吸疾病患者猛增。1952年12月那一次,5天内有4000多人死亡,两个月内又有8000多人死去。材料一 40、50和70年代,发生在美国的洛杉矶市。
40年代时,洛杉矶市的汽车保有量就达到了250万辆,每天需要消耗汽油1000多吨。汽车尾气中的碳氢化合物、氮氧化物等都漂浮在街道上的空气中,在强烈阳光的照射下发生物理化学反应,产生了有毒的浅蓝色烟雾,造成大量市民眼睛红肿、咽炎、呼吸道疾病恶化乃至思维紊乱,肺水肿等疾病。1955年发生的光化学烟雾事件导致400多人因中毒、呼吸衰竭死亡,1970年发生的事件使3/4的市民患病。洛杉矶光化学烟雾事件材料二比利时马斯河谷空气污染事件 比利时马斯河谷工业区位于狭窄河谷内,分布有大量的炼油厂、金属厂、玻璃厂。这些工厂排放出大量的废气和工业粉尘,严重影响了当地人们的健康。1930年12月1-5日,由于天气的影响,河谷内出现静风,空气污染物扩散不出去。同时,也出现了逆温层,污染物难以扩散到高空,只能在低空中聚集,污染物浓度迅速上升。结果造成60多人在一周内死亡,市民中心脏病、肺病患者的死亡率增高,家畜死亡率也大大增高。材料三 烟尘、二氧化硫、碳氧化物(二氧化碳和一氧化碳)、氮氧化物(主要是一氧化氮和二氧化氮)、碳氢化合物。 通过以上三则材料,你知道污染空气的污染物主要有哪些?来源于何处?谈一谈主要空气污染物燃料燃烧汽车尾气(一氧化碳、氮氧化物、碳烟、二氧化硫)(烟尘、废气)酸雨一、酸雨的形成SO2+H2O=H2SO32H2SO3+O2=2H2SO4(PH<5.6的酸性降水) 危害健康,使水域和土壤酸化,损害农作物和林木生长,危害渔业,腐蚀建筑物、工业设备和文化古迹。 你知道酸雨会造成哪些危害呢?本报讯 陈忠报道 国家环保总局日前发布的全国环境质量状况表明,全国酸雨污染呈加重趋势,在酸雨控制区的 106 个城市中,出现酸雨的城市占89.6%,温州市是4个酸雨频率超过95%的城市之一。据了解,该市每年因酸雨造成的经济损失达3亿多元。全国四个酸雨频率超过95%的城市之一 温州每年被酸雨夺走三个亿 陈忠 2004年3月29日酸雨几年变化图给我们什么启示?保护空气的措施1、要控制污染源
2、加强空气质量监测和预报
3、发展“绿色工业”
4、使用清洁能源
5、植树造林,绿化环境首要污染物:指污染最重的污染物。 空气质量状况: 优、良、轻度/中度/重污染通过空气质量日报,你知道预报的主要内容有哪些?通过这些你知道了什么?污染指数:将监测的几种空气污染物浓度简化成数值形式1、空气中按体积计算,含量最多 的气体 是( )
A 氧气 B 氮气
C 二氧化碳 D 稀有气体B3、空气中氧气与氮气的体积比约为( )
A 4:1 B 1:4 C 1:5 D 5:1B2、在100升空气里氮气的体积大约是( )
A 78升 B 78% C 21升 D 21% A 巩固练习4、实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)的方法制取氧气。
(1)请写出反应的化学方程式________________
(2)图中收集氧气的方法叫做________________
可用此方法收集氧气的原因是________________
(3)用该方法收集氧气时,检验集气瓶中氧气是否集满的方法是__________________
(4)如果锥形瓶中的反应很剧烈,应该采用的安全措施是( )
A、减慢液体滴加的速度
B、换用体积较小的锥形瓶
C、加热锥形瓶2H2O2 ===== 2H20 + O2MnO2向上排空气法氧气密度比空气密度略大把带火星的木条放在瓶口A二氧化锰过氧化氢溶液5、汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 ___________________________________。下列能控制空气污染源的方法是_______________①开发氢能源;②使用电动车;③植树造林;④戴呼吸面具。 2CO+2NO =N2+2CO2催化剂(1)(2)6、实验室制取氧气时,有如下各操作步骤:
1. 向大试管中装入药品并塞紧带导管的橡皮塞;
2. 检验装置是否漏气;
3. 将导气管从水槽中取出;
4. 给大试管加热;
5. 将大试管固定在铁架台上;
6. 用排水法收集气体;
7. 移开酒精灯并熄灭;
正确的操作顺序是(填序号) 。2154637 6、 在将有空气的密闭容器中,若用燃烧的方法除去其中的氧气且瓶内压强明显降低的是( )
A.硫 B.木炭 C.红磷 D.蜡烛C7、二氧化碳常用来灭火,是因为它( )
1.本身不能燃烧2.不支持燃烧3.能溶于水
4.密度比空气大
A. 1 2 3 B. 1 3 4 C.1 2 4 D.2 3 4
CAD
能否用模型表示空气中各成份的体积分数?1.空气的成份氦气
氖气
氩气
等稀有气体 0.94%
二氧化碳 0.03%
其他气体和杂质 0.03 %1、按图把装置连接,先在集气瓶内加入少量水,再把剩余的容积用记号划成5等份。2、点燃燃烧匙内的红磷,立即塞紧瓶塞,观察现象:
3、火焰熄灭后,振荡集气瓶,打开导管上的夹子,出现什么现象? ____________________________________________瓶内水位变化_______________ _______;消耗的气体跟余下的气体的体积比为______________________实验结论是:__________________________________磷燃烧,发出白光,冒出白烟水从烧杯倒吸入集气瓶内.水的体积约占瓶容积的1/51:4空气中氧气的体积分数约为1/5回答问题:
(1)为什么烧杯内的水会进入到集气瓶内?
(2)集气瓶内的水面为什么只上升了大约1/5?这说明什么问题?
(3)在一切正常下,为什么气体减少的体积小于1/5?红磷熄灭后瓶内还有没有残余的氧气一、氧气的性质1、物理性质: 无色无味的气体,不易溶于水,密度比空气略大,液态与固态时为蓝色。2、化学性质:氧化反应:物质跟氧发生的反应具有氧化性氧化物:两种元素组成,有一种是氧元素的化合物铁制品生锈金鱼呼吸铜币生锈医疗急救缓慢氧化二、呼吸作用可燃物与空气中的氧气发生发光发热的剧烈氧化反应三、燃烧1、定义:2、可燃物燃烧的条件:必须与氧气接触必须达到可燃物的着火点 燃烧、缓慢氧化、自燃的关系氧化反应燃烧缓慢氧化(剧烈氧化)爆炸自燃小结空 气氧 气氮气: 78%物理性质:无色无味的气体,密度比空气略大,
不易溶于水,固氧液氧都是淡蓝色的。化学性质:比较活泼的气体,在氧化反应中提供氧
具有氧化性和助燃性,是常用的氧化剂稀有气体:0.94%其它气体和杂质: 0.03%二氧化碳: 0.03%一般情况下
无助燃性
粉尘空气的污染:(21%〕二氧化硫、二氧化氮、一氧化碳
有害气体:煤、石油燃烧
工厂废气汽车尾气用 途:供给呼吸 和 支持燃烧性质 决定 用途小结碳 硫 磷 铁 镁 蜡 烛+氧气点燃 水和
二氧化碳氧 化 反 应燃烧平静燃烧急速燃烧空间 有限缓 慢 氧 化自 燃二氧化碳
二氧化硫
五氧化二磷
四氧化三铁
氧化镁
化合反应燃烧条件
灭火条件
掌握:反应方程式、反应现象、反应物
和生成物的颜色状态可能 引起爆炸氧气的化学性质单质现象反应式镁耀眼的白光2Mg+O2==2MgO点燃铁剧烈燃烧火星四射,生成黑色的固体.3Fe+2O2===Fe3O4点燃硫空气中微弱的淡蓝色火焰,氧气中发出明亮的蓝紫色火焰,有刺激性气味的气体S+O2==SO2点燃磷空气中发红光,氧气中发白光,产生大量的白烟.4P+5O2==2P2O5点燃氢气2H2+O2==2H2O点燃燃烧,有水珠生成 物质在氧气中燃烧实验室制法工业制法原 理制取过程药品颜色、仪器名称、操作步骤、注意事项收集方法、验满方法、放置方法催化剂改变:其它物质的化学反应速率不变:本身的质量和化学性质根据:液态氧和液态氮的沸点不同变化:发生物理变化实验室制法 H2O2分解 用MnO2催化,不加热 2H2O2===2H2O+O2↑MnO2KMmO4分解
不用催化剂,加热 试管口要加棉花 2KMnO4 == K2MnO4+MnO2+O2↑实验注意:试管口略向下、均匀加热、
先将导管水中取出再撤酒精灯KClO3分解 用MnO2催化,
加热 试管口不加棉花 2KClO3 === 2KCl+3O2↑MnO2在实验室制取氧气时,通常采用 法进行收集,因为氧气 ;还可以用
收集,因为在相同条件下氧气
的密度比空气的 .最佳的收集方法
是 ,因为这样收集的氧气纯净.排空气法收集比排水法收集具有的优点是收集到的气体比较 。但验满需要用
_______________________________________________________________________________________ 。排水不易溶于水向上排空气法大排水法带火星的木条放在瓶口看是否复燃
干燥二、质量守衡和
根据化学方程式计算在化学变化过程中可能改变:分子数目三、化学方程式1.定义: 用化学式来表示化学反应的方程式。2.化学方程式的书写书写原则:依据客观事实遵循质量守恒定律写出反应物生成物的化学式
注明反应条件及生成物状态
配平(体现质量守恒定律)
等号代替短线书写步骤:配平方法: 最小公倍数法 4228349333配平方法: 奇数化偶法 FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O41128322215126配平下列化学方程式:2、 Fe2O3 + HCl —— FeCl3 + H2O3、 Fe2O3 + CO —— Fe + CO24、 C2H5OH + O2 —— CO2 + H2O高温练一练高温22263332332↑2写出下列反应的化学方程式:1、镁在氧气中燃烧,生成氧化镁2、电解水,生成氢气和氧气3、铝与稀硫酸反应,生成硫酸铝和氢气4、乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水表示反应物,生成物和反应条件。质:量:反应物与生成物间的质量比。(各物质的相对分子质量与化学计量数的乘积比)3.化学方程式的意义4、化学方程式的读法 在点燃的条件下,碳和氧气反应生成二氧化碳。 在点燃的条件下,每一个碳原子和一个氧分子反应,生成一个二氧化碳分子。宏观上:微观上:质量上: 在点燃的条件下,每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。 在点燃的条件下,碳和氧气反应生成二氧化碳的质量比为12∶32∶44 ( 3∶8∶11 )。1、某化合物在纯氧中燃烧,只生成二氧化碳和二氧化硫,则该化合物中一定含有 元素和 元素,可能还含有 元素。碳硫氧3、将24.5克氯酸钾和2克二氧化锰共热,待反应 不再有气体生成时,试管内剩余物为16.9克,则 反应后生成的氧气为 克,剩余物中有 和 ,它们的质量分别为 克和 克。9.6二氧化锰214.9氯化钾2、质量为4.6克的某化合物在纯氧中燃烧,生成8.8克二氧化碳和5.4克水,则该化合物中( )A、一定含有碳、氢元素,可能含有氧元素 B、一定含有碳、氢、氧元素 C、一定含有碳、氢元素,一定没有氧元素 D、条件不足无法确定B四、根据化学方程式计算例:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?解:设需要过氧化氢的质量为X6832X2克=X = 4.3克答:需要过氧化氢4.3克。写方程式写出已知量与要求量的相对分子质量与质量列比例式、计算做答设未知数
例2、把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
(1)这三次实验,从数据看,哪几次符合质量守恒定律?
(2)第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
(3)第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
C6go28g3.将KClO3和MnO2的混合物共6.5g装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:
(1)制得O2多少克?
(2)4.58g固体中含有哪些物质?各多少克?解:(1)制得氧气质量6.5克-4.58克=1.92克(2)设4.58克固体中含有KCl X克149 96X 1.92克X=2.98克MnO2质量:4.58-2.98=1.6克答…三、二氧化碳性质和制取一、二氧化碳的实验室制法1、原理:CaCO3+2HCl=CaCl2+CO2↑+H2O3、实验装置:2、药品:大理石、盐酸5、验满方法:用燃烧的木条放在集气瓶口6、检验方法:将气体通入澄清石灰水4、收集方法:向上排空气法1、二氧化碳是 色 味的 。2、如图一所示,向烧杯里倾倒二氧化碳。观察火焰变化。3、如图二所示,在一个充满二氧化 碳的软塑料瓶里,迅速倒入少量水, 立即将瓶塞塞紧,振荡,观察有什么现象。4、向蓝色的石蕊试液中通入二氧化碳气体后, 显 色,若加热通入气体后的液体,显 色。无无气体红蓝无色无味的气体,密度比空气大,可溶于水二、二氧化碳的性质1、物理性质:2、化学性质:(1)既不能燃烧,也不支持燃烧;也不能 供给呼吸(2)与水的反应:CO2 + H2O = H2CO3(碳酸) 碳酸能使紫色石蕊试液变成红色(3)与石灰水的反应:CO2 + Ca(OH)2 = CaCO3 ↓ + H2O 人工降雨灭火工业原料致冷剂光合作用 CO2的用途温室效应温室效应,是指二氧化碳含量升高,增强大气对太阳光中红外线辐射的吸收,使地球表面温度上升。四、呼吸作用与光合作用生物是怎样呼吸的鼻腔呼吸系统鼻孔鼻喉咽气管左支气管左肺右支气管右肺一、呼吸系统呼吸道:肺:鼻、咽、喉、
气管、支气管、气体交换的场所(气体进出 肺的通道) 二、气体交换1、呼吸运动过程收缩收缩舒张舒张向上向外向下向内下降增大缩小上升变大变小2、气体交换:(依靠肋间外肌、膈肌的舒张与收缩来完成)肺泡是进行气体交换的主要场所动物的呼吸试管B的设置有 的作用。一段时间后,装置A、B中红色水滴分别有怎样的变化? 实验证明: 动物通过呼吸,得到氧气,排出二氧化碳对照A管水滴左移,B管水滴无明显变化碱石灰铁丝网指标蟑螂碱石灰铁丝网指标AB 把吸干外表水的豆芽装入塑料袋中,用夹子夹住橡皮管,不使外界空气进入,在暗处放置一个晚上。塑料袋内壁发生的现象: 将袋中气体通入澄清石灰水,可观察到: 用温度计测量豆芽温度可发现: 实验一内壁上出现水滴澄清石灰水变浑浊温度升高植物也会呼吸吗?实验二 取一大口塑料瓶,装入豆芽,盖紧瓶盖,在暗处放置一个晚上,然后打开瓶盖,将点燃的蜡烛放入瓶内,观察火焰的变化。植物和空气之间也存在气体交换(吸收氧气,放出二氧化碳),植物也会呼吸。 火焰很快熄灭光合作用普利斯特利的实验 在ABC三个钟罩内各放入一只活老鼠,A、C内放一盆绿色植物,将C遮光。三个装置均放到阳光下。 数十小时后,三只老鼠死了两只,剩一只还活着!想一想,死的为什么死了?活的为什么还活着? 想一想,这组实验说明了什么问题?它的实验原理是什么? 本实验说明,绿色植物在光照下能制造氧气。 探究光合作用需要 在光照条件下进行?二、植物制造淀粉的实验1、把盆栽的天竺葵(银边天竺葵)放在黑暗的地方一昼夜.第二天用两张大小相等的铝箔纸在叶片绿色部分的相同位置上下两面盖严,并用大头针固定然后放到阳光下照射.2、4小时后,去掉铝箔纸,将叶片摘下。3、把叶片放到盛有酒精的小烧杯中水浴加热,仔细观察叶片和酒精的颜色变化4、到叶片褪成黄色时,取出叶片并用清水洗净后,滴上碘酒。几分钟后,用清水冲掉叶片上的碘液,观察叶片的颜色是否发生变化问题讨论:1、为什么天竺葵要在暗处放置一昼夜(24小时)?利用呼吸作用来分解原来储存在植物体内的淀粉等有机物,消除淀粉对实验的影响。2、为什么要用铝箔纸在叶片的相同位置上下盖严?为了设置对比,证明绿叶光合作用需要光。3、为什么要水浴加热?酒精易燃,不能直接加热。4、酒精中漂洗的作用是什么?使叶片中的叶绿素褪去。实验现象 叶片照光的部分____,而遮光部分_______。显蓝色无蓝色实验结论 实验表明了绿叶在_______下能够制造_____。光淀粉说明光合作用的产物之一是淀粉,条件是光。检查淀粉光合作用 需要二氧化碳吗?探究检查淀粉照光2小时实验前先把整株植物放在黑暗处2-3天 圆圈内的叶片就没有水供应了 根据上面做的几个实验,你能总结出光合作用需要哪些原料,产物、场所和条件是什么吗?原料: 二氧化碳、水条件: 阳光场所: 叶绿体产物: 氧气、有机物 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物,并释放氧气的过程。一、光合作用1、概念:2、反应表示式:光合作用的意义(水中)二氧化碳生物(大气中)二氧化碳氧气有机物(能量)光合作用的意义 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物,并释放氧气的过程。一、光合作用1、概念:2、反应表示式:3、光合作用的意义:(2)一切生物的能量来源(1)一切生物的物质来源(3)稳定大气中氧气与二氧化碳的含量光合作用与呼吸作用之比较二氧化碳叶绿体光照氧气二氧化碳氧气活细胞内制造贮藏释放分解空气污染与保护 当空气中某些成分的含量超过了正常含量,或空气中进入了正常情况下不存在的成分或有毒有害物质,从而影响人的健康和生物的生长发育,或对各种物质以及对天气和气候产生不良的影响,这样的空气状态称为空气污染。 什么是空气污染? 空气有一定的自净能力,在一般情况下能保持清洁新鲜的状态。伦敦烟雾事件 自1952年以来,伦敦发生过12次大的烟雾事件,祸首是燃煤排放的粉尘和二氧化硫。烟雾逼迫所有飞机停飞,汽车白天开灯行驶,行人走路都困难,烟雾事件使呼吸疾病患者猛增。1952年12月那一次,5天内有4000多人死亡,两个月内又有8000多人死去。材料一 40、50和70年代,发生在美国的洛杉矶市。
40年代时,洛杉矶市的汽车保有量就达到了250万辆,每天需要消耗汽油1000多吨。汽车尾气中的碳氢化合物、氮氧化物等都漂浮在街道上的空气中,在强烈阳光的照射下发生物理化学反应,产生了有毒的浅蓝色烟雾,造成大量市民眼睛红肿、咽炎、呼吸道疾病恶化乃至思维紊乱,肺水肿等疾病。1955年发生的光化学烟雾事件导致400多人因中毒、呼吸衰竭死亡,1970年发生的事件使3/4的市民患病。洛杉矶光化学烟雾事件材料二比利时马斯河谷空气污染事件 比利时马斯河谷工业区位于狭窄河谷内,分布有大量的炼油厂、金属厂、玻璃厂。这些工厂排放出大量的废气和工业粉尘,严重影响了当地人们的健康。1930年12月1-5日,由于天气的影响,河谷内出现静风,空气污染物扩散不出去。同时,也出现了逆温层,污染物难以扩散到高空,只能在低空中聚集,污染物浓度迅速上升。结果造成60多人在一周内死亡,市民中心脏病、肺病患者的死亡率增高,家畜死亡率也大大增高。材料三 烟尘、二氧化硫、碳氧化物(二氧化碳和一氧化碳)、氮氧化物(主要是一氧化氮和二氧化氮)、碳氢化合物。 通过以上三则材料,你知道污染空气的污染物主要有哪些?来源于何处?谈一谈主要空气污染物燃料燃烧汽车尾气(一氧化碳、氮氧化物、碳烟、二氧化硫)(烟尘、废气)酸雨一、酸雨的形成SO2+H2O=H2SO32H2SO3+O2=2H2SO4(PH<5.6的酸性降水) 危害健康,使水域和土壤酸化,损害农作物和林木生长,危害渔业,腐蚀建筑物、工业设备和文化古迹。 你知道酸雨会造成哪些危害呢?本报讯 陈忠报道 国家环保总局日前发布的全国环境质量状况表明,全国酸雨污染呈加重趋势,在酸雨控制区的 106 个城市中,出现酸雨的城市占89.6%,温州市是4个酸雨频率超过95%的城市之一。据了解,该市每年因酸雨造成的经济损失达3亿多元。全国四个酸雨频率超过95%的城市之一 温州每年被酸雨夺走三个亿 陈忠 2004年3月29日酸雨几年变化图给我们什么启示?保护空气的措施1、要控制污染源
2、加强空气质量监测和预报
3、发展“绿色工业”
4、使用清洁能源
5、植树造林,绿化环境首要污染物:指污染最重的污染物。 空气质量状况: 优、良、轻度/中度/重污染通过空气质量日报,你知道预报的主要内容有哪些?通过这些你知道了什么?污染指数:将监测的几种空气污染物浓度简化成数值形式1、空气中按体积计算,含量最多 的气体 是( )
A 氧气 B 氮气
C 二氧化碳 D 稀有气体B3、空气中氧气与氮气的体积比约为( )
A 4:1 B 1:4 C 1:5 D 5:1B2、在100升空气里氮气的体积大约是( )
A 78升 B 78% C 21升 D 21% A 巩固练习4、实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)的方法制取氧气。
(1)请写出反应的化学方程式________________
(2)图中收集氧气的方法叫做________________
可用此方法收集氧气的原因是________________
(3)用该方法收集氧气时,检验集气瓶中氧气是否集满的方法是__________________
(4)如果锥形瓶中的反应很剧烈,应该采用的安全措施是( )
A、减慢液体滴加的速度
B、换用体积较小的锥形瓶
C、加热锥形瓶2H2O2 ===== 2H20 + O2MnO2向上排空气法氧气密度比空气密度略大把带火星的木条放在瓶口A二氧化锰过氧化氢溶液5、汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 ___________________________________。下列能控制空气污染源的方法是_______________①开发氢能源;②使用电动车;③植树造林;④戴呼吸面具。 2CO+2NO =N2+2CO2催化剂(1)(2)6、实验室制取氧气时,有如下各操作步骤:
1. 向大试管中装入药品并塞紧带导管的橡皮塞;
2. 检验装置是否漏气;
3. 将导气管从水槽中取出;
4. 给大试管加热;
5. 将大试管固定在铁架台上;
6. 用排水法收集气体;
7. 移开酒精灯并熄灭;
正确的操作顺序是(填序号) 。2154637 6、 在将有空气的密闭容器中,若用燃烧的方法除去其中的氧气且瓶内压强明显降低的是( )
A.硫 B.木炭 C.红磷 D.蜡烛C7、二氧化碳常用来灭火,是因为它( )
1.本身不能燃烧2.不支持燃烧3.能溶于水
4.密度比空气大
A. 1 2 3 B. 1 3 4 C.1 2 4 D.2 3 4
CAD
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
