第六章 6.3 物质的溶解性同步练习
图片预览

文档简介
6.3 物质的溶解性
一.选择题
1.下列物质溶于水时,溶液温度明显下降的是( )
A.食盐 B.浓硫酸 C.硝酸铵 D.氢氧化钠
2.下列固体物质溶于水的过程中,溶液温度显著升高的是( )
A.氢氧化钠 B.氯化钠 C.硝酸铵 D.蔗糖
3.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降,这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
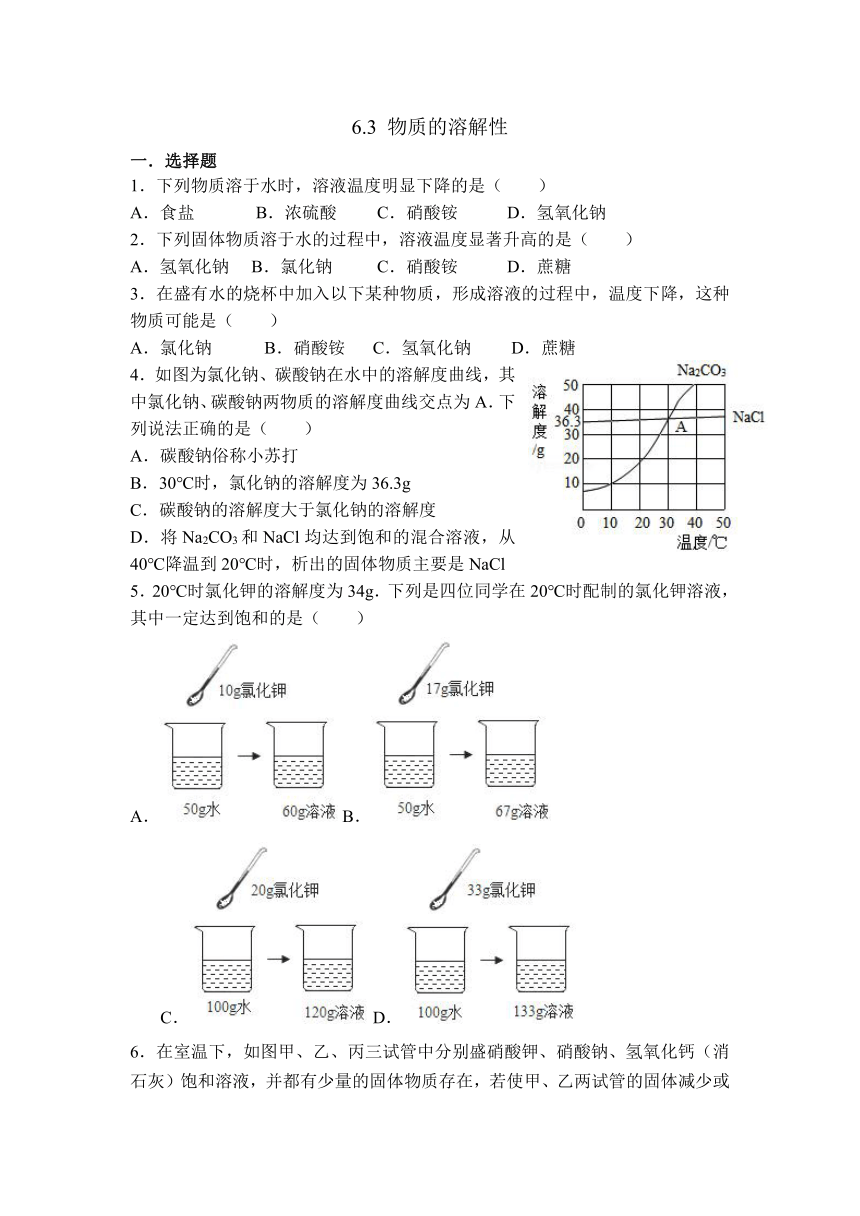
4.如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
A.碳酸钠俗称小苏打
B.30℃时,氯化钠的溶解度为36.3g
C.碳酸钠的溶解度大于氯化钠的溶解度
D.将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl
5.20℃时氯化钾的溶解度为34g.下列是四位同学在20℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
6.在室温下,如图甲、乙、丙三试管中分别 ( http: / / www.21cnjy.com )盛硝酸钾、硝酸钠、氢氧化钙(消石灰)饱和溶液,并都有少量的固体物质存在,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,应向试管外杯里的水中加入的物质是( )
( http: / / www.21cnjy.com )
A.氢氧化钠固体 B.硝酸铵固体 C.氯化钠固体 D.冰
7.要使一接近饱和的硝酸钾溶液变成饱和溶液,以下措施中不能达到目的是( )
A.恒温蒸发溶剂 B.加水
C.降低温度 D.加入适量硝酸钾
8.某同学往右图所示的烧杯(用石蜡将烧杯和 ( http: / / www.21cnjy.com )塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
( http: / / www.21cnjy.com )
A.蔗糖 B.硝酸铵 C.氯化钠 D.氢氧化钠
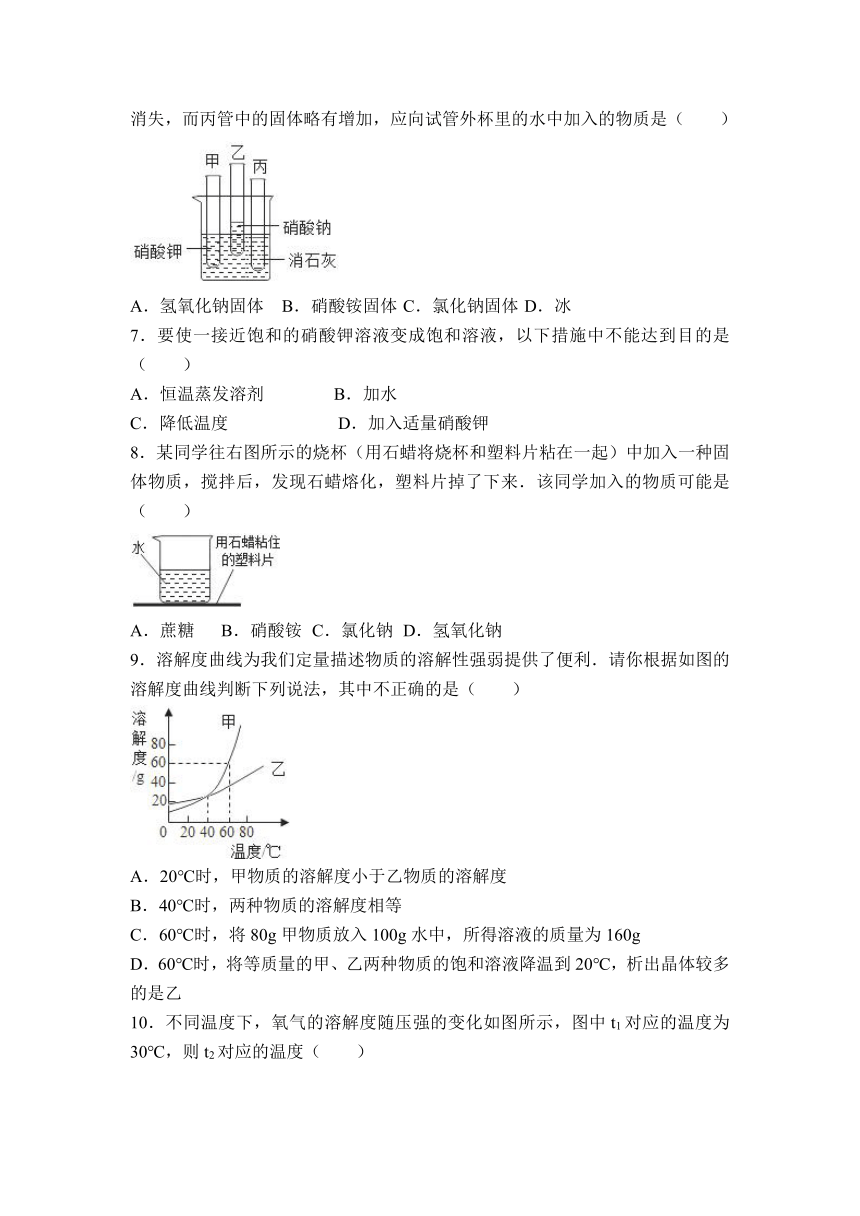
9.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线判断下列说法,其中不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
10.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
( http: / / www.21cnjy.com )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
11.使80℃的硝酸钾饱和溶液冷却到20℃,对可能发生的变化说法正确的是( )
A.溶液中溶质的质量分数不变 B.溶液质量增加
C.溶液中溶质的溶解度减小 D.溶液变成不饱和溶液
12.如图表示A、B两种物质的溶解度(s)随温度(t)的变化情况,下列说法正确的是( )
( http: / / www.21cnjy.com )
A.A的溶解度大于B的溶解度
B.升高温度可使A的不饱和溶液变为饱和
C.t3℃时,在100g水中溶解60gA能形成饱和溶液
D.t2℃时,A和B的饱和溶液的溶质质量分数相等
13.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是( )
( http: / / www.21cnjy.com )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液
C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b
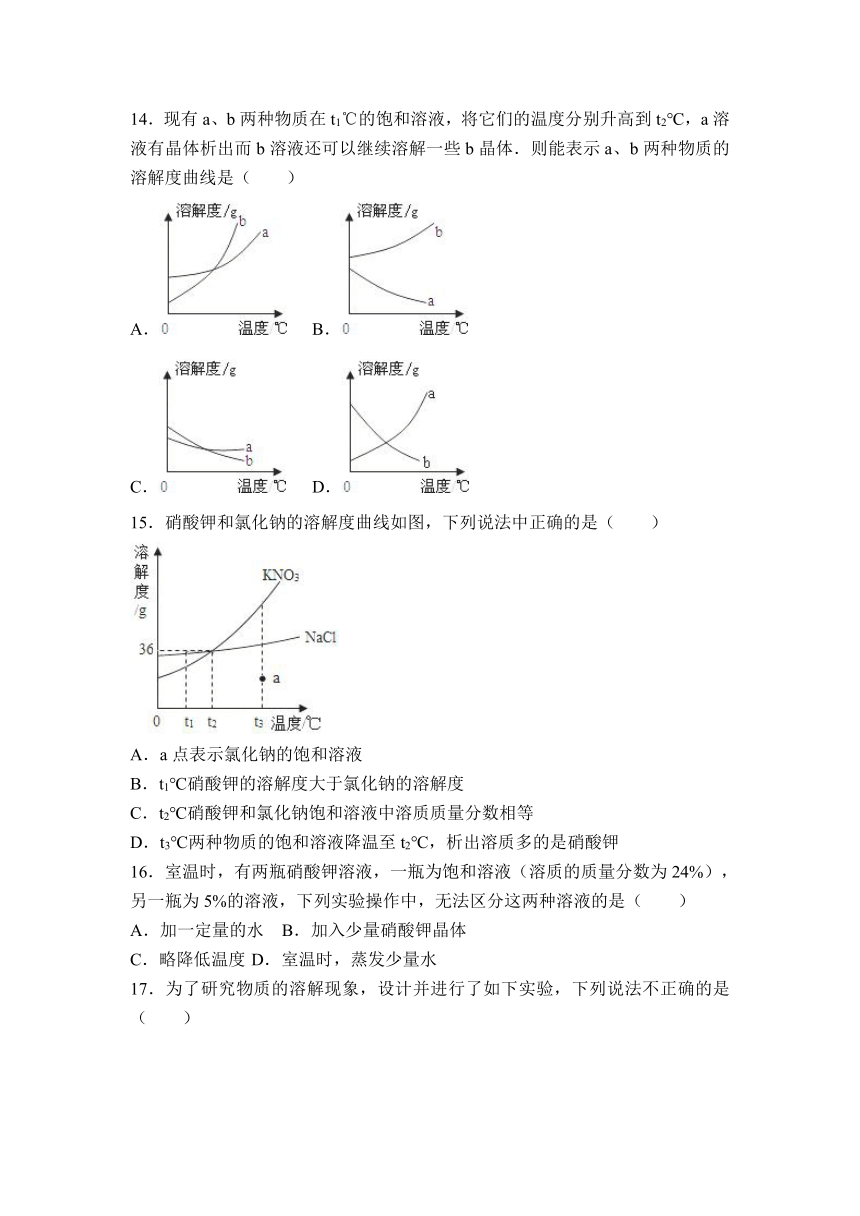
14.现有a、b两种物质在t1℃的饱和溶液 ( http: / / www.21cnjy.com ),将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体.则能表示a、b两种物质的溶解度曲线是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
15.硝酸钾和氯化钠的溶解度曲线如图,下列说法中正确的是( )
( http: / / www.21cnjy.com )
A.a点表示氯化钠的饱和溶液
B.t1℃硝酸钾的溶解度大于氯化钠的溶解度
C.t2℃硝酸钾和氯化钠饱和溶液中溶质质量分数相等
D.t3℃两种物质的饱和溶液降温至t2℃,析出溶质多的是硝酸钾
16.室温时,有两瓶硝酸钾 ( http: / / www.21cnjy.com )溶液,一瓶为饱和溶液(溶质的质量分数为24%),另一瓶为5%的溶液,下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
17.为了研究物质的溶解现象,设计并进行了如下实验,下列说法不正确的是( )
( http: / / www.21cnjy.com )
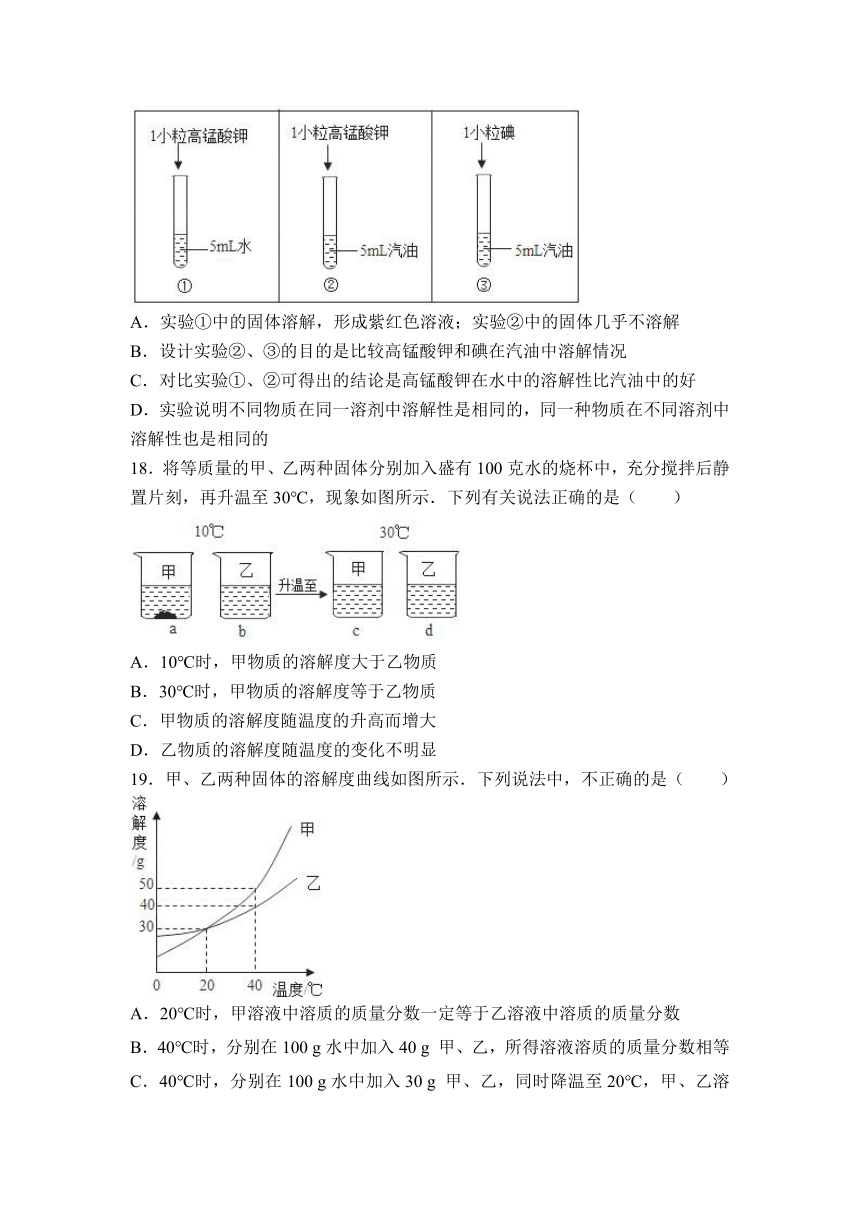
A.实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解
B.设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况
C.对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好
D.实验说明不同物质在同一溶剂中溶解性是相同的,同一种物质在不同溶剂中溶解性也是相同的
18.将等质量的甲、乙两种固体分别加入 ( http: / / www.21cnjy.com )盛有100克水的烧杯中,充分搅拌后静置片刻,再升温至30℃,现象如图所示.下列有关说法正确的是( )
( http: / / www.21cnjy.com )
A.10℃时,甲物质的溶解度大于乙物质
B.30℃时,甲物质的溶解度等于乙物质
C.甲物质的溶解度随温度的升高而增大
D.乙物质的溶解度随温度的变化不明显
19.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
B.40℃时,分别在100 g水中加入40 g 甲、乙,所得溶液溶质的质量分数相等
C.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D.20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液
20.如图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )
( http: / / www.21cnjy.com )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
21.如图为某固体溶解度随温度变化 ( http: / / www.21cnjy.com )的曲线.该固体从溶液中析出时不带结晶水.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )
( http: / / www.21cnjy.com )
A.升温10℃后,M点延曲线向右上移
B.降温10℃后,M点延曲线向左下移
C.降温10℃后,N点向左平移
D.恒温蒸发溶剂时,M点不动,N点向上移动至曲线后不再变化
22.不影响固体溶解度大小的因素是( )
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
23.60℃时,化合物甲的溶解度比 ( http: / / www.21cnjy.com )乙大.分别取等质量60℃时的甲、乙的饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水).以下叙述正确的是( )
A.60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B.a一定大于b
C.20℃时,若甲的溶解度仍比乙的大,则a一定小于b
D.20℃时,若甲的溶解度比乙的小,则a一定大于b
二.填空题
24.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示.
(1) ℃时,甲的溶解度为20g.
(2)t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为 .
( http: / / www.21cnjy.com )
25.根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)30℃时,NaCl的溶解度是 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 .
(3)20℃时,在100g水中加入50gNa ( http: / / www.21cnjy.com )Cl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 .
26.如图所示是甲、乙、丙 ( http: / / www.21cnjy.com )三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)b物质的溶解情况是
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: ;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是 ;(用a、b、c填空)
(4)40℃时,等质量饱和溶液中含水最少的是 物质.
(5)40℃时,甲溶液中溶质质量分数 大于丙溶液中溶质质量分数;(填“一定”或“不一定”).
( http: / / www.21cnjy.com )
27.如图是三种固体物质的溶解度曲线.
(1)物质c的溶解度随温度的升高而 ;
(2)物质a的溶解度大于物质c的溶解度的温度范围 ;
(3)t2℃时,用50g水配制物质a的饱和溶液至少需要 g物质;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃(溶剂量不变),溶液中溶质质量分数不变的是 .
( http: / / www.21cnjy.com )
28.如图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
①t2℃时,A、B、C三种物质溶解度的大小关系是 .
②有t1℃时A的饱和溶液80g,其中A的质量为 g.
③把C物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 .
Ⅰ.溶剂的质量一定变小Ⅱ.溶质的质量可能不变
Ⅲ.溶质的质量分数一定变大Ⅳ.溶质的质量一定变大
④将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后,三种溶液中溶质的质量分数由小到大的顺序是 .
( http: / / www.21cnjy.com )
29.如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
(1)随着温度的升高,a物质的溶解度的变化趋势是 .
(2)曲线a和b的交叉点M表示的含义是 .
(3)80℃时40g a物质溶于50g水中所形成的溶液是 溶液(选填“饱和”或“不饱和”).
( http: / / www.21cnjy.com )
30.如图是a、b两种固体物质的溶解度曲线.
(1)图中a物质的溶解度曲线比b物质的陡,说明: ;
(2)若要想在200g水中溶解更多的a物质,可采取的措施是: ;
(3)40℃时,将20g a物质放入50g水中,充分搅拌,所得溶液的溶质质量分数是 .
(4)下列说法正确的是:
A、a、b物质都是易溶物
B、可用结晶的方法分离a、b的混合物
C、a的饱和液从40℃降温至20℃后仍然饱和
D、30℃时,a、b的饱和液中所含溶质质量一定相等.
( http: / / www.21cnjy.com )
31.甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
(1)50℃时,乙物质的溶解度是 g.
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 .
(3)温度为 ℃时,甲、乙两物质溶解度相同.
( http: / / www.21cnjy.com )
32.如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.
①20℃时,甲乙丙三种物质的溶解度由大到小的顺序
②图中A点表示的意义是 .
③在室温时,将分别盛有甲 ( http: / / www.21cnjy.com )、丙饱和溶液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是 (填字母序号),该现象被叫做 .
( http: / / www.21cnjy.com )
33.如图是A、B、C三种固体物质的溶解度曲线,据图回答:
(1)t2℃时,三种物质的溶解度由大到小的顺序为 .
(2)图中P点表示 .
(3)t2℃时,将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为 .
( http: / / www.21cnjy.com )
34.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答
(1)在t3℃时,三种物质的溶解度从小到大的顺序是:
(2)在 时,B与C的溶解度相等;
(3)物质C的溶解度随温度升高而 .
( http: / / www.21cnjy.com )
35.右图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(1) 时,A、B两物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃ 析出晶体较多.(填“A”或“B”)
(3)40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后, 物质有剩余(填“A”或“B”).
(4)现有50℃时A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是 (填序号).
①降低温度 ②升高温度 ③加入A物质.
( http: / / www.21cnjy.com )
36.甲、乙两种物质的溶解度曲线如图.试回答以下问题:
(1)m点表示 ;
(2)20℃时,在100克甲物质的饱和溶液中加入10克水,为使溶液重新达到饱和,需加甲物质 克;
(3)常压下,CO2在水中的溶解度随温度的变化应类似于 物质;(填甲或乙)
(4)40℃时,将甲、乙两物质的饱和溶 ( http: / / www.21cnjy.com )液各100g,分别降温到20℃,所得甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量.
( http: / / www.21cnjy.com )
37.A、B、C、D四个烧杯中分别盛有 ( http: / / www.21cnjy.com )相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20 g、15 g、10 g、5 g某物质,充分溶解后观察到如图所示的现象.请完成下列问题:
( http: / / www.21cnjy.com )
(1)在A、B、C、D四个烧杯中, 中盛的一定是饱和溶液; 中盛的一定不是饱和溶液; 中盛的可能是饱和溶液.
(2)若固体是KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是 .
(3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解? .
38.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 .
(2)当温度为t1℃,三种物质溶解度由小到大依次为 ,当温度为t3℃时,溶解度最大的是 .
(3)C可能表示哪种物质: .
( http: / / www.21cnjy.com )
39.碘在不同溶剂中的溶解实验,根据实验操作图示回答相关问题.
( http: / / www.21cnjy.com )
(1)由图2所示现象可知:碘 (选填“不”、“微”或“易”)溶于水.
(2)图3所示试管中液体分层,说明碘在汽油中的溶解性比在水中 (选填“强”或“弱”).
(3)①碘易溶于酒精.若实验中汽油用酒精代替,振荡后静置,最终所得液体 (选填“分层”或“不分层”).
②“从稀碘水中提取碘”是“海带提碘 ( http: / / www.21cnjy.com )”工艺中的一个重要步骤,其原理类似实验中第二步操作.工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 .
三.实验探究题
40.控制变量是科学探究的重要方法之一. ( http: / / www.21cnjy.com )小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
温度(℃) 20 30 40 50 60 70 80
溶解度(g) 31.6 45.8 63.9 85.5 110 138 168
(1)建立假设: ;
(2)实施方案:
a. ;b. ;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果 ;
实验中,控制不变的因素是 (至少写出2点).
41.某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化.
【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验 水的体积 所加物质 测量液体温度(℃)
实验1 50mL 氯化铵 15
实验2 50mL 氯化钙 28
实验3 X 氯化钠 21
实验4 50mL 无 22
【数据分析】
(1)表中X为 mL.
(2)比较实验2与实验4,可获得的结论是 .
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 .
【反思评价】
(4)经讨论认为本实验操作中存在缺陷,它是 (填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样.
四.推断题
42.根据如图回答下列问题.
(1)能够证明同一物质在不同溶剂中的溶解性不同的实验是 .
(2)能够证明不同的物质在同一溶剂中的溶解性不同的实验是 .
( http: / / www.21cnjy.com )
43.如图是a、b、c三种固体物质的溶解度曲线
(1)a、b、c三种物质中,溶解度受温度的影响最大的是 .
(2)t1℃时,a的溶解度 c的溶解度.(填“>、<或=”)
(3)t1℃时,将30ga物质放入1 ( http: / / www.21cnjy.com )00g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液的质量是 g.
( http: / / www.21cnjy.com )
44.如图是a、b两种固体物质的溶解度曲线.
(1)30℃时,100g水中最多能溶解的a物质的质量是 g,此时,要想在100g水中溶解更多的a物质,可采取的措施是 .
(2)60℃时,将40g a物质放入在100g水中,充分搅拌,所得溶液的质量是 g.
(3)图中a物质的溶解度曲线比b物质陡,说明 .
( http: / / www.21cnjy.com )
45.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答:
①在t3℃时,三种物质的溶解度从小到大的顺序是: ;
②在 时,A与C的溶解度相等;
③物质C的溶解度随温度升高而 .
( http: / / www.21cnjy.com )
五.解答题
46.图表法是一种常用的数据处理方法,结合所给图表回答下列问题
氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
(1)上述图象表示 (填“氢氧化钠”或“碳酸钠”)的溶解度曲线
(2)20℃时,氢氧化钠的溶解度 (填“大于”或“小于”)碳酸钠
(3)40℃时,若将50gNaOH分别 ( http: / / www.21cnjy.com )投入到100g水和100g酒精中,能形成饱和溶液的是 ,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为 .
( http: / / www.21cnjy.com )
47.根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0℃时,KNO3的溶解度是 g.
(2)与KNO3相比较,NaCl的溶解度受温度变化影响 ;
(3)20℃时,在100g水中 ( http: / / www.21cnjy.com )加入40gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是饱和或不饱和中的 溶液.
( http: / / www.21cnjy.com )
48.根据下表实验,回答相关问题
实验步骤 实验操作 实验现象
Ⅰ 在盛有100g水的烧杯中,加入25g氯化钾,搅拌,恢复到20℃. 全部溶解
Ⅱ 再加Xg氯化钾,搅拌,恢复到20℃,恰好饱和. 全部溶解
Ⅲ 再加6g氯化钾,搅拌,恢复到20℃ 固体不溶
Ⅳ 加热 全部溶解
Ⅴ 冷却至20℃
①实验步骤Ⅱ中加入Xg氯化钾,X= g.
②实验步骤Ⅲ中所得溶液是 (填“饱和”或“不饱和”)溶液.
③冷却至20℃,烧杯中的现象是 .
④有五瓶氯化钾溶液,与上述实验步骤Ⅰ﹣ ( http: / / www.21cnjy.com )Ⅴ形成的溶液溶质质量分数分别相等,现各取10g于5个小烧杯中,分别滴入足量的等质量等浓度的硝酸银溶液,其中有 个小烧杯中产生的沉淀质量相等.
( http: / / www.21cnjy.com )
49.运城盐湖被称为中国的“死海”,含盐量 ( http: / / www.21cnjy.com )极高,其主要成分为MgSO4和NaCl,两物质的溶解度如表所示.随着温度的变化,该盐湖会析出不同的物质,水温在10℃左右开始析出NaCl在0℃时开始析出MgSO4.
温度 0℃ 10℃ 20℃ 30℃
MgSO 22.0 28.2 33.7 38.9
NaCl 35.7 35.8 36.0 36.3
(1)据如表可知,10℃时,MgSO4的溶解度比NaCl的小,但NaCl先析出的原因是 .
(2)模拟盐湖结晶的过程如图:
x的质量为 ,溶液a开始有晶体析出的温度范围是 ,溶液b中的溶质是 .
( http: / / www.21cnjy.com )
50.图一是甲、乙两种固体物质的溶解度曲线,分析并回答问题.
( http: / / www.21cnjy.com )
(1)P点的含义是 .
(2)t2℃时,将甲、乙各30g分别加入到盛有50g水的两个烧杯中,充分溶解后,现象如图二所示.
①B烧杯中溶液的溶质是 (填“甲”或“乙”).
②将B烧杯中的溶液全部倒入A烧杯中(甲和乙不反应),充分搅拌后,A烧杯中的固体 (填“全部溶解”“部分溶解”或“不溶解”).
③欲使混合溶液恰好形成甲的饱和溶液,应再加入甲 g.
51.食品工业中合理使用食品添加剂可改善食品的色、香、味等品质.碳酸钠和碳酸氢钠就是食品中常用的添加剂,二者在不同温度时的溶解度如表所示
温度/℃ 0 10 20 30 40
碳酸钠的溶解度/g 7.1 12.5 21.5 39.7 49.0
碳酸氢钠的溶解度/g 6.9 8.1 9.6 11.1 12.7
(1)10℃时,碳酸钠的溶解度为 .
(2)两种物质的溶解度曲线关系合理的是 .
( http: / / www.21cnjy.com )
(3)区分两种物质的方法:取 ( http: / / www.21cnjy.com )两种固体粉末各xg加入20℃的10g水中充分溶解,通过观察现象可区分碳酸钠和碳酸氢钠,x的值可能是 (填字母),此时碳酸氢钠溶液中溶质的质量分数是 (精确到0.01%)
A、2 B、0.96 C、0.5.
52.同学们分别取6g固体和20mL水,研究物质溶解前后温度的变化.
实验序号 ① ② ③
实验内容 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
温度变化 温度升高 基本不变
(1)由于NaOH有腐蚀性,称量时应将NaOH固体放在 .
(2)实验③中可观察到的温度变化是 .
(3)三个实验中,固体和水的用量相同,这样做的目的是 .
53.A、B 两种物质的溶解度曲线如图所示.
(1)m点的意义 .
(2)当温度为10℃时,溶解度较大的是 ( http: / / www.21cnjy.com ) 物质; 30℃时,分别用100g水配制成A、B的饱和溶液,溶解度大的物质比溶解小的物质多溶解 g.
(3)30℃时,将A和B 各40g分别投入到盛有50g水的烧杯中充分溶解后,所得A溶液的质量为 g,B溶液的质量是 g.
( http: / / www.21cnjy.com )
参考答案与解析
一.选择题
1.(2017 桂林)下列物质溶于水时,溶液温度明显下降的是( )
A.食盐 B.浓硫酸 C.硝酸铵 D.氢氧化钠
【分析】根据常见物质溶于水的吸热与放热现象、溶液温度的变化情况进行分析解答即可.
【解答】解:物质在溶解时经常伴随有吸热 ( http: / / www.21cnjy.com )或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低;氯化钠、蔗糖等溶于水,温度变化不大.
A、食盐溶于水温度变化不大,故选项错误.
B、浓硫酸溶于水温度升高,故选项错误.
C、硝酸铵溶于水吸热,使溶液的温度明显下降,故选项正确.
D、氢氧化钠溶于放出大量的热,溶液温度明显升高,故选项错误.
故选:C.
【点评】本题难度不大,掌握常见物质溶于水的吸热与放热现象、温度变化情况是正确解答本题的关键.
2.(2017 宜昌)下列固体物质溶于水的过程中,溶液温度显著升高的是( )
A.氢氧化钠 B.氯化钠 C.硝酸铵 D.蔗糖
【分析】溶液的温度显著上升,说明此物质溶于水时会放热,分别对选项中的物质进行分析即可解决此题.
【解答】解:氢氧化钠溶于水放热,蔗糖、氯化钠溶于水温度无明显变化,硝酸铵溶于水会吸热水温降低;
故选A.
【点评】此题是对物质溶于水时温度变化的考查,解题的重点是依据对课本中几种特殊物质的溶解现象必须熟悉,属基础性识记知识考查题.
3.(2017 无锡)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降,这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
【分析】根据物质溶于水后的放热与吸热现象来考虑,要由物质溶于水的整个过程来分析.
【解答】解:物质溶于水分为两个过程,向水 ( http: / / www.21cnjy.com )中扩散的过程吸收热量,与水分子结合形成水合分子的过程放出热量,如果吸收热量大于放出热量,就表现为吸热,如果吸收热量小于放出热量,就表现为放热,如果相等就表现为既不放热,也不吸热.
A、氯化钠溶于水溶液温度基本不变,故错误;
B、硝酸铵溶于水吸收热量,溶液温度降低,故正确;
C、氢氧化钠溶于水放出热量,溶液温度升高,故错误;
D、蔗糖溶于水溶液温度基本不变,故错误;
故选B.
【点评】熟记以下物质:溶于水放热的物质有:浓硫酸、生石灰、氢氧化钠固体;溶于水吸热的有硝酸铵.
4.(2017 广安)如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
( http: / / www.21cnjy.com )
A.碳酸钠俗称小苏打
B.30℃时,氯化钠的溶解度为36.3g
C.碳酸钠的溶解度大于氯化钠的溶解度
D.将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl
【分析】根据固体的溶解度曲线可以:①查出某物 ( http: / / www.21cnjy.com )质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:A、碳酸钠俗称苏打,碳酸氢钠俗称小苏打,故A错误;
B、通过分析溶解度曲线可知,30℃时,氯化钠的溶解度为36.3g,故B正确;
C、在比较物质的溶解度时,需要指明温度,故C错误;
D、碳酸钠的溶解度受温度变化影响较大 ( http: / / www.21cnjy.com ),所以将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是碳酸钠,故D错误.
故选:B.
【点评】本题难度不是很大,主要考查了固 ( http: / / www.21cnjy.com )体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
5.(2017 来宾)20℃时氯化钾的溶解度为34g.下列是四位同学在20℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
【分析】根据题意,20℃时氯化钾的溶解度为34g,根据溶解度的含义判断选项中的溶液是否达到饱和状态,进行分析判断.
【解答】解:20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态.
A、20℃时氯化钾的溶解度为34g,含义 ( http: / / www.21cnjy.com )是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入10g氯化钾,所得溶液是不饱和溶液,故选项错误.
B、20℃时氯化钾的溶解度为34g ( http: / / www.21cnjy.com ),含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入17g氯化钾,所得溶液是恰好是饱和溶液,故选项正确.
C、20℃时氯化钾的溶解度为34g, ( http: / / www.21cnjy.com )含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入20g氯化钾,所得溶液是不饱和溶液,故选项错误.
D、20℃时氯化钾的溶解度为34g,含 ( http: / / www.21cnjy.com )义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入33g氯化钾,所得溶液是不饱和溶液,故选项错误.
故选:B.
【点评】本题难度不大,掌握溶解度的含义、饱和溶液的特征等并能灵活运用是正确解答本题的关键.
6.在室温下,如图甲、乙、丙 ( http: / / www.21cnjy.com )三试管中分别盛硝酸钾、硝酸钠、氢氧化钙(消石灰)饱和溶液,并都有少量的固体物质存在,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,应向试管外杯里的水中加入的物质是( )
( http: / / www.21cnjy.com )
A.氢氧化钠固体 B.硝酸铵固体 C.氯化钠固体 D.冰
【分析】根据硝酸钾、硝酸钠 ( http: / / www.21cnjy.com )的溶解度随温度的升高而升高;氢氧化钙随温度的升高而降低,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,试管外杯里的水温度应升高,因此需加入溶于水温度升高的物质.
【解答】解:硝酸钾、硝酸钠的溶解度随温度的 ( http: / / www.21cnjy.com )升高而升高;氢氧化钙随温度的升高而降低,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,试管外杯里的水温度应升高,因此需加入溶于水温度升高的物质.
A、氢氧化钠固体溶于水,溶液温度升高,故正确;
B、硝酸铵溶于水,溶液温度降低,故错误;
C、氯化钠溶于水,溶液温度基本不变,故错误;
D、冰融化吸热,温度降低,故错误.
故选A.
【点评】溶解度曲线能定量地表示出溶解度变化的 ( http: / / www.21cnjy.com )规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同;了解哪些物质溶于水溶液温度升高还是降低.
7.要使一接近饱和的硝酸钾溶液变成饱和溶液,以下措施中不能达到目的是( )
A.恒温蒸发溶剂 B.加水
C.降低温度 D.加入适量硝酸钾
【分析】A、根据恒温蒸发溶剂接近饱和的硝酸钾溶液变成饱和溶液判断;
B、根据加水后溶液更不饱和判断;
C、根据硝酸钾的溶解度随温度升高而增大,降低温度硝酸钾的溶解度减小判断;
D、根据加入适量硝酸钾能使不饱和溶液再溶解一部分硝酸钾变为饱和溶液判断.
【解答】解:A、恒温蒸发水分,因溶剂减少而使不饱和溶液达饱和;
B、加水后溶液更不饱和;
C、降低温度,使同量水溶解硝酸钾的量减少而达到饱和;
D、不饱和硝酸钾溶液加入硝酸钾,继续溶解至不能再溶解而成为饱和溶液;
故选B.
【点评】增加溶质、减少溶剂都可以把不饱和溶液变成饱和溶液,但改变温度使不饱和溶液变成饱和溶液时却要具体分析溶质溶解度与温度的关系.
8.某同学往右图所示的烧杯(用石蜡将烧杯和塑 ( http: / / www.21cnjy.com )料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
( http: / / www.21cnjy.com )
A.蔗糖 B.硝酸铵 C.氯化钠 D.氢氧化钠
【分析】发现石蜡熔化,塑料片掉了下来说明加入的物质放出热量,使溶液温度升高.
【解答】解:A、蔗糖溶于水既不放出热量,也不吸收热量,溶液温度不变,故A错;
B、硝酸铵溶于水吸收热量,使溶液温度降低,故B错;
C、氯化钠溶于水既不放出热量,也不吸收热量,溶液温度不变,故C错;
D、氢氧化钠溶于水放出热量,使溶液温度升高,故D正确.
故选D.
【点评】解答本题关键是要知道常见物质溶于水是吸收热量还是放出热量.
9.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线判断下列说法,其中不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
【分析】由溶解度曲线:可以比 ( http: / / www.21cnjy.com )较20℃、40℃时甲、乙两物质的溶解度大小;由60℃时,甲物质的溶解度可以判断形成溶液的质量;由甲、乙两物质的溶解度受温度的影响变化趋势,可以判断降温后析出晶体的质量多少.
【解答】解:A、由图可知,20℃时,甲物质的溶解度小于乙物质的溶解度,故说法正确;
B、40℃时,两种物质的溶解度曲线交于一点,故两种物质的溶解度相等,故说法正确;
C、60℃时,甲物质的溶解度为60g,故将80g甲物质放入100g水中,充分搅拌后只能溶解60g,将得到溶液的质量为160g;故说法正确;
D、甲物质的溶解度受温度的影响变化较大,故60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是甲;
故选D.
【点评】主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
10.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
( http: / / www.21cnjy.com )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
【分析】利用气体的溶解度随温度的升高而减小,结合图示进行分析解答.
【解答】解:气体的溶解度随温度的 ( http: / / www.21cnjy.com )升高而减小,由氧气的溶解度随压强的变化图,t1对应的溶解度大于t2对应的溶解度,t1对应的温度为30℃,则t2对应的温度应大于30℃.
故选:A.
【点评】本题难度不大,主要考查气体的溶解度的影响因素,掌握气体溶解度的两个影响因素(温度、压强)是正确解答本题的关键.
11.使80℃的硝酸钾饱和溶液冷却到20℃,对可能发生的变化说法正确的是( )
A.溶液中溶质的质量分数不变 B.溶液质量增加
C.溶液中溶质的溶解度减小 D.溶液变成不饱和溶液
【分析】根据溶解度的知识进行分析,硝酸钾的溶解度随着温度的升高而增大.
【解答】解:A、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,导致溶质质量分数减小,故A错误;
B、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,导致溶液质量减小,故B错误;
C、降低温度硝酸钾的溶解度减小,故C正确;
D、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,析出晶体后的溶液仍然是饱和溶液,故D错误;
故选C.
【点评】本题考查了溶解度的有关知识,完成此题,可以依据硝酸钾的溶解度受温度变化的因素进行.
12.如图表示A、B两种物质的溶解度(s)随温度(t)的变化情况,下列说法正确的是( )
( http: / / www.21cnjy.com )
A.A的溶解度大于B的溶解度
B.升高温度可使A的不饱和溶液变为饱和
C.t3℃时,在100g水中溶解60gA能形成饱和溶液
D.t2℃时,A和B的饱和溶液的溶质质量分数相等
【分析】由于固体物质的溶解度会随温度的变化 ( http: / / www.21cnjy.com )而变化,从图中可以看出,只有在高于t2℃℃时,A的溶解度大于B的溶解度;由A的溶解度受温度的变化趋势,可以升高温度可使A的不饱和溶液是否饱和;t3℃时,A的溶解度为80g,可以确定在100g水中溶解60gA能否形成饱和溶液;t2℃时,A、B两种物质的溶解度大小,可以判断溶质的质量分数的大小.
【解答】解:A、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于t2℃℃时,A的溶解度大于B的溶解度,故A错误;
B、A的溶解度随着温度的升高而增大,故升高温度后A的不饱和溶液仍为不饱和溶液,故B错误;
C、t3℃时,A的溶解度为80g,故在100g水中溶解60gA能全部溶解,形成不饱和溶液.
D、t2℃时,A、B两种物质的溶解度相等,故在t2℃时,A和B的饱和溶液的溶质质量分数相等.
故选D.
【点评】本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.
13.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是( )
( http: / / www.21cnjy.com )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液
C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b
【分析】A、依据物质的溶解度随温度变化及饱和溶液中溶质质量分数的计算分析解答;
B、依据t1℃时c的溶解度分析解答;
C、依据溶液的状态及a、b物质的溶解度分析解答;
D、依据该温度下物质的溶解度及饱和溶液中溶质的质量分数分析.
【解答】解:A、曲线从t2℃降到t1℃后a和b的溶解度都减小,仍然是饱和溶液,又因为饱和溶液的溶质质量分数的计算式为 ( http: / / www.21cnjy.com )×100%,由此可知饱和溶液的溶解度越大溶质质量分数就越大,所以在t1℃时b的溶解度大于a的,所以溶质质量分数也是b大于a;由于c降温后变为不饱和溶液,它的溶质质量分数不变,取决于t2℃时的溶解度大小,因此只要比较一下在t2℃时c的溶解度与t2℃时a和b的溶解度大小就行,因为t1℃时a的溶解度大于t2℃时c的溶解度,所以温度降低到t1℃时,溶液的溶质质量分数大小关系是:b>a>c,故A错误;
B、t1℃时c的溶解度是20g,所以将20gc加入50g水中,最多溶解10gc,得到60克饱和溶液,故B错误;
C、t2℃时a的溶解度大于b的溶解度, ( http: / / www.21cnjy.com )若为饱和溶液则a溶液的溶质质量分数一定大于b溶液的溶质质量分数,若为不饱和溶液,则无法判断,故C错误;
D、t1℃时b的溶解度最大,则a、b、c的饱和溶液中,溶质质量分数最大的是b,故D正确.
故选D.
【点评】通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的影响因素,考查了学生对知识的掌握和应用.
14.现有a、b两种物质在t1℃的 ( http: / / www.21cnjy.com )饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体.则能表示a、b两种物质的溶解度曲线是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
【分析】a、b两种物质在t1℃的 ( http: / / www.21cnjy.com )饱和溶液,将温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体,可以得出a、b的溶解度随着温度的升高的变化趋势,进而可以判断a、b的曲线趋势即可.
【解答】解:a、b两种物质在t1℃的饱 ( http: / / www.21cnjy.com )和溶液,将温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体,说明a的溶解度随着温度的升高的减小,b的溶解度随着温度的升高的增大;故B图符合要求.
故选B.
【点评】主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
15.硝酸钾和氯化钠的溶解度曲线如图,下列说法中正确的是( )
( http: / / www.21cnjy.com )
A.a点表示氯化钠的饱和溶液
B.t1℃硝酸钾的溶解度大于氯化钠的溶解度
C.t2℃硝酸钾和氯化钠饱和溶液中溶质质量分数相等
D.t3℃两种物质的饱和溶液降温至t2℃,析出溶质多的是硝酸钾
【分析】根据固体物质的溶解度曲线可 ( http: / / www.21cnjy.com )知:①查出某物质在某温度下的溶解度;②比较不同物质在同一温度下的溶解度的大小,③判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液中溶质的质量分数.
【解答】A、a点在氯化钠溶解度曲线下面,所以是氯化钠的不饱和溶液,故A错误;
B、通过溶解度曲线可以看出,t1℃硝酸钾的溶解度小于氯化钠的溶解度,故B错误;
C、t2℃硝酸钾和氯化钠的溶解度相等,所以两者饱和溶液中溶质质量分数相等,故C正确;
D、t3℃两种物质的饱和溶液降温至t2℃,溶液质量不能确定,所以析出的晶体质量也不能确定,故D错误.
故选:C.
【点评】主要考查了固体溶解度曲线的意义及固体溶解度和温度间的关系,并能利用所学知识来解决实际问题.
16.室温时,有两瓶硝酸钾溶液,一瓶 ( http: / / www.21cnjy.com )为饱和溶液(溶质的质量分数为24%),另一瓶为5%的溶液,下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
【分析】(1)在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;还能继续溶解的溶液,称为该物质的不饱和溶液;
(2)要想说明溶液是否饱和,必须在温度一定、溶剂的量一定的情况下.
(3)判断溶液是否饱和,可以采用加入少量该溶质看是否溶解.
【解答】解:
A、各加入少量水振荡,没有现象.故此选项错误.
B、向硝酸钾的饱和溶液中各加入少量硝酸钾晶体,振荡.晶体不溶解.可区分开饱和溶液和不饱和溶液,故此选项正确.
C、硝酸钾的饱和溶液在降低温度时会有晶体析出,不饱和的不会析出晶体,故此选项正确.
D、蒸发少量水饱和的溶液会有晶体析出,不饱和的不会析出晶体,故此选项正确.
故选:A.
【点评】此题主要考查了饱和溶液和不饱和 ( http: / / www.21cnjy.com )溶液的区分.在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;要想说明溶液是否饱和,必须温度一定、溶剂的量一定.
17.为了研究物质的溶解现象,设计并进行了如下实验,下列说法不正确的是( )
( http: / / www.21cnjy.com )
A.实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解
B.设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况
C.对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好
D.实验说明不同物质在同一溶剂中溶解性是相同的,同一种物质在不同溶剂中溶解性也是相同的
【分析】根据实验①、②是高锰酸钾溶解在等体积的水、汽油中,进行分析解答.实验②、③分别是高锰酸钾、碘溶解在等体积的汽油里,进行分析解答.
【解答】解:A、高锰酸钾易溶于水形成紫红色溶液,高锰酸钾几乎不溶于汽油,故A说法正确;
B、实验②、③分别是高锰 ( http: / / www.21cnjy.com )酸钾、碘溶解在等体积的汽油里,现象分别是固体几乎不溶解,固体溶解,形成紫红色溶液,目的是比较高锰酸钾和碘在汽油中溶解情况,故B说法正确;
C、实验①、②是高锰酸钾溶解在等体 ( http: / / www.21cnjy.com )积的水、汽油中,现象分别是固体溶解,形成紫色溶液,固体几乎不溶解,所以对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好,故C说法正确;
D、实验说明不同物质在同一溶剂中溶解性是不相同的,同一种物质在不同溶剂中溶解性也是不相同的,故D说法错误.
故选D.
【点评】本题难度不大,根据实验确定影响常见物质的溶解性的因素是正确解答本题的关键.
18.将等质量的甲、乙两 ( http: / / www.21cnjy.com )种固体分别加入盛有100克水的烧杯中,充分搅拌后静置片刻,再升温至30℃,现象如图所示.下列有关说法正确的是( )
( http: / / www.21cnjy.com )
A.10℃时,甲物质的溶解度大于乙物质
B.30℃时,甲物质的溶解度等于乙物质
C.甲物质的溶解度随温度的升高而增大
D.乙物质的溶解度随温度的变化不明显
【分析】根据物质的溶解度曲线可以判断物质的溶解度大小和饱和溶液和不饱和溶液可以相互转化进行分析.
【解答】解:A、10℃时,向盛有100g水的烧杯中分别加入等质量的甲、乙两种固体,乙全部溶解,说明10℃时乙的溶解度大于甲的溶解度,错误;
B、30℃时,不知道是否是饱和溶液,所以无法判断甲物质的溶解度等于乙物质,错误;
C、甲物质的溶解度随温度的升高而增大,正确;
D、不知道是否是饱和溶液,所以无法判断乙物质的溶解度随温度的变化不明显,错误;
故选C
【点评】溶解度曲线能定量地表示出溶 ( http: / / www.21cnjy.com )解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
19.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
B.40℃时,分别在100 g水中加入40 g 甲、乙,所得溶液溶质的质量分数相等
C.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D.20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液
【分析】A、不知溶液状态和溶质、溶剂质量多少,故无法判断溶液中溶质的质量分数大小;
B、据40℃时甲、乙的溶解度分析判断;
C、据甲乙在20℃时的溶解度分析解答;
D、据甲乙在40℃时的溶解度分析解答.
【解答】解:A、不知溶液状态和溶质、溶剂质量多少,故无法判断溶液中溶质的质量分数大小,若二者均为饱和溶液,则溶质的质量分数相等,故错误;
B、40℃时甲、乙的溶解度分别是 ( http: / / www.21cnjy.com )50g、40g,所以分别在100 g水中加入40 g 甲、乙均能完全溶解,所得溶液溶质的质量分数相等,正确;
C、甲乙在20℃时的溶解度是30g ( http: / / www.21cnjy.com ),所以40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均恰好为饱和溶液,正确;
D、40℃时甲、乙的溶解度 ( http: / / www.21cnjy.com )分别是50g、40g,所以分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液,甲溶液为不饱和溶液,正确;
故选A.
【点评】溶解度是一定温度下,某固态物质在100g水中最多溶解的质量,同时能据溶解度曲线正确分析物质的状态变化,及溶质的质量情况.
20.如图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )
( http: / / www.21cnjy.com )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
【分析】根据固体物质的溶解度曲 ( http: / / www.21cnjy.com )线可知:①查出某固体物质在某温度下的溶解度,②比较不同的物质在同一温度下的溶解度的大小,从而比较同温度下的物质的饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而确定升温或降温时溶液中溶质的质量分数的变化等.
【解答】解:A、t1℃时,M、N两物质的溶解度相同,说明t1℃时,M、N两物质饱和溶液溶质质量分数相,故A错误;
B、由于N的溶解度随温度的升高而减小,因此如 ( http: / / www.21cnjy.com )果把N的饱和溶液由t1℃升温到t2℃时,N的饱和溶液中就会有晶体析出,则溶液中溶质的质量分数就会减小,故B错误;
C、由两物质的溶解度曲线可知,在高于t1℃时,M的溶解度才大于N的溶解度,故C错误;
D、由N的溶解度曲线不难看出,N的溶解度随温度的升高而减小,故D正确;
故选D.
【点评】本题难度不是很大,主要考查了根据固体的溶解度曲线来解决相关的问题,从而加强学生对固体溶解度的理解.
21.如图为某固体溶解度随温度变化的 ( http: / / www.21cnjy.com )曲线.该固体从溶液中析出时不带结晶水.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )
( http: / / www.21cnjy.com )
A.升温10℃后,M点延曲线向右上移
B.降温10℃后,M点延曲线向左下移
C.降温10℃后,N点向左平移
D.恒温蒸发溶剂时,M点不动,N点向上移动至曲线后不再变化
【分析】根据固体的溶解度 ( http: / / www.21cnjy.com )曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:A、升温10℃后,M点变为不饱和溶液,故M点延曲线向右平移移,错误;
B、降温10℃后,M点延曲线向左下移,正确;
C、降温10℃后,N点变为饱和溶液,故N点向左平移,正确;
D、恒温蒸发溶剂时,M点仍为饱和溶液,M点不动,N点逐渐变为饱和溶液,故N点向上移动至曲线后不再变化,正确;
故选A.
【点评】本题难度不是很大 ( http: / / www.21cnjy.com ),主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
22.不影响固体溶解度大小的因素是( )
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
【分析】影响固体物质溶解度大小的因素有外因和内因,内因是指溶质的性质和溶剂的性,外因是温度;所以温度是影响溶解度大小的重要因素.
【解答】解:A、大多数固体物质的溶解 ( http: / / www.21cnjy.com )度随温度的升高而增大,少数物质的溶解度受温度变化影响不大,极少数物质溶解度随温度的升高而减小,温度影响固体物质的溶解度,故选项不符合题意.
B、溶解度是指某温度时100g溶剂中最多溶解的质量为该温时该物质的溶解度,溶剂质量不影响固体物质的溶解度,故选项符合题意.
C、溶剂的种类影响固体溶解度大小,如20℃时高锰酸钾易溶于水中,但难溶于汽油中,溶剂种类影响固体物质的溶解度,故选项不符合题意.
D、当温度相同时,溶质不同,溶解度可能 ( http: / / www.21cnjy.com )不同,如20℃时氯化钠的溶解度为36g,而硝酸钾的溶解度为31.6g,溶质种类影响固体物质的溶解度,故选项不符合题意.
故选B.
【点评】本题难度不大,是对溶解度影响因素的考查,注意固体物质的溶解度受温度、溶剂和溶质性质的影响,与当前溶液是否处于饱和、溶剂的多少无关.
23.60℃时,化合物甲的溶解度比乙大. ( http: / / www.21cnjy.com )分别取等质量60℃时的甲、乙的饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水).以下叙述正确的是( )
A.60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B.a一定大于b
C.20℃时,若甲的溶解度仍比乙的大,则a一定小于b
D.20℃时,若甲的溶解度比乙的小,则a一定大于b
【分析】根据溶解度随温度的变化特点解答;析出晶体的大小与溶解度随温度变化的程度有关,据此解答.
【解答】解:A、60℃时,化合物甲的溶解度比乙大,60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量大,错误;
B、由于溶解度受温度影响的变化程度不知道,无法比较ab的大小,错误;
C、20℃时,若甲的溶解度仍比乙的大,a不一定大于b,错误;
D、20℃时,若甲的溶解度比乙的小,则a一定大于b,正确;
故选D.
【点评】本题考查的是溶解度曲线的应用以及结晶的知识,完成此题,可以依据已有的知识进行.
二.填空题
24.(2017 襄阳)甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示.
(1) t1 ℃时,甲的溶解度为20g.
(2)t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为 丙、乙、甲 .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:①查 ( http: / / www.21cnjy.com )出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,t1℃时,甲的溶解度为20g;
(2)t2℃时,甲物质的溶解度最大,乙物质的 ( http: / / www.21cnjy.com )溶解度次之,丙物质的溶解度最小,所以甲、乙、丙三种物质的饱和溶液各100g,丙溶液中的溶剂最多,甲溶液中的溶剂最少,所以t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,溶剂质量不变,所得溶液中溶剂的质量由大到小依次为:丙、乙、甲.
故答案为:(1)t1;
(2)丙、乙、甲.
【点评】本题难度不是很大,主要 ( http: / / www.21cnjy.com )考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
25.(2017 毕节市)根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)30℃时,NaCl的溶解度是 36.3 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 NaCl .
(3)20℃时,在100g水中加入 ( http: / / www.21cnjy.com )50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 硝酸钾 .
【分析】(1)根据表格中,物质溶解度的信息来分析;
(2)根据不同温度下,两种物质的溶解度以及溶液随温度的变化情况来分析;
(3)根据40℃时两种物质的溶解度来分析.
【解答】解:(1)由表格信息可知,30℃时,NaCl的溶解度是36.3g;故填:36.3;
(2)由表格数据可知,KNO ( http: / / www.21cnjy.com )3、NaCl两种固体物质的溶解度,都是随温度升高而增大,变化较小的是NaCl,变化较大的是KNO3;故答案为:NaCl;
(3)由表格数据可知,40℃时,氯化钠的溶解 ( http: / / www.21cnjy.com )度为36.6g,硝酸钾的溶解度为63.9g,所以20℃时,在100g水中加入50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液是硝酸钾;故填:硝酸钾.
【点评】此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,要学会分析溶解度曲线和溶解度表格.
26.如图所示是甲、乙、丙三种物质的溶解度 ( http: / / www.21cnjy.com )曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)b物质的溶解情况是 完全不溶解,固体增多
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: acb ;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是 b、a、c ;(用a、b、c填空)
(4)40℃时,等质量饱和溶液中含水最少的是 甲 物质.
(5)40℃时,甲溶液中溶质质量分数 不一定 大于丙溶液中溶质质量分数;(填“一定”或“不一定”).
( http: / / www.21cnjy.com )
【分析】由在20℃时,分别取等质量的三种物质 ( http: / / www.21cnjy.com )的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,结合溶解度曲线可以确定乙物质的溶解情况和甲、乙、丙三种物质的溶解度曲线的序号;
根据固体物质的溶解度曲线可以比 ( http: / / www.21cnjy.com )较在20℃~30℃时三种物质的溶解度大小;40℃时,甲的溶解度最大,故等质量饱和溶液中含水最少的是甲;由于不知溶液是否饱和,故无法比较甲、丙两溶液中溶质的质量分数.
【解答】解:(1)由溶解度曲线可以看出,温度 ( http: / / www.21cnjy.com )由20℃升高到40℃,a、b的溶解度增大,c的溶解度减小,故将向20℃时等质量的三种物质的饱和溶液中,加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,说明甲、丙两物质的溶解度随着温度的升高而增大,且甲的溶解度受温度的影响最大;故乙物质应是溶解度随着温度的升高而减小,故乙物质的溶解情况是完全不溶解固体增多.
(2)由(1)的分析可知,甲、乙、丙三种物质的溶解度曲线的序号为acb.
(3)温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是b、a、c.
(4)40℃时,甲的溶解度最大,故等质量饱和溶液中含水最少的是甲.
(5)由于不知甲、丙溶液是否饱和,故无法比较甲、丙两溶液中溶质的质量分数.
故答案为:
(1)完全不溶解,固体增多;(2)acb;(3)b、a、c;(4)甲;(5)不一定.
【点评】本题主要考查了根据 ( http: / / www.21cnjy.com )固体物质的溶解度曲线解决相关的问题,培养学生的分析能力和解题能力.解题的关键是结合题意看懂溶解度曲线图并明确溶解度曲线的意义.
27.如图是三种固体物质的溶解度曲线.
(1)物质c的溶解度随温度的升高而 降低 ;
(2)物质a的溶解度大于物质c的溶解度的温度范围 t>t1℃ ;
(3)t2℃时,用50g水配制物质a的饱和溶液至少需要 25 g物质;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃(溶剂量不变),溶液中溶质质量分数不变的是 ab .
( http: / / www.21cnjy.com )
【分析】(1)根据溶解度曲 ( http: / / www.21cnjy.com )线的变化考虑;(2)根据在曲线中a在b的上边考虑;(3)根据t2℃时,a的溶解度考虑;(4)根据饱和溶液升温至t2℃溶解度的变化考虑.
【解答】解:(1)由图示可知c的溶解度随温度的升高而降低;
(2)大于t1℃时,a的溶解度在b溶解度的上边,即a的溶解度大于物质c的溶解度;
(3)t2℃时,a的溶解度是50g,即100g水中最多溶解50g,所以50g水中最多溶解25g;
(4)将t1℃时a、b、c三种物质的 ( http: / / www.21cnjy.com )饱和溶液升温至t2℃,a和b的溶解度变大,由饱和溶液变为不饱和,溶质质量分数不变,c的溶解度减小,析出晶体,溶质质量分数减小.
故答案为:(1)降低;(2)t>t1℃;(3)25;(4)ab.
【点评】解答本题关键是要知道溶解度曲线的 ( http: / / www.21cnjy.com )意义,知道根据溶解度进行分析问题的方法,饱和溶液不管是升温还是降温,只要溶解度减小,就会析出晶体,溶解度变大,变为不饱和溶液.
28.如图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
①t2℃时,A、B、C三种物质溶解度的大小关系是 A═B>C .
②有t1℃时A的饱和溶液80g,其中A的质量为 16 g.
③把C物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 Ⅱ .
Ⅰ.溶剂的质量一定变小Ⅱ.溶质的质量可能不变
Ⅲ.溶质的质量分数一定变大Ⅳ.溶质的质量一定变大
④将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后,三种溶液中溶质的质量分数由小到大的顺序是 C<A<B .
( http: / / www.21cnjy.com )
【分析】①根据某一温度时物质溶解度的比较方法考虑;②根据t1℃时A的溶解度考虑;③根据C物质的不饱和溶液变为饱和溶液的方法进行分析.
【解答】解:①从t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小顺序是:A═B>C;
②t1℃时A的溶解度是25g,即100g水中最多溶解25g,设t1℃时A的饱和溶液80g中含溶质质量为X则: ( http: / / www.21cnjy.com )解得X=16g;
③C物质的不饱和溶液变为饱和溶液的 ( http: / / www.21cnjy.com )方法有:a.加入溶质,此时溶质质量变大,溶剂不变,溶质质量分数变大;b.蒸发溶剂,此时溶质不变,溶剂减少,溶质质量分数不变;c.升高温度刚好饱和,此时溶质和溶剂都不变,溶质质量分数也不变.故选Ⅱ;
④饱和溶液溶质质量分数的大小与溶解 ( http: / / www.21cnjy.com )度有关,在t3℃时A、B、C三种物质的溶解度大小是:A>B>C;将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后A、B仍然是饱和溶液,且此时B的溶解度大于A的溶解度,所以降温后溶质质量分数是A<B;C物质降温后溶解度增大变为不饱和溶液,溶质质量分数不变,因为t3℃时C的溶解度<t1℃A的溶解度,所以C物质的溶质质量分数最小,故答案为:C<A<B.
故答案为:①A═B>C;②16;③Ⅱ;④C<A<B.
【点评】解答本题关键是要知道溶解度大小的比较方法,知道溶液中溶质的计算方法,不饱和溶液变为饱和溶液的方法,溶质质量分数的计算方法.
29.如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
(1)随着温度的升高,a物质的溶解度的变化趋势是 温度升高,溶解度增大 .
(2)曲线a和b的交叉点M表示的含义是 60℃时a、b物质溶解度相等 .
(3)80℃时40g a物质溶于50g水中所形成的溶液是 不饱和 溶液(选填“饱和”或“不饱和”).
( http: / / www.21cnjy.com )
【分析】根据题目信息和溶解度 ( http: / / www.21cnjy.com )曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,而a的溶解度随温度的升高变化比b大;曲线a和b的交叉点M表示的含义是:60℃时a、b物质溶解度相等;80℃时40ga物质溶于50g水中所形成的溶液是不饱和溶液,因为在该温度下,a的溶解度是85g.
【解答】解:(1)由溶解度曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,故答案为:温度升高,溶解度增大;
(2)曲线a和b的交叉点M表示的含义是:60℃时a、b物质溶解度相等;故答案为:60℃时a、b物质溶解度相等;
(3)80℃时40ga物质溶于50g水中所形成的溶液是不饱和溶液,因为在该温度下,a的溶解度是85g;故答案为:不饱和;
【点评】本考点考查了溶解度曲线及 ( http: / / www.21cnjy.com )其应用,通过溶解度曲线我们可以获得很多信息;还考查了判断有关溶液是否饱和等,本考点主要出现在选择题和填空题中.
30.如图是a、b两种固体物质的溶解度曲线.
(1)图中a物质的溶解度曲线比b物质的陡,说明: a溶解度受温度影响比b大 ;
(2)若要想在200g水中溶解更多的a物质,可采取的措施是: 升温 ;
(3)40℃时,将20g a物质放入50g水中,充分搅拌,所得溶液的溶质质量分数是 23.1% .
(4)下列说法正确的是: ABC
A、a、b物质都是易溶物
B、可用结晶的方法分离a、b的混合物
C、a的饱和液从40℃降温至20℃后仍然饱和
D、30℃时,a、b的饱和液中所含溶质质量一定相等.
( http: / / www.21cnjy.com )
【分析】溶解度曲线的应用:
(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况.
(2)根据溶解度曲线,结合饱和溶液和不饱和溶液的转化方法来完成解答;
(3)根据物质的溶解度结合溶质的质量分数来完成解答;
(4)A、根据对物质溶解性的粗略分类来判断;
B、根据a、b的溶解度受温度的变化情况来完成解答;
C、根据a的溶解度来进行判断;
D、根据a和b的溶解度来进行判断.
【解答】解:(1)图中a物质的溶解度曲线比b物质的陡,说明a的溶解度受温度变化影响较大;
(2)从溶解度曲线可以看出,a的溶解度随温度升高而增大,所以若要想在200g水中溶解更多的a物质,可采取的升高温度的方法;
(3)由溶解度曲线可知40℃时a的溶解度为30g,所以100g水中溶解30ga物质,而50g水中能够溶解15ga物质,即题给的20ga不能全部溶解,此时得到的溶液为饱和溶液,其溶质的质量分数为: ( http: / / www.21cnjy.com )×100%=23.1%.
(4)A、在20℃时a和b的溶解度都大于10g,所以a和b都是易溶物质,故A正确;
B、a的溶解度受温度变化影响大,而b的溶解度受温度变化影响较小,所以可以可用结晶的方法分离a、b的混合物,故B正确;
C、a的溶解度随温度升高而增大,所以降低温度之后a的溶液仍然是饱和溶液,故C正确;
D、在没有指明溶液的质量的情况下是无法比较溶质的质量的,故D错误.
故选ABC.
故答案为:(1)a溶解度受温度影响比b大;
(2)升温;
(3)23.1%;
(4)ABC.
【点评】本题难度不大,主要考查了固体物质的溶解度曲线所表示的意义及根据固体的溶解度曲线解决相关的问题.
31.甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
(1)50℃时,乙物质的溶解度是 40 g.
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 乙>甲>丙 .
(3)温度为 40 ℃时,甲、乙两物质溶解度相同.
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:① ( http: / / www.21cnjy.com )查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,50℃时,乙物质的溶解度是40g;
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为:乙>甲>丙;
(3)温度为40℃时,甲、乙两物质溶解度相铜.
故答案为:(1)40;
(2)乙>甲>丙;
(3)40.
【点评】本题难度不是很大,主要考查了 ( http: / / www.21cnjy.com )固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
32.如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.
①20℃时,甲乙丙三种物质的溶解度由大到小的顺序 乙>甲>丙
②图中A点表示的意义是 40℃时,甲、乙两物质的溶解度相等,都为36g .
③在室温时,将分别盛有甲、丙饱和溶 ( http: / / www.21cnjy.com )液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是 AD (填字母序号),该现象被叫做 结晶 .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:① ( http: / / www.21cnjy.com )查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:①由题目中溶解度曲线查阅20℃时三种物质的溶解度,容易看出乙的溶解度最大,甲次之,丙最小.故答案为:乙>甲>丙;
②由溶解度曲线可以看出甲乙物质的溶 ( http: / / www.21cnjy.com )解度关系,40℃时是甲乙二物质溶解度曲线的交点,即此温度时二者溶解度相等,且易查得此时溶解度为36g.故答案为:40℃时,甲、乙两物质的溶解度相等,都为36g;
③由溶解度曲线分析可知, ( http: / / www.21cnjy.com )丙溶解度随温度的升高而减小,随温度的降低而增大,甲溶解度随温度的升高而增大,随温度的降低而减小,所以丙的饱和溶液在升温时,溶液中有晶体析出,而甲的饱和溶液在降温后溶液中有晶体析出,该过程叫结晶.故答案为:AD;结晶.
【点评】本题难度不是很大, ( http: / / www.21cnjy.com )主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
33.如图是A、B、C三种固体物质的溶解度曲线,据图回答:
(1)t2℃时,三种物质的溶解度由大到小的顺序为 A>B>C .
(2)图中P点表示 t1℃时,A、B物质的溶解度相等 .
(3)t2℃时,将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为 65g .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以 ( http: / / www.21cnjy.com ):①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C;
(2)图中P点表示:t1℃时,A、B物质的溶解度相等;
(3)t2℃时,A物质的溶解度是30g,所以将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为65g.
故答案为:(1)A>B>C;
(2)t1℃时,A、B物质的溶解度相等;
(3)65g.
【点评】本题难度不是很大,主要考查 ( http: / / www.21cnjy.com )了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
34.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答
(1)在t3℃时,三种物质的溶解度从小到大的顺序是: A<B<C
(2)在 t2℃ 时,B与C的溶解度相等;
(3)物质C的溶解度随温度升高而 增大 .
( http: / / www.21cnjy.com )
【分析】根据题目信息和溶解度曲线可知 ( http: / / www.21cnjy.com ):C固体物质的溶解度,是随温度升高而增大,而A、B的溶解度都随温度的升高而减少;在t3℃时,三种物质的溶解度从小到大的顺序是:A<B<C;在t2℃时,B与C有交点,因此B与C的溶解度相等.
【解答】解:(1)根据题目信息和溶解度曲线可知:在t3℃时,三种物质的溶解度从小到大的顺序是:A<B<C;故答案为:A<B<C
(2)在t2℃时,B与C有交点,因此B与C的溶解度相等,故答案为:t2℃
(3)根据题目信息和溶解度曲线可知:C固体物质的溶解度,是随温度升高而增大,故答案为:增大
【点评】本考点考查了溶解度曲线及其 ( http: / / www.21cnjy.com )应用、实验数据的处理问题,通过溶解度曲线我们可以获得很多信息;还考查了溶解度大小的比较,本考点主要出现在选择题和填空题中.
35.右图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(1) 30℃ 时,A、B两物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃ A 析出晶体较多.(填“A”或“B”)
(3)40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后, B 物质有剩余(填“A”或“B”).
(4)现有50℃时A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是 ② (填序号).
①降低温度 ②升高温度 ③加入A物质.
( http: / / www.21cnjy.com )
【分析】(1)根据曲线中交点的含义考虑;
(2)根据溶解度变化的范围大小考虑;
(3)根据40℃时,A、B的溶解度判断;
(4)根据不饱和溶液到饱和溶液的转化方法考虑.
【解答】解:(1)曲线中交点表示该温度时两种物质的溶解度相等,所以30℃两种物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃,A物质溶解度减小得多,即溶不了得多,析出来的就多;
(3)40℃时,A的溶解度大于30g, ( http: / / www.21cnjy.com )B的溶解度小于30g,所以40℃时,50g水中溶解A物质的质量大于15g,溶解B物质的质量小于15g,所以40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后B物质有剩余;
(4)不饱和溶液变为饱和溶液的方法有:蒸发溶剂,降低温度,增加溶质,因为在不减少溶剂的情况下,所以是后两者.
故答案为:(1)30℃(2)A;(3)B;(4)②.
【点评】通过回答本题知道了交点的 ( http: / / www.21cnjy.com )含义,降温后析出晶体多少的判断方法,一定量溶剂中加入一定量溶质是否全部溶解的判断方法,不饱和溶液变为饱和溶液的方法.
36.甲、乙两种物质的溶解度曲线如图.试回答以下问题:
(1)m点表示 20℃时,甲和乙的溶解度相等都是40g ;
(2)20℃时,在100克甲物质的饱和溶液中加入10克水,为使溶液重新达到饱和,需加甲物质 4 克;
(3)常压下,CO2在水中的溶解度随温度的变化应类似于 乙 物质;(填甲或乙)
(4)40℃时,将甲、乙 ( http: / / www.21cnjy.com )两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 < (选填“>”或“=”或“<”)乙物质溶液的质量.
( http: / / www.21cnjy.com )
【分析】根据固体物质的溶解度曲线可知:① ( http: / / www.21cnjy.com )查出某物质在一定温度时的溶解度,从而可以确定出一定量的水中最多溶解的溶质的质量,②比较不同物质在相同温度下的溶解度的大小,③判断物质的溶解度随温度变化的变化情况,从而可以判断温度变化时饱和溶液中量的变化等.
【解答】解:(1)由于m点是甲和 ( http: / / www.21cnjy.com )乙的溶解度曲线的交点,即两种物质的溶解度在20℃时相等都是40g,故答案为:20℃时,甲、乙两种物质的溶解度相等都是40g
(2)由于在20℃时,甲的溶解度是40g,即100g水中最多溶解40g甲,则10g水中最多溶解4g甲,故答案为:4
(3)由于二氧化碳的溶解度随温度的升高而减小,故答案为:乙
(4)由于甲的溶解度随温度的升高 ( http: / / www.21cnjy.com )而增大,而乙的溶解度随温度的升高而减小,因此给它们的饱和溶液降温时,甲的饱和溶液中就会有晶体析出,而乙的饱和溶液就会变成不饱和溶液,因此降温后,甲的溶液小于乙的溶液,故答案为:<
【点评】本题难度不是很大,主要考查了固体溶解度曲线所表示的意义及对固体溶解度概念的理解和应用.
37.A、B、C、D四个 ( http: / / www.21cnjy.com )烧杯中分别盛有相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20 g、15 g、10 g、5 g某物质,充分溶解后观察到如图所示的现象.请完成下列问题:
( http: / / www.21cnjy.com )
(1)在A、B、C、D四个烧杯中, AB 中盛的一定是饱和溶液; D 中盛的一定不是饱和溶液; C 中盛的可能是饱和溶液.
(2)若固体是KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是 B .
(3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解? 不能 .
【分析】(1)在一定温度和溶剂 ( http: / / www.21cnjy.com )中,有溶质析出的溶液中,溶质达到最大溶解能力,溶质不会溶解,则溶液一定为饱和溶液,没有固体析出的溶液可能是恰好饱和或不是饱和溶液.
(2)KNO3的溶解度随温度的升高而增大,对饱和溶液升温会变为不饱和溶液.
(3)在有固体析出的饱和溶液中增加溶剂,将会有固体继续溶解.
【解答】解:(1)依据饱和溶液 ( http: / / www.21cnjy.com )的概念可知,A、B中有固体出现,一定是饱和溶液,C中的溶质质量比D多,而比C的少,可能是恰好溶解,则可能饱和,D一定不饱和.
(2)因KNO3的溶解度随温度的升高而增大,A和B一定是饱和溶液,B中的溶质比C中多一点,则升温B先变为不饱和.
(3)在一定温度下,往A、B中加入相同质量的水,因A中溶质比B中的多,B中固体刚好溶解时,A中肯定还有固体剩余.
故答案是:(1)AB; D;C;(2)B;(3)不能(或否).
【点评】本题考查了学生对饱和溶液的判断及饱和溶液与不饱和溶液的转化,应注意条件的变化来分析解答.
38.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 t2℃时A与C两物质溶解度相等 .
(2)当温度为t1℃,三种物质溶解度由小到大依次为 B<A<C ,当温度为t3℃时,溶解度最大的是 A .
(3)C可能表示哪种物质: 氢氧化钙 .
( http: / / www.21cnjy.com )
【分析】(1)溶解度曲线交点M的含义:溶解度曲线交于一点表明两物质的溶解度此时相等;
(2)根据溶解度曲线可以比较同一温度下不同物质的溶解度大小;
(3)根据氢氧化钙或气体的溶解度随温度的升高而减小解答.
【解答】解:
(1)t2℃时A与C两物质溶解度曲线的交点,说明此时它们的溶解度相等.
(2)t1℃时,三种物质溶解度从下 ( http: / / www.21cnjy.com )到上依次为B、A、C,所以三种物质此时的溶解度由小到大依次为:B<A<C,t3℃时物质A的溶解度曲线在最上方,所以此时A物质的溶解度最大;
(3)氢氧化钙或气体的溶解度随温度的升高而减小,C可能是氢氧化钙.
答案:
(1)t2℃时A与C两物质溶解度相等
(2)B<A<C A
(3)氢氧化钙
【点评】本题主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决有关的问题.
39.碘在不同溶剂中的溶解实验,根据实验操作图示回答相关问题.
( http: / / www.21cnjy.com )
(1)由图2所示现象可知:碘 微 (选填“不”、“微”或“易”)溶于水.
(2)图3所示试管中液体分层,说明碘在汽油中的溶解性比在水中 强 (选填“强”或“弱”).
(3)①碘易溶于酒精.若实验中汽油用酒精代替,振荡后静置,最终所得液体 不分层 (选填“分层”或“不分层”).
②“从稀碘水中提取碘”是“海带提碘”工艺 ( http: / / www.21cnjy.com )中的一个重要步骤,其原理类似实验中第二步操作.工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度 .
【分析】(1)根据实验的现象得出结论;
(2)根据溶液命名的方法及实验对比得出结论;
(3)①根据酒精可以和水相互溶解分析现象;
②根据实验的目的结合实验现象回答.
【解答】解:(1)由图2所示现象溶液为淡黄色可知碘能溶于水,对比图3可知碘并不是易溶于水,因此用微溶来描述;故填:微;
(2)碘溶于汽油,因此得到的是碘的汽油溶于;根据图2和图3的对比说明碘在汽油中的溶解性比在水中强;故填:强;
(3)①酒精可以和水相互溶解,因此用酒精代替汽油,就不会出现分层现象;故填:不分层;
②对比碘在酒精和汽油中的溶解及酒 ( http: / / www.21cnjy.com )精溶于水的现象,可知选择的挥发性液体必须与水相互不溶解,且碘在这种液体中的溶解度远大于在水中的溶解度.这样通过明显的分层现象而得到分离提纯;故填:与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度.
【点评】对于探究型实验探究,要熟悉实验 ( http: / / www.21cnjy.com )探究的环节和方法,精心设计实验方案,将所学过探究物质的性质或变化规律的技巧迁移至此,进行细心地探究实验和观察现象,再通过分析实验现象,推断、总结出该物质的性质或变化规律等.
三.实验探究题
40.控制变量是科学探究的重要方法之一. ( http: / / www.21cnjy.com )小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
温度(℃) 20 30 40 50 60 70 80
溶解度(g) 31.6 45.8 63.9 85.5 110 138 168
(1)建立假设: 温度影响硝酸钾溶解快慢 ;
(2)实施方案:
a. 取两只小烧杯分别加入2 ( http: / / www.21cnjy.com )g硝酸钾 ;b. 在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水 ;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果 热水中的硝酸钾溶解的快 ;
实验中,控制不变的因素是 硝酸钾的质量、水的体积 (至少写出2点).
【分析】根据题干提供的信息结合已有的知识进行分析解答,要设计实验证明溶解的快慢因素,需要控制变量,据此解答.
【解答】解:(1)由表格信息可知,温度越高硝酸钾的溶解度越大,所以可能影响硝酸钾溶解快慢的因素是温度,故填:温度影响硝酸钾溶解快慢;
(2)设计实验时,应该称 ( http: / / www.21cnjy.com )量相同质量的硝酸钾,分别放入到盛有相同体积的但是温度不同的水的烧杯中,比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;故填:取两只小烧杯分别加入2g硝酸钾;在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水;
(3)在盛有热水的烧杯中的硝酸钾最先完全 ( http: / / www.21cnjy.com )溶解,在该实验中控制不变的量有硝酸钾的质量以及水的体积;故填:热水中的硝酸钾溶解的快;硝酸钾的质量、水的体积.
【点评】熟记影响固体在水中的溶解速度因素:温度、搅拌、颗粒大小.知道它们的具体影响过程.
41.某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化.
【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验 水的体积 所加物质 测量液体温度(℃)
实验1 50mL 氯化铵 15
实验2 50mL 氯化钙 28
实验3 X 氯化钠 21
实验4 50mL 无 22
【数据分析】
(1)表中X为 50 mL.
(2)比较实验2与实验4,可获得的结论是 氯化钙溶解过程中放热 .
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 NH4Cl .
【反思评价】
(4)经讨论认为本实验操作中存在缺陷,它是 AB (填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样.
【分析】【数据分析】
(1)实验目的是探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此水的量要控制;
(2)比较实验2与实验4,即可得到物质溶于水时的吸放热情况.
(3)根据题中信息可知所选的物质需溶解时吸热.
【反思提升】
(4)A.实验操作过程中若保温措施不行会影响实验效果;
B.加入物质的质量必须相等,否则影响实验效果;
C.探究的就是NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此加入物质的种类不会影响实验.
【解答】【数据分析】
(1)实验目的是探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此水的量要控制,所以X=50mL,故答案为:50.
(2)比较实验2与实验4,往水中加入氯化钙后,温度升高,因此可获得结论是氯化钙溶解过程中放热,故答案为:氯化钙溶解过程中放热.
(3)如果要生产一种“冰袋”用于冷敷,说明这种物质溶解时吸热,从表中可以看出上述三种物质中氯化铵溶解时吸热,故答案为:NH4Cl.
【
一.选择题
1.下列物质溶于水时,溶液温度明显下降的是( )
A.食盐 B.浓硫酸 C.硝酸铵 D.氢氧化钠
2.下列固体物质溶于水的过程中,溶液温度显著升高的是( )
A.氢氧化钠 B.氯化钠 C.硝酸铵 D.蔗糖
3.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降,这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
4.如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
A.碳酸钠俗称小苏打
B.30℃时,氯化钠的溶解度为36.3g
C.碳酸钠的溶解度大于氯化钠的溶解度
D.将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl
5.20℃时氯化钾的溶解度为34g.下列是四位同学在20℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
6.在室温下,如图甲、乙、丙三试管中分别 ( http: / / www.21cnjy.com )盛硝酸钾、硝酸钠、氢氧化钙(消石灰)饱和溶液,并都有少量的固体物质存在,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,应向试管外杯里的水中加入的物质是( )
( http: / / www.21cnjy.com )
A.氢氧化钠固体 B.硝酸铵固体 C.氯化钠固体 D.冰
7.要使一接近饱和的硝酸钾溶液变成饱和溶液,以下措施中不能达到目的是( )
A.恒温蒸发溶剂 B.加水
C.降低温度 D.加入适量硝酸钾
8.某同学往右图所示的烧杯(用石蜡将烧杯和 ( http: / / www.21cnjy.com )塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
( http: / / www.21cnjy.com )
A.蔗糖 B.硝酸铵 C.氯化钠 D.氢氧化钠
9.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线判断下列说法,其中不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
10.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
( http: / / www.21cnjy.com )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
11.使80℃的硝酸钾饱和溶液冷却到20℃,对可能发生的变化说法正确的是( )
A.溶液中溶质的质量分数不变 B.溶液质量增加
C.溶液中溶质的溶解度减小 D.溶液变成不饱和溶液
12.如图表示A、B两种物质的溶解度(s)随温度(t)的变化情况,下列说法正确的是( )
( http: / / www.21cnjy.com )
A.A的溶解度大于B的溶解度
B.升高温度可使A的不饱和溶液变为饱和
C.t3℃时,在100g水中溶解60gA能形成饱和溶液
D.t2℃时,A和B的饱和溶液的溶质质量分数相等
13.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是( )
( http: / / www.21cnjy.com )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液
C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b
14.现有a、b两种物质在t1℃的饱和溶液 ( http: / / www.21cnjy.com ),将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体.则能表示a、b两种物质的溶解度曲线是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
15.硝酸钾和氯化钠的溶解度曲线如图,下列说法中正确的是( )
( http: / / www.21cnjy.com )
A.a点表示氯化钠的饱和溶液
B.t1℃硝酸钾的溶解度大于氯化钠的溶解度
C.t2℃硝酸钾和氯化钠饱和溶液中溶质质量分数相等
D.t3℃两种物质的饱和溶液降温至t2℃,析出溶质多的是硝酸钾
16.室温时,有两瓶硝酸钾 ( http: / / www.21cnjy.com )溶液,一瓶为饱和溶液(溶质的质量分数为24%),另一瓶为5%的溶液,下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
17.为了研究物质的溶解现象,设计并进行了如下实验,下列说法不正确的是( )
( http: / / www.21cnjy.com )
A.实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解
B.设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况
C.对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好
D.实验说明不同物质在同一溶剂中溶解性是相同的,同一种物质在不同溶剂中溶解性也是相同的
18.将等质量的甲、乙两种固体分别加入 ( http: / / www.21cnjy.com )盛有100克水的烧杯中,充分搅拌后静置片刻,再升温至30℃,现象如图所示.下列有关说法正确的是( )
( http: / / www.21cnjy.com )
A.10℃时,甲物质的溶解度大于乙物质
B.30℃时,甲物质的溶解度等于乙物质
C.甲物质的溶解度随温度的升高而增大
D.乙物质的溶解度随温度的变化不明显
19.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
B.40℃时,分别在100 g水中加入40 g 甲、乙,所得溶液溶质的质量分数相等
C.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D.20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液
20.如图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )
( http: / / www.21cnjy.com )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
21.如图为某固体溶解度随温度变化 ( http: / / www.21cnjy.com )的曲线.该固体从溶液中析出时不带结晶水.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )
( http: / / www.21cnjy.com )
A.升温10℃后,M点延曲线向右上移
B.降温10℃后,M点延曲线向左下移
C.降温10℃后,N点向左平移
D.恒温蒸发溶剂时,M点不动,N点向上移动至曲线后不再变化
22.不影响固体溶解度大小的因素是( )
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
23.60℃时,化合物甲的溶解度比 ( http: / / www.21cnjy.com )乙大.分别取等质量60℃时的甲、乙的饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水).以下叙述正确的是( )
A.60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B.a一定大于b
C.20℃时,若甲的溶解度仍比乙的大,则a一定小于b
D.20℃时,若甲的溶解度比乙的小,则a一定大于b
二.填空题
24.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示.
(1) ℃时,甲的溶解度为20g.
(2)t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为 .
( http: / / www.21cnjy.com )
25.根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)30℃时,NaCl的溶解度是 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 .
(3)20℃时,在100g水中加入50gNa ( http: / / www.21cnjy.com )Cl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 .
26.如图所示是甲、乙、丙 ( http: / / www.21cnjy.com )三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)b物质的溶解情况是
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: ;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是 ;(用a、b、c填空)
(4)40℃时,等质量饱和溶液中含水最少的是 物质.
(5)40℃时,甲溶液中溶质质量分数 大于丙溶液中溶质质量分数;(填“一定”或“不一定”).
( http: / / www.21cnjy.com )
27.如图是三种固体物质的溶解度曲线.
(1)物质c的溶解度随温度的升高而 ;
(2)物质a的溶解度大于物质c的溶解度的温度范围 ;
(3)t2℃时,用50g水配制物质a的饱和溶液至少需要 g物质;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃(溶剂量不变),溶液中溶质质量分数不变的是 .
( http: / / www.21cnjy.com )
28.如图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
①t2℃时,A、B、C三种物质溶解度的大小关系是 .
②有t1℃时A的饱和溶液80g,其中A的质量为 g.
③把C物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 .
Ⅰ.溶剂的质量一定变小Ⅱ.溶质的质量可能不变
Ⅲ.溶质的质量分数一定变大Ⅳ.溶质的质量一定变大
④将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后,三种溶液中溶质的质量分数由小到大的顺序是 .
( http: / / www.21cnjy.com )
29.如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
(1)随着温度的升高,a物质的溶解度的变化趋势是 .
(2)曲线a和b的交叉点M表示的含义是 .
(3)80℃时40g a物质溶于50g水中所形成的溶液是 溶液(选填“饱和”或“不饱和”).
( http: / / www.21cnjy.com )
30.如图是a、b两种固体物质的溶解度曲线.
(1)图中a物质的溶解度曲线比b物质的陡,说明: ;
(2)若要想在200g水中溶解更多的a物质,可采取的措施是: ;
(3)40℃时,将20g a物质放入50g水中,充分搅拌,所得溶液的溶质质量分数是 .
(4)下列说法正确的是:
A、a、b物质都是易溶物
B、可用结晶的方法分离a、b的混合物
C、a的饱和液从40℃降温至20℃后仍然饱和
D、30℃时,a、b的饱和液中所含溶质质量一定相等.
( http: / / www.21cnjy.com )
31.甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
(1)50℃时,乙物质的溶解度是 g.
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 .
(3)温度为 ℃时,甲、乙两物质溶解度相同.
( http: / / www.21cnjy.com )
32.如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.
①20℃时,甲乙丙三种物质的溶解度由大到小的顺序
②图中A点表示的意义是 .
③在室温时,将分别盛有甲 ( http: / / www.21cnjy.com )、丙饱和溶液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是 (填字母序号),该现象被叫做 .
( http: / / www.21cnjy.com )
33.如图是A、B、C三种固体物质的溶解度曲线,据图回答:
(1)t2℃时,三种物质的溶解度由大到小的顺序为 .
(2)图中P点表示 .
(3)t2℃时,将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为 .
( http: / / www.21cnjy.com )
34.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答
(1)在t3℃时,三种物质的溶解度从小到大的顺序是:
(2)在 时,B与C的溶解度相等;
(3)物质C的溶解度随温度升高而 .
( http: / / www.21cnjy.com )
35.右图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(1) 时,A、B两物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃ 析出晶体较多.(填“A”或“B”)
(3)40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后, 物质有剩余(填“A”或“B”).
(4)现有50℃时A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是 (填序号).
①降低温度 ②升高温度 ③加入A物质.
( http: / / www.21cnjy.com )
36.甲、乙两种物质的溶解度曲线如图.试回答以下问题:
(1)m点表示 ;
(2)20℃时,在100克甲物质的饱和溶液中加入10克水,为使溶液重新达到饱和,需加甲物质 克;
(3)常压下,CO2在水中的溶解度随温度的变化应类似于 物质;(填甲或乙)
(4)40℃时,将甲、乙两物质的饱和溶 ( http: / / www.21cnjy.com )液各100g,分别降温到20℃,所得甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量.
( http: / / www.21cnjy.com )
37.A、B、C、D四个烧杯中分别盛有 ( http: / / www.21cnjy.com )相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20 g、15 g、10 g、5 g某物质,充分溶解后观察到如图所示的现象.请完成下列问题:
( http: / / www.21cnjy.com )
(1)在A、B、C、D四个烧杯中, 中盛的一定是饱和溶液; 中盛的一定不是饱和溶液; 中盛的可能是饱和溶液.
(2)若固体是KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是 .
(3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解? .
38.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 .
(2)当温度为t1℃,三种物质溶解度由小到大依次为 ,当温度为t3℃时,溶解度最大的是 .
(3)C可能表示哪种物质: .
( http: / / www.21cnjy.com )
39.碘在不同溶剂中的溶解实验,根据实验操作图示回答相关问题.
( http: / / www.21cnjy.com )
(1)由图2所示现象可知:碘 (选填“不”、“微”或“易”)溶于水.
(2)图3所示试管中液体分层,说明碘在汽油中的溶解性比在水中 (选填“强”或“弱”).
(3)①碘易溶于酒精.若实验中汽油用酒精代替,振荡后静置,最终所得液体 (选填“分层”或“不分层”).
②“从稀碘水中提取碘”是“海带提碘 ( http: / / www.21cnjy.com )”工艺中的一个重要步骤,其原理类似实验中第二步操作.工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 .
三.实验探究题
40.控制变量是科学探究的重要方法之一. ( http: / / www.21cnjy.com )小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
温度(℃) 20 30 40 50 60 70 80
溶解度(g) 31.6 45.8 63.9 85.5 110 138 168
(1)建立假设: ;
(2)实施方案:
a. ;b. ;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果 ;
实验中,控制不变的因素是 (至少写出2点).
41.某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化.
【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验 水的体积 所加物质 测量液体温度(℃)
实验1 50mL 氯化铵 15
实验2 50mL 氯化钙 28
实验3 X 氯化钠 21
实验4 50mL 无 22
【数据分析】
(1)表中X为 mL.
(2)比较实验2与实验4,可获得的结论是 .
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 .
【反思评价】
(4)经讨论认为本实验操作中存在缺陷,它是 (填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样.
四.推断题
42.根据如图回答下列问题.
(1)能够证明同一物质在不同溶剂中的溶解性不同的实验是 .
(2)能够证明不同的物质在同一溶剂中的溶解性不同的实验是 .
( http: / / www.21cnjy.com )
43.如图是a、b、c三种固体物质的溶解度曲线
(1)a、b、c三种物质中,溶解度受温度的影响最大的是 .
(2)t1℃时,a的溶解度 c的溶解度.(填“>、<或=”)
(3)t1℃时,将30ga物质放入1 ( http: / / www.21cnjy.com )00g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液的质量是 g.
( http: / / www.21cnjy.com )
44.如图是a、b两种固体物质的溶解度曲线.
(1)30℃时,100g水中最多能溶解的a物质的质量是 g,此时,要想在100g水中溶解更多的a物质,可采取的措施是 .
(2)60℃时,将40g a物质放入在100g水中,充分搅拌,所得溶液的质量是 g.
(3)图中a物质的溶解度曲线比b物质陡,说明 .
( http: / / www.21cnjy.com )
45.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答:
①在t3℃时,三种物质的溶解度从小到大的顺序是: ;
②在 时,A与C的溶解度相等;
③物质C的溶解度随温度升高而 .
( http: / / www.21cnjy.com )
五.解答题
46.图表法是一种常用的数据处理方法,结合所给图表回答下列问题
氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
(1)上述图象表示 (填“氢氧化钠”或“碳酸钠”)的溶解度曲线
(2)20℃时,氢氧化钠的溶解度 (填“大于”或“小于”)碳酸钠
(3)40℃时,若将50gNaOH分别 ( http: / / www.21cnjy.com )投入到100g水和100g酒精中,能形成饱和溶液的是 ,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为 .
( http: / / www.21cnjy.com )
47.根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0℃时,KNO3的溶解度是 g.
(2)与KNO3相比较,NaCl的溶解度受温度变化影响 ;
(3)20℃时,在100g水中 ( http: / / www.21cnjy.com )加入40gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是饱和或不饱和中的 溶液.
( http: / / www.21cnjy.com )
48.根据下表实验,回答相关问题
实验步骤 实验操作 实验现象
Ⅰ 在盛有100g水的烧杯中,加入25g氯化钾,搅拌,恢复到20℃. 全部溶解
Ⅱ 再加Xg氯化钾,搅拌,恢复到20℃,恰好饱和. 全部溶解
Ⅲ 再加6g氯化钾,搅拌,恢复到20℃ 固体不溶
Ⅳ 加热 全部溶解
Ⅴ 冷却至20℃
①实验步骤Ⅱ中加入Xg氯化钾,X= g.
②实验步骤Ⅲ中所得溶液是 (填“饱和”或“不饱和”)溶液.
③冷却至20℃,烧杯中的现象是 .
④有五瓶氯化钾溶液,与上述实验步骤Ⅰ﹣ ( http: / / www.21cnjy.com )Ⅴ形成的溶液溶质质量分数分别相等,现各取10g于5个小烧杯中,分别滴入足量的等质量等浓度的硝酸银溶液,其中有 个小烧杯中产生的沉淀质量相等.
( http: / / www.21cnjy.com )
49.运城盐湖被称为中国的“死海”,含盐量 ( http: / / www.21cnjy.com )极高,其主要成分为MgSO4和NaCl,两物质的溶解度如表所示.随着温度的变化,该盐湖会析出不同的物质,水温在10℃左右开始析出NaCl在0℃时开始析出MgSO4.
温度 0℃ 10℃ 20℃ 30℃
MgSO 22.0 28.2 33.7 38.9
NaCl 35.7 35.8 36.0 36.3
(1)据如表可知,10℃时,MgSO4的溶解度比NaCl的小,但NaCl先析出的原因是 .
(2)模拟盐湖结晶的过程如图:
x的质量为 ,溶液a开始有晶体析出的温度范围是 ,溶液b中的溶质是 .
( http: / / www.21cnjy.com )
50.图一是甲、乙两种固体物质的溶解度曲线,分析并回答问题.
( http: / / www.21cnjy.com )
(1)P点的含义是 .
(2)t2℃时,将甲、乙各30g分别加入到盛有50g水的两个烧杯中,充分溶解后,现象如图二所示.
①B烧杯中溶液的溶质是 (填“甲”或“乙”).
②将B烧杯中的溶液全部倒入A烧杯中(甲和乙不反应),充分搅拌后,A烧杯中的固体 (填“全部溶解”“部分溶解”或“不溶解”).
③欲使混合溶液恰好形成甲的饱和溶液,应再加入甲 g.
51.食品工业中合理使用食品添加剂可改善食品的色、香、味等品质.碳酸钠和碳酸氢钠就是食品中常用的添加剂,二者在不同温度时的溶解度如表所示
温度/℃ 0 10 20 30 40
碳酸钠的溶解度/g 7.1 12.5 21.5 39.7 49.0
碳酸氢钠的溶解度/g 6.9 8.1 9.6 11.1 12.7
(1)10℃时,碳酸钠的溶解度为 .
(2)两种物质的溶解度曲线关系合理的是 .
( http: / / www.21cnjy.com )
(3)区分两种物质的方法:取 ( http: / / www.21cnjy.com )两种固体粉末各xg加入20℃的10g水中充分溶解,通过观察现象可区分碳酸钠和碳酸氢钠,x的值可能是 (填字母),此时碳酸氢钠溶液中溶质的质量分数是 (精确到0.01%)
A、2 B、0.96 C、0.5.
52.同学们分别取6g固体和20mL水,研究物质溶解前后温度的变化.
实验序号 ① ② ③
实验内容 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
温度变化 温度升高 基本不变
(1)由于NaOH有腐蚀性,称量时应将NaOH固体放在 .
(2)实验③中可观察到的温度变化是 .
(3)三个实验中,固体和水的用量相同,这样做的目的是 .
53.A、B 两种物质的溶解度曲线如图所示.
(1)m点的意义 .
(2)当温度为10℃时,溶解度较大的是 ( http: / / www.21cnjy.com ) 物质; 30℃时,分别用100g水配制成A、B的饱和溶液,溶解度大的物质比溶解小的物质多溶解 g.
(3)30℃时,将A和B 各40g分别投入到盛有50g水的烧杯中充分溶解后,所得A溶液的质量为 g,B溶液的质量是 g.
( http: / / www.21cnjy.com )
参考答案与解析
一.选择题
1.(2017 桂林)下列物质溶于水时,溶液温度明显下降的是( )
A.食盐 B.浓硫酸 C.硝酸铵 D.氢氧化钠
【分析】根据常见物质溶于水的吸热与放热现象、溶液温度的变化情况进行分析解答即可.
【解答】解:物质在溶解时经常伴随有吸热 ( http: / / www.21cnjy.com )或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低;氯化钠、蔗糖等溶于水,温度变化不大.
A、食盐溶于水温度变化不大,故选项错误.
B、浓硫酸溶于水温度升高,故选项错误.
C、硝酸铵溶于水吸热,使溶液的温度明显下降,故选项正确.
D、氢氧化钠溶于放出大量的热,溶液温度明显升高,故选项错误.
故选:C.
【点评】本题难度不大,掌握常见物质溶于水的吸热与放热现象、温度变化情况是正确解答本题的关键.
2.(2017 宜昌)下列固体物质溶于水的过程中,溶液温度显著升高的是( )
A.氢氧化钠 B.氯化钠 C.硝酸铵 D.蔗糖
【分析】溶液的温度显著上升,说明此物质溶于水时会放热,分别对选项中的物质进行分析即可解决此题.
【解答】解:氢氧化钠溶于水放热,蔗糖、氯化钠溶于水温度无明显变化,硝酸铵溶于水会吸热水温降低;
故选A.
【点评】此题是对物质溶于水时温度变化的考查,解题的重点是依据对课本中几种特殊物质的溶解现象必须熟悉,属基础性识记知识考查题.
3.(2017 无锡)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降,这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
【分析】根据物质溶于水后的放热与吸热现象来考虑,要由物质溶于水的整个过程来分析.
【解答】解:物质溶于水分为两个过程,向水 ( http: / / www.21cnjy.com )中扩散的过程吸收热量,与水分子结合形成水合分子的过程放出热量,如果吸收热量大于放出热量,就表现为吸热,如果吸收热量小于放出热量,就表现为放热,如果相等就表现为既不放热,也不吸热.
A、氯化钠溶于水溶液温度基本不变,故错误;
B、硝酸铵溶于水吸收热量,溶液温度降低,故正确;
C、氢氧化钠溶于水放出热量,溶液温度升高,故错误;
D、蔗糖溶于水溶液温度基本不变,故错误;
故选B.
【点评】熟记以下物质:溶于水放热的物质有:浓硫酸、生石灰、氢氧化钠固体;溶于水吸热的有硝酸铵.
4.(2017 广安)如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A.下列说法正确的是( )
( http: / / www.21cnjy.com )
A.碳酸钠俗称小苏打
B.30℃时,氯化钠的溶解度为36.3g
C.碳酸钠的溶解度大于氯化钠的溶解度
D.将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl
【分析】根据固体的溶解度曲线可以:①查出某物 ( http: / / www.21cnjy.com )质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:A、碳酸钠俗称苏打,碳酸氢钠俗称小苏打,故A错误;
B、通过分析溶解度曲线可知,30℃时,氯化钠的溶解度为36.3g,故B正确;
C、在比较物质的溶解度时,需要指明温度,故C错误;
D、碳酸钠的溶解度受温度变化影响较大 ( http: / / www.21cnjy.com ),所以将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是碳酸钠,故D错误.
故选:B.
【点评】本题难度不是很大,主要考查了固 ( http: / / www.21cnjy.com )体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
5.(2017 来宾)20℃时氯化钾的溶解度为34g.下列是四位同学在20℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
【分析】根据题意,20℃时氯化钾的溶解度为34g,根据溶解度的含义判断选项中的溶液是否达到饱和状态,进行分析判断.
【解答】解:20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态.
A、20℃时氯化钾的溶解度为34g,含义 ( http: / / www.21cnjy.com )是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入10g氯化钾,所得溶液是不饱和溶液,故选项错误.
B、20℃时氯化钾的溶解度为34g ( http: / / www.21cnjy.com ),含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入17g氯化钾,所得溶液是恰好是饱和溶液,故选项正确.
C、20℃时氯化钾的溶解度为34g, ( http: / / www.21cnjy.com )含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入20g氯化钾,所得溶液是不饱和溶液,故选项错误.
D、20℃时氯化钾的溶解度为34g,含 ( http: / / www.21cnjy.com )义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入33g氯化钾,所得溶液是不饱和溶液,故选项错误.
故选:B.
【点评】本题难度不大,掌握溶解度的含义、饱和溶液的特征等并能灵活运用是正确解答本题的关键.
6.在室温下,如图甲、乙、丙 ( http: / / www.21cnjy.com )三试管中分别盛硝酸钾、硝酸钠、氢氧化钙(消石灰)饱和溶液,并都有少量的固体物质存在,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,应向试管外杯里的水中加入的物质是( )
( http: / / www.21cnjy.com )
A.氢氧化钠固体 B.硝酸铵固体 C.氯化钠固体 D.冰
【分析】根据硝酸钾、硝酸钠 ( http: / / www.21cnjy.com )的溶解度随温度的升高而升高;氢氧化钙随温度的升高而降低,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,试管外杯里的水温度应升高,因此需加入溶于水温度升高的物质.
【解答】解:硝酸钾、硝酸钠的溶解度随温度的 ( http: / / www.21cnjy.com )升高而升高;氢氧化钙随温度的升高而降低,若使甲、乙两试管的固体减少或消失,而丙管中的固体略有增加,试管外杯里的水温度应升高,因此需加入溶于水温度升高的物质.
A、氢氧化钠固体溶于水,溶液温度升高,故正确;
B、硝酸铵溶于水,溶液温度降低,故错误;
C、氯化钠溶于水,溶液温度基本不变,故错误;
D、冰融化吸热,温度降低,故错误.
故选A.
【点评】溶解度曲线能定量地表示出溶解度变化的 ( http: / / www.21cnjy.com )规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同;了解哪些物质溶于水溶液温度升高还是降低.
7.要使一接近饱和的硝酸钾溶液变成饱和溶液,以下措施中不能达到目的是( )
A.恒温蒸发溶剂 B.加水
C.降低温度 D.加入适量硝酸钾
【分析】A、根据恒温蒸发溶剂接近饱和的硝酸钾溶液变成饱和溶液判断;
B、根据加水后溶液更不饱和判断;
C、根据硝酸钾的溶解度随温度升高而增大,降低温度硝酸钾的溶解度减小判断;
D、根据加入适量硝酸钾能使不饱和溶液再溶解一部分硝酸钾变为饱和溶液判断.
【解答】解:A、恒温蒸发水分,因溶剂减少而使不饱和溶液达饱和;
B、加水后溶液更不饱和;
C、降低温度,使同量水溶解硝酸钾的量减少而达到饱和;
D、不饱和硝酸钾溶液加入硝酸钾,继续溶解至不能再溶解而成为饱和溶液;
故选B.
【点评】增加溶质、减少溶剂都可以把不饱和溶液变成饱和溶液,但改变温度使不饱和溶液变成饱和溶液时却要具体分析溶质溶解度与温度的关系.
8.某同学往右图所示的烧杯(用石蜡将烧杯和塑 ( http: / / www.21cnjy.com )料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
( http: / / www.21cnjy.com )
A.蔗糖 B.硝酸铵 C.氯化钠 D.氢氧化钠
【分析】发现石蜡熔化,塑料片掉了下来说明加入的物质放出热量,使溶液温度升高.
【解答】解:A、蔗糖溶于水既不放出热量,也不吸收热量,溶液温度不变,故A错;
B、硝酸铵溶于水吸收热量,使溶液温度降低,故B错;
C、氯化钠溶于水既不放出热量,也不吸收热量,溶液温度不变,故C错;
D、氢氧化钠溶于水放出热量,使溶液温度升高,故D正确.
故选D.
【点评】解答本题关键是要知道常见物质溶于水是吸收热量还是放出热量.
9.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线判断下列说法,其中不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.40℃时,两种物质的溶解度相等
C.60℃时,将80g甲物质放入100g水中,所得溶液的质量为160g
D.60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是乙
【分析】由溶解度曲线:可以比 ( http: / / www.21cnjy.com )较20℃、40℃时甲、乙两物质的溶解度大小;由60℃时,甲物质的溶解度可以判断形成溶液的质量;由甲、乙两物质的溶解度受温度的影响变化趋势,可以判断降温后析出晶体的质量多少.
【解答】解:A、由图可知,20℃时,甲物质的溶解度小于乙物质的溶解度,故说法正确;
B、40℃时,两种物质的溶解度曲线交于一点,故两种物质的溶解度相等,故说法正确;
C、60℃时,甲物质的溶解度为60g,故将80g甲物质放入100g水中,充分搅拌后只能溶解60g,将得到溶液的质量为160g;故说法正确;
D、甲物质的溶解度受温度的影响变化较大,故60℃时,将等质量的甲、乙两种物质的饱和溶液降温到20℃,析出晶体较多的是甲;
故选D.
【点评】主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
10.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
( http: / / www.21cnjy.com )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
【分析】利用气体的溶解度随温度的升高而减小,结合图示进行分析解答.
【解答】解:气体的溶解度随温度的 ( http: / / www.21cnjy.com )升高而减小,由氧气的溶解度随压强的变化图,t1对应的溶解度大于t2对应的溶解度,t1对应的温度为30℃,则t2对应的温度应大于30℃.
故选:A.
【点评】本题难度不大,主要考查气体的溶解度的影响因素,掌握气体溶解度的两个影响因素(温度、压强)是正确解答本题的关键.
11.使80℃的硝酸钾饱和溶液冷却到20℃,对可能发生的变化说法正确的是( )
A.溶液中溶质的质量分数不变 B.溶液质量增加
C.溶液中溶质的溶解度减小 D.溶液变成不饱和溶液
【分析】根据溶解度的知识进行分析,硝酸钾的溶解度随着温度的升高而增大.
【解答】解:A、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,导致溶质质量分数减小,故A错误;
B、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,导致溶液质量减小,故B错误;
C、降低温度硝酸钾的溶解度减小,故C正确;
D、80℃的硝酸钾饱和溶液冷却到20℃,降低温度硝酸钾的溶解度减小,会析出晶体,析出晶体后的溶液仍然是饱和溶液,故D错误;
故选C.
【点评】本题考查了溶解度的有关知识,完成此题,可以依据硝酸钾的溶解度受温度变化的因素进行.
12.如图表示A、B两种物质的溶解度(s)随温度(t)的变化情况,下列说法正确的是( )
( http: / / www.21cnjy.com )
A.A的溶解度大于B的溶解度
B.升高温度可使A的不饱和溶液变为饱和
C.t3℃时,在100g水中溶解60gA能形成饱和溶液
D.t2℃时,A和B的饱和溶液的溶质质量分数相等
【分析】由于固体物质的溶解度会随温度的变化 ( http: / / www.21cnjy.com )而变化,从图中可以看出,只有在高于t2℃℃时,A的溶解度大于B的溶解度;由A的溶解度受温度的变化趋势,可以升高温度可使A的不饱和溶液是否饱和;t3℃时,A的溶解度为80g,可以确定在100g水中溶解60gA能否形成饱和溶液;t2℃时,A、B两种物质的溶解度大小,可以判断溶质的质量分数的大小.
【解答】解:A、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于t2℃℃时,A的溶解度大于B的溶解度,故A错误;
B、A的溶解度随着温度的升高而增大,故升高温度后A的不饱和溶液仍为不饱和溶液,故B错误;
C、t3℃时,A的溶解度为80g,故在100g水中溶解60gA能全部溶解,形成不饱和溶液.
D、t2℃时,A、B两种物质的溶解度相等,故在t2℃时,A和B的饱和溶液的溶质质量分数相等.
故选D.
【点评】本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.
13.如图为a、b、c三种固体物质的溶解度曲线.下列说法中,正确的是( )
( http: / / www.21cnjy.com )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1°C时,将20gc加入50g水中充分溶解,得到70克饱和溶液
C.t2°C时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1°C时,a、b、c的饱和溶液中,溶质质量分数最大的是b
【分析】A、依据物质的溶解度随温度变化及饱和溶液中溶质质量分数的计算分析解答;
B、依据t1℃时c的溶解度分析解答;
C、依据溶液的状态及a、b物质的溶解度分析解答;
D、依据该温度下物质的溶解度及饱和溶液中溶质的质量分数分析.
【解答】解:A、曲线从t2℃降到t1℃后a和b的溶解度都减小,仍然是饱和溶液,又因为饱和溶液的溶质质量分数的计算式为 ( http: / / www.21cnjy.com )×100%,由此可知饱和溶液的溶解度越大溶质质量分数就越大,所以在t1℃时b的溶解度大于a的,所以溶质质量分数也是b大于a;由于c降温后变为不饱和溶液,它的溶质质量分数不变,取决于t2℃时的溶解度大小,因此只要比较一下在t2℃时c的溶解度与t2℃时a和b的溶解度大小就行,因为t1℃时a的溶解度大于t2℃时c的溶解度,所以温度降低到t1℃时,溶液的溶质质量分数大小关系是:b>a>c,故A错误;
B、t1℃时c的溶解度是20g,所以将20gc加入50g水中,最多溶解10gc,得到60克饱和溶液,故B错误;
C、t2℃时a的溶解度大于b的溶解度, ( http: / / www.21cnjy.com )若为饱和溶液则a溶液的溶质质量分数一定大于b溶液的溶质质量分数,若为不饱和溶液,则无法判断,故C错误;
D、t1℃时b的溶解度最大,则a、b、c的饱和溶液中,溶质质量分数最大的是b,故D正确.
故选D.
【点评】通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的影响因素,考查了学生对知识的掌握和应用.
14.现有a、b两种物质在t1℃的 ( http: / / www.21cnjy.com )饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体.则能表示a、b两种物质的溶解度曲线是( )
A. ( http: / / www.21cnjy.com ) B. ( http: / / www.21cnjy.com )
C. ( http: / / www.21cnjy.com ) D. ( http: / / www.21cnjy.com )
【分析】a、b两种物质在t1℃的 ( http: / / www.21cnjy.com )饱和溶液,将温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体,可以得出a、b的溶解度随着温度的升高的变化趋势,进而可以判断a、b的曲线趋势即可.
【解答】解:a、b两种物质在t1℃的饱 ( http: / / www.21cnjy.com )和溶液,将温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体,说明a的溶解度随着温度的升高的减小,b的溶解度随着温度的升高的增大;故B图符合要求.
故选B.
【点评】主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
15.硝酸钾和氯化钠的溶解度曲线如图,下列说法中正确的是( )
( http: / / www.21cnjy.com )
A.a点表示氯化钠的饱和溶液
B.t1℃硝酸钾的溶解度大于氯化钠的溶解度
C.t2℃硝酸钾和氯化钠饱和溶液中溶质质量分数相等
D.t3℃两种物质的饱和溶液降温至t2℃,析出溶质多的是硝酸钾
【分析】根据固体物质的溶解度曲线可 ( http: / / www.21cnjy.com )知:①查出某物质在某温度下的溶解度;②比较不同物质在同一温度下的溶解度的大小,③判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液中溶质的质量分数.
【解答】A、a点在氯化钠溶解度曲线下面,所以是氯化钠的不饱和溶液,故A错误;
B、通过溶解度曲线可以看出,t1℃硝酸钾的溶解度小于氯化钠的溶解度,故B错误;
C、t2℃硝酸钾和氯化钠的溶解度相等,所以两者饱和溶液中溶质质量分数相等,故C正确;
D、t3℃两种物质的饱和溶液降温至t2℃,溶液质量不能确定,所以析出的晶体质量也不能确定,故D错误.
故选:C.
【点评】主要考查了固体溶解度曲线的意义及固体溶解度和温度间的关系,并能利用所学知识来解决实际问题.
16.室温时,有两瓶硝酸钾溶液,一瓶 ( http: / / www.21cnjy.com )为饱和溶液(溶质的质量分数为24%),另一瓶为5%的溶液,下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
【分析】(1)在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;还能继续溶解的溶液,称为该物质的不饱和溶液;
(2)要想说明溶液是否饱和,必须在温度一定、溶剂的量一定的情况下.
(3)判断溶液是否饱和,可以采用加入少量该溶质看是否溶解.
【解答】解:
A、各加入少量水振荡,没有现象.故此选项错误.
B、向硝酸钾的饱和溶液中各加入少量硝酸钾晶体,振荡.晶体不溶解.可区分开饱和溶液和不饱和溶液,故此选项正确.
C、硝酸钾的饱和溶液在降低温度时会有晶体析出,不饱和的不会析出晶体,故此选项正确.
D、蒸发少量水饱和的溶液会有晶体析出,不饱和的不会析出晶体,故此选项正确.
故选:A.
【点评】此题主要考查了饱和溶液和不饱和 ( http: / / www.21cnjy.com )溶液的区分.在一定的温度下,在一定的溶剂里,不能再溶解某种溶质的溶液就是该种物质的饱和溶液;要想说明溶液是否饱和,必须温度一定、溶剂的量一定.
17.为了研究物质的溶解现象,设计并进行了如下实验,下列说法不正确的是( )
( http: / / www.21cnjy.com )
A.实验①中的固体溶解,形成紫红色溶液;实验②中的固体几乎不溶解
B.设计实验②、③的目的是比较高锰酸钾和碘在汽油中溶解情况
C.对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好
D.实验说明不同物质在同一溶剂中溶解性是相同的,同一种物质在不同溶剂中溶解性也是相同的
【分析】根据实验①、②是高锰酸钾溶解在等体积的水、汽油中,进行分析解答.实验②、③分别是高锰酸钾、碘溶解在等体积的汽油里,进行分析解答.
【解答】解:A、高锰酸钾易溶于水形成紫红色溶液,高锰酸钾几乎不溶于汽油,故A说法正确;
B、实验②、③分别是高锰 ( http: / / www.21cnjy.com )酸钾、碘溶解在等体积的汽油里,现象分别是固体几乎不溶解,固体溶解,形成紫红色溶液,目的是比较高锰酸钾和碘在汽油中溶解情况,故B说法正确;
C、实验①、②是高锰酸钾溶解在等体 ( http: / / www.21cnjy.com )积的水、汽油中,现象分别是固体溶解,形成紫色溶液,固体几乎不溶解,所以对比实验①、②可得出的结论是高锰酸钾在水中的溶解性比汽油中的好,故C说法正确;
D、实验说明不同物质在同一溶剂中溶解性是不相同的,同一种物质在不同溶剂中溶解性也是不相同的,故D说法错误.
故选D.
【点评】本题难度不大,根据实验确定影响常见物质的溶解性的因素是正确解答本题的关键.
18.将等质量的甲、乙两 ( http: / / www.21cnjy.com )种固体分别加入盛有100克水的烧杯中,充分搅拌后静置片刻,再升温至30℃,现象如图所示.下列有关说法正确的是( )
( http: / / www.21cnjy.com )
A.10℃时,甲物质的溶解度大于乙物质
B.30℃时,甲物质的溶解度等于乙物质
C.甲物质的溶解度随温度的升高而增大
D.乙物质的溶解度随温度的变化不明显
【分析】根据物质的溶解度曲线可以判断物质的溶解度大小和饱和溶液和不饱和溶液可以相互转化进行分析.
【解答】解:A、10℃时,向盛有100g水的烧杯中分别加入等质量的甲、乙两种固体,乙全部溶解,说明10℃时乙的溶解度大于甲的溶解度,错误;
B、30℃时,不知道是否是饱和溶液,所以无法判断甲物质的溶解度等于乙物质,错误;
C、甲物质的溶解度随温度的升高而增大,正确;
D、不知道是否是饱和溶液,所以无法判断乙物质的溶解度随温度的变化不明显,错误;
故选C
【点评】溶解度曲线能定量地表示出溶 ( http: / / www.21cnjy.com )解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
19.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )
( http: / / www.21cnjy.com )
A.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
B.40℃时,分别在100 g水中加入40 g 甲、乙,所得溶液溶质的质量分数相等
C.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D.20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液
【分析】A、不知溶液状态和溶质、溶剂质量多少,故无法判断溶液中溶质的质量分数大小;
B、据40℃时甲、乙的溶解度分析判断;
C、据甲乙在20℃时的溶解度分析解答;
D、据甲乙在40℃时的溶解度分析解答.
【解答】解:A、不知溶液状态和溶质、溶剂质量多少,故无法判断溶液中溶质的质量分数大小,若二者均为饱和溶液,则溶质的质量分数相等,故错误;
B、40℃时甲、乙的溶解度分别是 ( http: / / www.21cnjy.com )50g、40g,所以分别在100 g水中加入40 g 甲、乙均能完全溶解,所得溶液溶质的质量分数相等,正确;
C、甲乙在20℃时的溶解度是30g ( http: / / www.21cnjy.com ),所以40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均恰好为饱和溶液,正确;
D、40℃时甲、乙的溶解度 ( http: / / www.21cnjy.com )分别是50g、40g,所以分别在100 g水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液,甲溶液为不饱和溶液,正确;
故选A.
【点评】溶解度是一定温度下,某固态物质在100g水中最多溶解的质量,同时能据溶解度曲线正确分析物质的状态变化,及溶质的质量情况.
20.如图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )
( http: / / www.21cnjy.com )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
【分析】根据固体物质的溶解度曲 ( http: / / www.21cnjy.com )线可知:①查出某固体物质在某温度下的溶解度,②比较不同的物质在同一温度下的溶解度的大小,从而比较同温度下的物质的饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而确定升温或降温时溶液中溶质的质量分数的变化等.
【解答】解:A、t1℃时,M、N两物质的溶解度相同,说明t1℃时,M、N两物质饱和溶液溶质质量分数相,故A错误;
B、由于N的溶解度随温度的升高而减小,因此如 ( http: / / www.21cnjy.com )果把N的饱和溶液由t1℃升温到t2℃时,N的饱和溶液中就会有晶体析出,则溶液中溶质的质量分数就会减小,故B错误;
C、由两物质的溶解度曲线可知,在高于t1℃时,M的溶解度才大于N的溶解度,故C错误;
D、由N的溶解度曲线不难看出,N的溶解度随温度的升高而减小,故D正确;
故选D.
【点评】本题难度不是很大,主要考查了根据固体的溶解度曲线来解决相关的问题,从而加强学生对固体溶解度的理解.
21.如图为某固体溶解度随温度变化的 ( http: / / www.21cnjy.com )曲线.该固体从溶液中析出时不带结晶水.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )
( http: / / www.21cnjy.com )
A.升温10℃后,M点延曲线向右上移
B.降温10℃后,M点延曲线向左下移
C.降温10℃后,N点向左平移
D.恒温蒸发溶剂时,M点不动,N点向上移动至曲线后不再变化
【分析】根据固体的溶解度 ( http: / / www.21cnjy.com )曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:A、升温10℃后,M点变为不饱和溶液,故M点延曲线向右平移移,错误;
B、降温10℃后,M点延曲线向左下移,正确;
C、降温10℃后,N点变为饱和溶液,故N点向左平移,正确;
D、恒温蒸发溶剂时,M点仍为饱和溶液,M点不动,N点逐渐变为饱和溶液,故N点向上移动至曲线后不再变化,正确;
故选A.
【点评】本题难度不是很大 ( http: / / www.21cnjy.com ),主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
22.不影响固体溶解度大小的因素是( )
A.温度 B.溶剂质量 C.溶剂种类 D.溶质种类
【分析】影响固体物质溶解度大小的因素有外因和内因,内因是指溶质的性质和溶剂的性,外因是温度;所以温度是影响溶解度大小的重要因素.
【解答】解:A、大多数固体物质的溶解 ( http: / / www.21cnjy.com )度随温度的升高而增大,少数物质的溶解度受温度变化影响不大,极少数物质溶解度随温度的升高而减小,温度影响固体物质的溶解度,故选项不符合题意.
B、溶解度是指某温度时100g溶剂中最多溶解的质量为该温时该物质的溶解度,溶剂质量不影响固体物质的溶解度,故选项符合题意.
C、溶剂的种类影响固体溶解度大小,如20℃时高锰酸钾易溶于水中,但难溶于汽油中,溶剂种类影响固体物质的溶解度,故选项不符合题意.
D、当温度相同时,溶质不同,溶解度可能 ( http: / / www.21cnjy.com )不同,如20℃时氯化钠的溶解度为36g,而硝酸钾的溶解度为31.6g,溶质种类影响固体物质的溶解度,故选项不符合题意.
故选B.
【点评】本题难度不大,是对溶解度影响因素的考查,注意固体物质的溶解度受温度、溶剂和溶质性质的影响,与当前溶液是否处于饱和、溶剂的多少无关.
23.60℃时,化合物甲的溶解度比乙大. ( http: / / www.21cnjy.com )分别取等质量60℃时的甲、乙的饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水).以下叙述正确的是( )
A.60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B.a一定大于b
C.20℃时,若甲的溶解度仍比乙的大,则a一定小于b
D.20℃时,若甲的溶解度比乙的小,则a一定大于b
【分析】根据溶解度随温度的变化特点解答;析出晶体的大小与溶解度随温度变化的程度有关,据此解答.
【解答】解:A、60℃时,化合物甲的溶解度比乙大,60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量大,错误;
B、由于溶解度受温度影响的变化程度不知道,无法比较ab的大小,错误;
C、20℃时,若甲的溶解度仍比乙的大,a不一定大于b,错误;
D、20℃时,若甲的溶解度比乙的小,则a一定大于b,正确;
故选D.
【点评】本题考查的是溶解度曲线的应用以及结晶的知识,完成此题,可以依据已有的知识进行.
二.填空题
24.(2017 襄阳)甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示.
(1) t1 ℃时,甲的溶解度为20g.
(2)t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为 丙、乙、甲 .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:①查 ( http: / / www.21cnjy.com )出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,t1℃时,甲的溶解度为20g;
(2)t2℃时,甲物质的溶解度最大,乙物质的 ( http: / / www.21cnjy.com )溶解度次之,丙物质的溶解度最小,所以甲、乙、丙三种物质的饱和溶液各100g,丙溶液中的溶剂最多,甲溶液中的溶剂最少,所以t2℃时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1℃时,溶剂质量不变,所得溶液中溶剂的质量由大到小依次为:丙、乙、甲.
故答案为:(1)t1;
(2)丙、乙、甲.
【点评】本题难度不是很大,主要 ( http: / / www.21cnjy.com )考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
25.(2017 毕节市)根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)30℃时,NaCl的溶解度是 36.3 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 NaCl .
(3)20℃时,在100g水中加入 ( http: / / www.21cnjy.com )50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 硝酸钾 .
【分析】(1)根据表格中,物质溶解度的信息来分析;
(2)根据不同温度下,两种物质的溶解度以及溶液随温度的变化情况来分析;
(3)根据40℃时两种物质的溶解度来分析.
【解答】解:(1)由表格信息可知,30℃时,NaCl的溶解度是36.3g;故填:36.3;
(2)由表格数据可知,KNO ( http: / / www.21cnjy.com )3、NaCl两种固体物质的溶解度,都是随温度升高而增大,变化较小的是NaCl,变化较大的是KNO3;故答案为:NaCl;
(3)由表格数据可知,40℃时,氯化钠的溶解 ( http: / / www.21cnjy.com )度为36.6g,硝酸钾的溶解度为63.9g,所以20℃时,在100g水中加入50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液是硝酸钾;故填:硝酸钾.
【点评】此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,要学会分析溶解度曲线和溶解度表格.
26.如图所示是甲、乙、丙三种物质的溶解度 ( http: / / www.21cnjy.com )曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)b物质的溶解情况是 完全不溶解,固体增多
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: acb ;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是 b、a、c ;(用a、b、c填空)
(4)40℃时,等质量饱和溶液中含水最少的是 甲 物质.
(5)40℃时,甲溶液中溶质质量分数 不一定 大于丙溶液中溶质质量分数;(填“一定”或“不一定”).
( http: / / www.21cnjy.com )
【分析】由在20℃时,分别取等质量的三种物质 ( http: / / www.21cnjy.com )的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,结合溶解度曲线可以确定乙物质的溶解情况和甲、乙、丙三种物质的溶解度曲线的序号;
根据固体物质的溶解度曲线可以比 ( http: / / www.21cnjy.com )较在20℃~30℃时三种物质的溶解度大小;40℃时,甲的溶解度最大,故等质量饱和溶液中含水最少的是甲;由于不知溶液是否饱和,故无法比较甲、丙两溶液中溶质的质量分数.
【解答】解:(1)由溶解度曲线可以看出,温度 ( http: / / www.21cnjy.com )由20℃升高到40℃,a、b的溶解度增大,c的溶解度减小,故将向20℃时等质量的三种物质的饱和溶液中,加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,说明甲、丙两物质的溶解度随着温度的升高而增大,且甲的溶解度受温度的影响最大;故乙物质应是溶解度随着温度的升高而减小,故乙物质的溶解情况是完全不溶解固体增多.
(2)由(1)的分析可知,甲、乙、丙三种物质的溶解度曲线的序号为acb.
(3)温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是b、a、c.
(4)40℃时,甲的溶解度最大,故等质量饱和溶液中含水最少的是甲.
(5)由于不知甲、丙溶液是否饱和,故无法比较甲、丙两溶液中溶质的质量分数.
故答案为:
(1)完全不溶解,固体增多;(2)acb;(3)b、a、c;(4)甲;(5)不一定.
【点评】本题主要考查了根据 ( http: / / www.21cnjy.com )固体物质的溶解度曲线解决相关的问题,培养学生的分析能力和解题能力.解题的关键是结合题意看懂溶解度曲线图并明确溶解度曲线的意义.
27.如图是三种固体物质的溶解度曲线.
(1)物质c的溶解度随温度的升高而 降低 ;
(2)物质a的溶解度大于物质c的溶解度的温度范围 t>t1℃ ;
(3)t2℃时,用50g水配制物质a的饱和溶液至少需要 25 g物质;
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃(溶剂量不变),溶液中溶质质量分数不变的是 ab .
( http: / / www.21cnjy.com )
【分析】(1)根据溶解度曲 ( http: / / www.21cnjy.com )线的变化考虑;(2)根据在曲线中a在b的上边考虑;(3)根据t2℃时,a的溶解度考虑;(4)根据饱和溶液升温至t2℃溶解度的变化考虑.
【解答】解:(1)由图示可知c的溶解度随温度的升高而降低;
(2)大于t1℃时,a的溶解度在b溶解度的上边,即a的溶解度大于物质c的溶解度;
(3)t2℃时,a的溶解度是50g,即100g水中最多溶解50g,所以50g水中最多溶解25g;
(4)将t1℃时a、b、c三种物质的 ( http: / / www.21cnjy.com )饱和溶液升温至t2℃,a和b的溶解度变大,由饱和溶液变为不饱和,溶质质量分数不变,c的溶解度减小,析出晶体,溶质质量分数减小.
故答案为:(1)降低;(2)t>t1℃;(3)25;(4)ab.
【点评】解答本题关键是要知道溶解度曲线的 ( http: / / www.21cnjy.com )意义,知道根据溶解度进行分析问题的方法,饱和溶液不管是升温还是降温,只要溶解度减小,就会析出晶体,溶解度变大,变为不饱和溶液.
28.如图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
①t2℃时,A、B、C三种物质溶解度的大小关系是 A═B>C .
②有t1℃时A的饱和溶液80g,其中A的质量为 16 g.
③把C物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 Ⅱ .
Ⅰ.溶剂的质量一定变小Ⅱ.溶质的质量可能不变
Ⅲ.溶质的质量分数一定变大Ⅳ.溶质的质量一定变大
④将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后,三种溶液中溶质的质量分数由小到大的顺序是 C<A<B .
( http: / / www.21cnjy.com )
【分析】①根据某一温度时物质溶解度的比较方法考虑;②根据t1℃时A的溶解度考虑;③根据C物质的不饱和溶液变为饱和溶液的方法进行分析.
【解答】解:①从t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小顺序是:A═B>C;
②t1℃时A的溶解度是25g,即100g水中最多溶解25g,设t1℃时A的饱和溶液80g中含溶质质量为X则: ( http: / / www.21cnjy.com )解得X=16g;
③C物质的不饱和溶液变为饱和溶液的 ( http: / / www.21cnjy.com )方法有:a.加入溶质,此时溶质质量变大,溶剂不变,溶质质量分数变大;b.蒸发溶剂,此时溶质不变,溶剂减少,溶质质量分数不变;c.升高温度刚好饱和,此时溶质和溶剂都不变,溶质质量分数也不变.故选Ⅱ;
④饱和溶液溶质质量分数的大小与溶解 ( http: / / www.21cnjy.com )度有关,在t3℃时A、B、C三种物质的溶解度大小是:A>B>C;将t3℃时A、B、C三种物质饱和溶液的温度降到t1℃后A、B仍然是饱和溶液,且此时B的溶解度大于A的溶解度,所以降温后溶质质量分数是A<B;C物质降温后溶解度增大变为不饱和溶液,溶质质量分数不变,因为t3℃时C的溶解度<t1℃A的溶解度,所以C物质的溶质质量分数最小,故答案为:C<A<B.
故答案为:①A═B>C;②16;③Ⅱ;④C<A<B.
【点评】解答本题关键是要知道溶解度大小的比较方法,知道溶液中溶质的计算方法,不饱和溶液变为饱和溶液的方法,溶质质量分数的计算方法.
29.如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
(1)随着温度的升高,a物质的溶解度的变化趋势是 温度升高,溶解度增大 .
(2)曲线a和b的交叉点M表示的含义是 60℃时a、b物质溶解度相等 .
(3)80℃时40g a物质溶于50g水中所形成的溶液是 不饱和 溶液(选填“饱和”或“不饱和”).
( http: / / www.21cnjy.com )
【分析】根据题目信息和溶解度 ( http: / / www.21cnjy.com )曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,而a的溶解度随温度的升高变化比b大;曲线a和b的交叉点M表示的含义是:60℃时a、b物质溶解度相等;80℃时40ga物质溶于50g水中所形成的溶液是不饱和溶液,因为在该温度下,a的溶解度是85g.
【解答】解:(1)由溶解度曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,故答案为:温度升高,溶解度增大;
(2)曲线a和b的交叉点M表示的含义是:60℃时a、b物质溶解度相等;故答案为:60℃时a、b物质溶解度相等;
(3)80℃时40ga物质溶于50g水中所形成的溶液是不饱和溶液,因为在该温度下,a的溶解度是85g;故答案为:不饱和;
【点评】本考点考查了溶解度曲线及 ( http: / / www.21cnjy.com )其应用,通过溶解度曲线我们可以获得很多信息;还考查了判断有关溶液是否饱和等,本考点主要出现在选择题和填空题中.
30.如图是a、b两种固体物质的溶解度曲线.
(1)图中a物质的溶解度曲线比b物质的陡,说明: a溶解度受温度影响比b大 ;
(2)若要想在200g水中溶解更多的a物质,可采取的措施是: 升温 ;
(3)40℃时,将20g a物质放入50g水中,充分搅拌,所得溶液的溶质质量分数是 23.1% .
(4)下列说法正确的是: ABC
A、a、b物质都是易溶物
B、可用结晶的方法分离a、b的混合物
C、a的饱和液从40℃降温至20℃后仍然饱和
D、30℃时,a、b的饱和液中所含溶质质量一定相等.
( http: / / www.21cnjy.com )
【分析】溶解度曲线的应用:
(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况.
(2)根据溶解度曲线,结合饱和溶液和不饱和溶液的转化方法来完成解答;
(3)根据物质的溶解度结合溶质的质量分数来完成解答;
(4)A、根据对物质溶解性的粗略分类来判断;
B、根据a、b的溶解度受温度的变化情况来完成解答;
C、根据a的溶解度来进行判断;
D、根据a和b的溶解度来进行判断.
【解答】解:(1)图中a物质的溶解度曲线比b物质的陡,说明a的溶解度受温度变化影响较大;
(2)从溶解度曲线可以看出,a的溶解度随温度升高而增大,所以若要想在200g水中溶解更多的a物质,可采取的升高温度的方法;
(3)由溶解度曲线可知40℃时a的溶解度为30g,所以100g水中溶解30ga物质,而50g水中能够溶解15ga物质,即题给的20ga不能全部溶解,此时得到的溶液为饱和溶液,其溶质的质量分数为: ( http: / / www.21cnjy.com )×100%=23.1%.
(4)A、在20℃时a和b的溶解度都大于10g,所以a和b都是易溶物质,故A正确;
B、a的溶解度受温度变化影响大,而b的溶解度受温度变化影响较小,所以可以可用结晶的方法分离a、b的混合物,故B正确;
C、a的溶解度随温度升高而增大,所以降低温度之后a的溶液仍然是饱和溶液,故C正确;
D、在没有指明溶液的质量的情况下是无法比较溶质的质量的,故D错误.
故选ABC.
故答案为:(1)a溶解度受温度影响比b大;
(2)升温;
(3)23.1%;
(4)ABC.
【点评】本题难度不大,主要考查了固体物质的溶解度曲线所表示的意义及根据固体的溶解度曲线解决相关的问题.
31.甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
(1)50℃时,乙物质的溶解度是 40 g.
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 乙>甲>丙 .
(3)温度为 40 ℃时,甲、乙两物质溶解度相同.
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:① ( http: / / www.21cnjy.com )查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,50℃时,乙物质的溶解度是40g;
(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为:乙>甲>丙;
(3)温度为40℃时,甲、乙两物质溶解度相铜.
故答案为:(1)40;
(2)乙>甲>丙;
(3)40.
【点评】本题难度不是很大,主要考查了 ( http: / / www.21cnjy.com )固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
32.如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.
①20℃时,甲乙丙三种物质的溶解度由大到小的顺序 乙>甲>丙
②图中A点表示的意义是 40℃时,甲、乙两物质的溶解度相等,都为36g .
③在室温时,将分别盛有甲、丙饱和溶 ( http: / / www.21cnjy.com )液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是 AD (填字母序号),该现象被叫做 结晶 .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以:① ( http: / / www.21cnjy.com )查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:①由题目中溶解度曲线查阅20℃时三种物质的溶解度,容易看出乙的溶解度最大,甲次之,丙最小.故答案为:乙>甲>丙;
②由溶解度曲线可以看出甲乙物质的溶 ( http: / / www.21cnjy.com )解度关系,40℃时是甲乙二物质溶解度曲线的交点,即此温度时二者溶解度相等,且易查得此时溶解度为36g.故答案为:40℃时,甲、乙两物质的溶解度相等,都为36g;
③由溶解度曲线分析可知, ( http: / / www.21cnjy.com )丙溶解度随温度的升高而减小,随温度的降低而增大,甲溶解度随温度的升高而增大,随温度的降低而减小,所以丙的饱和溶液在升温时,溶液中有晶体析出,而甲的饱和溶液在降温后溶液中有晶体析出,该过程叫结晶.故答案为:AD;结晶.
【点评】本题难度不是很大, ( http: / / www.21cnjy.com )主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
33.如图是A、B、C三种固体物质的溶解度曲线,据图回答:
(1)t2℃时,三种物质的溶解度由大到小的顺序为 A>B>C .
(2)图中P点表示 t1℃时,A、B物质的溶解度相等 .
(3)t2℃时,将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为 65g .
( http: / / www.21cnjy.com )
【分析】根据固体的溶解度曲线可以 ( http: / / www.21cnjy.com ):①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)通过分析溶解度曲线可知,t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C;
(2)图中P点表示:t1℃时,A、B物质的溶解度相等;
(3)t2℃时,A物质的溶解度是30g,所以将A物质充分溶解在50g的水中,最多能够得到A溶液的质量为65g.
故答案为:(1)A>B>C;
(2)t1℃时,A、B物质的溶解度相等;
(3)65g.
【点评】本题难度不是很大,主要考查 ( http: / / www.21cnjy.com )了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
34.如图是A、B、C三种固体物质的溶解度曲线,试看图后回答
(1)在t3℃时,三种物质的溶解度从小到大的顺序是: A<B<C
(2)在 t2℃ 时,B与C的溶解度相等;
(3)物质C的溶解度随温度升高而 增大 .
( http: / / www.21cnjy.com )
【分析】根据题目信息和溶解度曲线可知 ( http: / / www.21cnjy.com ):C固体物质的溶解度,是随温度升高而增大,而A、B的溶解度都随温度的升高而减少;在t3℃时,三种物质的溶解度从小到大的顺序是:A<B<C;在t2℃时,B与C有交点,因此B与C的溶解度相等.
【解答】解:(1)根据题目信息和溶解度曲线可知:在t3℃时,三种物质的溶解度从小到大的顺序是:A<B<C;故答案为:A<B<C
(2)在t2℃时,B与C有交点,因此B与C的溶解度相等,故答案为:t2℃
(3)根据题目信息和溶解度曲线可知:C固体物质的溶解度,是随温度升高而增大,故答案为:增大
【点评】本考点考查了溶解度曲线及其 ( http: / / www.21cnjy.com )应用、实验数据的处理问题,通过溶解度曲线我们可以获得很多信息;还考查了溶解度大小的比较,本考点主要出现在选择题和填空题中.
35.右图是A、B两种固体物质的溶解度随温度变化的曲线.请回答:
(1) 30℃ 时,A、B两物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃ A 析出晶体较多.(填“A”或“B”)
(3)40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后, B 物质有剩余(填“A”或“B”).
(4)现有50℃时A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是 ② (填序号).
①降低温度 ②升高温度 ③加入A物质.
( http: / / www.21cnjy.com )
【分析】(1)根据曲线中交点的含义考虑;
(2)根据溶解度变化的范围大小考虑;
(3)根据40℃时,A、B的溶解度判断;
(4)根据不饱和溶液到饱和溶液的转化方法考虑.
【解答】解:(1)曲线中交点表示该温度时两种物质的溶解度相等,所以30℃两种物质的溶解度相等;
(2)50℃时,相同质量的A、B两物质的饱和溶液降温到20℃,A物质溶解度减小得多,即溶不了得多,析出来的就多;
(3)40℃时,A的溶解度大于30g, ( http: / / www.21cnjy.com )B的溶解度小于30g,所以40℃时,50g水中溶解A物质的质量大于15g,溶解B物质的质量小于15g,所以40℃时,将A、B各15g分别加到均盛有50g水的两只小烧杯中,充分搅拌后B物质有剩余;
(4)不饱和溶液变为饱和溶液的方法有:蒸发溶剂,降低温度,增加溶质,因为在不减少溶剂的情况下,所以是后两者.
故答案为:(1)30℃(2)A;(3)B;(4)②.
【点评】通过回答本题知道了交点的 ( http: / / www.21cnjy.com )含义,降温后析出晶体多少的判断方法,一定量溶剂中加入一定量溶质是否全部溶解的判断方法,不饱和溶液变为饱和溶液的方法.
36.甲、乙两种物质的溶解度曲线如图.试回答以下问题:
(1)m点表示 20℃时,甲和乙的溶解度相等都是40g ;
(2)20℃时,在100克甲物质的饱和溶液中加入10克水,为使溶液重新达到饱和,需加甲物质 4 克;
(3)常压下,CO2在水中的溶解度随温度的变化应类似于 乙 物质;(填甲或乙)
(4)40℃时,将甲、乙 ( http: / / www.21cnjy.com )两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 < (选填“>”或“=”或“<”)乙物质溶液的质量.
( http: / / www.21cnjy.com )
【分析】根据固体物质的溶解度曲线可知:① ( http: / / www.21cnjy.com )查出某物质在一定温度时的溶解度,从而可以确定出一定量的水中最多溶解的溶质的质量,②比较不同物质在相同温度下的溶解度的大小,③判断物质的溶解度随温度变化的变化情况,从而可以判断温度变化时饱和溶液中量的变化等.
【解答】解:(1)由于m点是甲和 ( http: / / www.21cnjy.com )乙的溶解度曲线的交点,即两种物质的溶解度在20℃时相等都是40g,故答案为:20℃时,甲、乙两种物质的溶解度相等都是40g
(2)由于在20℃时,甲的溶解度是40g,即100g水中最多溶解40g甲,则10g水中最多溶解4g甲,故答案为:4
(3)由于二氧化碳的溶解度随温度的升高而减小,故答案为:乙
(4)由于甲的溶解度随温度的升高 ( http: / / www.21cnjy.com )而增大,而乙的溶解度随温度的升高而减小,因此给它们的饱和溶液降温时,甲的饱和溶液中就会有晶体析出,而乙的饱和溶液就会变成不饱和溶液,因此降温后,甲的溶液小于乙的溶液,故答案为:<
【点评】本题难度不是很大,主要考查了固体溶解度曲线所表示的意义及对固体溶解度概念的理解和应用.
37.A、B、C、D四个 ( http: / / www.21cnjy.com )烧杯中分别盛有相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20 g、15 g、10 g、5 g某物质,充分溶解后观察到如图所示的现象.请完成下列问题:
( http: / / www.21cnjy.com )
(1)在A、B、C、D四个烧杯中, AB 中盛的一定是饱和溶液; D 中盛的一定不是饱和溶液; C 中盛的可能是饱和溶液.
(2)若固体是KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是 B .
(3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解? 不能 .
【分析】(1)在一定温度和溶剂 ( http: / / www.21cnjy.com )中,有溶质析出的溶液中,溶质达到最大溶解能力,溶质不会溶解,则溶液一定为饱和溶液,没有固体析出的溶液可能是恰好饱和或不是饱和溶液.
(2)KNO3的溶解度随温度的升高而增大,对饱和溶液升温会变为不饱和溶液.
(3)在有固体析出的饱和溶液中增加溶剂,将会有固体继续溶解.
【解答】解:(1)依据饱和溶液 ( http: / / www.21cnjy.com )的概念可知,A、B中有固体出现,一定是饱和溶液,C中的溶质质量比D多,而比C的少,可能是恰好溶解,则可能饱和,D一定不饱和.
(2)因KNO3的溶解度随温度的升高而增大,A和B一定是饱和溶液,B中的溶质比C中多一点,则升温B先变为不饱和.
(3)在一定温度下,往A、B中加入相同质量的水,因A中溶质比B中的多,B中固体刚好溶解时,A中肯定还有固体剩余.
故答案是:(1)AB; D;C;(2)B;(3)不能(或否).
【点评】本题考查了学生对饱和溶液的判断及饱和溶液与不饱和溶液的转化,应注意条件的变化来分析解答.
38.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 t2℃时A与C两物质溶解度相等 .
(2)当温度为t1℃,三种物质溶解度由小到大依次为 B<A<C ,当温度为t3℃时,溶解度最大的是 A .
(3)C可能表示哪种物质: 氢氧化钙 .
( http: / / www.21cnjy.com )
【分析】(1)溶解度曲线交点M的含义:溶解度曲线交于一点表明两物质的溶解度此时相等;
(2)根据溶解度曲线可以比较同一温度下不同物质的溶解度大小;
(3)根据氢氧化钙或气体的溶解度随温度的升高而减小解答.
【解答】解:
(1)t2℃时A与C两物质溶解度曲线的交点,说明此时它们的溶解度相等.
(2)t1℃时,三种物质溶解度从下 ( http: / / www.21cnjy.com )到上依次为B、A、C,所以三种物质此时的溶解度由小到大依次为:B<A<C,t3℃时物质A的溶解度曲线在最上方,所以此时A物质的溶解度最大;
(3)氢氧化钙或气体的溶解度随温度的升高而减小,C可能是氢氧化钙.
答案:
(1)t2℃时A与C两物质溶解度相等
(2)B<A<C A
(3)氢氧化钙
【点评】本题主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决有关的问题.
39.碘在不同溶剂中的溶解实验,根据实验操作图示回答相关问题.
( http: / / www.21cnjy.com )
(1)由图2所示现象可知:碘 微 (选填“不”、“微”或“易”)溶于水.
(2)图3所示试管中液体分层,说明碘在汽油中的溶解性比在水中 强 (选填“强”或“弱”).
(3)①碘易溶于酒精.若实验中汽油用酒精代替,振荡后静置,最终所得液体 不分层 (选填“分层”或“不分层”).
②“从稀碘水中提取碘”是“海带提碘”工艺 ( http: / / www.21cnjy.com )中的一个重要步骤,其原理类似实验中第二步操作.工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度 .
【分析】(1)根据实验的现象得出结论;
(2)根据溶液命名的方法及实验对比得出结论;
(3)①根据酒精可以和水相互溶解分析现象;
②根据实验的目的结合实验现象回答.
【解答】解:(1)由图2所示现象溶液为淡黄色可知碘能溶于水,对比图3可知碘并不是易溶于水,因此用微溶来描述;故填:微;
(2)碘溶于汽油,因此得到的是碘的汽油溶于;根据图2和图3的对比说明碘在汽油中的溶解性比在水中强;故填:强;
(3)①酒精可以和水相互溶解,因此用酒精代替汽油,就不会出现分层现象;故填:不分层;
②对比碘在酒精和汽油中的溶解及酒 ( http: / / www.21cnjy.com )精溶于水的现象,可知选择的挥发性液体必须与水相互不溶解,且碘在这种液体中的溶解度远大于在水中的溶解度.这样通过明显的分层现象而得到分离提纯;故填:与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度.
【点评】对于探究型实验探究,要熟悉实验 ( http: / / www.21cnjy.com )探究的环节和方法,精心设计实验方案,将所学过探究物质的性质或变化规律的技巧迁移至此,进行细心地探究实验和观察现象,再通过分析实验现象,推断、总结出该物质的性质或变化规律等.
三.实验探究题
40.控制变量是科学探究的重要方法之一. ( http: / / www.21cnjy.com )小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
温度(℃) 20 30 40 50 60 70 80
溶解度(g) 31.6 45.8 63.9 85.5 110 138 168
(1)建立假设: 温度影响硝酸钾溶解快慢 ;
(2)实施方案:
a. 取两只小烧杯分别加入2 ( http: / / www.21cnjy.com )g硝酸钾 ;b. 在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水 ;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果 热水中的硝酸钾溶解的快 ;
实验中,控制不变的因素是 硝酸钾的质量、水的体积 (至少写出2点).
【分析】根据题干提供的信息结合已有的知识进行分析解答,要设计实验证明溶解的快慢因素,需要控制变量,据此解答.
【解答】解:(1)由表格信息可知,温度越高硝酸钾的溶解度越大,所以可能影响硝酸钾溶解快慢的因素是温度,故填:温度影响硝酸钾溶解快慢;
(2)设计实验时,应该称 ( http: / / www.21cnjy.com )量相同质量的硝酸钾,分别放入到盛有相同体积的但是温度不同的水的烧杯中,比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;故填:取两只小烧杯分别加入2g硝酸钾;在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水;
(3)在盛有热水的烧杯中的硝酸钾最先完全 ( http: / / www.21cnjy.com )溶解,在该实验中控制不变的量有硝酸钾的质量以及水的体积;故填:热水中的硝酸钾溶解的快;硝酸钾的质量、水的体积.
【点评】熟记影响固体在水中的溶解速度因素:温度、搅拌、颗粒大小.知道它们的具体影响过程.
41.某化学兴趣小组探究氯化铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化.
【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验 水的体积 所加物质 测量液体温度(℃)
实验1 50mL 氯化铵 15
实验2 50mL 氯化钙 28
实验3 X 氯化钠 21
实验4 50mL 无 22
【数据分析】
(1)表中X为 50 mL.
(2)比较实验2与实验4,可获得的结论是 氯化钙溶解过程中放热 .
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 NH4Cl .
【反思评价】
(4)经讨论认为本实验操作中存在缺陷,它是 AB (填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样.
【分析】【数据分析】
(1)实验目的是探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此水的量要控制;
(2)比较实验2与实验4,即可得到物质溶于水时的吸放热情况.
(3)根据题中信息可知所选的物质需溶解时吸热.
【反思提升】
(4)A.实验操作过程中若保温措施不行会影响实验效果;
B.加入物质的质量必须相等,否则影响实验效果;
C.探究的就是NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此加入物质的种类不会影响实验.
【解答】【数据分析】
(1)实验目的是探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化,因此水的量要控制,所以X=50mL,故答案为:50.
(2)比较实验2与实验4,往水中加入氯化钙后,温度升高,因此可获得结论是氯化钙溶解过程中放热,故答案为:氯化钙溶解过程中放热.
(3)如果要生产一种“冰袋”用于冷敷,说明这种物质溶解时吸热,从表中可以看出上述三种物质中氯化铵溶解时吸热,故答案为:NH4Cl.
【
