空气与生命(一)[下学期]
图片预览









文档简介
课件52张PPT。第二章复习(一)一、复习内容1、空气 2、氧气与氧化
3、化学反应与质量守恒 4、生物是怎样呼吸的二、复习重点
1、空气成分及其体积分数 2、氧气的性质及制取
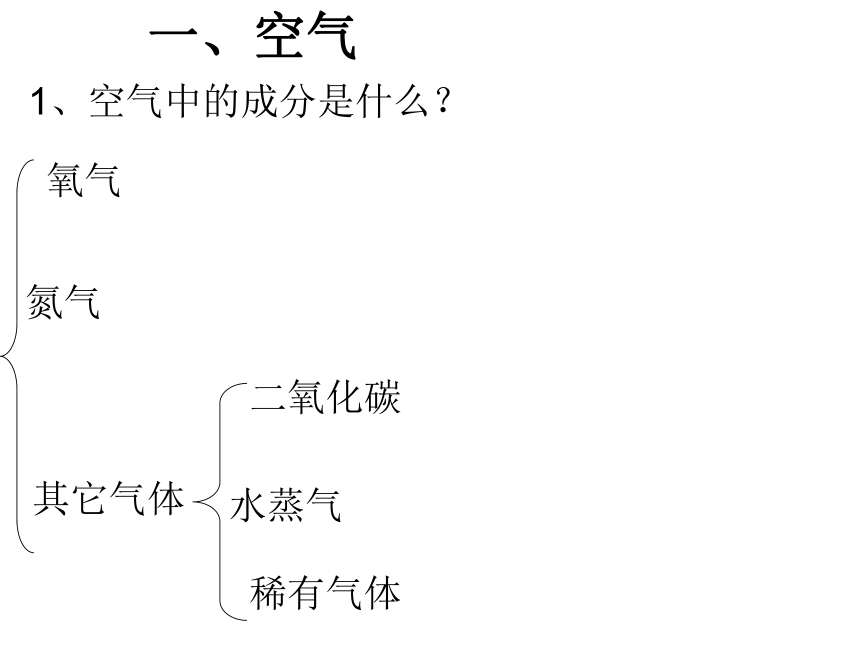
3、化学方程式及计算 4、生物的呼吸1、空气中的成分是什么?氧气氮气其它气体二氧化碳水蒸气稀有气体一、空气一百份体积的空气2、空气的组成(体积分数)氧气(O2)
21%氮气(N2) 78%如何探究空气中氧气的体积分数?实验装置:
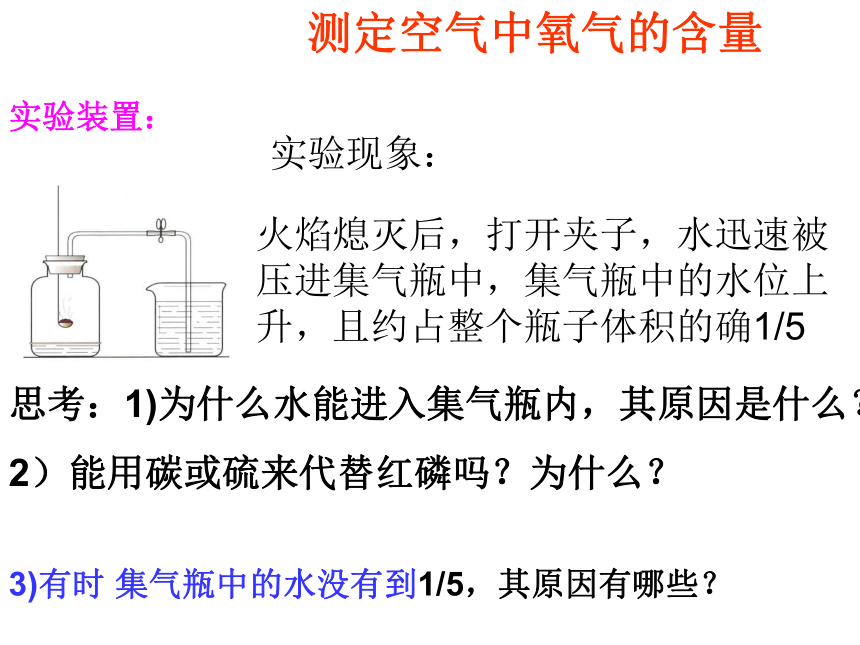
测定空气中氧气的含量 实验现象:火焰熄灭后,打开夹子,水迅速被压进集气瓶中,集气瓶中的水位上升,且约占整个瓶子体积的确1/5
思考:1)为什么水能进入集气瓶内,其原因是什么?
2)能用碳或硫来代替红磷吗?为什么?3)有时 集气瓶中的水没有到1/5,其原因有哪些?空气的体积成分
空
气
的
组
成
成
分
氧 气二氧化碳氮 气稀有气体其他气体三、空气的应用(21%)(78%)稀有气体用于飞艇、闪光灯、液氦冷冻机、霓虹灯等
空气是一种重要的天然资源01、对于空气的叙述正确的是 ( )
A 空气中含量最高的是氧气
B 空气是由几种单质组成的混合物
C 空气是由氮和氧两种元素组成的混合物
D 空气是由几种单质和几种化合物组成的混合物
2、空气中氮气与氧气的体积比约是( )
A1:4 B5:4 C4:1 D5:1
3、要除去密闭容器中空气里的氧气,最好选用下列哪种物质在其中燃烧( )
A 铁丝 B 硫黄 C 木炭 D 红磷
4、空气的成分按体积计算最多的是___ _,其次是 ;
(05金华)将足量的下列物质分别放在燃烧匙上点燃(或灼烧),分别放入四只图示装置的广口瓶中,立即塞紧橡皮塞,反应结束待冷却后,打开止水夹,导管中水柱上升最少的是放入哪种物质的装置?( ) A.铁粉 B.磷 C.木炭 D.镁氧气是一种_____色____味的气体。____溶于水,密度比空气____, -183℃时液化成____________,
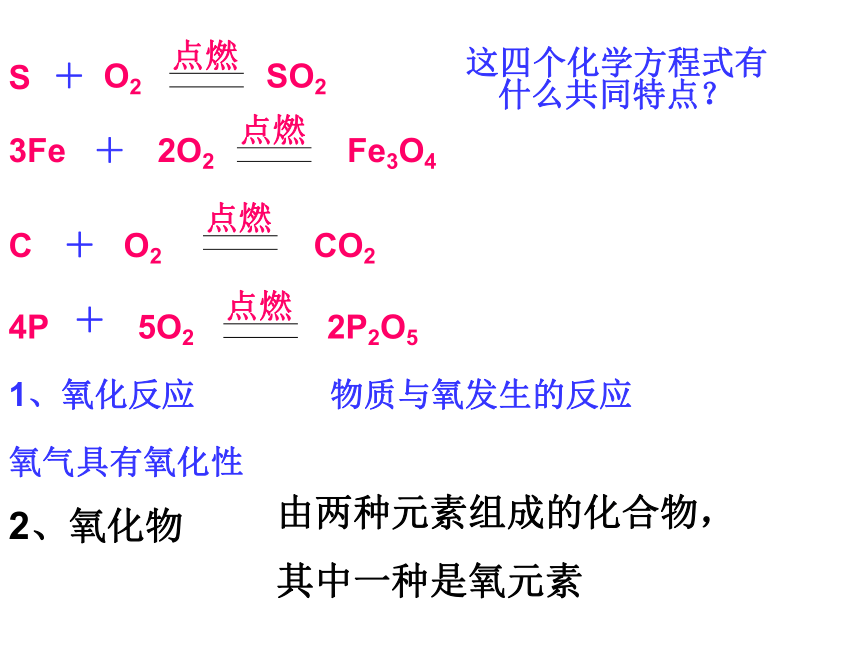
-218 ℃变成___________________。无无不易略大淡蓝色液体雪花状的蓝色固体二、氧气与氧化1、氧气的性质1)、物理性质2、氧气的化学性质氧气分别与硫、铁、磷、碳发生反应的现象与化学方程式记住反应的现象掌握正确的闻气体的方法与硫的反应硫在空气中燃烧发出___________色火焰硫在纯氧中燃烧发出_____________色火焰,反应后生成一种具有___________气味的二氧化硫(化学式为_______),微弱的淡蓝明亮的蓝紫色刺激性SO2化学方程式铁丝在纯氧气_________________________放出______生成一种___色的固体四氧化三铁(化学式为_______).化学方程式想一想:为什么要在集气瓶底部预先放些水或细沙?剧烈燃烧,火星四射热量黑Fe3O4防止生成的熔化物溅落而炸裂瓶底.木炭在氧气中燃烧的现象: 木炭在氧气中燃烧更旺,发出白光,放出热量,生成一种使澄清石灰水变浑浊的气体.红磷在氧气中燃烧的现象:红磷在氧气中燃烧发出白光,冒出白烟,放出热量.这四个化学方程式有什么共同特点?1、氧化反应物质与氧发生的反应氧气具有氧化性2、氧化物由两种元素组成的化合物,
其中一种是氧元素氧化还原反应还原剂:在化学反应过程得到氧的反应物,具有还原性如 C、CO 、 H2氧化剂:在化学反应过程的失去氧的反应物,
具有氧化性
如:CO2 CuO思考下列反应哪个是氧化还原反应吗?如果是,请指出氧化剂与还原剂?1)3C+2Fe2O3==4Fe+3CO22) 3CO+Fe2O3==4Fe+3CO2
3) 2H2+O2===2H2O4) 2Al+Fe2O3==2Fe+Al2O35) H2+CuO==H2O+Cu点燃1)、缓慢氧化请列举相关的例子如:金属生锈、动植物体的腐烂、动植物的呼吸作用动物的呼吸作用2)、燃烧(剧烈氧化现象)可燃物燃烧的条件:
① 温度要达到着火点
②可燃物跟氧气充分接触同时满足为生物的生命活动提供能量。爆炸灭火与火灾自救灭火方法:消除燃烧发生的条件的任何一个①隔绝空气
②把可燃物的温度降低到着火点以下酒精灯用灯帽灭火
火柴点燃后,放到水中灭火
厨房里锅着火用盖子灭火方法隔绝空气没有充足的氧气,温度不够高隔绝空气思考:酒精、汽油等液态物质着火,能不能用水,
为什么?灭火的常用方法:覆盖灭火
二氧化碳灭火器
水隔绝空气降低温度练习:燃烧与缓慢氧化的比较相同点不同点都是氧化反应都能放热缓慢氧化速率缓慢,不能发光燃烧反应速率剧烈,能发光5、下列有关氧气的说法错误的是( ) A、氧气在常温下是无色无味的气体 B、相同条件下,氧气的密度比空气大 C、实验室里收集氧气常用排水法 D、硫在氧气里燃烧发出淡蓝色火焰 6、下列物质不属于氧化物的是( ) A、H2O B、H2O2 C、P2O5 D、CaCO3 6、既包含缓慢氧化,又包含剧烈氧化的变化是( ) A、汽油遇火燃烧 B、食物腐败 C、白磷自燃 D、铁生锈 8、下列关于燃烧的叙述错误的是( ) A,燃烧时有发光放热现象 B、有发光放热现象的一定是燃烧 C、燃烧一定是氧化反应 D、温度低于可燃物的着火点就不可能燃烧 8、下列物质在氧气中燃烧,集气瓶内需预先假如少量细纱或水的是( ) A. 硫 B.铁丝 C.木炭 D.红磷 9、要除去密闭容器中空气中的氧气,得到较纯净的氮气,可用燃烧除氧气的方法,下列物质中可选用的是 A.硫 B.木炭 C.红磷 D.蜡烛10.已知白磷的着火点为40℃,下列实验中自磷能够燃烧的是11、炒菜时若锅里的油因过热而起火,最佳的灭火措施是 A、往锅里加水 B、往锅里撤沙子 C、立即端锅离火 D、盖上锅盖 12、在一个标准大气压下,下列关于氧气性质的叙述正确的是( ) A. 易溶于水 B.密度比空气略小 C.在-183℃时变为淡蓝色液体 D.在-218℃时变为白色固体13、空气中体积分数占78%的气体是( )
(A)氧气 (B)氮气
(C)二氧化碳 (D)稀有气体空气多次压缩降温液态空气低温蒸发-196℃氮气液氧沸点-196℃沸点-183℃N2O2物理变化三、化学反应与质量守恒1、氧气的制取氧气的工业制法氧气的实验室制法1)制取的(原理)化学方程式分解反应2)、催化剂像二氧化锰那样,在反应中只起到改变(加快或减慢)其它物质的反应速率,本身的质量和化学性质在反应前后都不变的物质
(一变二不变)在实验室制取氧气的过程中二氧化锰是加快反应速率3)收集方法A、排水法X要求:气体不易溶于水B、向上排空气法X操作:瓶口朝上,要求:密度大于空气密度C、向下排空气法操作:瓶口朝下,要求:密度小于空气密度4)实验仪器方法二:加热高锰酸钾(氯酸钾)法方法一:分解双氧水法左为发生装置,右为收集装置思考:这两个发生装置适用于什么条件?5)实验过程检:检查装置的气密性装:装药品夹:将烧瓶夹到铁架台上开:打开分液漏斗的开关收:用合适的方法收集氧气移:从水槽中移出导管关:关上开关加热高锰酸钾(氯酸钾)法步骤:检、装、夹、点、收、移、熄检:检验装置的气密性装:往试管里装药品夹:把试管夹在铁架台上点:点燃酒精灯,给药品加热收:用排水法收集氧气移:从水槽中移出导管熄:熄灭酒精灯讨论1、利用图示信息讨论夹试管的时候要注意什么?2、收集满氧气后,为什么要先从水槽中移出导管,再熄灭酒精灯?试管口应略低于试管底(试管口略向下倾斜)铁夹夹在离管口约1/3至1/4处?防止水倒流入试管底部而使试管破裂如果先熄灭酒精灯,试管内压强减小,水槽中的水会倒吸入试管,使试管破裂。应注意些什么6)、在什么时候开始收集氧气?当导管口的气泡连续、均匀地放出后开始收集7)、用高锰酸钾制取氧气的时候应注意什么?在试管口塞入一团棉花,防止高锰酸钾颗粒堵塞导管8)、如何证明集气瓶中的氧气已经收满?用带火星的木条放在集气瓶口 14、如图是实验室里用过氧化氢和二氧化锰来制取少量氧气的装置图
1)、如图,写出下列氧气的仪器装置名称;
① ② ③ ④ ⑤ ,
①②③④⑤2)、写出装置中所发生的反应化学表达式:
。3)、图中采用 法收集氧气,因为氧气具有 的性质,又由于氧气 ,所以氧气也可用 法收集。15、下列反应中,属于分解反应的是( )A.C+O2==CO2 B、2KClO3 == 2KCl+3O2↑ C.Zn+ H2SO4 = ZnSO4+H2↑ D.HCl + NaOH=NaCl+H2O16、判断题
1)二氧化锰是一种催化剂( )
2)催化剂就是二气化锰( )
3)催化剂能加快其它物质的化学反应速率( )
4)催化剂在反应前后,本身的质量与性质都不变化( )
5)催化剂在反应中一定不参加反应( )
17、某气体即能用排水法又能用向上排空气法收集,该气体具有的性质是( ) A难溶于水,密度比空气小 B难溶于水,密度比空气大 C易溶于水,密度比空气小 D易溶于不,密度比空气大 18、 实验室在用过氧化氢制取氧气时,忘记了 加入二氧化锰,其结果是( ) A不能产生氧气 B生成氧气的速度很慢 C产生氧气的总量减小 D生成了氢气和氧气18、实验室里在制取氧气时,装置连接顺序是 A从下到上,从左到右 B从上到下,从左到右 C从下到上,从右到左 D从下到上,从右到左 19、一氧化氮在常温下是一种气体,它难溶于水,密度比空气略大,能跟空气中的氧气迅速反应生成二氧化氮,现要收集一瓶一氧化氮气体,应采用的方法是( ) A.向上排气法 B.排水法 C.向下排气法 D.无法确定 20、在化学反应中,使用适当的催化剂 ,可以( ) A改变化学反应的速率 B增加生成物的量 C加快化学反应速率 D减慢化学反应速率 21、实验室用高锰酸钾制取并用排水法收集氧气时,下列操作错误的是( )
A试管口略向上倾斜
B药品铺在试管底部,扩大受热面积
C先使试管均匀受热,再集中加热
D集满气体后,先把导管移出水面,再停止加热。22、下图是实验室用高锰酸钾制取和收集氧气装置图
1)指出此装置的三处错误: 、 、
。
2)实验的正确顺序是 。A、给试管加热 B、用排水法收集氧气 C、熄灭酒精灯
D、装高锰酸钾于试管 E、将导管移出水面 F、检查装置的气密性
G、把试管固定,集气瓶注满水倒置在水槽中3)完全反应后,试管中的残留固体是 . 23、双氧水是过氧化氢(H2O2)的水溶液,常用于消毒、漂白等。实验室也常用它来制取氧气,反应的化学方程式为2 H2O2 2H2O+O2↑。用这种方法制得的氧气中往往含有少量的水汽。欲制得干燥的氧气,两位同许分别设计了如图甲、乙所示的实验装置
(A中盛有MnO2、B中盛有浓H2SO4、C中盛有无水CuSO4)。
你认为 (填“甲”或“乙”)装置较为合理。装置C的作用主要是 。24、现有如图所示的实验装置。请回答有关问题: ⑴写出实验室用氯酸钾和二氧化锰混合加热制取氧气的化学方程式 。 ⑵装置C可用来检验出CO气体中混有的CO2,请写出检验时产生的实验现象 。 ⑶现有稀H2SO4、CuO、Fe粉三种物质,利用上述装置进行连接后能否制得铜(若能,请选出所需装置的编号;若不能,则说明原因) 。2、质量守恒定律1)什么是质量守恒定律在化学反应中,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2)如何用分子、原子的观点去解释质量守恒定律
在一切化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也就没有变化。只是分子种类发生改变31、 下列能质量守恒定律解释的是( ) A a克水受热形成a克水蒸气 B铁在氧气中燃烧,生成物的质量比铁的质量大 C 10克食盐溶于70克水得到食盐水 D 湿衣服晾干后,质量变小 32、在化学反应前后,一定不变的是( ) ⑴原子的数目 ⑵分子的数目 ⑶分子种类 ⑷物质种类 ⑸物质质量总和 ⑹相对原子质量 ⑺相对分子质量 ⑻元素种类 A. ⑸⑻ B. ⑴⑸⑹⑻ C. ⑴⑵⑹⑸ D. ⑴⑸ 33、某化合物在空气中燃烧后只生成二氧化碳和水,判断该化合物中一定含有 元素,可能含有 元素。 34、根据质量守恒定律推断 2XY2+Y2 = 2Z 中 Z 的化学式为 。 35、 在化学反应前后可能发生改变的是( ) A元素种类 B各物质的质量总和 C原子总数 D分子总数 37、X+2O2=CO2+2H2O在的反应中,根据质量守恒定律可判断的化学式为( ) A CH4 B C2H5OH C CH3OH D CO 3、化学方程式及其计算原则:以客观事实为依据
遵守质量守恒定律质量守恒定律的本质:在一切化学反应中,反应前后 、 没有改变, 没有增减,原子的质量也就没有变化。元素种类原子种类原子数目1)它有什么规则呢?2)化学方程式的意义说出下列化学方程式的意义2CO+O2 2CO2点燃一氧化碳与氧气参加反应生成二氧化碳各物质的分子个数比
CO:O2:CO2(个数)=2:1:2各物质的质量比
CO:O2:CO2(质量)=56:32:88表示这个反应在点燃的条件下进行化学方程式配平**奇数配偶法:在等式两边找出是一奇一偶的原子,把较大奇数的原子配成偶数。4233)、书写化学方程式配平下列化学方程式:22222263332实验室里用分解过氧化氢的方法制取氧气。现要制得8克氧气,需要多少克过氧化氢?解:设需要过氧化氢的质量为m.2×(1×2+16×2)16×2m8克答:需要过氧化氢17克。4)、根据化学方程式的计算
第一步第二步第三步第四步第五步
根据化学方程式进行计算的步骤(1)设未知数 ……………....…设 (2)写出化学方程式 …...….写 (3) 写出相应已知物与待求物的相对分 量...…… … …… …求(4) 列比例式,求解 …...….…..列(5) 简明地写出答案 ….…...答练习一:
(1)加热分解4.9克氯酸钾,可以得到多少克氧气?解:设:需要氯酸钾的质量为X。2KClO3======MnO22KCl+3O224596△↑4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克. (2) .制取4.8克氧气,需要氯酸钾多少克?(根据生成物求反应物的质量)(06省卷)如图是两套实验室常用的气体制取装置。请回答:
(1)实验室用稀盐酸和石灰石制取二氧化碳时,应采
用 装置;若实验室用加热无水醋酸钠和碱石灰固体混合物来制取甲烷时,应采用 装置。
(2)如果用73克溶质质量分数为10%的稀盐酸和足量石灰石反应制取二氧化碳,其化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑。求:
①反应前稀盐酸中氯化氢的质量是 克。
②反应后生成的二氧化碳的质量(要求列式计算 将氯酸钾和二氧化锰的混合物22.5g加热,完全反应后,冷却,称得剩余固体为17.7 g , 求:
(1)制得氧气多少克?
(2)原混合物中氯酸钾的质量为多少克?思考题过量计算2019-3-31把一定量的碳放在一定量的氧气中燃烧.实验数据如下1)从以所提供的数据分析,这三次有什么不同?
2)第二次实验为什么不生成28克CO2,哪种物质有剩余?余下多少克?(提示:根据化学方程式来计算)
3)第三次为什么不生成30克CO2?哪种物质有剩余?余下多少?
3、化学反应与质量守恒 4、生物是怎样呼吸的二、复习重点
1、空气成分及其体积分数 2、氧气的性质及制取
3、化学方程式及计算 4、生物的呼吸1、空气中的成分是什么?氧气氮气其它气体二氧化碳水蒸气稀有气体一、空气一百份体积的空气2、空气的组成(体积分数)氧气(O2)
21%氮气(N2) 78%如何探究空气中氧气的体积分数?实验装置:
测定空气中氧气的含量 实验现象:火焰熄灭后,打开夹子,水迅速被压进集气瓶中,集气瓶中的水位上升,且约占整个瓶子体积的确1/5
思考:1)为什么水能进入集气瓶内,其原因是什么?
2)能用碳或硫来代替红磷吗?为什么?3)有时 集气瓶中的水没有到1/5,其原因有哪些?空气的体积成分
空
气
的
组
成
成
分
氧 气二氧化碳氮 气稀有气体其他气体三、空气的应用(21%)(78%)稀有气体用于飞艇、闪光灯、液氦冷冻机、霓虹灯等
空气是一种重要的天然资源01、对于空气的叙述正确的是 ( )
A 空气中含量最高的是氧气
B 空气是由几种单质组成的混合物
C 空气是由氮和氧两种元素组成的混合物
D 空气是由几种单质和几种化合物组成的混合物
2、空气中氮气与氧气的体积比约是( )
A1:4 B5:4 C4:1 D5:1
3、要除去密闭容器中空气里的氧气,最好选用下列哪种物质在其中燃烧( )
A 铁丝 B 硫黄 C 木炭 D 红磷
4、空气的成分按体积计算最多的是___ _,其次是 ;
(05金华)将足量的下列物质分别放在燃烧匙上点燃(或灼烧),分别放入四只图示装置的广口瓶中,立即塞紧橡皮塞,反应结束待冷却后,打开止水夹,导管中水柱上升最少的是放入哪种物质的装置?( ) A.铁粉 B.磷 C.木炭 D.镁氧气是一种_____色____味的气体。____溶于水,密度比空气____, -183℃时液化成____________,
-218 ℃变成___________________。无无不易略大淡蓝色液体雪花状的蓝色固体二、氧气与氧化1、氧气的性质1)、物理性质2、氧气的化学性质氧气分别与硫、铁、磷、碳发生反应的现象与化学方程式记住反应的现象掌握正确的闻气体的方法与硫的反应硫在空气中燃烧发出___________色火焰硫在纯氧中燃烧发出_____________色火焰,反应后生成一种具有___________气味的二氧化硫(化学式为_______),微弱的淡蓝明亮的蓝紫色刺激性SO2化学方程式铁丝在纯氧气_________________________放出______生成一种___色的固体四氧化三铁(化学式为_______).化学方程式想一想:为什么要在集气瓶底部预先放些水或细沙?剧烈燃烧,火星四射热量黑Fe3O4防止生成的熔化物溅落而炸裂瓶底.木炭在氧气中燃烧的现象: 木炭在氧气中燃烧更旺,发出白光,放出热量,生成一种使澄清石灰水变浑浊的气体.红磷在氧气中燃烧的现象:红磷在氧气中燃烧发出白光,冒出白烟,放出热量.这四个化学方程式有什么共同特点?1、氧化反应物质与氧发生的反应氧气具有氧化性2、氧化物由两种元素组成的化合物,
其中一种是氧元素氧化还原反应还原剂:在化学反应过程得到氧的反应物,具有还原性如 C、CO 、 H2氧化剂:在化学反应过程的失去氧的反应物,
具有氧化性
如:CO2 CuO思考下列反应哪个是氧化还原反应吗?如果是,请指出氧化剂与还原剂?1)3C+2Fe2O3==4Fe+3CO22) 3CO+Fe2O3==4Fe+3CO2
3) 2H2+O2===2H2O4) 2Al+Fe2O3==2Fe+Al2O35) H2+CuO==H2O+Cu点燃1)、缓慢氧化请列举相关的例子如:金属生锈、动植物体的腐烂、动植物的呼吸作用动物的呼吸作用2)、燃烧(剧烈氧化现象)可燃物燃烧的条件:
① 温度要达到着火点
②可燃物跟氧气充分接触同时满足为生物的生命活动提供能量。爆炸灭火与火灾自救灭火方法:消除燃烧发生的条件的任何一个①隔绝空气
②把可燃物的温度降低到着火点以下酒精灯用灯帽灭火
火柴点燃后,放到水中灭火
厨房里锅着火用盖子灭火方法隔绝空气没有充足的氧气,温度不够高隔绝空气思考:酒精、汽油等液态物质着火,能不能用水,
为什么?灭火的常用方法:覆盖灭火
二氧化碳灭火器
水隔绝空气降低温度练习:燃烧与缓慢氧化的比较相同点不同点都是氧化反应都能放热缓慢氧化速率缓慢,不能发光燃烧反应速率剧烈,能发光5、下列有关氧气的说法错误的是( ) A、氧气在常温下是无色无味的气体 B、相同条件下,氧气的密度比空气大 C、实验室里收集氧气常用排水法 D、硫在氧气里燃烧发出淡蓝色火焰 6、下列物质不属于氧化物的是( ) A、H2O B、H2O2 C、P2O5 D、CaCO3 6、既包含缓慢氧化,又包含剧烈氧化的变化是( ) A、汽油遇火燃烧 B、食物腐败 C、白磷自燃 D、铁生锈 8、下列关于燃烧的叙述错误的是( ) A,燃烧时有发光放热现象 B、有发光放热现象的一定是燃烧 C、燃烧一定是氧化反应 D、温度低于可燃物的着火点就不可能燃烧 8、下列物质在氧气中燃烧,集气瓶内需预先假如少量细纱或水的是( ) A. 硫 B.铁丝 C.木炭 D.红磷 9、要除去密闭容器中空气中的氧气,得到较纯净的氮气,可用燃烧除氧气的方法,下列物质中可选用的是 A.硫 B.木炭 C.红磷 D.蜡烛10.已知白磷的着火点为40℃,下列实验中自磷能够燃烧的是11、炒菜时若锅里的油因过热而起火,最佳的灭火措施是 A、往锅里加水 B、往锅里撤沙子 C、立即端锅离火 D、盖上锅盖 12、在一个标准大气压下,下列关于氧气性质的叙述正确的是( ) A. 易溶于水 B.密度比空气略小 C.在-183℃时变为淡蓝色液体 D.在-218℃时变为白色固体13、空气中体积分数占78%的气体是( )
(A)氧气 (B)氮气
(C)二氧化碳 (D)稀有气体空气多次压缩降温液态空气低温蒸发-196℃氮气液氧沸点-196℃沸点-183℃N2O2物理变化三、化学反应与质量守恒1、氧气的制取氧气的工业制法氧气的实验室制法1)制取的(原理)化学方程式分解反应2)、催化剂像二氧化锰那样,在反应中只起到改变(加快或减慢)其它物质的反应速率,本身的质量和化学性质在反应前后都不变的物质
(一变二不变)在实验室制取氧气的过程中二氧化锰是加快反应速率3)收集方法A、排水法X要求:气体不易溶于水B、向上排空气法X操作:瓶口朝上,要求:密度大于空气密度C、向下排空气法操作:瓶口朝下,要求:密度小于空气密度4)实验仪器方法二:加热高锰酸钾(氯酸钾)法方法一:分解双氧水法左为发生装置,右为收集装置思考:这两个发生装置适用于什么条件?5)实验过程检:检查装置的气密性装:装药品夹:将烧瓶夹到铁架台上开:打开分液漏斗的开关收:用合适的方法收集氧气移:从水槽中移出导管关:关上开关加热高锰酸钾(氯酸钾)法步骤:检、装、夹、点、收、移、熄检:检验装置的气密性装:往试管里装药品夹:把试管夹在铁架台上点:点燃酒精灯,给药品加热收:用排水法收集氧气移:从水槽中移出导管熄:熄灭酒精灯讨论1、利用图示信息讨论夹试管的时候要注意什么?2、收集满氧气后,为什么要先从水槽中移出导管,再熄灭酒精灯?试管口应略低于试管底(试管口略向下倾斜)铁夹夹在离管口约1/3至1/4处?防止水倒流入试管底部而使试管破裂如果先熄灭酒精灯,试管内压强减小,水槽中的水会倒吸入试管,使试管破裂。应注意些什么6)、在什么时候开始收集氧气?当导管口的气泡连续、均匀地放出后开始收集7)、用高锰酸钾制取氧气的时候应注意什么?在试管口塞入一团棉花,防止高锰酸钾颗粒堵塞导管8)、如何证明集气瓶中的氧气已经收满?用带火星的木条放在集气瓶口 14、如图是实验室里用过氧化氢和二氧化锰来制取少量氧气的装置图
1)、如图,写出下列氧气的仪器装置名称;
① ② ③ ④ ⑤ ,
①②③④⑤2)、写出装置中所发生的反应化学表达式:
。3)、图中采用 法收集氧气,因为氧气具有 的性质,又由于氧气 ,所以氧气也可用 法收集。15、下列反应中,属于分解反应的是( )A.C+O2==CO2 B、2KClO3 == 2KCl+3O2↑ C.Zn+ H2SO4 = ZnSO4+H2↑ D.HCl + NaOH=NaCl+H2O16、判断题
1)二氧化锰是一种催化剂( )
2)催化剂就是二气化锰( )
3)催化剂能加快其它物质的化学反应速率( )
4)催化剂在反应前后,本身的质量与性质都不变化( )
5)催化剂在反应中一定不参加反应( )
17、某气体即能用排水法又能用向上排空气法收集,该气体具有的性质是( ) A难溶于水,密度比空气小 B难溶于水,密度比空气大 C易溶于水,密度比空气小 D易溶于不,密度比空气大 18、 实验室在用过氧化氢制取氧气时,忘记了 加入二氧化锰,其结果是( ) A不能产生氧气 B生成氧气的速度很慢 C产生氧气的总量减小 D生成了氢气和氧气18、实验室里在制取氧气时,装置连接顺序是 A从下到上,从左到右 B从上到下,从左到右 C从下到上,从右到左 D从下到上,从右到左 19、一氧化氮在常温下是一种气体,它难溶于水,密度比空气略大,能跟空气中的氧气迅速反应生成二氧化氮,现要收集一瓶一氧化氮气体,应采用的方法是( ) A.向上排气法 B.排水法 C.向下排气法 D.无法确定 20、在化学反应中,使用适当的催化剂 ,可以( ) A改变化学反应的速率 B增加生成物的量 C加快化学反应速率 D减慢化学反应速率 21、实验室用高锰酸钾制取并用排水法收集氧气时,下列操作错误的是( )
A试管口略向上倾斜
B药品铺在试管底部,扩大受热面积
C先使试管均匀受热,再集中加热
D集满气体后,先把导管移出水面,再停止加热。22、下图是实验室用高锰酸钾制取和收集氧气装置图
1)指出此装置的三处错误: 、 、
。
2)实验的正确顺序是 。A、给试管加热 B、用排水法收集氧气 C、熄灭酒精灯
D、装高锰酸钾于试管 E、将导管移出水面 F、检查装置的气密性
G、把试管固定,集气瓶注满水倒置在水槽中3)完全反应后,试管中的残留固体是 . 23、双氧水是过氧化氢(H2O2)的水溶液,常用于消毒、漂白等。实验室也常用它来制取氧气,反应的化学方程式为2 H2O2 2H2O+O2↑。用这种方法制得的氧气中往往含有少量的水汽。欲制得干燥的氧气,两位同许分别设计了如图甲、乙所示的实验装置
(A中盛有MnO2、B中盛有浓H2SO4、C中盛有无水CuSO4)。
你认为 (填“甲”或“乙”)装置较为合理。装置C的作用主要是 。24、现有如图所示的实验装置。请回答有关问题: ⑴写出实验室用氯酸钾和二氧化锰混合加热制取氧气的化学方程式 。 ⑵装置C可用来检验出CO气体中混有的CO2,请写出检验时产生的实验现象 。 ⑶现有稀H2SO4、CuO、Fe粉三种物质,利用上述装置进行连接后能否制得铜(若能,请选出所需装置的编号;若不能,则说明原因) 。2、质量守恒定律1)什么是质量守恒定律在化学反应中,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2)如何用分子、原子的观点去解释质量守恒定律
在一切化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也就没有变化。只是分子种类发生改变31、 下列能质量守恒定律解释的是( ) A a克水受热形成a克水蒸气 B铁在氧气中燃烧,生成物的质量比铁的质量大 C 10克食盐溶于70克水得到食盐水 D 湿衣服晾干后,质量变小 32、在化学反应前后,一定不变的是( ) ⑴原子的数目 ⑵分子的数目 ⑶分子种类 ⑷物质种类 ⑸物质质量总和 ⑹相对原子质量 ⑺相对分子质量 ⑻元素种类 A. ⑸⑻ B. ⑴⑸⑹⑻ C. ⑴⑵⑹⑸ D. ⑴⑸ 33、某化合物在空气中燃烧后只生成二氧化碳和水,判断该化合物中一定含有 元素,可能含有 元素。 34、根据质量守恒定律推断 2XY2+Y2 = 2Z 中 Z 的化学式为 。 35、 在化学反应前后可能发生改变的是( ) A元素种类 B各物质的质量总和 C原子总数 D分子总数 37、X+2O2=CO2+2H2O在的反应中,根据质量守恒定律可判断的化学式为( ) A CH4 B C2H5OH C CH3OH D CO 3、化学方程式及其计算原则:以客观事实为依据
遵守质量守恒定律质量守恒定律的本质:在一切化学反应中,反应前后 、 没有改变, 没有增减,原子的质量也就没有变化。元素种类原子种类原子数目1)它有什么规则呢?2)化学方程式的意义说出下列化学方程式的意义2CO+O2 2CO2点燃一氧化碳与氧气参加反应生成二氧化碳各物质的分子个数比
CO:O2:CO2(个数)=2:1:2各物质的质量比
CO:O2:CO2(质量)=56:32:88表示这个反应在点燃的条件下进行化学方程式配平**奇数配偶法:在等式两边找出是一奇一偶的原子,把较大奇数的原子配成偶数。4233)、书写化学方程式配平下列化学方程式:22222263332实验室里用分解过氧化氢的方法制取氧气。现要制得8克氧气,需要多少克过氧化氢?解:设需要过氧化氢的质量为m.2×(1×2+16×2)16×2m8克答:需要过氧化氢17克。4)、根据化学方程式的计算
第一步第二步第三步第四步第五步
根据化学方程式进行计算的步骤(1)设未知数 ……………....…设 (2)写出化学方程式 …...….写 (3) 写出相应已知物与待求物的相对分 量...…… … …… …求(4) 列比例式,求解 …...….…..列(5) 简明地写出答案 ….…...答练习一:
(1)加热分解4.9克氯酸钾,可以得到多少克氧气?解:设:需要氯酸钾的质量为X。2KClO3======MnO22KCl+3O224596△↑4.8克X245X4.8克96=--------------X = --------------4.8克×24596= 12.25克答:需要氯酸钾12.25克. (2) .制取4.8克氧气,需要氯酸钾多少克?(根据生成物求反应物的质量)(06省卷)如图是两套实验室常用的气体制取装置。请回答:
(1)实验室用稀盐酸和石灰石制取二氧化碳时,应采
用 装置;若实验室用加热无水醋酸钠和碱石灰固体混合物来制取甲烷时,应采用 装置。
(2)如果用73克溶质质量分数为10%的稀盐酸和足量石灰石反应制取二氧化碳,其化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑。求:
①反应前稀盐酸中氯化氢的质量是 克。
②反应后生成的二氧化碳的质量(要求列式计算 将氯酸钾和二氧化锰的混合物22.5g加热,完全反应后,冷却,称得剩余固体为17.7 g , 求:
(1)制得氧气多少克?
(2)原混合物中氯酸钾的质量为多少克?思考题过量计算2019-3-31把一定量的碳放在一定量的氧气中燃烧.实验数据如下1)从以所提供的数据分析,这三次有什么不同?
2)第二次实验为什么不生成28克CO2,哪种物质有剩余?余下多少克?(提示:根据化学方程式来计算)
3)第三次为什么不生成30克CO2?哪种物质有剩余?余下多少?
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
