科学第四册第二章(第3节)A 06年3月16日[下学期]
文档属性
| 名称 | 科学第四册第二章(第3节)A 06年3月16日[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 182.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2006-05-08 00:00:00 | ||
图片预览



文档简介
科学第四册第二章(第3节)A 06年3月16日
班级 姓名 学号
可能用到的相对原子质量:H-1,C-12,O-16,N-14,Cl-35.5,Fe-56,Mg-24,P-31,S-32, K-39,Mn-55,Hg-200,Al-27,Zn-65。
一.选择题
1.已知A物质发生分解反应生成B物质和C物质(用A=B+C表示),当一定量A反应片刻后,生成56克B和44克C,则实际发生分解的A物质是 ( )
A.12克 B.44克 C.56克 D.100克
2.根据已配平的化学方程式A+5O2==3CO2+4H2O可推测A的化学式是 ( )
A.CH4 B.C2H4 C.C3H6 D.C3H8
3.某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是 ( )
A.一定含有碳、氢元素,但肯定不含氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素 D.一定含有碳、氧元素,可能含有氢元素
4.液化气中一种主要成分是C2H6,其燃烧的化学方程式为xC2H6+7O2==4CO2+6H2O,根据质量守恒定律推断出x的值为 ( )
A.2 B.4 C.6 D.7
5.在化学反应A+B==C+D中,已知25克A与10克B恰好完全反应,生成5克C,当反应有6克D生成时,参加反应的A是 ( )
A.10g B.5g C.25g D.20g
6.某化合物完全燃烧,消耗2.9g氧气,生成8.8g二氧化碳和5.4g水,该化合物中 ( )
A.只含有碳和氢两种元素 B.含有碳、氢、氧三种元素
C.只含有碳氧两种元素 D.无法确定
7.根据质量守恒定律,镁条完全燃烧后,生成氧化镁的质量 ( )
A.小于镁条的质量 B.大于镁条的质量 C.等于镁条的质量 D.无法确定
8.关于质量守恒定律,下列叙述中正确的是 ( )
A.一切化学反应都遵从质量守恒定律 B.煤燃烧化为灰烬,该反应不符合质量守恒定律
C.质量守恒定律只适用于有气体或固体生成的化学反应
D.24克镁在空气中完全燃烧生成40克氧化镁,实际消耗空气质量为16克
9.12克镁和12克氧气反应,最多可得到氧化镁 ( )
A.16克 B.20克 C.24克 D.36克
10.根据质量守恒定律,在A2+3B2==2C中,C的化学式用A、B表示的是 ( )
A.AB2 B.AB3 C.A2B3 D.A3B2
11.在2H2+O2 点燃 ====2H2O的反应中,反应前后肯定发生变化的是 ( )
A.元素种类 B.物质的质量总和 C.各元素的化合价 D.各种原子的数目
12.已知反应3A+2B=2C+D,A.B两物质完全反应时,质量比为3∶4。若生成C和D共140g,则该反应消耗B的质量为 ( )
A.60g B.80g C.90g D.120g
13.下列叙述符合质量守恒定律的是 ( ) A.水加热变成水蒸气,变化前后质量相等 B.50ml水与50ml酒精混合不等于100ml
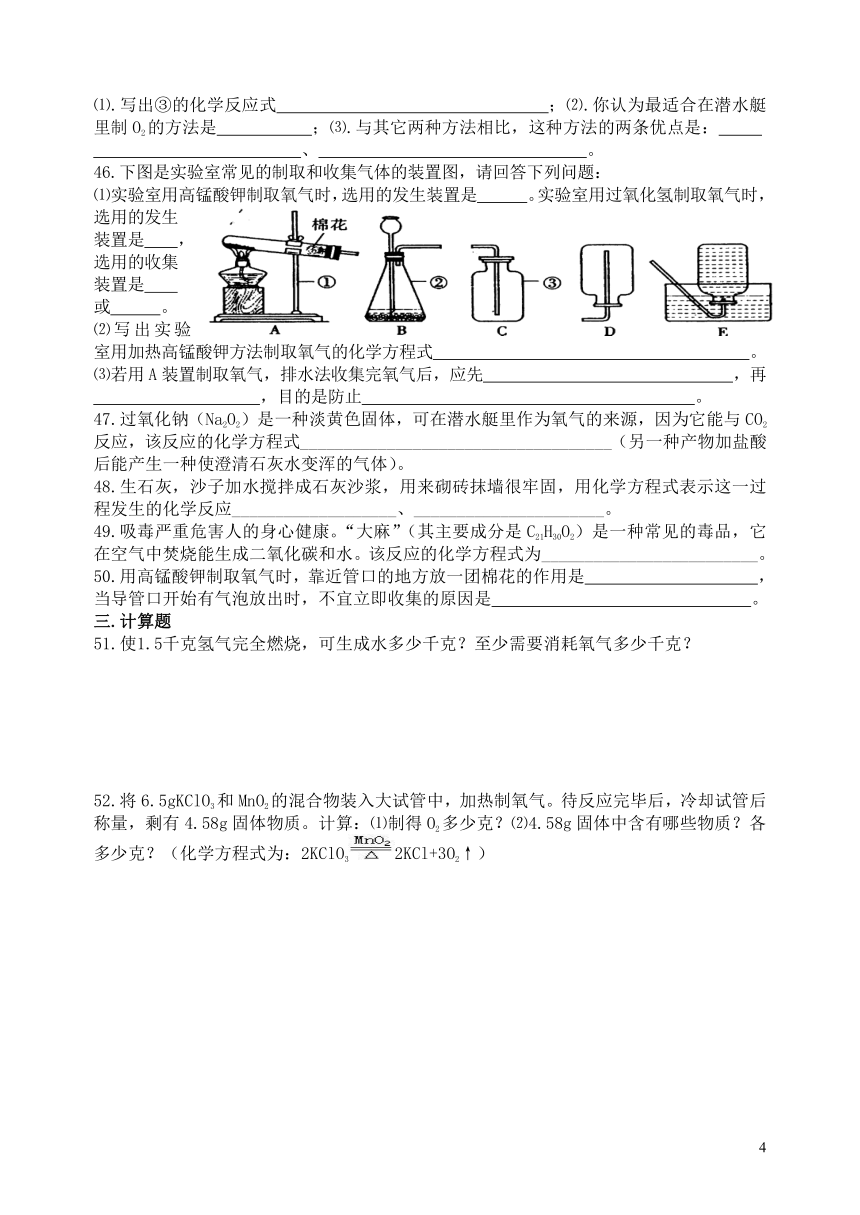
C.在90g水中含10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
14.等质量的碳、镁、铁分别在足量的氧气中充分燃烧,消耗氧气的质量比是 ( )
A.1∶4∶7 B.6∶3∶4 C.7∶4∶1 D.28∶7∶4
15.下列物质在一定条件下都会分解,生成氧气,若相同质量的下列物质完全分解,生成O2的质量最多的是 ( )
A.HgO B. KMnO4 C.H2O D. KClO3
16.已知化学反应:2A+B=C+D,7克的A与20克B恰好完全反应生成16克C,已知D的相对分子质量为44,则下列说法正确的是 ( )
A.B的相对分子质量是80 B.14克A参加反应一定可生成D22克
C.A的相对分子质量是28 D.A、B、C、D中C的相对分子质量最大
17.化学反应后,生成物的总质量与反应前反应物的总质量相等,因为 ( )
A.反应后物质的种类没有变化 B.反应后原子的种类和数目没有变化
C.反应后元素的种类没有变化 D.反应后分子的种类和数目没有变化
18.在3Fe+2O2 点燃 ===== Fe3O4的反应中,各物质之间质量比为 ( )
A.3∶2∶1 B.21∶8∶29 C.7∶8∶29 D.56∶32∶160
19.完全电解xg水能得到5mL氧气,同时得到氢气的质量和体积分别是 ( )
A.(8x/9)g,5mL B.(x/9)g,10mL C.xg,5mL D.xg,10mL
20.将24.5g氯酸钾与4.5g二氧化锰混合后,放入试管加热充分反应后,试管中剩余固体物质质量为 ( )
A.19.4g B.20g C.29g D.14.9g
21.化学方程式4P+5O2 点燃 ====2P2O5表示 ( )A.磷加氧气等于五氧化二磷 B.磷和氧气混合后生成五氧化二磷
C.在点燃条件下,4个磷原子与10个氧原子反应后,生成2个五氧化二磷分子
D.在点燃时,每4个磷原子与5个氧分子反应生成2个五氧化二磷分子
22.对于反应X2+3Y2=2Z,根据质量守恒定律,推知下列说法一定错误的是 ( ) A.Z的化学式为XY3,其质量等于参加反应的X2.Y2质量之和
B.若agX2和bgY2恰好完全反应,则生成(a+b)gZ
C.若X2的式量为a,Y2的式量为b,则Z的式量为(a+3b)
D.若agX2完全反应生成bgZ,则同时消耗(b-a)gY2
23.化学方程式配平后,有的时候不需要在等号上方注明反应条件,这表示 ( )A.此反应化学方程式不完整 B.此反应不能发生
C.此反应在通常条件下即可发生 D.此反应化学方程式不符合质量守恒定律
24.在化学反应4A+3B2=2AxBy中,x、y的数值是 ( )
A.4,6 B.2,3 C.1,2 D.1,1.5
25.书写锌与稀硫酸反应的化学方程式时不需要用到的条件符号是 ( )
A.“+ ” B.“=” C.“△” D.“↑”
26.用足量的氢气在加热条件下还原氧化铜,当完全反应后测得生成铜的质量为64克,则消耗掉氢气的质量 (CuO+H2 高温 ====Cu+H2O) ( )
A.小于2克 B.等于2克 C.大于2克 D.无法确定
27.有化学反应A+B=C+D,下列说法中正确的是 ( ) A.反应前后物质的分子总数不一定相等 B.A和B的质量比一定等于C和D的质量比
C.若A、C为单质,B、D为化合物,该反应不一定是置换反应
D.若A.B各取5g混合并使其反应,则C和D的质量总和一定等于10g
28.某二价金属2g与适量的稀H2SO4完全反应后得到10g硫酸盐,则该金属的相对原子质量是
A.65 B.56 C.24 D.23 ( )
29.在反应A2+2AB2==4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的相对分子质量之比为 ( )
A.3∶4 B.4∶3 C.1∶2 D.2∶1
30.下列化学反应方程式正确的是 ( ) A.C+O2CO2 B.Mg+O2MgO2 C.P2+O5P2O5 D.2Al+3O=Al2O3
31.铁在氯气中燃烧生成氯化铁,在这个反应中,铁、氯气、氯化铁的质量比为( ) A.112:213:325 B.56:71:127 C.56:71:162.5 D.112:142:325
32.某金属氧化物跟足量的盐酸反应,生成氯化物和水的分子数之比为2∶3,该金属元素的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
33.在3A+B=2C+D的化学反应中,12gA与3gB恰好完全反应,生成C和D的质量比为3∶2。当有8gB参加反应时,生成D的质量是 ( )
A.16g B.14g C.8g D.5g
34.质量相等的三种物质:①KClO3(另加少量催化剂)、②HgO、③KMnO4,充分加热分解后,产生氧气的质量由多到少的顺序是 ( )
A.①③② B.②③① C.①②③ D.③②①
35.现有化学反应:X+Y=Z,若将agX和bgY在一定条件下充分反应,生成物Z的质量( )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
二.填空题
36.在一切化学反应里,由于反应前后, 种类没有改变, 的数目没有增减,
的质量也没有变化,所以反应前后各物质的 必然相等。
37.完成并配平下列反应的化学方程式。
(1)□C2H6+□O2□CO2+□H2O (2)□NH3+□O2──□N2+□H2O
(3)□C+□Fe3O4□Fe+□CO2 (4)□MnO2+□HCl──□MnCl2+□Cl2↑+□H2O
38.物质X、Y、Z发生反应:X+3Y=2Z,现有6gX与一定质量的Y恰好完全反应,生成12gZ。则X.Y的相对分子质量之比是 。
39.火柴是生活中不可缺少的必需品,火柴头上的物质主要成分是KClO3,MnO2,Sb2S3(硫化锑),火柴盒侧面涂有一层红褐色的物质,它的主要成分是红磷和玻璃粉。划火柴时,借摩擦之力,产生热量,放到氧气,生成白烟,并发生氧化反应,引燃木条。请你根据以上信息回答:⑴写出产生氧气的化学方程式 ;⑵写出生成白烟的化学方程式 ;⑶可燃物Sb2S3燃烧生成Sb2O3和SO2,并放出大量热的化学方程式 。
40.植物的光合作用可以表示为:。由此推断淀粉中一定含有 元素,可能含有 元素。
41.铁在高温下和水蒸气反应生成四氧化三铁和氢气,这个反应的化学方程式是
。
42.设R表示某元素,且在下面反应中R元素化合价不变:RxOy+3H2SO4=R2(SO4)3+zH2O,则x=
;y= ;z= 。
43.写出下列化学方程式
⑴汽车尾气中含有CO、NO等有害气体可在用铂.钯作催化剂的条件下,使CO与NO反应生成绿色植物光合作用所需的一种气体和空气中体积分数最大的一种气体:
;
⑵为延长白炽灯泡的使用时间,灯泡内放有极少量的红磷以减少灯丝氧化:
;
⑶市场出售的某种麦片中含有微量的颗粒极细的铁粉,食用后在胃液里(含少量盐酸HCl)可转变为人体所需的亚铁盐,以防缺铁性贫血: 。
44.某纯净物4.6g在空气中充分燃烧,生成5.4gH2O和8.8gCO2,试写出该纯净物在空气中燃烧的化学方程式 。
45.为保证长时间的潜航,在潜水艇里要配备O2的发生装置,有以下几种制备O2的方法:①加热高锰酸钾 ②电解水 ③在常温下Na2O2与CO2反应生成Na2CO3和氧气O2
⑴.写出③的化学反应式 ;⑵.你认为最适合在潜水艇里制O2的方法是 ;⑶.与其它两种方法相比,这种方法的两条优点是:
、 。
46.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
⑴实验室用高锰酸钾制取氧气时,选用的发生装置是 。实验室用过氧化氢制取氧气时,选用的发生装置是 ,选用的收集装置是 或 。
⑵写出实验室用加热高锰酸钾方法制取氧气的化学方程式 。
⑶若用A装置制取氧气,排水法收集完氧气后,应先 ,再
,目的是防止 。
47.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________________________________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
48.生石灰,沙子加水搅拌成石灰沙浆,用来砌砖抹墙很牢固,用化学方程式表示这一过程发生的化学反应___________________、______________________。
49.吸毒严重危害人的身心健康。“大麻”(其主要成分是C21H30O2)是一种常见的毒品,它在空气中焚烧能生成二氧化碳和水。该反应的化学方程式为_________________________。
50.用高锰酸钾制取氧气时,靠近管口的地方放一团棉花的作用是 ,当导管口开始有气泡放出时,不宜立即收集的原因是 。
三.计算题
51.使1.5千克氢气完全燃烧,可生成水多少千克?至少需要消耗氧气多少千克?
52.将6.5gKClO3和MnO2的混合物装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:⑴制得O2多少克?⑵4.58g固体中含有哪些物质?各多少克?(化学方程式为:2KClO32KCl+3O2↑)
科学第四册第二章(第3节)A 06年3月16日
班级 姓名 学号
可能用到的相对原子质量:H-1,C-12,O-16,N-14,Cl-35.5,Fe-56,Mg-24,P-31,S-32, K-39,Mn-55,Hg-200,Al-27,Zn-65。
一.选择题
1.已知A物质发生分解反应生成B物质和C物质(用A=B+C表示),当一定量A反应片刻后,生成56克B和44克C,则实际发生分解的A物质是 ( D )
A.12克 B.44克 C.56克 D.100克
2.根据已配平的化学方程式A+5O2==3CO2+4H2O可推测A的化学式是 ( D )
A.CH4 B.C2H4 C.C3H6 D.C3H8
3.某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是 ( C )
A.一定含有碳、氢元素,但肯定不含氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素 D.一定含有碳、氧元素,可能含有氢元素
4.液化气中一种主要成分是C2H6,其燃烧的化学方程式为xC2H6+7O2==4CO2+6H2O,根据质量守恒定律推断出x的值为 ( A )
A.2 B.4 C.6 D.7
5.在化学反应A+B==C+D中,已知25克A与10克B恰好完全反应,生成5克C,当反应有6克D生成时,参加反应的A是 ( B )
A.10g B.5g C.25g D.20g
6.某化合物完全燃烧,消耗2.9g氧气,生成8.8g二氧化碳和5.4g水,该化合物中 ( B )
A.只含有碳和氢两种元素 B.含有碳、氢、氧三种元素
C.只含有碳氧两种元素 D.无法确定
7.根据质量守恒定律,镁条完全燃烧后,生成氧化镁的质量 ( B )
A.小于镁条的质量 B.大于镁条的质量 C.等于镁条的质量 D.无法确定
8.关于质量守恒定律,下列叙述中正确的是 ( A )
A.一切化学反应都遵从质量守恒定律 B.煤燃烧化为灰烬,该反应不符合质量守恒定律
C.质量守恒定律只适用于有气体或固体生成的化学反应
D.24克镁在空气中完全燃烧生成40克氧化镁,实际消耗空气质量为16克
9.12克镁和12克氧气反应,最多可得到氧化镁 ( B )
A.16克 B.20克 C.24克 D.36克
10.根据质量守恒定律,在A2+3B2==2C中,C的化学式用A、B表示的是 ( B )
A.AB2 B.AB3 C.A2B3 D.A3B2
11.在2H2+O2 点燃 ====2H2O的反应中,反应前后肯定发生变化的是 ( C )
A.元素种类 B.物质的质量总和 C.各元素的化合价 D.各种原子的数目
12.已知反应3A+2B=2C+D,A.B两物质完全反应时,质量比为3∶4。若生成C和D共140g,则该反应消耗B的质量为 ( B )
A.60g B.80g C.90g D.120g
13.下列叙述符合质量守恒定律的是 ( D ) A.水加热变成水蒸气,变化前后质量相等 B.50ml水与50ml酒精混合不等于100ml
C.在90g水中含10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
14.等质量的碳、镁、铁分别在足量的氧气中充分燃烧,消耗氧气的质量比是 ( D )
A.1∶4∶7 B.6∶3∶4 C.7∶4∶1 D.28∶7∶4
15.下列物质在一定条件下都会分解,生成氧气,若相同质量的下列物质完全分解,生成O2的质量最多的是 ( C )
A.HgO B. KMnO4 C.H2O D. KClO3
16.已知化学反应:2A+B=C+D,7克的A与20克B恰好完全反应生成16克C,已知D的相对分子质量为44,则下列说法正确的是 ( A )
A.B的相对分子质量是80 B.14克A参加反应一定可生成D22克
C.A的相对分子质量是28 D.A、B、C、D中C的相对分子质量最大
17.化学反应后,生成物的总质量与反应前反应物的总质量相等,因为 ( B )
A.反应后物质的种类没有变化 B.反应后原子的种类和数目没有变化
C.反应后元素的种类没有变化 D.反应后分子的种类和数目没有变化
18.在3Fe+2O2 点燃 ===== Fe3O4的反应中,各物质之间质量比为 ( B )
A.3∶2∶1 B.21∶8∶29 C.7∶8∶29 D.56∶32∶160
19.完全电解xg水能得到5mL氧气,同时得到氢气的质量和体积分别是 ( B )
A.(8x/9)g,5mL B.(x/9)g,10mL C.xg,5mL D.xg,10mL
20.将24.5g氯酸钾与4.5g二氧化锰混合后,放入试管加热充分反应后,试管中剩余固体物质质量为 ( A )
A.19.4g B.20g C.29g D.14.9g
21.化学方程式4P+5O2 点燃 ====2P2O5表示 ( D )A.磷加氧气等于五氧化二磷 B.磷和氧气混合后生成五氧化二磷
C.在点燃条件下,4个磷原子与10个氧原子反应后,生成2个五氧化二磷分子
D.在点燃时,每4个磷原子与5个氧分子反应生成2个五氧化二磷分子
22.对于反应X2+3Y2=2Z,根据质量守恒定律,推知下列说法一定错误的是 ( C ) A.Z的化学式为XY3,其质量等于参加反应的X2.Y2质量之和
B.若agX2和bgY2恰好完全反应,则生成(a+b)gZ
C.若X2的式量为a,Y2的式量为b,则Z的式量为(a+3b)
D.若agX2完全反应生成bgZ,则同时消耗(b-a)gY2
23.化学方程式配平后,有的时候不需要在等号上方注明反应条件,这表示 ( C )A.此反应化学方程式不完整 B.此反应不能发生
C.此反应在通常条件下即可发生 D.此反应化学方程式不符合质量守恒定律
24.在化学反应4A+3B2=2AxBy中,x、y的数值是 ( B )
A.4,6 B.2,3 C.1,2 D.1,1.5
25.书写锌与稀硫酸反应的化学方程式时不需要用到的条件符号是 ( C )
A.“+ ” B.“=” C.“△” D.“↑”
26.用足量的氢气在加热条件下还原氧化铜,当完全反应后测得生成铜的质量为64克,则消耗掉氢气的质量 (CuO+H2 高温 ====Cu+H2O) ( C )
A.小于2克 B.等于2克 C.大于2克 D.无法确定
27.有化学反应A+B=C+D,下列说法中正确的是 ( A ) A.反应前后物质的分子总数不一定相等 B.A和B的质量比一定等于C和D的质量比
C.若A、C为单质,B、D为化合物,该反应不一定是置换反应
D.若A.B各取5g混合并使其反应,则C和D的质量总和一定等于10g
28.某二价金属2g与适量的稀H2SO4完全反应后得到10g硫酸盐,则该金属的相对原子质量是
A.65 B.56 C.24 D.23 ( C )
29.在反应A2+2AB2==4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的相对分子质量之比为 ( C )
A.3∶4 B.4∶3 C.1∶2 D.2∶1
30.下列化学反应方程式正确的是 ( A ) A.C+O2CO2 B.Mg+O2MgO2 C.P2+O5P2O5 D.2Al+3O=Al2O3
31.铁在氯气中燃烧生成氯化铁,在这个反应中,铁、氯气、氯化铁的质量比为( A ) A.112:213:325 B.56:71:127 C.56:71:162.5 D.112:142:325
32.某金属氧化物跟足量的盐酸反应,生成氯化物和水的分子数之比为2∶3,该金属元素的化合价是 ( C )
A.+1 B.+2 C.+3 D.+4
33.在3A+B=2C+D的化学反应中,12gA与3gB恰好完全反应,生成C和D的质量比为3∶2。当有8gB参加反应时,生成D的质量是 ( A )
A.16g B.14g C.8g D.5g
34.质量相等的三种物质:①KClO3(另加少量催化剂)、②HgO、③KMnO4,充分加热分解后,产生氧气的质量由多到少的顺序是 ( A )
A.①③② B.②③① C.①②③ D.③②①
35.现有化学反应:X+Y=Z,若将agX和bgY在一定条件下充分反应,生成物Z的质量 ( D )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
二.填空题
36.在一切化学反应里,由于反应前后,___原子_种类没有改变,__原子__的数目没有增减,__原子___的质量也没有变化,所以反应前后各物质的__质量总和_必然相等。
37.完成并配平下列反应的化学方程式。
(1)□C2H6+□O2□CO2+□H2O (2)□NH3+□O2──□N2+□H2O
(3)□C+□Fe3O4□Fe+□CO2 (4)□MnO2+□HCl──□MnCl2+□Cl2↑+□H2O
38.物质X、Y、Z发生反应:X+3Y=2Z,现有6gX与一定质量的Y恰好完全反应,生成12gZ。则X.Y的相对分子质量之比是 3∶1 。
39.火柴是生活中不可缺少的必需品,火柴头上的物质主要成分是KClO3,MnO2,Sb2S3(硫化锑),火柴盒侧面涂有一层红褐色的物质,它的主要成分是红磷和玻璃粉。划火柴时,借摩擦之力,产生热量,放到氧气,生成白烟,并发生氧化反应,引燃木条。请你根据以上信息回答:⑴写出产生氧气的化学方程式 ;⑵写出生成白烟的化学方程式 ;⑶可燃物Sb2S3燃烧生成Sb2O3和SO2,并放出大量热的化学方程式 。
40.植物的光合作用可以表示为:。由此推断淀粉中一定含有 H、C 元素,可能含有 O 元素。
41.铁在高温下和水蒸气反应生成四氧化三铁和氢气,这个反应的化学方程式是
。
42.设R表示某元素,且在下面反应中R元素化合价不变:RxOy+3H2SO4=R2(SO4)3+zH2O,则x=
2 ;y= 3 ;z= 3 。
43.写出下列化学方程式
⑴汽车尾气中含有CO、NO等有害气体可在用铂.钯作催化剂的条件下,使CO与NO反应生成绿色植物光合作用所需的一种气体和空气中体积分数最大的一种气体:
;
⑵为延长白炽灯泡的使用时间,灯泡内放有极少量的红磷以减少灯丝氧化:
;
⑶市场出售的某种麦片中含有微量的颗粒极细的铁粉,食用后在胃液里(含少量盐酸HCl)可转变为人体所需的亚铁盐,以防缺铁性贫血: 。
44.某纯净物4.6g在空气中充分燃烧,生成5.4gH2O和8.8gCO2,试写出该纯净物在空气中燃烧的化学方程式 。
45.为保证长时间的潜航,在潜水艇里要配备O2的发生装置,有以下几种制备O2的方法:①加热高锰酸钾 ②电解水 ③在常温下Na2O2与CO2反应生成Na2CO3和氧气O2
⑴.写出③的化学反应式 2Na2O2+2CO2=2Na2CO3+ O2 ;⑵.你认为最适合在潜水艇里制O2的方法是 ③ ;⑶.与其它两种方法相比,这种方法的两条优点是: 不需要加热等反应条件 、 可以减少二氧化碳的含量 。
46.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
⑴实验室用高锰酸钾制取氧气时,选用的发生装置是 A 。实验室用过氧化氢制取氧气时,选用的发生装置是 B ,选用的收集装置是 C 或 F 。
⑵写出实验室用加热高锰酸钾方法制取氧气的化学方程式 2KMnO4点 燃 K2MnO4+MnO2+O2↑
⑶若用A装置制取氧气,排水法收集完氧气后,应先 将导气管从水槽中移出 ,再 熄灭酒精灯 ,目的是防止 防止水倒流造成试管破裂 。
47.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________________________________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
48.生石灰,沙子加水搅拌成石灰沙浆,用来砌砖抹墙很牢固,用化学方程式表示这一过程发生的化学反应___________________、______________________。
49.吸毒严重危害人的身心健康。“大麻”(其主要成分是C21H30O2)是一种常见的毒品,它在空气中焚烧能生成二氧化碳和水。该反应的化学方程式为_________________________。
50.用高锰酸钾制取氧气时,靠近管口的地方放一团棉花的作用是 防止高锰酸钾堵塞导管口 ,当导管口开始有气泡放出时,不宜立即收集的原因是 氧气不纯,有大量空气 。
三.计算题
51.使1.5千克氢气完全燃烧,可生成水多少千克?至少需要消耗氧气多少千克?
52.将6.5gKClO3和MnO2的混合物装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:⑴制得O2多少克?⑵4.58g固体中含有哪些物质?各多少克?(化学方程式为:2KClO32KCl+3O2↑)
解:依质量守恒定律可知制得O2质量为:6.5-4.58=1.92g。设反应完毕后,生成KCl质量为x。2KClO32KCl+3O2↑ 149 96 x 1.92 149∶96=x∶1.92 即x=2.98g 4.58g固体中含有KCl和MnO2 MnO2质量为4.58-2.98=1.6g
PAGE
8
班级 姓名 学号
可能用到的相对原子质量:H-1,C-12,O-16,N-14,Cl-35.5,Fe-56,Mg-24,P-31,S-32, K-39,Mn-55,Hg-200,Al-27,Zn-65。
一.选择题
1.已知A物质发生分解反应生成B物质和C物质(用A=B+C表示),当一定量A反应片刻后,生成56克B和44克C,则实际发生分解的A物质是 ( )
A.12克 B.44克 C.56克 D.100克
2.根据已配平的化学方程式A+5O2==3CO2+4H2O可推测A的化学式是 ( )
A.CH4 B.C2H4 C.C3H6 D.C3H8
3.某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是 ( )
A.一定含有碳、氢元素,但肯定不含氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素 D.一定含有碳、氧元素,可能含有氢元素
4.液化气中一种主要成分是C2H6,其燃烧的化学方程式为xC2H6+7O2==4CO2+6H2O,根据质量守恒定律推断出x的值为 ( )
A.2 B.4 C.6 D.7
5.在化学反应A+B==C+D中,已知25克A与10克B恰好完全反应,生成5克C,当反应有6克D生成时,参加反应的A是 ( )
A.10g B.5g C.25g D.20g
6.某化合物完全燃烧,消耗2.9g氧气,生成8.8g二氧化碳和5.4g水,该化合物中 ( )
A.只含有碳和氢两种元素 B.含有碳、氢、氧三种元素
C.只含有碳氧两种元素 D.无法确定
7.根据质量守恒定律,镁条完全燃烧后,生成氧化镁的质量 ( )
A.小于镁条的质量 B.大于镁条的质量 C.等于镁条的质量 D.无法确定
8.关于质量守恒定律,下列叙述中正确的是 ( )
A.一切化学反应都遵从质量守恒定律 B.煤燃烧化为灰烬,该反应不符合质量守恒定律
C.质量守恒定律只适用于有气体或固体生成的化学反应
D.24克镁在空气中完全燃烧生成40克氧化镁,实际消耗空气质量为16克
9.12克镁和12克氧气反应,最多可得到氧化镁 ( )
A.16克 B.20克 C.24克 D.36克
10.根据质量守恒定律,在A2+3B2==2C中,C的化学式用A、B表示的是 ( )
A.AB2 B.AB3 C.A2B3 D.A3B2
11.在2H2+O2 点燃 ====2H2O的反应中,反应前后肯定发生变化的是 ( )
A.元素种类 B.物质的质量总和 C.各元素的化合价 D.各种原子的数目
12.已知反应3A+2B=2C+D,A.B两物质完全反应时,质量比为3∶4。若生成C和D共140g,则该反应消耗B的质量为 ( )
A.60g B.80g C.90g D.120g
13.下列叙述符合质量守恒定律的是 ( ) A.水加热变成水蒸气,变化前后质量相等 B.50ml水与50ml酒精混合不等于100ml
C.在90g水中含10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
14.等质量的碳、镁、铁分别在足量的氧气中充分燃烧,消耗氧气的质量比是 ( )
A.1∶4∶7 B.6∶3∶4 C.7∶4∶1 D.28∶7∶4
15.下列物质在一定条件下都会分解,生成氧气,若相同质量的下列物质完全分解,生成O2的质量最多的是 ( )
A.HgO B. KMnO4 C.H2O D. KClO3
16.已知化学反应:2A+B=C+D,7克的A与20克B恰好完全反应生成16克C,已知D的相对分子质量为44,则下列说法正确的是 ( )
A.B的相对分子质量是80 B.14克A参加反应一定可生成D22克
C.A的相对分子质量是28 D.A、B、C、D中C的相对分子质量最大
17.化学反应后,生成物的总质量与反应前反应物的总质量相等,因为 ( )
A.反应后物质的种类没有变化 B.反应后原子的种类和数目没有变化
C.反应后元素的种类没有变化 D.反应后分子的种类和数目没有变化
18.在3Fe+2O2 点燃 ===== Fe3O4的反应中,各物质之间质量比为 ( )
A.3∶2∶1 B.21∶8∶29 C.7∶8∶29 D.56∶32∶160
19.完全电解xg水能得到5mL氧气,同时得到氢气的质量和体积分别是 ( )
A.(8x/9)g,5mL B.(x/9)g,10mL C.xg,5mL D.xg,10mL
20.将24.5g氯酸钾与4.5g二氧化锰混合后,放入试管加热充分反应后,试管中剩余固体物质质量为 ( )
A.19.4g B.20g C.29g D.14.9g
21.化学方程式4P+5O2 点燃 ====2P2O5表示 ( )A.磷加氧气等于五氧化二磷 B.磷和氧气混合后生成五氧化二磷
C.在点燃条件下,4个磷原子与10个氧原子反应后,生成2个五氧化二磷分子
D.在点燃时,每4个磷原子与5个氧分子反应生成2个五氧化二磷分子
22.对于反应X2+3Y2=2Z,根据质量守恒定律,推知下列说法一定错误的是 ( ) A.Z的化学式为XY3,其质量等于参加反应的X2.Y2质量之和
B.若agX2和bgY2恰好完全反应,则生成(a+b)gZ
C.若X2的式量为a,Y2的式量为b,则Z的式量为(a+3b)
D.若agX2完全反应生成bgZ,则同时消耗(b-a)gY2
23.化学方程式配平后,有的时候不需要在等号上方注明反应条件,这表示 ( )A.此反应化学方程式不完整 B.此反应不能发生
C.此反应在通常条件下即可发生 D.此反应化学方程式不符合质量守恒定律
24.在化学反应4A+3B2=2AxBy中,x、y的数值是 ( )
A.4,6 B.2,3 C.1,2 D.1,1.5
25.书写锌与稀硫酸反应的化学方程式时不需要用到的条件符号是 ( )
A.“+ ” B.“=” C.“△” D.“↑”
26.用足量的氢气在加热条件下还原氧化铜,当完全反应后测得生成铜的质量为64克,则消耗掉氢气的质量 (CuO+H2 高温 ====Cu+H2O) ( )
A.小于2克 B.等于2克 C.大于2克 D.无法确定
27.有化学反应A+B=C+D,下列说法中正确的是 ( ) A.反应前后物质的分子总数不一定相等 B.A和B的质量比一定等于C和D的质量比
C.若A、C为单质,B、D为化合物,该反应不一定是置换反应
D.若A.B各取5g混合并使其反应,则C和D的质量总和一定等于10g
28.某二价金属2g与适量的稀H2SO4完全反应后得到10g硫酸盐,则该金属的相对原子质量是
A.65 B.56 C.24 D.23 ( )
29.在反应A2+2AB2==4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的相对分子质量之比为 ( )
A.3∶4 B.4∶3 C.1∶2 D.2∶1
30.下列化学反应方程式正确的是 ( ) A.C+O2CO2 B.Mg+O2MgO2 C.P2+O5P2O5 D.2Al+3O=Al2O3
31.铁在氯气中燃烧生成氯化铁,在这个反应中,铁、氯气、氯化铁的质量比为( ) A.112:213:325 B.56:71:127 C.56:71:162.5 D.112:142:325
32.某金属氧化物跟足量的盐酸反应,生成氯化物和水的分子数之比为2∶3,该金属元素的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
33.在3A+B=2C+D的化学反应中,12gA与3gB恰好完全反应,生成C和D的质量比为3∶2。当有8gB参加反应时,生成D的质量是 ( )
A.16g B.14g C.8g D.5g
34.质量相等的三种物质:①KClO3(另加少量催化剂)、②HgO、③KMnO4,充分加热分解后,产生氧气的质量由多到少的顺序是 ( )
A.①③② B.②③① C.①②③ D.③②①
35.现有化学反应:X+Y=Z,若将agX和bgY在一定条件下充分反应,生成物Z的质量( )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
二.填空题
36.在一切化学反应里,由于反应前后, 种类没有改变, 的数目没有增减,
的质量也没有变化,所以反应前后各物质的 必然相等。
37.完成并配平下列反应的化学方程式。
(1)□C2H6+□O2□CO2+□H2O (2)□NH3+□O2──□N2+□H2O
(3)□C+□Fe3O4□Fe+□CO2 (4)□MnO2+□HCl──□MnCl2+□Cl2↑+□H2O
38.物质X、Y、Z发生反应:X+3Y=2Z,现有6gX与一定质量的Y恰好完全反应,生成12gZ。则X.Y的相对分子质量之比是 。
39.火柴是生活中不可缺少的必需品,火柴头上的物质主要成分是KClO3,MnO2,Sb2S3(硫化锑),火柴盒侧面涂有一层红褐色的物质,它的主要成分是红磷和玻璃粉。划火柴时,借摩擦之力,产生热量,放到氧气,生成白烟,并发生氧化反应,引燃木条。请你根据以上信息回答:⑴写出产生氧气的化学方程式 ;⑵写出生成白烟的化学方程式 ;⑶可燃物Sb2S3燃烧生成Sb2O3和SO2,并放出大量热的化学方程式 。
40.植物的光合作用可以表示为:。由此推断淀粉中一定含有 元素,可能含有 元素。
41.铁在高温下和水蒸气反应生成四氧化三铁和氢气,这个反应的化学方程式是
。
42.设R表示某元素,且在下面反应中R元素化合价不变:RxOy+3H2SO4=R2(SO4)3+zH2O,则x=
;y= ;z= 。
43.写出下列化学方程式
⑴汽车尾气中含有CO、NO等有害气体可在用铂.钯作催化剂的条件下,使CO与NO反应生成绿色植物光合作用所需的一种气体和空气中体积分数最大的一种气体:
;
⑵为延长白炽灯泡的使用时间,灯泡内放有极少量的红磷以减少灯丝氧化:
;
⑶市场出售的某种麦片中含有微量的颗粒极细的铁粉,食用后在胃液里(含少量盐酸HCl)可转变为人体所需的亚铁盐,以防缺铁性贫血: 。
44.某纯净物4.6g在空气中充分燃烧,生成5.4gH2O和8.8gCO2,试写出该纯净物在空气中燃烧的化学方程式 。
45.为保证长时间的潜航,在潜水艇里要配备O2的发生装置,有以下几种制备O2的方法:①加热高锰酸钾 ②电解水 ③在常温下Na2O2与CO2反应生成Na2CO3和氧气O2
⑴.写出③的化学反应式 ;⑵.你认为最适合在潜水艇里制O2的方法是 ;⑶.与其它两种方法相比,这种方法的两条优点是:
、 。
46.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
⑴实验室用高锰酸钾制取氧气时,选用的发生装置是 。实验室用过氧化氢制取氧气时,选用的发生装置是 ,选用的收集装置是 或 。
⑵写出实验室用加热高锰酸钾方法制取氧气的化学方程式 。
⑶若用A装置制取氧气,排水法收集完氧气后,应先 ,再
,目的是防止 。
47.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________________________________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
48.生石灰,沙子加水搅拌成石灰沙浆,用来砌砖抹墙很牢固,用化学方程式表示这一过程发生的化学反应___________________、______________________。
49.吸毒严重危害人的身心健康。“大麻”(其主要成分是C21H30O2)是一种常见的毒品,它在空气中焚烧能生成二氧化碳和水。该反应的化学方程式为_________________________。
50.用高锰酸钾制取氧气时,靠近管口的地方放一团棉花的作用是 ,当导管口开始有气泡放出时,不宜立即收集的原因是 。
三.计算题
51.使1.5千克氢气完全燃烧,可生成水多少千克?至少需要消耗氧气多少千克?
52.将6.5gKClO3和MnO2的混合物装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:⑴制得O2多少克?⑵4.58g固体中含有哪些物质?各多少克?(化学方程式为:2KClO32KCl+3O2↑)
科学第四册第二章(第3节)A 06年3月16日
班级 姓名 学号
可能用到的相对原子质量:H-1,C-12,O-16,N-14,Cl-35.5,Fe-56,Mg-24,P-31,S-32, K-39,Mn-55,Hg-200,Al-27,Zn-65。
一.选择题
1.已知A物质发生分解反应生成B物质和C物质(用A=B+C表示),当一定量A反应片刻后,生成56克B和44克C,则实际发生分解的A物质是 ( D )
A.12克 B.44克 C.56克 D.100克
2.根据已配平的化学方程式A+5O2==3CO2+4H2O可推测A的化学式是 ( D )
A.CH4 B.C2H4 C.C3H6 D.C3H8
3.某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是 ( C )
A.一定含有碳、氢元素,但肯定不含氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素 D.一定含有碳、氧元素,可能含有氢元素
4.液化气中一种主要成分是C2H6,其燃烧的化学方程式为xC2H6+7O2==4CO2+6H2O,根据质量守恒定律推断出x的值为 ( A )
A.2 B.4 C.6 D.7
5.在化学反应A+B==C+D中,已知25克A与10克B恰好完全反应,生成5克C,当反应有6克D生成时,参加反应的A是 ( B )
A.10g B.5g C.25g D.20g
6.某化合物完全燃烧,消耗2.9g氧气,生成8.8g二氧化碳和5.4g水,该化合物中 ( B )
A.只含有碳和氢两种元素 B.含有碳、氢、氧三种元素
C.只含有碳氧两种元素 D.无法确定
7.根据质量守恒定律,镁条完全燃烧后,生成氧化镁的质量 ( B )
A.小于镁条的质量 B.大于镁条的质量 C.等于镁条的质量 D.无法确定
8.关于质量守恒定律,下列叙述中正确的是 ( A )
A.一切化学反应都遵从质量守恒定律 B.煤燃烧化为灰烬,该反应不符合质量守恒定律
C.质量守恒定律只适用于有气体或固体生成的化学反应
D.24克镁在空气中完全燃烧生成40克氧化镁,实际消耗空气质量为16克
9.12克镁和12克氧气反应,最多可得到氧化镁 ( B )
A.16克 B.20克 C.24克 D.36克
10.根据质量守恒定律,在A2+3B2==2C中,C的化学式用A、B表示的是 ( B )
A.AB2 B.AB3 C.A2B3 D.A3B2
11.在2H2+O2 点燃 ====2H2O的反应中,反应前后肯定发生变化的是 ( C )
A.元素种类 B.物质的质量总和 C.各元素的化合价 D.各种原子的数目
12.已知反应3A+2B=2C+D,A.B两物质完全反应时,质量比为3∶4。若生成C和D共140g,则该反应消耗B的质量为 ( B )
A.60g B.80g C.90g D.120g
13.下列叙述符合质量守恒定律的是 ( D ) A.水加热变成水蒸气,变化前后质量相等 B.50ml水与50ml酒精混合不等于100ml
C.在90g水中含10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
14.等质量的碳、镁、铁分别在足量的氧气中充分燃烧,消耗氧气的质量比是 ( D )
A.1∶4∶7 B.6∶3∶4 C.7∶4∶1 D.28∶7∶4
15.下列物质在一定条件下都会分解,生成氧气,若相同质量的下列物质完全分解,生成O2的质量最多的是 ( C )
A.HgO B. KMnO4 C.H2O D. KClO3
16.已知化学反应:2A+B=C+D,7克的A与20克B恰好完全反应生成16克C,已知D的相对分子质量为44,则下列说法正确的是 ( A )
A.B的相对分子质量是80 B.14克A参加反应一定可生成D22克
C.A的相对分子质量是28 D.A、B、C、D中C的相对分子质量最大
17.化学反应后,生成物的总质量与反应前反应物的总质量相等,因为 ( B )
A.反应后物质的种类没有变化 B.反应后原子的种类和数目没有变化
C.反应后元素的种类没有变化 D.反应后分子的种类和数目没有变化
18.在3Fe+2O2 点燃 ===== Fe3O4的反应中,各物质之间质量比为 ( B )
A.3∶2∶1 B.21∶8∶29 C.7∶8∶29 D.56∶32∶160
19.完全电解xg水能得到5mL氧气,同时得到氢气的质量和体积分别是 ( B )
A.(8x/9)g,5mL B.(x/9)g,10mL C.xg,5mL D.xg,10mL
20.将24.5g氯酸钾与4.5g二氧化锰混合后,放入试管加热充分反应后,试管中剩余固体物质质量为 ( A )
A.19.4g B.20g C.29g D.14.9g
21.化学方程式4P+5O2 点燃 ====2P2O5表示 ( D )A.磷加氧气等于五氧化二磷 B.磷和氧气混合后生成五氧化二磷
C.在点燃条件下,4个磷原子与10个氧原子反应后,生成2个五氧化二磷分子
D.在点燃时,每4个磷原子与5个氧分子反应生成2个五氧化二磷分子
22.对于反应X2+3Y2=2Z,根据质量守恒定律,推知下列说法一定错误的是 ( C ) A.Z的化学式为XY3,其质量等于参加反应的X2.Y2质量之和
B.若agX2和bgY2恰好完全反应,则生成(a+b)gZ
C.若X2的式量为a,Y2的式量为b,则Z的式量为(a+3b)
D.若agX2完全反应生成bgZ,则同时消耗(b-a)gY2
23.化学方程式配平后,有的时候不需要在等号上方注明反应条件,这表示 ( C )A.此反应化学方程式不完整 B.此反应不能发生
C.此反应在通常条件下即可发生 D.此反应化学方程式不符合质量守恒定律
24.在化学反应4A+3B2=2AxBy中,x、y的数值是 ( B )
A.4,6 B.2,3 C.1,2 D.1,1.5
25.书写锌与稀硫酸反应的化学方程式时不需要用到的条件符号是 ( C )
A.“+ ” B.“=” C.“△” D.“↑”
26.用足量的氢气在加热条件下还原氧化铜,当完全反应后测得生成铜的质量为64克,则消耗掉氢气的质量 (CuO+H2 高温 ====Cu+H2O) ( C )
A.小于2克 B.等于2克 C.大于2克 D.无法确定
27.有化学反应A+B=C+D,下列说法中正确的是 ( A ) A.反应前后物质的分子总数不一定相等 B.A和B的质量比一定等于C和D的质量比
C.若A、C为单质,B、D为化合物,该反应不一定是置换反应
D.若A.B各取5g混合并使其反应,则C和D的质量总和一定等于10g
28.某二价金属2g与适量的稀H2SO4完全反应后得到10g硫酸盐,则该金属的相对原子质量是
A.65 B.56 C.24 D.23 ( C )
29.在反应A2+2AB2==4AB中,1克A2与足量的AB2反应生成5克AB,则A2与AB2的相对分子质量之比为 ( C )
A.3∶4 B.4∶3 C.1∶2 D.2∶1
30.下列化学反应方程式正确的是 ( A ) A.C+O2CO2 B.Mg+O2MgO2 C.P2+O5P2O5 D.2Al+3O=Al2O3
31.铁在氯气中燃烧生成氯化铁,在这个反应中,铁、氯气、氯化铁的质量比为( A ) A.112:213:325 B.56:71:127 C.56:71:162.5 D.112:142:325
32.某金属氧化物跟足量的盐酸反应,生成氯化物和水的分子数之比为2∶3,该金属元素的化合价是 ( C )
A.+1 B.+2 C.+3 D.+4
33.在3A+B=2C+D的化学反应中,12gA与3gB恰好完全反应,生成C和D的质量比为3∶2。当有8gB参加反应时,生成D的质量是 ( A )
A.16g B.14g C.8g D.5g
34.质量相等的三种物质:①KClO3(另加少量催化剂)、②HgO、③KMnO4,充分加热分解后,产生氧气的质量由多到少的顺序是 ( A )
A.①③② B.②③① C.①②③ D.③②①
35.现有化学反应:X+Y=Z,若将agX和bgY在一定条件下充分反应,生成物Z的质量 ( D )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
二.填空题
36.在一切化学反应里,由于反应前后,___原子_种类没有改变,__原子__的数目没有增减,__原子___的质量也没有变化,所以反应前后各物质的__质量总和_必然相等。
37.完成并配平下列反应的化学方程式。
(1)□C2H6+□O2□CO2+□H2O (2)□NH3+□O2──□N2+□H2O
(3)□C+□Fe3O4□Fe+□CO2 (4)□MnO2+□HCl──□MnCl2+□Cl2↑+□H2O
38.物质X、Y、Z发生反应:X+3Y=2Z,现有6gX与一定质量的Y恰好完全反应,生成12gZ。则X.Y的相对分子质量之比是 3∶1 。
39.火柴是生活中不可缺少的必需品,火柴头上的物质主要成分是KClO3,MnO2,Sb2S3(硫化锑),火柴盒侧面涂有一层红褐色的物质,它的主要成分是红磷和玻璃粉。划火柴时,借摩擦之力,产生热量,放到氧气,生成白烟,并发生氧化反应,引燃木条。请你根据以上信息回答:⑴写出产生氧气的化学方程式 ;⑵写出生成白烟的化学方程式 ;⑶可燃物Sb2S3燃烧生成Sb2O3和SO2,并放出大量热的化学方程式 。
40.植物的光合作用可以表示为:。由此推断淀粉中一定含有 H、C 元素,可能含有 O 元素。
41.铁在高温下和水蒸气反应生成四氧化三铁和氢气,这个反应的化学方程式是
。
42.设R表示某元素,且在下面反应中R元素化合价不变:RxOy+3H2SO4=R2(SO4)3+zH2O,则x=
2 ;y= 3 ;z= 3 。
43.写出下列化学方程式
⑴汽车尾气中含有CO、NO等有害气体可在用铂.钯作催化剂的条件下,使CO与NO反应生成绿色植物光合作用所需的一种气体和空气中体积分数最大的一种气体:
;
⑵为延长白炽灯泡的使用时间,灯泡内放有极少量的红磷以减少灯丝氧化:
;
⑶市场出售的某种麦片中含有微量的颗粒极细的铁粉,食用后在胃液里(含少量盐酸HCl)可转变为人体所需的亚铁盐,以防缺铁性贫血: 。
44.某纯净物4.6g在空气中充分燃烧,生成5.4gH2O和8.8gCO2,试写出该纯净物在空气中燃烧的化学方程式 。
45.为保证长时间的潜航,在潜水艇里要配备O2的发生装置,有以下几种制备O2的方法:①加热高锰酸钾 ②电解水 ③在常温下Na2O2与CO2反应生成Na2CO3和氧气O2
⑴.写出③的化学反应式 2Na2O2+2CO2=2Na2CO3+ O2 ;⑵.你认为最适合在潜水艇里制O2的方法是 ③ ;⑶.与其它两种方法相比,这种方法的两条优点是: 不需要加热等反应条件 、 可以减少二氧化碳的含量 。
46.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
⑴实验室用高锰酸钾制取氧气时,选用的发生装置是 A 。实验室用过氧化氢制取氧气时,选用的发生装置是 B ,选用的收集装置是 C 或 F 。
⑵写出实验室用加热高锰酸钾方法制取氧气的化学方程式 2KMnO4点 燃 K2MnO4+MnO2+O2↑
⑶若用A装置制取氧气,排水法收集完氧气后,应先 将导气管从水槽中移出 ,再 熄灭酒精灯 ,目的是防止 防止水倒流造成试管破裂 。
47.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________________________________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
48.生石灰,沙子加水搅拌成石灰沙浆,用来砌砖抹墙很牢固,用化学方程式表示这一过程发生的化学反应___________________、______________________。
49.吸毒严重危害人的身心健康。“大麻”(其主要成分是C21H30O2)是一种常见的毒品,它在空气中焚烧能生成二氧化碳和水。该反应的化学方程式为_________________________。
50.用高锰酸钾制取氧气时,靠近管口的地方放一团棉花的作用是 防止高锰酸钾堵塞导管口 ,当导管口开始有气泡放出时,不宜立即收集的原因是 氧气不纯,有大量空气 。
三.计算题
51.使1.5千克氢气完全燃烧,可生成水多少千克?至少需要消耗氧气多少千克?
52.将6.5gKClO3和MnO2的混合物装入大试管中,加热制氧气。待反应完毕后,冷却试管后称量,剩有4.58g固体物质。计算:⑴制得O2多少克?⑵4.58g固体中含有哪些物质?各多少克?(化学方程式为:2KClO32KCl+3O2↑)
解:依质量守恒定律可知制得O2质量为:6.5-4.58=1.92g。设反应完毕后,生成KCl质量为x。2KClO32KCl+3O2↑ 149 96 x 1.92 149∶96=x∶1.92 即x=2.98g 4.58g固体中含有KCl和MnO2 MnO2质量为4.58-2.98=1.6g
PAGE
8
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
