7.5 基础实验8《酸与碱的化学性质》课件(共28张PPT)
文档属性
| 名称 | 7.5 基础实验8《酸与碱的化学性质》课件(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 100.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-30 00:00:00 | ||
图片预览








文档简介
课件28张PPT。沪教版九年级全册第七单元 应用广泛的酸、碱、盐基础实验8 酸与碱的化学性质1.比较常见酸的化学性质,认识其特征;
2.认识常见碱的一些化学性质;
3.通过探究,认识酸碱中和反应。稀盐酸、稀硫酸、稀氢氧化钠溶液、石灰水、镁条、锌粒、铜片、碳酸钠粉末、石灰石(或大理石)、生锈铁钉、生锈铜制品、硫酸铜溶液、蒸馏水等;
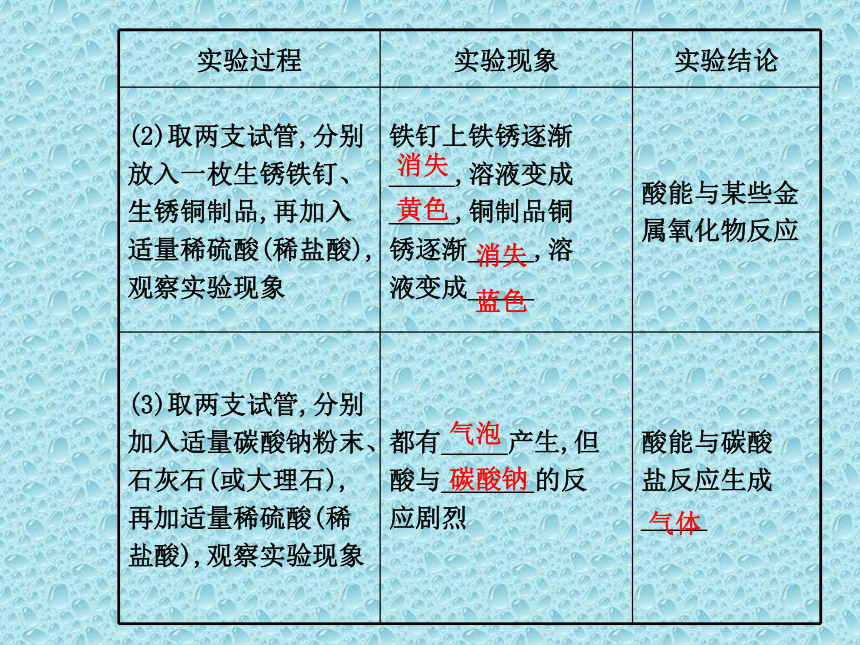
试管、烧杯、胶头滴管、玻璃棒等。1.常见酸的化学性质:气泡剧烈无明显现象氢气消失黄色消失蓝色气泡碳酸钠气体2.常见碱的化学性质:蓝色沉淀3.酸碱中和反应:红色碱性升高放出中性红色碱性1.在实验室为什么常用稀盐酸和大理石反应来制取CO2气体,而不用稀硫酸和大理石或稀盐酸和碳酸钠?
提示:由于稀硫酸与大理石反应生成微溶于水的硫酸钙,会附着在未反应的大理石表面,使反应自动停止,所以一般用稀盐酸而不用稀硫酸;由于稀盐酸和碳酸钠反应速度太快,不利于收集。
2.酸碱中和反应实验中,步骤(3)的目的是什么?
提示:由于酸溶液也不能使酚酞变色,再滴加氢氧化钠溶液是为了判断反应后的溶液呈中性还是酸性。 1. 下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
A.紫色石蕊溶液 B.氯化钠溶液
C.铁粉 D.pH试纸
【解析】选B。酸能使紫色石蕊溶液变红色,碱能使紫色石蕊溶液变蓝色,A能鉴别;氯化钠和氢氧化钠、稀盐酸都不反应,B不能鉴别;铁能和稀盐酸反应产生氢气,和氢氧化钠不反应,C能鉴别;碱的pH大于7,酸的pH小于7,D能鉴别。2.食醋中含有醋酸,食醋除作调味品外,在生活中还有些妙用,下列使用食醋肯定不能达到目的的是( )
A.除去菜刀上的铁锈
B.除去水壶壁上的水垢
C.清洗溅到皮肤上的碱液
D.鉴别黄金饰品中是否含有铜
【解析】选D。铁锈的主要成分是氧化铁,能与醋酸反应,A正确;水垢的主要成分是碳酸钙,能与醋酸反应,B正确;醋酸与碱能发生中和反应,C正确;铜不能与醋酸发生反应,D不正确。3.进行下列实验,根据实验现象得出的结论中,错误的
是( )
A.滴入紫色石蕊试液,溶液颜色变红,则该溶液显酸性
B.滴入无色酚酞试液,溶液保持无色,则该溶液显酸性
C.加入镁粉有气泡产生,则该溶液显酸性
D.加入石灰石,有气泡产生,则该溶液显酸性
【解析】选B。酚酞试液在酸性和中性溶液中均为无色,故不能判断该溶液一定是酸性溶液。4.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )【解析】选D。氢氧化钠溶液和澄清石灰水与盐酸反应都无明显现象,都能使酚酞变红,都产生蓝色沉淀,A、B、C都不正确;氢氧化钠溶液与二氧化碳反应无明显现象,澄清石灰水与二氧化碳反应,溶液变浑浊,D正确。5.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
【解析】选B。氢氧化钠与二氧化碳能发生化学反应生成碳酸钠,但碳酸钠易溶于水,故无白色沉淀生成。6.(双选)某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )【解析】选B、D。若反应后氢氧化钠过量,加硫酸铜后,氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀;氢氧化钠与硫酸反应生成硫酸钠和水,不论两者是否恰好完全反应,溶液中都有硫酸根离子,滴加氯化钡溶液后,都会出现白色沉淀;若硫酸过量,过量的硫酸与锌粒反应生成氢气;无色酚酞在中性或酸性条件下都不变色,所以在硫酸过量的条件下,滴加无色酚酞,溶液也不变色。7.小强在厨房里发现一瓶标签损坏的无色液体。
(1)他闻了闻,初步判断为白醋,小强是利用了白醋的______(选填“物理”或“化学”)性质作出的判断。
(2)他取少量此液体放入玻璃杯中,加入大理石,产生气体,说明该液体含有______(选填“酸性”“碱性”或“中性”)物质,进一步判断为白醋。
(3)他另取少量此液体滴入石蕊溶液,溶液变为______色,要使其变为蓝色,可向其中加入_____(填编号)。
a.食盐 b.熟石灰
c.白酒 d.水【解析】闻气味不需要经过化学变化,利用的是物理性质;碳酸钙与酸反应产生气体二氧化碳,由此证明该溶液显酸性;石蕊溶液遇酸变红色,要使其变为蓝色,需加入过量的碱,使溶液变为碱性。
答案:(1)物理 (2)酸性 (3)红 b8.某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为__________________,
待铁锈消失后又看到__________________________现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为溶液。这是由于过量的铁继续与黄色溶液的主要成分反应造成的,该反应的化学方程式为________________________________________________
_________________________________________________。【解析】本题考查学生对盐酸与铁锈反应的认知能力。铁锈的主要成分是三氧化二铁,能与盐酸反应生成氯化铁(溶液为黄色)和水,铁与盐酸反应生成氯化亚铁(溶液为浅绿色)和氢气,能观察到有气泡产生;观察到溶液为浅绿色,说明氯化铁溶液与铁钉中的铁发生反应变为氯化亚铁溶液。
答案:(1)Fe2O3+6HCl====2FeCl3+3H2O 有气泡产生
(2)氯化亚铁 Fe+2FeCl3====3FeCl29.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ.写出该中和反应的化学方程式:__________________。
Ⅱ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:________________________________。【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:___________________,结论:猜想一不正确。
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:___________________,结论:猜想二不正确,猜想三正确。【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑______________。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?______________(填序号)。
a.pH试纸 b.铜
c.紫色石蕊溶液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是___________(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的___________。【解析】氢氧化钙与盐酸反应生成氯化钙和水,由此写出化学方程式;【猜想】两者发生反应时有可能盐酸过量,也有可能氢氧化钙过量,还有可能两者恰好完全反应,故猜想三为可能是CaCl2和HCl;【进行实验】CaCl2溶液呈中性,Ca(OH)2溶液呈碱性,由于生成物氯化钙一定存在,故猜想一不正确,说明溶液中不含氢氧化钙,因此滴入酚酞溶液无明显变化;由结论:猜想二不正确,猜想三正确,说明溶液中有盐酸,因此加入碳酸钠后,有气体放出,由于碳酸钠过量,故碳酸钠还会与氯化钙反应生成碳酸钙沉淀。【反思与拓展】(1)在分析化学反应后所得物质成分时,除考虑生成物外,还需考虑反应物的用量;(2)盐酸呈酸性,故可以通过用pH试纸和紫色石蕊溶液进行验证,铜不与盐酸反应,由于氯化钙中含氯离子,也会与硝酸银反应生成沉淀,会对结果造成干扰,故铜与硝酸银都不能用来验证;(3)下水道大部分为铁质管道,酸液倒入下水道会腐蚀下水道,可以加入石灰石将盐酸转化为氯化钙。答案:Ca(OH)2+2HCl====CaCl2+2H2O
【猜想】可能是CaCl2和HCl
【进行实验】溶液无明显变化(或溶液不变红色) 先有气体产生,后产生沉淀(只答出一种现象不可)
【反思与拓展】(1)反应物的用量 (2) a、c
(3)腐蚀铁质下水管(或污染水源)
石灰石(或CaCO3)
2.认识常见碱的一些化学性质;
3.通过探究,认识酸碱中和反应。稀盐酸、稀硫酸、稀氢氧化钠溶液、石灰水、镁条、锌粒、铜片、碳酸钠粉末、石灰石(或大理石)、生锈铁钉、生锈铜制品、硫酸铜溶液、蒸馏水等;
试管、烧杯、胶头滴管、玻璃棒等。1.常见酸的化学性质:气泡剧烈无明显现象氢气消失黄色消失蓝色气泡碳酸钠气体2.常见碱的化学性质:蓝色沉淀3.酸碱中和反应:红色碱性升高放出中性红色碱性1.在实验室为什么常用稀盐酸和大理石反应来制取CO2气体,而不用稀硫酸和大理石或稀盐酸和碳酸钠?
提示:由于稀硫酸与大理石反应生成微溶于水的硫酸钙,会附着在未反应的大理石表面,使反应自动停止,所以一般用稀盐酸而不用稀硫酸;由于稀盐酸和碳酸钠反应速度太快,不利于收集。
2.酸碱中和反应实验中,步骤(3)的目的是什么?
提示:由于酸溶液也不能使酚酞变色,再滴加氢氧化钠溶液是为了判断反应后的溶液呈中性还是酸性。 1. 下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
A.紫色石蕊溶液 B.氯化钠溶液
C.铁粉 D.pH试纸
【解析】选B。酸能使紫色石蕊溶液变红色,碱能使紫色石蕊溶液变蓝色,A能鉴别;氯化钠和氢氧化钠、稀盐酸都不反应,B不能鉴别;铁能和稀盐酸反应产生氢气,和氢氧化钠不反应,C能鉴别;碱的pH大于7,酸的pH小于7,D能鉴别。2.食醋中含有醋酸,食醋除作调味品外,在生活中还有些妙用,下列使用食醋肯定不能达到目的的是( )
A.除去菜刀上的铁锈
B.除去水壶壁上的水垢
C.清洗溅到皮肤上的碱液
D.鉴别黄金饰品中是否含有铜
【解析】选D。铁锈的主要成分是氧化铁,能与醋酸反应,A正确;水垢的主要成分是碳酸钙,能与醋酸反应,B正确;醋酸与碱能发生中和反应,C正确;铜不能与醋酸发生反应,D不正确。3.进行下列实验,根据实验现象得出的结论中,错误的
是( )
A.滴入紫色石蕊试液,溶液颜色变红,则该溶液显酸性
B.滴入无色酚酞试液,溶液保持无色,则该溶液显酸性
C.加入镁粉有气泡产生,则该溶液显酸性
D.加入石灰石,有气泡产生,则该溶液显酸性
【解析】选B。酚酞试液在酸性和中性溶液中均为无色,故不能判断该溶液一定是酸性溶液。4.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )【解析】选D。氢氧化钠溶液和澄清石灰水与盐酸反应都无明显现象,都能使酚酞变红,都产生蓝色沉淀,A、B、C都不正确;氢氧化钠溶液与二氧化碳反应无明显现象,澄清石灰水与二氧化碳反应,溶液变浑浊,D正确。5.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
【解析】选B。氢氧化钠与二氧化碳能发生化学反应生成碳酸钠,但碳酸钠易溶于水,故无白色沉淀生成。6.(双选)某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )【解析】选B、D。若反应后氢氧化钠过量,加硫酸铜后,氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀;氢氧化钠与硫酸反应生成硫酸钠和水,不论两者是否恰好完全反应,溶液中都有硫酸根离子,滴加氯化钡溶液后,都会出现白色沉淀;若硫酸过量,过量的硫酸与锌粒反应生成氢气;无色酚酞在中性或酸性条件下都不变色,所以在硫酸过量的条件下,滴加无色酚酞,溶液也不变色。7.小强在厨房里发现一瓶标签损坏的无色液体。
(1)他闻了闻,初步判断为白醋,小强是利用了白醋的______(选填“物理”或“化学”)性质作出的判断。
(2)他取少量此液体放入玻璃杯中,加入大理石,产生气体,说明该液体含有______(选填“酸性”“碱性”或“中性”)物质,进一步判断为白醋。
(3)他另取少量此液体滴入石蕊溶液,溶液变为______色,要使其变为蓝色,可向其中加入_____(填编号)。
a.食盐 b.熟石灰
c.白酒 d.水【解析】闻气味不需要经过化学变化,利用的是物理性质;碳酸钙与酸反应产生气体二氧化碳,由此证明该溶液显酸性;石蕊溶液遇酸变红色,要使其变为蓝色,需加入过量的碱,使溶液变为碱性。
答案:(1)物理 (2)酸性 (3)红 b8.某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为__________________,
待铁锈消失后又看到__________________________现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为溶液。这是由于过量的铁继续与黄色溶液的主要成分反应造成的,该反应的化学方程式为________________________________________________
_________________________________________________。【解析】本题考查学生对盐酸与铁锈反应的认知能力。铁锈的主要成分是三氧化二铁,能与盐酸反应生成氯化铁(溶液为黄色)和水,铁与盐酸反应生成氯化亚铁(溶液为浅绿色)和氢气,能观察到有气泡产生;观察到溶液为浅绿色,说明氯化铁溶液与铁钉中的铁发生反应变为氯化亚铁溶液。
答案:(1)Fe2O3+6HCl====2FeCl3+3H2O 有气泡产生
(2)氯化亚铁 Fe+2FeCl3====3FeCl29.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ.写出该中和反应的化学方程式:__________________。
Ⅱ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:________________________________。【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:___________________,结论:猜想一不正确。
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:___________________,结论:猜想二不正确,猜想三正确。【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑______________。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?______________(填序号)。
a.pH试纸 b.铜
c.紫色石蕊溶液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是___________(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的___________。【解析】氢氧化钙与盐酸反应生成氯化钙和水,由此写出化学方程式;【猜想】两者发生反应时有可能盐酸过量,也有可能氢氧化钙过量,还有可能两者恰好完全反应,故猜想三为可能是CaCl2和HCl;【进行实验】CaCl2溶液呈中性,Ca(OH)2溶液呈碱性,由于生成物氯化钙一定存在,故猜想一不正确,说明溶液中不含氢氧化钙,因此滴入酚酞溶液无明显变化;由结论:猜想二不正确,猜想三正确,说明溶液中有盐酸,因此加入碳酸钠后,有气体放出,由于碳酸钠过量,故碳酸钠还会与氯化钙反应生成碳酸钙沉淀。【反思与拓展】(1)在分析化学反应后所得物质成分时,除考虑生成物外,还需考虑反应物的用量;(2)盐酸呈酸性,故可以通过用pH试纸和紫色石蕊溶液进行验证,铜不与盐酸反应,由于氯化钙中含氯离子,也会与硝酸银反应生成沉淀,会对结果造成干扰,故铜与硝酸银都不能用来验证;(3)下水道大部分为铁质管道,酸液倒入下水道会腐蚀下水道,可以加入石灰石将盐酸转化为氯化钙。答案:Ca(OH)2+2HCl====CaCl2+2H2O
【猜想】可能是CaCl2和HCl
【进行实验】溶液无明显变化(或溶液不变红色) 先有气体产生,后产生沉淀(只答出一种现象不可)
【反思与拓展】(1)反应物的用量 (2) a、c
(3)腐蚀铁质下水管(或污染水源)
石灰石(或CaCO3)
