空气和生命复习课(2课时)[下学期]
图片预览








文档简介
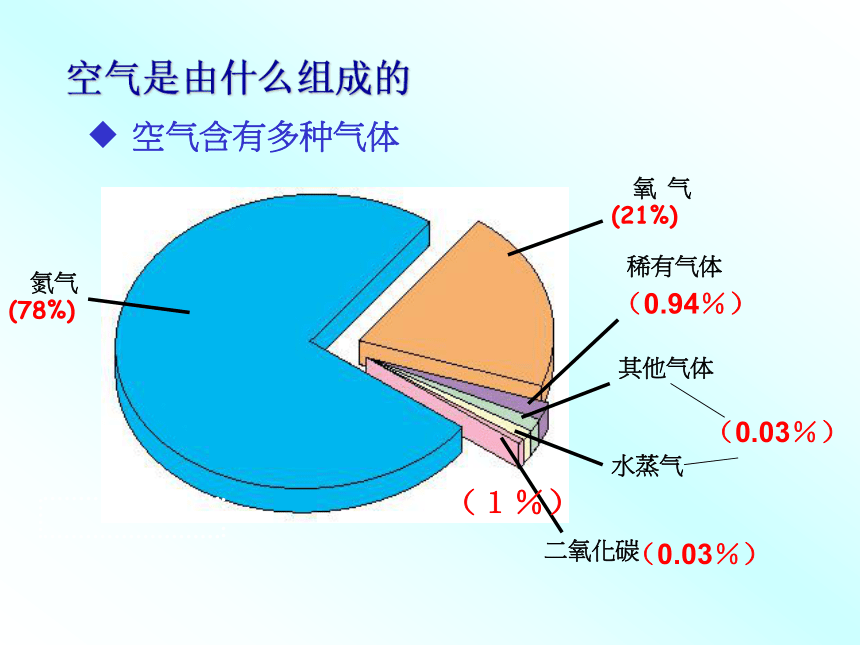
课件55张PPT。第二章复习课空气是由什么组成的空气含有多种气体(0.94%)
(0.03%)
(0.03%)
(1%)完成下表。1、构成人体蛋白质的主要元素1、可帮助病人呼吸 3、充入灯光,延长灯光寿命;充入食品保装袋防腐,保鲜。2、制化肥、炸药4、用作致冷剂,医疗上常用液氮冷冻麻醉或冷藏人 体细胞2、燃烧在氧气中燃烧后产生的高温火焰可用来切割或焊接金属1、植物光合作用的原料2、致冷剂、人工降雨3、工业原料:制纯碱、尿素、汽水4、灭火1、霓虹灯内充气2、激光技术,制造低温环境(氦气)用于医疗麻醉(氙气)氧气的性质:1、物理性质:(色、态、味、密度、溶解性等)氧气是一种_____色____味的气体;____溶于水,密度比空气____ 。无无不易略大钢瓶内装的是什么物质?
呈什么状态?淡蓝色的液态氧氧气在1标准大气压
下,降温到-183℃时
液化成淡蓝色液体,
-218 ℃时变成雪花
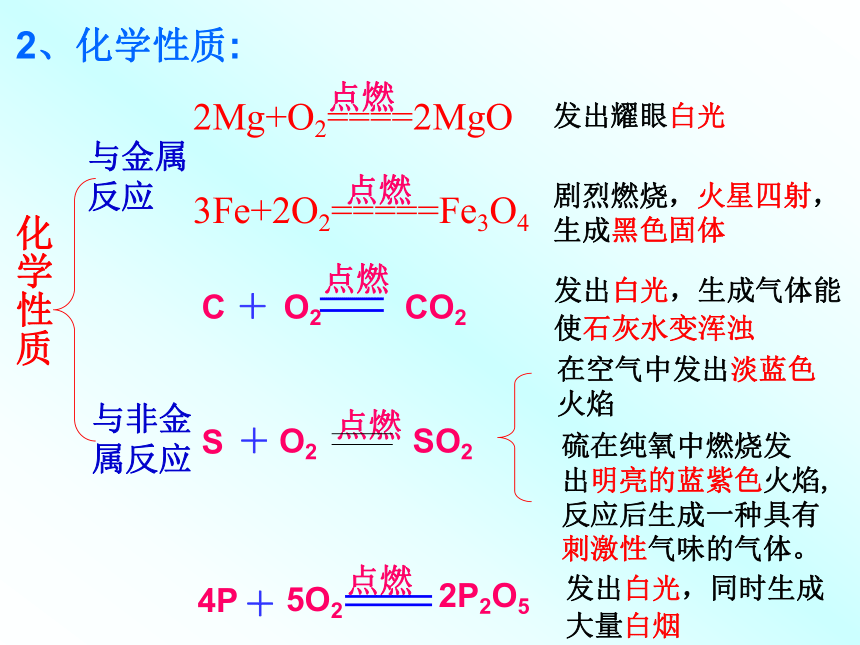
状的蓝色固体。二、氧气的化学性质1、木炭在氧气中燃烧:(1)实验现象:(2)反应方程式:剧烈燃烧,发出白光,生成能使澄清石灰水变浑浊的气体二、氧气的化学性质2、硫的燃烧:(1)实验现象:(2)反应方程式:微弱的淡蓝色火焰,生成有刺激性气味的气体在空气中:在氧气中:明亮的蓝紫色火焰,生成有刺激性气味的气体二、氧气的化学性质3、磷在氧气中燃烧:(1)实验现象:(2)反应方程式:发出耀眼的白光,产生大量的白烟二、氧气的化学性质4、铁在氧气中燃烧:(1)实验现象:(2)反应表达式:剧烈燃烧,火星四射,生成黑色固体思考:在Fe与O2气反应实验中,为什么要预先在集气瓶中装少量水或铺上一薄层细沙? 防止溅落的熔化物炸裂瓶底2、化学性质:化学性质与金属反应与非金属反应发出耀眼白光剧烈燃烧,火星四射,生成黑色固体发出白光,生成气体能
使石灰水变浑浊
发出白光,同时生成
大量白烟在空气中发出淡蓝色
火焰硫在纯氧中燃烧发
出明亮的蓝紫色火焰,
反应后生成一种具有
刺激性气味的气体。
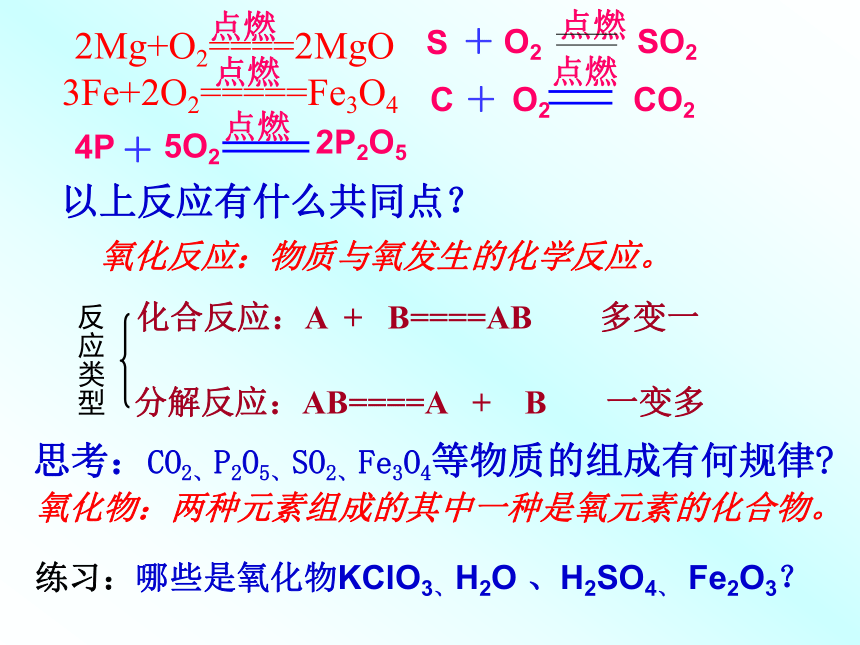
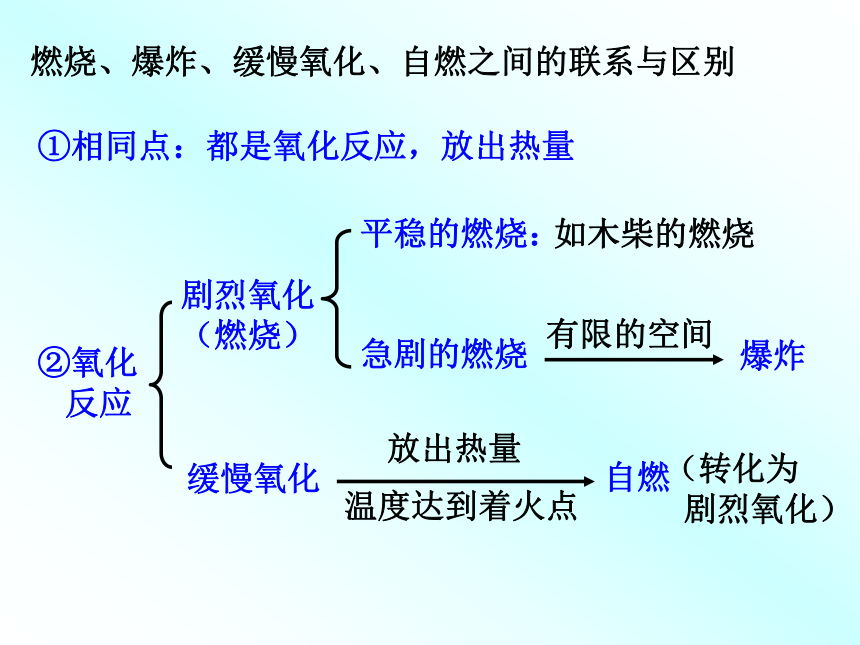
氧化反应:物质与氧发生的化学反应。化合反应:A + B====AB 多变一氧化物:两种元素组成的其中一种是氧元素的化合物。以上反应有什么共同点?思考:CO2、P2O5、SO2、Fe3O4等物质的组成有何规律?练习:哪些是氧化物KClO3、H2O 、H2SO4、 Fe2O3?分解反应:AB====A + B 一变多反应类型燃烧、爆炸、缓慢氧化、自燃之间的联系与区别①相同点:都是氧化反应,放出热量②氧化
反应剧烈氧化
(燃烧)缓慢氧化平稳的燃烧:
急剧的燃烧如木柴的燃烧有限的空间爆炸放出热量温度达到着火点自燃(转化为
剧烈氧化)燃烧的条件可燃物燃烧必须同时满足两个条件:
1、要有氧气参与;
2、温度要达到一定的温度燃烧的条件1、可燃物
2、有氧气参与
3、温度要达到着火点着火点:物质着火燃烧所需的最低温度。
每种物质的着火点是不同的,这是
物质的一种特性。 2.将镁条点燃后,伸入到装有二氧化碳的集气瓶中,发现镁条仍能继续燃烧,生成了白色的氧化镁和黑色的碳粉。该过程用化学方程式表示为: 。我们可以知道,可燃物燃烧时不一定都与 反应。 氧气1.下列灭火的措施中不恰当的是 ( )
(1)炒菜时,锅里的油起火应采取的最佳灭火措施是盖上锅盖(2)秸秆,柴草着火,最好用嘴吹灭 (3)熄灭酒精灯,最好用嘴吹灭(4)电器着火,应当先切断电源,再用干粉灭火器灭火(5)汽油着火,应立即用水浇灭(6)撒在实验桌上的酒精着火,应用湿的抹布盖灭
A.135 B.246 C.136 D.235
D?3. 下列变化属于缓慢氧化的是???? ? ;属于自燃的是??? ?? ;属于燃烧的是???? ? ;属于爆炸的是??? ?? 。(均用序号填写)
??? A.农家肥料的腐烂
??? B.存放汽油的仓库里接触到火星而发生火灾
??? C.棉花在不通风的地方堆放得太多,又长时间不翻动而着火
D.用蜡烛照明ACCBCDB1.常温下是一种无色无味的气体
2.密度比空气大(所以能覆盖灭火)3.微溶于水(所以可制各种汽水)4.二氧化碳也有三态的变化,固态二氧化碳的俗称干冰
(可致冷,也可用于人工降雨)干冰升华人工降雨二氧化碳的性质1、物理性质:(色、态、味、密度、溶解性等)4.二氧化碳与澄清石灰水{ Ca(OH)2的水溶液}反应:(3)这是二氧化碳的特征性反应,据此可检验某气体
是否是二氧化碳.(1)现象:澄清石灰水变浑浊(2)原因:生成了难溶于水的白色固体碳酸钙H2O + CO2 = H2CO3 (碳酸具有酸性能使紫色石蕊变红)1.一般情况下,二氧化碳既不可燃,也不支持燃烧。
(所以二氧化碳可以灭火。)2.二氧化碳不能供给呼吸。3.二氧化碳与水的反应:你知道二氧化碳的化学性质吗?
1、在四个集气瓶中,分别盛着氢气、氧气、二氧化碳、空气,如何用简单的实验把它们一一区别出来?
2、在一个刚用石灰浆粉刷的房间内放一个炭火盆,当时看到的情况是______________[多选]
(1)墙壁硬化加快 (2)墙壁硬化变慢
(3)墙壁更潮湿 (4)墙壁变干燥些(1) (3)白磷燃烧前后的质量测定这个实验得出了什么结论?质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。你知道质量守恒的原因吗?你知道吗?1、下列事实不能用质量守恒定律来解释的是( )
A.镁带在空气中燃烧后,生成的氧化镁的质量比镁重.
B.煤燃烧后留下的煤灰比煤轻.
C.16克硫在氧气中燃烧生成32克二氧化硫.
D.水加热沸腾一段时间后质量变轻.
2、在化学反应前后一定不发生变化的有_ _ 。
A、分子个数;B、原子的种类D;C、元素的种类;D、反应物质量总和与生成物质量总和;E、物质的种类DB、C、D3、蜡烛燃烧后的产物有二氧化碳和水,根据质量守恒定律可知,该物质的组成中一定含有 元素和 元素,可能含有的是 元素。
4、在A + B → C + D的反应中,5克A和一定的B恰好完全反应,生成3克C和10克D,则B的质量是 ( )
A.18克 B.7克 C.8克 D.6克COCH你会写吗?化学方程式用化学式表示化学反应的式子书写原则:1.以客观事实为依据,(反应是真实存在的)
2.符合质量守恒定律
书写步骤:
写写出反应物和生成物的分子式配配平化学方程式等将短线改为等号 注注明反应条件,生成物的状态你知道下式代表什么意义吗?124 160 2841、表示磷和氧气参加反应,结果生成五氧化二磷。2、表示反应在点燃的条件下进行
3、表示反应物中磷原子、氧分子和生成物
中五氧化二磷分子的个数比为4∶5∶2。4、表示124份质量的磷与160份质量的氧气反应生成
284份质量的五氧化二磷。质量比为31∶40∶711. 只根据化学方程式不能知道的是 ( )
A.反应物、生成物 B.反应条件
C.各物质间的质量之比 D.各物质的物理性质 3.在A+2B===C+2D的反应中,若 A、B、C的相对分子质量依次为16、32、44,则D的相对分子质量为 ( )
A.4 B.36 C.18 D.无法确定DC例1、加热分解5.8克氯酸钾,可以得到多少克氧气?解:设加热分解5.8克氯酸钾得到氧气的质量为x1、设未知数:
一般是求什么,
设什么。245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气。2、正确的写出
化学方程式:3、找出有关物质
的量:上下对齐,
已知量单位要写出4、列比例式:5、求解:
(除不尽时一般
保留一位小数)6、简明写出
答案。根据化学方程式的计算步骤:
设、写、 找、列、解、答思考:
1、上例中,同时生成氯化钾
多少克?如何解答?
2、实验室要制取2.3克氧气,
需分解多少克氯酸钾?
如何改动?你会算吗?根椐化学方程式计算例1、加热分解5.8克氯酸钾,可以得到多少克氧气?同时生成氯化钾多少克?解:设加热分解5.8克氯酸钾得到氧气
的质量为x,245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气;同时生成氯化钾的质量为y149y245∶149==5.8克∶yy=3.5克同时可得到3.5克氯化钾。根据化学方程式计算时应注意:步骤要完整
解题要规范
得数要准确三个要领三个关键准确书写化学式
配平化学方程式
准确计算各物质的质量比计算时还要注意:
必须代入纯净物的质量,若是体积,
要根据密度换算成物质的质量。二、有关不纯物质的计算。** 化学反应方程式中不管是反应物还是生成物,代入的都是纯物质的质量。如果遇到不纯反应物或生成物,应将不纯物质换算成纯物质的质量。** 不纯物质和纯物质质量间的换算:纯物质的质量 = 不纯物质的质量 ×纯度例题2:
在二氧化锰的催化下,加热氯酸钾来制取氧气,如果用20克纯度为96%的氯酸钾起反应,能制得多少克氧气?练习:
有一不纯的锌片15.25克,跟足量的稀硫酸完全反应(杂质不参加反应),生成0.4克氢气,求此锌片中含锌的质量分数。
(Zn + H2SO4 === ZnSO4 + H2↑)加热高锰酸钾(或氯酸钾)法分解双氧水法氧气的制取1、工业制法:膜分离技术分离液态空气2、氧气的实验室制法:制取操作步骤1、检查气密性2、装入药品3、固定装置4、加热5、收集6、将导管移出水面7、撤去酒精灯如果1和2、6和7互相换位,结果会怎样发生装置收集装置(1)原理:(2)收集方法:排水法(不易溶于水)向上排空气法(密度比空气略大)(3)验满方法:(4)注意事项: 将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。本实验装置易错处:1)试管口应略向下2)导管应稍露出橡皮塞3)酒精灯应用外焰加热4)铁夹应夹在离试管口1/3处5)火焰应加热在试管底部6)酒精量不少于1/4,不多于2/37)排水收集时导管不能太长二氧化碳的制取原料:石灰石(碳酸钙)、盐酸原理:装置:锥形瓶(或平底烧瓶)、长颈漏斗、导管(橡皮塞)、集气瓶。收集:向上排空气法 工业制法:煅烧石灰石实验室制法:验满:用燃着的木条放在瓶口检验一、二氧化碳的实验室制法1、制法原理CaCO3+2HCl==CaCl2 + H2O + CO2↑原料选择:a为什么不用碳酸钠? 速度太快,不易控制石灰石或大理石、稀盐酸b为什么不用稀硫酸? 生成硫酸钙是微溶物质,附着在石灰石表面,使之与稀硫酸隔绝,阻碍反应进行。c、为什么不用浓盐酸因为浓盐酸有挥发性,生成的二氧化碳中含有大量的氯化氢气体该仪器的适用范围
a、固液反应;
b、不需加热。2、发生装置选择:——启普发生器或简易装置思考:如何检查装置的气密性?制二氧化碳装置注意点液封要加热吗?导气管稍露出橡皮塞即可3、收集装置与收集方法收集方法:排水集气法 向上排空法人体呼吸系统的构成呼吸道 肺:鼻咽 气管 支气管喉呼吸系统 肺泡呼吸(呼气和吸气)过程吸气:膈肌、肋间肌————,肋骨———,胸腔容积————,肺扩张,肺内气压——,小于大气压,外界气体进入————。呼气:——————舒张,——————向下向内移动,胸腔容积——,肺借本身的弹性而回缩,肺内气压————,大于大气压,——————内的气体排到体外。收缩向上向外移升增大减小肺内膈肌和肋间肌肋骨减小增大肺O2CO2肺泡内的气体交换O2CO2组织内的气体交换 指细胞内的有机物与氧发生反应,最终产生二氧化碳、水和其它产物,同时把有机物中的能量释放出来,供生命活动的需要。呼吸作用的反应式 :呼吸作用光合作用 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物质,并释放氧气的过程。光叶绿体二氧化碳 +氧气+水光合作用和呼吸作用的区别与联系1.光合作用的原料刚好是呼吸作用的产物。2.光合作用所需要的能量来自于呼吸作用分解有机物而得到的能量,呼吸作用时分解释放的能量是光合作用时贮藏在有机物中的能量。3.没有光合作用就不可能有呼吸作用,没有呼吸作用也不可能有光合作用,它们之间是一种相互依存和相互对立的关系,推动着植物全部的生命活动。联系:区别:吸收排出吸收释放制造分解吸收是否是否释放自然界中的氧循环1、大自然中产生氧气的主要途径:绿色植物的光合作用2、大自然中消耗氧气的主要途径:(1)各种燃料的燃烧
(2)动植物的呼吸作用 大自然中氧气的含量会随着生物的呼吸和物质的燃烧等而减少,但又会随植物的光合作用而增加,周而复始地进行循环。这就是自然界的氧循环。自然界中的碳循环1、CO2→ _______作用→ _______物→ ____________作用 → CO2光合有机植物呼吸2、CO2→ _______作用→_______物→______吸收→ 体内氧化→CO2光合有机动物 3、CO2→______作用→_______物→动植物尸体 →微生物分解→CO2 光合有机4、CO2→______作用→______物→动植物残体→地下漫长反应→煤、石油、天然气→燃烧→CO2光合有机在大自然中,消耗氧气的途径主要有哪些?产生氧气的途径主要是什么?消耗氧气的途径主要有:(1)各种燃料的燃烧(2)生物的呼吸(3)微生物氧化分解有机物绿色植物的光合作 用产生氧气的途径:
1、臭氧化学式:O3
紫外线
(1)来源: O2=====2O O+O2====O3(2)臭氧的性质:是一种蓝色带腥臭味的气体,有很强的氧化性和不稳定性(3)分布:臭氧主要集中在大气平流层(距地面20—35千米处)——臭氧层 2、臭氧层的作用:阻挡和削弱过强的紫外线,对生 物起保护作 用 造成空气污染的因素(1)燃料燃烧排放的废气和烟尘
(2)工业废气(3)汽车等车辆排放的尾气(4)燃烧香烟、建筑装饰材料释放的有毒气体空气污染的种类是如何划分? 空气污染的种类 (1)汽车尾气:
二氧化硫、氮氧化物(主要是一氧化氮
和二氧化氮)、碳氧化物(二氧化碳和
一氧化碳)、碳氢化合物等光化学烟雾污染:汽车排放的废气在阳光紫外线的照射下,
发生一系列化学反应,反应产物与废气一
起构成光化学烟雾污染具体表现:烟雾弥漫呈浅兰色,危害:刺激眼睛和呼吸道黏膜,引起眼睛
红肿和喉炎。(2)烟尘等可吸入颗粒物当空气中可吸入颗粒物过多时,就会直接影响
人们的生活与生产,如引起慢性气管炎、矽肺、
肺癌等疾病和影响制药或电子产品的质量等。 (3)酸雨:pH低于5.6的酸性降水叫酸雨成因:空气中的二氧化硫、氮氧化物在
降水时溶解在水中形成有害的硫酸
和硝酸的缘故危害:酸雨直接危害人类健康;酸雨使水域和
土壤酸化,损害农作物和林木生长,危害
渔业;腐蚀建筑物、工厂设备和文化古迹。
保护空气的措施:(1)控制污染源,
加强空气质量滥测
和预报(2)发展“绿色工业”,
使用洁净无污染的能源(3)植树造林,绿化环境(4)制订环境保护法AD
(0.03%)
(0.03%)
(1%)完成下表。1、构成人体蛋白质的主要元素1、可帮助病人呼吸 3、充入灯光,延长灯光寿命;充入食品保装袋防腐,保鲜。2、制化肥、炸药4、用作致冷剂,医疗上常用液氮冷冻麻醉或冷藏人 体细胞2、燃烧在氧气中燃烧后产生的高温火焰可用来切割或焊接金属1、植物光合作用的原料2、致冷剂、人工降雨3、工业原料:制纯碱、尿素、汽水4、灭火1、霓虹灯内充气2、激光技术,制造低温环境(氦气)用于医疗麻醉(氙气)氧气的性质:1、物理性质:(色、态、味、密度、溶解性等)氧气是一种_____色____味的气体;____溶于水,密度比空气____ 。无无不易略大钢瓶内装的是什么物质?
呈什么状态?淡蓝色的液态氧氧气在1标准大气压
下,降温到-183℃时
液化成淡蓝色液体,
-218 ℃时变成雪花
状的蓝色固体。二、氧气的化学性质1、木炭在氧气中燃烧:(1)实验现象:(2)反应方程式:剧烈燃烧,发出白光,生成能使澄清石灰水变浑浊的气体二、氧气的化学性质2、硫的燃烧:(1)实验现象:(2)反应方程式:微弱的淡蓝色火焰,生成有刺激性气味的气体在空气中:在氧气中:明亮的蓝紫色火焰,生成有刺激性气味的气体二、氧气的化学性质3、磷在氧气中燃烧:(1)实验现象:(2)反应方程式:发出耀眼的白光,产生大量的白烟二、氧气的化学性质4、铁在氧气中燃烧:(1)实验现象:(2)反应表达式:剧烈燃烧,火星四射,生成黑色固体思考:在Fe与O2气反应实验中,为什么要预先在集气瓶中装少量水或铺上一薄层细沙? 防止溅落的熔化物炸裂瓶底2、化学性质:化学性质与金属反应与非金属反应发出耀眼白光剧烈燃烧,火星四射,生成黑色固体发出白光,生成气体能
使石灰水变浑浊
发出白光,同时生成
大量白烟在空气中发出淡蓝色
火焰硫在纯氧中燃烧发
出明亮的蓝紫色火焰,
反应后生成一种具有
刺激性气味的气体。
氧化反应:物质与氧发生的化学反应。化合反应:A + B====AB 多变一氧化物:两种元素组成的其中一种是氧元素的化合物。以上反应有什么共同点?思考:CO2、P2O5、SO2、Fe3O4等物质的组成有何规律?练习:哪些是氧化物KClO3、H2O 、H2SO4、 Fe2O3?分解反应:AB====A + B 一变多反应类型燃烧、爆炸、缓慢氧化、自燃之间的联系与区别①相同点:都是氧化反应,放出热量②氧化
反应剧烈氧化
(燃烧)缓慢氧化平稳的燃烧:
急剧的燃烧如木柴的燃烧有限的空间爆炸放出热量温度达到着火点自燃(转化为
剧烈氧化)燃烧的条件可燃物燃烧必须同时满足两个条件:
1、要有氧气参与;
2、温度要达到一定的温度燃烧的条件1、可燃物
2、有氧气参与
3、温度要达到着火点着火点:物质着火燃烧所需的最低温度。
每种物质的着火点是不同的,这是
物质的一种特性。 2.将镁条点燃后,伸入到装有二氧化碳的集气瓶中,发现镁条仍能继续燃烧,生成了白色的氧化镁和黑色的碳粉。该过程用化学方程式表示为: 。我们可以知道,可燃物燃烧时不一定都与 反应。 氧气1.下列灭火的措施中不恰当的是 ( )
(1)炒菜时,锅里的油起火应采取的最佳灭火措施是盖上锅盖(2)秸秆,柴草着火,最好用嘴吹灭 (3)熄灭酒精灯,最好用嘴吹灭(4)电器着火,应当先切断电源,再用干粉灭火器灭火(5)汽油着火,应立即用水浇灭(6)撒在实验桌上的酒精着火,应用湿的抹布盖灭
A.135 B.246 C.136 D.235
D?3. 下列变化属于缓慢氧化的是???? ? ;属于自燃的是??? ?? ;属于燃烧的是???? ? ;属于爆炸的是??? ?? 。(均用序号填写)
??? A.农家肥料的腐烂
??? B.存放汽油的仓库里接触到火星而发生火灾
??? C.棉花在不通风的地方堆放得太多,又长时间不翻动而着火
D.用蜡烛照明ACCBCDB1.常温下是一种无色无味的气体
2.密度比空气大(所以能覆盖灭火)3.微溶于水(所以可制各种汽水)4.二氧化碳也有三态的变化,固态二氧化碳的俗称干冰
(可致冷,也可用于人工降雨)干冰升华人工降雨二氧化碳的性质1、物理性质:(色、态、味、密度、溶解性等)4.二氧化碳与澄清石灰水{ Ca(OH)2的水溶液}反应:(3)这是二氧化碳的特征性反应,据此可检验某气体
是否是二氧化碳.(1)现象:澄清石灰水变浑浊(2)原因:生成了难溶于水的白色固体碳酸钙H2O + CO2 = H2CO3 (碳酸具有酸性能使紫色石蕊变红)1.一般情况下,二氧化碳既不可燃,也不支持燃烧。
(所以二氧化碳可以灭火。)2.二氧化碳不能供给呼吸。3.二氧化碳与水的反应:你知道二氧化碳的化学性质吗?
1、在四个集气瓶中,分别盛着氢气、氧气、二氧化碳、空气,如何用简单的实验把它们一一区别出来?
2、在一个刚用石灰浆粉刷的房间内放一个炭火盆,当时看到的情况是______________[多选]
(1)墙壁硬化加快 (2)墙壁硬化变慢
(3)墙壁更潮湿 (4)墙壁变干燥些(1) (3)白磷燃烧前后的质量测定这个实验得出了什么结论?质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。你知道质量守恒的原因吗?你知道吗?1、下列事实不能用质量守恒定律来解释的是( )
A.镁带在空气中燃烧后,生成的氧化镁的质量比镁重.
B.煤燃烧后留下的煤灰比煤轻.
C.16克硫在氧气中燃烧生成32克二氧化硫.
D.水加热沸腾一段时间后质量变轻.
2、在化学反应前后一定不发生变化的有_ _ 。
A、分子个数;B、原子的种类D;C、元素的种类;D、反应物质量总和与生成物质量总和;E、物质的种类DB、C、D3、蜡烛燃烧后的产物有二氧化碳和水,根据质量守恒定律可知,该物质的组成中一定含有 元素和 元素,可能含有的是 元素。
4、在A + B → C + D的反应中,5克A和一定的B恰好完全反应,生成3克C和10克D,则B的质量是 ( )
A.18克 B.7克 C.8克 D.6克COCH你会写吗?化学方程式用化学式表示化学反应的式子书写原则:1.以客观事实为依据,(反应是真实存在的)
2.符合质量守恒定律
书写步骤:
写写出反应物和生成物的分子式配配平化学方程式等将短线改为等号 注注明反应条件,生成物的状态你知道下式代表什么意义吗?124 160 2841、表示磷和氧气参加反应,结果生成五氧化二磷。2、表示反应在点燃的条件下进行
3、表示反应物中磷原子、氧分子和生成物
中五氧化二磷分子的个数比为4∶5∶2。4、表示124份质量的磷与160份质量的氧气反应生成
284份质量的五氧化二磷。质量比为31∶40∶711. 只根据化学方程式不能知道的是 ( )
A.反应物、生成物 B.反应条件
C.各物质间的质量之比 D.各物质的物理性质 3.在A+2B===C+2D的反应中,若 A、B、C的相对分子质量依次为16、32、44,则D的相对分子质量为 ( )
A.4 B.36 C.18 D.无法确定DC例1、加热分解5.8克氯酸钾,可以得到多少克氧气?解:设加热分解5.8克氯酸钾得到氧气的质量为x1、设未知数:
一般是求什么,
设什么。245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气。2、正确的写出
化学方程式:3、找出有关物质
的量:上下对齐,
已知量单位要写出4、列比例式:5、求解:
(除不尽时一般
保留一位小数)6、简明写出
答案。根据化学方程式的计算步骤:
设、写、 找、列、解、答思考:
1、上例中,同时生成氯化钾
多少克?如何解答?
2、实验室要制取2.3克氧气,
需分解多少克氯酸钾?
如何改动?你会算吗?根椐化学方程式计算例1、加热分解5.8克氯酸钾,可以得到多少克氧气?同时生成氯化钾多少克?解:设加热分解5.8克氯酸钾得到氧气
的质量为x,245965.8克x245∶96==5.8克∶xX=2.3克答:加热分解5.8克氯酸钾,可得到2.3克氧气;同时生成氯化钾的质量为y149y245∶149==5.8克∶yy=3.5克同时可得到3.5克氯化钾。根据化学方程式计算时应注意:步骤要完整
解题要规范
得数要准确三个要领三个关键准确书写化学式
配平化学方程式
准确计算各物质的质量比计算时还要注意:
必须代入纯净物的质量,若是体积,
要根据密度换算成物质的质量。二、有关不纯物质的计算。** 化学反应方程式中不管是反应物还是生成物,代入的都是纯物质的质量。如果遇到不纯反应物或生成物,应将不纯物质换算成纯物质的质量。** 不纯物质和纯物质质量间的换算:纯物质的质量 = 不纯物质的质量 ×纯度例题2:
在二氧化锰的催化下,加热氯酸钾来制取氧气,如果用20克纯度为96%的氯酸钾起反应,能制得多少克氧气?练习:
有一不纯的锌片15.25克,跟足量的稀硫酸完全反应(杂质不参加反应),生成0.4克氢气,求此锌片中含锌的质量分数。
(Zn + H2SO4 === ZnSO4 + H2↑)加热高锰酸钾(或氯酸钾)法分解双氧水法氧气的制取1、工业制法:膜分离技术分离液态空气2、氧气的实验室制法:制取操作步骤1、检查气密性2、装入药品3、固定装置4、加热5、收集6、将导管移出水面7、撤去酒精灯如果1和2、6和7互相换位,结果会怎样发生装置收集装置(1)原理:(2)收集方法:排水法(不易溶于水)向上排空气法(密度比空气略大)(3)验满方法:(4)注意事项: 将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。本实验装置易错处:1)试管口应略向下2)导管应稍露出橡皮塞3)酒精灯应用外焰加热4)铁夹应夹在离试管口1/3处5)火焰应加热在试管底部6)酒精量不少于1/4,不多于2/37)排水收集时导管不能太长二氧化碳的制取原料:石灰石(碳酸钙)、盐酸原理:装置:锥形瓶(或平底烧瓶)、长颈漏斗、导管(橡皮塞)、集气瓶。收集:向上排空气法 工业制法:煅烧石灰石实验室制法:验满:用燃着的木条放在瓶口检验一、二氧化碳的实验室制法1、制法原理CaCO3+2HCl==CaCl2 + H2O + CO2↑原料选择:a为什么不用碳酸钠? 速度太快,不易控制石灰石或大理石、稀盐酸b为什么不用稀硫酸? 生成硫酸钙是微溶物质,附着在石灰石表面,使之与稀硫酸隔绝,阻碍反应进行。c、为什么不用浓盐酸因为浓盐酸有挥发性,生成的二氧化碳中含有大量的氯化氢气体该仪器的适用范围
a、固液反应;
b、不需加热。2、发生装置选择:——启普发生器或简易装置思考:如何检查装置的气密性?制二氧化碳装置注意点液封要加热吗?导气管稍露出橡皮塞即可3、收集装置与收集方法收集方法:排水集气法 向上排空法人体呼吸系统的构成呼吸道 肺:鼻咽 气管 支气管喉呼吸系统 肺泡呼吸(呼气和吸气)过程吸气:膈肌、肋间肌————,肋骨———,胸腔容积————,肺扩张,肺内气压——,小于大气压,外界气体进入————。呼气:——————舒张,——————向下向内移动,胸腔容积——,肺借本身的弹性而回缩,肺内气压————,大于大气压,——————内的气体排到体外。收缩向上向外移升增大减小肺内膈肌和肋间肌肋骨减小增大肺O2CO2肺泡内的气体交换O2CO2组织内的气体交换 指细胞内的有机物与氧发生反应,最终产生二氧化碳、水和其它产物,同时把有机物中的能量释放出来,供生命活动的需要。呼吸作用的反应式 :呼吸作用光合作用 绿色植物在阳光的作用下,利用二氧化碳和水等物质制造有机物质,并释放氧气的过程。光叶绿体二氧化碳 +氧气+水光合作用和呼吸作用的区别与联系1.光合作用的原料刚好是呼吸作用的产物。2.光合作用所需要的能量来自于呼吸作用分解有机物而得到的能量,呼吸作用时分解释放的能量是光合作用时贮藏在有机物中的能量。3.没有光合作用就不可能有呼吸作用,没有呼吸作用也不可能有光合作用,它们之间是一种相互依存和相互对立的关系,推动着植物全部的生命活动。联系:区别:吸收排出吸收释放制造分解吸收是否是否释放自然界中的氧循环1、大自然中产生氧气的主要途径:绿色植物的光合作用2、大自然中消耗氧气的主要途径:(1)各种燃料的燃烧
(2)动植物的呼吸作用 大自然中氧气的含量会随着生物的呼吸和物质的燃烧等而减少,但又会随植物的光合作用而增加,周而复始地进行循环。这就是自然界的氧循环。自然界中的碳循环1、CO2→ _______作用→ _______物→ ____________作用 → CO2光合有机植物呼吸2、CO2→ _______作用→_______物→______吸收→ 体内氧化→CO2光合有机动物 3、CO2→______作用→_______物→动植物尸体 →微生物分解→CO2 光合有机4、CO2→______作用→______物→动植物残体→地下漫长反应→煤、石油、天然气→燃烧→CO2光合有机在大自然中,消耗氧气的途径主要有哪些?产生氧气的途径主要是什么?消耗氧气的途径主要有:(1)各种燃料的燃烧(2)生物的呼吸(3)微生物氧化分解有机物绿色植物的光合作 用产生氧气的途径:
1、臭氧化学式:O3
紫外线
(1)来源: O2=====2O O+O2====O3(2)臭氧的性质:是一种蓝色带腥臭味的气体,有很强的氧化性和不稳定性(3)分布:臭氧主要集中在大气平流层(距地面20—35千米处)——臭氧层 2、臭氧层的作用:阻挡和削弱过强的紫外线,对生 物起保护作 用 造成空气污染的因素(1)燃料燃烧排放的废气和烟尘
(2)工业废气(3)汽车等车辆排放的尾气(4)燃烧香烟、建筑装饰材料释放的有毒气体空气污染的种类是如何划分? 空气污染的种类 (1)汽车尾气:
二氧化硫、氮氧化物(主要是一氧化氮
和二氧化氮)、碳氧化物(二氧化碳和
一氧化碳)、碳氢化合物等光化学烟雾污染:汽车排放的废气在阳光紫外线的照射下,
发生一系列化学反应,反应产物与废气一
起构成光化学烟雾污染具体表现:烟雾弥漫呈浅兰色,危害:刺激眼睛和呼吸道黏膜,引起眼睛
红肿和喉炎。(2)烟尘等可吸入颗粒物当空气中可吸入颗粒物过多时,就会直接影响
人们的生活与生产,如引起慢性气管炎、矽肺、
肺癌等疾病和影响制药或电子产品的质量等。 (3)酸雨:pH低于5.6的酸性降水叫酸雨成因:空气中的二氧化硫、氮氧化物在
降水时溶解在水中形成有害的硫酸
和硝酸的缘故危害:酸雨直接危害人类健康;酸雨使水域和
土壤酸化,损害农作物和林木生长,危害
渔业;腐蚀建筑物、工厂设备和文化古迹。
保护空气的措施:(1)控制污染源,
加强空气质量滥测
和预报(2)发展“绿色工业”,
使用洁净无污染的能源(3)植树造林,绿化环境(4)制订环境保护法AD
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
