核外电子排布[下学期]
图片预览









文档简介
课件37张PPT。核外电子排布的初步知识上课原子的发现史公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
1.道尔顿原子模型(1803年)
2.汤姆生原子模型(1904年)
3.卢瑟福原子模型(1911年)
4.波尔原子模型(1913年)
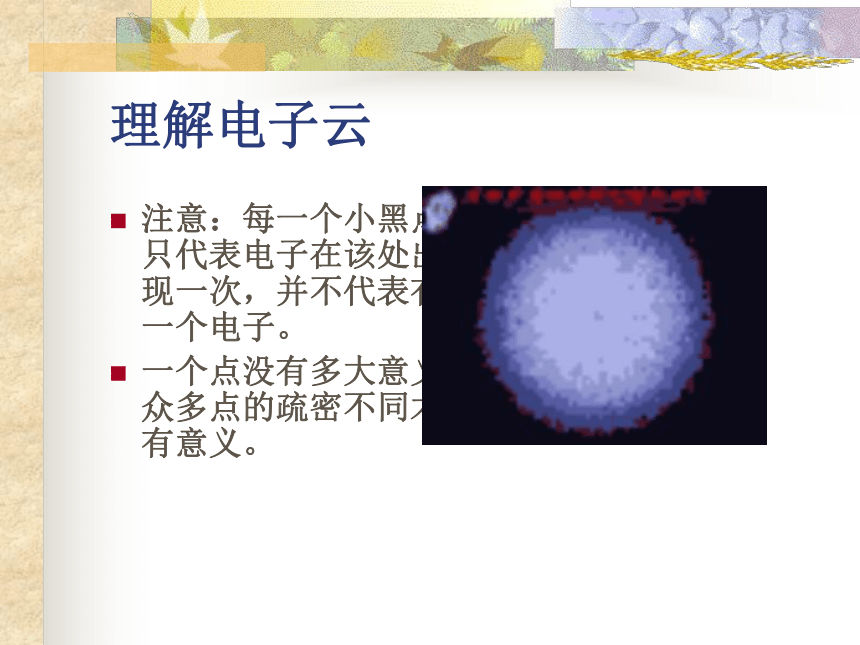
5.电子云模型(1927~1935年)道尔顿原子模型 原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。汤姆生原子模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。卢瑟福原子模型 原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就象行星环绕太阳运转一样。波尔原子模型 电子在原子核外空间的一定轨道上绕核做高速的圆周运动。电子云模型现代物质结构学说。波粒二象性。理解电子云注意:每一个小黑点只代表电子在该处出现一次,并不代表有一个电子。
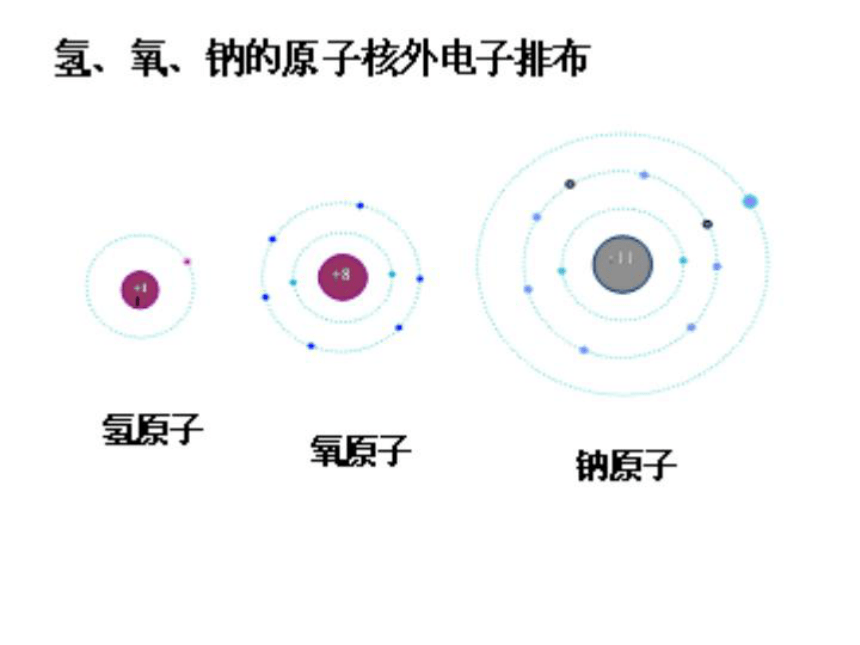
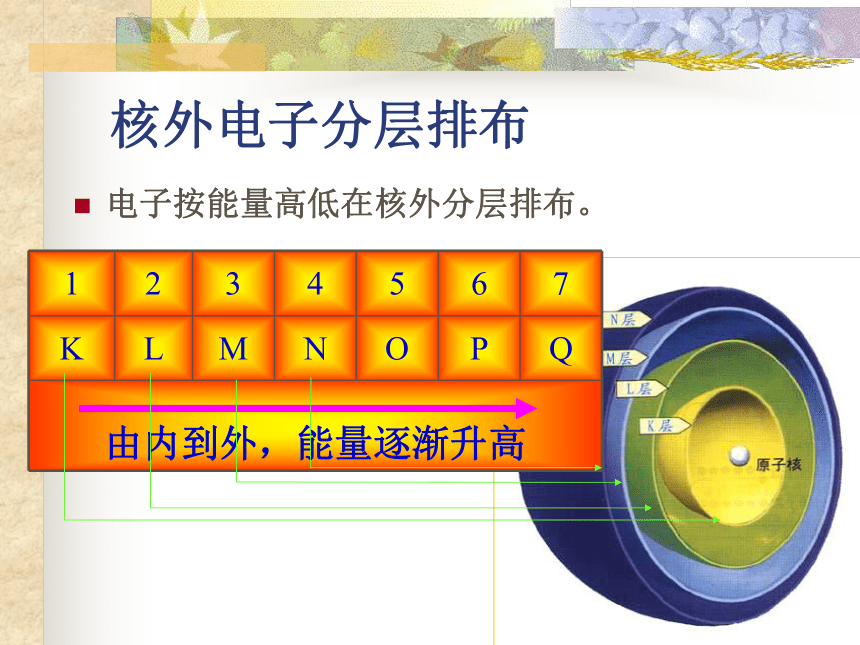
一个点没有多大意义,众多点的疏密不同才有意义。核 外 电 子 的 分 层 排 布1-18号元素的原子结构示意图离 子氯 化 钠 的 形 成小 结作 业退 出核外电子分层排布电子按能量高低在核外分层排布。 氢原子核外只有一个电子,比较简单。 在含有多个电子的原子里,电子是分层运动的。以离核的远近,由里往外依次分为一、二、三、四、五、六、七层。
电子层数、离核距离、能量高低之关系如下所示:电子层 1 2 3 4 5 6 7
返回一、核外电子的分层排布逐 渐 到逐 渐 到 1. 原子结构示意图
如氧原子的结构示意图如下所示:原子核核内质子数二、1-18号元素的原子结构示意图电子层电子层上的电子个数注:每个电子层上所容纳的电子个数为2n2 个1—18号原子结构示意图 锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne) 钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar) 氢(H) 氦(He) +1核外电子排 布 规 律K→ L → M→N → O → P2→ 8 →18→32→50→ 2n21→ 2 → 3→ 4→ 5 → 6[小结]:(1)第一层电子数不超过去2个;第2层电子数不超过去8个;最外层电子数不超过去8个;每个电子层最多只能排布2n2个电子。次外层最多不超过18个电子。
(2)电子总是先排内层,后排外层。电子总是尽先排布在能量最低的电子层里
(3)不同种类的元素的原子,核外电子的排布各有特点:3. 元素原子的最外层电子
数目和元素性质的关系 最外层
电子数得失电子元素性质金属性
非金属性
稳定性易失
易得
稳定金属元素
非金属元素
稀有气体元素一般<4
一般≥4
8或2(He)类型项目称有气体元素原子电子层排布1.稳定结构:通常把最外层电子数为8(第一层作最外层时有2 个电子)的结构,叫做稳定结构。
2.离子:带电荷的原子叫离子。它通常由原子(或原子团)通过得或失电子而形成。如:Na 失1e → Na+ O 得2e → O2- Al 失3e → Al3+Cl 得e → Cl- 三、离子1、离子:带电的原子或原子团2、离子的表示法--离子符号阳离子:H+ ,Na+,Mg2+,……(NH4+) 阴离子:Cl-,F-,O2-,S2-,……(OH-,SO42-) 3、离子符号的意义2Mg2+表示两个镁离子 表示每个镁离子带两个单位的正电荷 返回(数字“2”的意义)4、离子跟原子的比较核内质子数=
核外电子数核内质子数>
核外电子数核内质子数<
核外电子数不带电带正电带负电用元素符号表示 Na,S 用离子符号表示Na+用离子符号表示 S2-原子失电子返回阳离子得电子阴离子失电子得电子小结:构成物质的微粒:分子、原子和离子由原子直接构成的物质,如:Na , Zn , Fe , He ……
由分子构成的物质,如:H2O , CO2 , HCl , O2 , H2 , …… 由离子构成的物质,如:NaCl , CaCl2 , ZnSO4 , …… 返回课堂练习11.下列原子结构示意图中,正确的是:2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17答案:1.B 2.D 3.A
2、下列粒子在人体中起着重要的作用,其中属于阴离子的是 ( )课堂练习21.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
2.X和Y是原子序数小于18的元素,X原子比Y原子多1个电子层;X原子的最外层中只有1个电子;Y原子的最外层电子层中有7个电子。这两种元素形成的化合物的化学式是__________________.答案:1.(1) 硫 2 8 4 (2) 硼 2 3 (3) 氖 2 8 2. NaF补充练习11.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为:
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有:
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为:
A. A2B3 B. BA2 C. AB4 D.B3A2答案:1.AC 2.B 3.D 补充练习2有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K你有信心完成下列题目吗?1、下列微粒是原子的是( )加油喔!2、比较氯、钠二种元素的原子结构示意图产,判断这三种元素的原子在化学反应中是易失电子,还是易得电子;是金属,还是非金属?从氯、钠二种元素的原子结构,可以判断氯是非金属,钠是金属,当一个易失去电子的原子和一个易获得电子的原子相遇时,会出现什么情况呢?四、氯化钠的形成+返回二、氯化钠的形成从钠和氯的原子结构看,钠原子的最外层电子层有1个电子,容易失去;氯原子的最外层电子层有7个电子,容易得到1个电子,从而使最外层都达到8个电子的稳定结构。所以当钠跟氯反应时,气态钠原子的最外电子层的1个电子转移到气态氯原子最外电子层上去,这样,两个原子的最外电子层都成了8个电子的稳定结构。离子的概念在这个过程中,钠原子因失去1个电子而带上了1个单位的正电荷;氯原子因得到1个电子而带上了1个单位的负电荷。这种带电的原子叫做离子。离子的分类离子阳离子:带正电的离子,如钠离子(Na+)阴离子:带负电的离子,如氯离子(Cl-)这两种带有相反电荷的离子之间相互作用,就形成化合物氯化钠。它呈电中性。氯化钠的形成可以表示为:钠 +氯气 氯化钠点燃(Na) (Cl2) (NaCl) 在通常情况下,氯化钠是固体。离子化合物的概念像氯化钠这种由阴、阳离子相互作用而构成的化合物,就是离子化合物。如氯化钾(KCl)、氯化镁(MgCl2)、氯化钙(CaCl2)、氟化钙(CaF2)等都是离子化合物。带电的原子团也叫离子,如硫酸根离子(SO42-)、氢氧根离子(OH-)等。硫酸锌(ZnSO4)、氢氧化钠(NaOH)等也是离子化合物.三、氯化氢的形成在氢气的实验室制法一节中,我们曾经讲到盐酸,它的化学式是HCl。盐酸是氯化氢气体的水溶液。氢气跟氯气化合可以生成氯化氢气体。这一反应可以表示如下:
氢气 + 氯气 氯化氢点燃 (H2) (Cl2) (HCl)共用电子对氯和氢都是非金属元素以,不仅氯原子很容易获得1个电子形成最外层8个电子的稳定结构,而且氢原子也容易获得1个电子形成最外层2个电子的稳定结构。这两种元素的原子获得电子的难易的程度相差不大,所以都未能把对方的电子夺取过来。两种元素的原子相互作用的结果是双方各以最外层1个电子组成一个电子对,这个电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构。这种电子对,叫共用电子对。共用电子对受两个核的共同吸引,使两个原子形成化合物的分子。氯化氢分子呈电中性在氯化氢分子里,由于氯原子对于电子对的吸引力比氢原子的稍强一些,所以电子对偏向氯原子一方,因此氯原子一方略显负电性,氢原子一方略显正电性,但作为分子整体仍呈电中性。什么叫共价化合物像氯化氢这样以共用电子对形成分子的化合物,叫共价化合物。如水、二氧化碳等都是共价化合物。
1.道尔顿原子模型(1803年)
2.汤姆生原子模型(1904年)
3.卢瑟福原子模型(1911年)
4.波尔原子模型(1913年)
5.电子云模型(1927~1935年)道尔顿原子模型 原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。汤姆生原子模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。卢瑟福原子模型 原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就象行星环绕太阳运转一样。波尔原子模型 电子在原子核外空间的一定轨道上绕核做高速的圆周运动。电子云模型现代物质结构学说。波粒二象性。理解电子云注意:每一个小黑点只代表电子在该处出现一次,并不代表有一个电子。
一个点没有多大意义,众多点的疏密不同才有意义。核 外 电 子 的 分 层 排 布1-18号元素的原子结构示意图离 子氯 化 钠 的 形 成小 结作 业退 出核外电子分层排布电子按能量高低在核外分层排布。 氢原子核外只有一个电子,比较简单。 在含有多个电子的原子里,电子是分层运动的。以离核的远近,由里往外依次分为一、二、三、四、五、六、七层。
电子层数、离核距离、能量高低之关系如下所示:电子层 1 2 3 4 5 6 7
返回一、核外电子的分层排布逐 渐 到逐 渐 到 1. 原子结构示意图
如氧原子的结构示意图如下所示:原子核核内质子数二、1-18号元素的原子结构示意图电子层电子层上的电子个数注:每个电子层上所容纳的电子个数为2n2 个1—18号原子结构示意图 锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne) 钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar) 氢(H) 氦(He) +1核外电子排 布 规 律K→ L → M→N → O → P2→ 8 →18→32→50→ 2n21→ 2 → 3→ 4→ 5 → 6[小结]:(1)第一层电子数不超过去2个;第2层电子数不超过去8个;最外层电子数不超过去8个;每个电子层最多只能排布2n2个电子。次外层最多不超过18个电子。
(2)电子总是先排内层,后排外层。电子总是尽先排布在能量最低的电子层里
(3)不同种类的元素的原子,核外电子的排布各有特点:3. 元素原子的最外层电子
数目和元素性质的关系 最外层
电子数得失电子元素性质金属性
非金属性
稳定性易失
易得
稳定金属元素
非金属元素
稀有气体元素一般<4
一般≥4
8或2(He)类型项目称有气体元素原子电子层排布1.稳定结构:通常把最外层电子数为8(第一层作最外层时有2 个电子)的结构,叫做稳定结构。
2.离子:带电荷的原子叫离子。它通常由原子(或原子团)通过得或失电子而形成。如:Na 失1e → Na+ O 得2e → O2- Al 失3e → Al3+Cl 得e → Cl- 三、离子1、离子:带电的原子或原子团2、离子的表示法--离子符号阳离子:H+ ,Na+,Mg2+,……(NH4+) 阴离子:Cl-,F-,O2-,S2-,……(OH-,SO42-) 3、离子符号的意义2Mg2+表示两个镁离子 表示每个镁离子带两个单位的正电荷 返回(数字“2”的意义)4、离子跟原子的比较核内质子数=
核外电子数核内质子数>
核外电子数核内质子数<
核外电子数不带电带正电带负电用元素符号表示 Na,S 用离子符号表示Na+用离子符号表示 S2-原子失电子返回阳离子得电子阴离子失电子得电子小结:构成物质的微粒:分子、原子和离子由原子直接构成的物质,如:Na , Zn , Fe , He ……
由分子构成的物质,如:H2O , CO2 , HCl , O2 , H2 , …… 由离子构成的物质,如:NaCl , CaCl2 , ZnSO4 , …… 返回课堂练习11.下列原子结构示意图中,正确的是:2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为:
A.14 B.15 C.16 D.17答案:1.B 2.D 3.A
2、下列粒子在人体中起着重要的作用,其中属于阴离子的是 ( )课堂练习21.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
2.X和Y是原子序数小于18的元素,X原子比Y原子多1个电子层;X原子的最外层中只有1个电子;Y原子的最外层电子层中有7个电子。这两种元素形成的化合物的化学式是__________________.答案:1.(1) 硫 2 8 4 (2) 硼 2 3 (3) 氖 2 8 2. NaF补充练习11.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为:
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有:
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为:
A. A2B3 B. BA2 C. AB4 D.B3A2答案:1.AC 2.B 3.D 补充练习2有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K你有信心完成下列题目吗?1、下列微粒是原子的是( )加油喔!2、比较氯、钠二种元素的原子结构示意图产,判断这三种元素的原子在化学反应中是易失电子,还是易得电子;是金属,还是非金属?从氯、钠二种元素的原子结构,可以判断氯是非金属,钠是金属,当一个易失去电子的原子和一个易获得电子的原子相遇时,会出现什么情况呢?四、氯化钠的形成+返回二、氯化钠的形成从钠和氯的原子结构看,钠原子的最外层电子层有1个电子,容易失去;氯原子的最外层电子层有7个电子,容易得到1个电子,从而使最外层都达到8个电子的稳定结构。所以当钠跟氯反应时,气态钠原子的最外电子层的1个电子转移到气态氯原子最外电子层上去,这样,两个原子的最外电子层都成了8个电子的稳定结构。离子的概念在这个过程中,钠原子因失去1个电子而带上了1个单位的正电荷;氯原子因得到1个电子而带上了1个单位的负电荷。这种带电的原子叫做离子。离子的分类离子阳离子:带正电的离子,如钠离子(Na+)阴离子:带负电的离子,如氯离子(Cl-)这两种带有相反电荷的离子之间相互作用,就形成化合物氯化钠。它呈电中性。氯化钠的形成可以表示为:钠 +氯气 氯化钠点燃(Na) (Cl2) (NaCl) 在通常情况下,氯化钠是固体。离子化合物的概念像氯化钠这种由阴、阳离子相互作用而构成的化合物,就是离子化合物。如氯化钾(KCl)、氯化镁(MgCl2)、氯化钙(CaCl2)、氟化钙(CaF2)等都是离子化合物。带电的原子团也叫离子,如硫酸根离子(SO42-)、氢氧根离子(OH-)等。硫酸锌(ZnSO4)、氢氧化钠(NaOH)等也是离子化合物.三、氯化氢的形成在氢气的实验室制法一节中,我们曾经讲到盐酸,它的化学式是HCl。盐酸是氯化氢气体的水溶液。氢气跟氯气化合可以生成氯化氢气体。这一反应可以表示如下:
氢气 + 氯气 氯化氢点燃 (H2) (Cl2) (HCl)共用电子对氯和氢都是非金属元素以,不仅氯原子很容易获得1个电子形成最外层8个电子的稳定结构,而且氢原子也容易获得1个电子形成最外层2个电子的稳定结构。这两种元素的原子获得电子的难易的程度相差不大,所以都未能把对方的电子夺取过来。两种元素的原子相互作用的结果是双方各以最外层1个电子组成一个电子对,这个电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构。这种电子对,叫共用电子对。共用电子对受两个核的共同吸引,使两个原子形成化合物的分子。氯化氢分子呈电中性在氯化氢分子里,由于氯原子对于电子对的吸引力比氢原子的稍强一些,所以电子对偏向氯原子一方,因此氯原子一方略显负电性,氢原子一方略显正电性,但作为分子整体仍呈电中性。什么叫共价化合物像氯化氢这样以共用电子对形成分子的化合物,叫共价化合物。如水、二氧化碳等都是共价化合物。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
