物质的结构[下学期]
图片预览









文档简介
课件65张PPT。物质的结构一、分子:是保持物质化学性质的最小粒子;保持二氧化碳化学性质的最小粒子是:二氧化碳分子(CO2)保持氯气化学性质的最小粒子是:氯分子(Cl2)用分子的观点解释一些现象:
⒈我们可以闻到花的香味:______________________
⒉50mL酒精和50mL水混合后体积小于100mL:
_____________________________________________分子的特点:⒈分子很小;⒉分子是不断运动的;⒊分子之间有间隔。分子是不断运动的分子之间有间隔3、下列物质中存在氧气分子的是:( )
A、高锰酸钾 B、过氧化氢 C、水 D、空气4、n个H2CO3和H2SO4中,相同的是( )
A、氢分子数 B、氢原子数
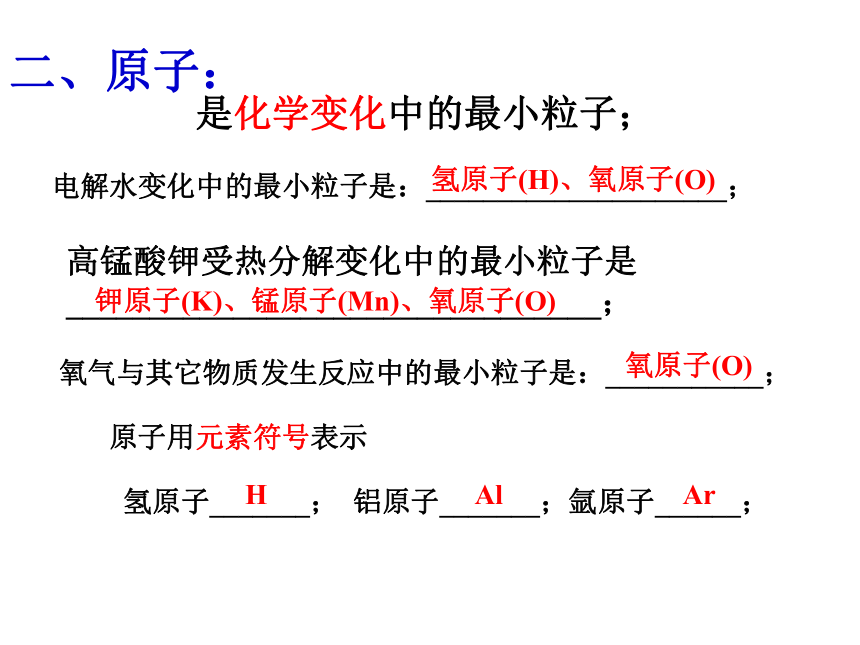
C、元素的种类 D、氢元素的质量分数D在化学式前加上系数:表示?个?分子2个水分子___________2H2O5个硫酸分子_________5H2SO4分子用化学式来表示氢分子_________;高锰酸钾分子____________。H2KMnO43个氮分子__________3N2B二、原子:是化学变化中的最小粒子;电解水变化中的最小粒子是:_____________________;高锰酸钾受热分解变化中的最小粒子是________________________________;氧气与其它物质发生反应中的最小粒子是:___________;原子用元素符号表示氢原子(H)、氧原子(O)氧原子(O) 钾原子(K)、锰原子(Mn)、氧原子(O)氢原子_______; 铝原子_______;氩原子______;HAlAr原子:在元素符号前加上系数:表示?个?原子n个汞原子_________;nHg3个氮原子_________;3N原子由__________和_________构成;原子核由__________和_________构成;构成原子的微粒有 ________、________、_________。原子核电 子质子中子质子中子电 子在原子中:_________数=___________数=___________数核 电 荷核 内 质子核 外 电 子已知电子的质量约为质子(或中子)质量的1/1840,
下表是几种原子的组成和它们的相对原子质量。通过此表可以总结出如“质子数等于核外电子数”等结论,请你再总结出两条:
⑴_______________________________________________________
⑵______________________________________________________
01227148162630质子数决定元素的种类原子的相对质子质量等于质子数加中子数分子和原子的本质区别是:
____________________________________________;在化学变化中,分子可以再分,原子不可以再分分子和原子的联系是:___________________;分子由原子构成用分子、原子的观点解释下列变化:1、汽油挥发:_____________________________________
________________________________________________
2、白磷燃烧生成五氧化二磷:______________________
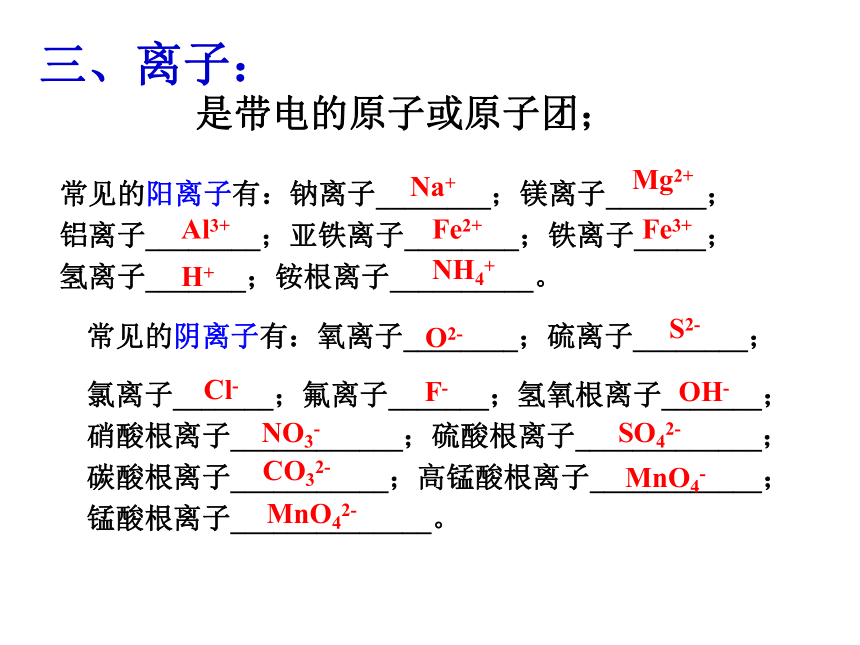
_________________________________________分子和原子:汽油分子之间的间隔增大,分子本身不变,因此是物理变化。 磷原子和氧原子重新组合成五氧化二磷分子,分子本身发生了变化,是化学变化。三、离子:是带电的原子或原子团;常见的阳离子有:钠离子________;镁离子_______;铝离子________;亚铁离子________;铁离子_____;氢离子_______;铵根离子__________。常见的阴离子有:氧离子________;硫离子________;
氯离子_______;氟离子_______;氢氧根离子_______;硝酸根离子____________;硫酸根离子_____________;碳酸根离子___________;高锰酸根离子____________;锰酸根离子______________。Na+Mg2+Al3+Fe2+Fe3+H+NH4+O2-S2-Cl-F-OH-NO3-SO42-CO32-MnO4-MnO42-下列符号中,表示意义最少的是:______
A、2Cu B、H2 C、H2O D、SiA写出下列符号意义:C:______________________________
N2:____________________________
2Ag:____________________
3H2O2:______________________
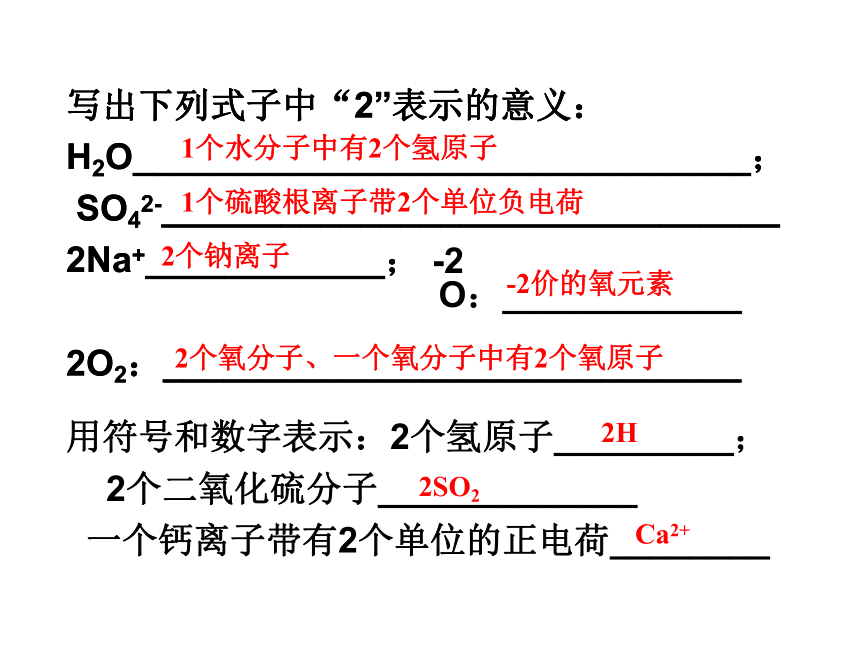
Fe3+:__________________________碳元素、一个碳原子、碳这种物质氮气、一个氮分子2个银原子3个过氧化氢分子铁离子写出下列式子中“2”表示的意义:H2O_______________________________;
SO42-_______________________________
2Na+____________;
2O2:_____________________________用符号和数字表示:2个氢原子_________;
2个二氧化硫分子_____________
一个钙离子带有2个单位的正电荷________O:____________-21个水分子中有2个氢原子1个硫酸根离子带2个单位负电荷2个钠离子写出下列式子中“2”表示的意义:H2O_______________________________;
SO42-_______________________________
2Na+____________;
2O2:_____________________________-2价的氧元素2个氧分子、一个氧分子中有2个氧原子2H2SO2Ca2+《超越自我》P82思考:科学上是如何将物质分类的呢?科学家常常根据组成来给物质分类。优点:组成决定性质,性质决定用途,有利于全面认识物质。物质纯净物:混合物:①只由一种物质组成 ①由两种(或两种以上)物质组成 问题1:纯净物如何分类?纯净物元素组成单质:由一种元素组成的纯净物化合物:由不同种元素组成的纯净物问题2:单质如何分类?单质组成元素的性质金属非金属问题3:化合物如何分类?化合物元素组成无机化合物:一般由碳以外的其他元素组成的化合物(包括少数含碳化合物)有机化合物:含碳化合物(除少数)由一种物质组成由两种或多种物质组成能用一个化学式表示不可用一个化学式表式没有固定的性质,各物质保持原有的化学性质纯净物和混合物有固定不变的组成
没有一定的组成问题4:无机化合物如何分类?无机化合物组成和性质氧化物:由两种元素组成,其 中一种是氧元素的化合物酸:电离时产生的阳离子全部是氢离子的化合物碱:电离时产生的阴离子全部是氢氧根离子的化合物盐:由金属阳离子(铵根)
和酸根组成的化合物在组成上的最大区别:是否含有碳元素有机物在组成上最大的特点是:含有碳元素练习:1.在下列几种物质中,从物质的组成分析其中和
另外三种物质不相同的是( )
A.四氧化三铁 B.河水 C.稀盐酸
D.高锰酸钾制氧气后的剩余物2.有下列六种物质:①纯净的空气 ②氮气
③硫磺 ④矿泉水 ⑤氯酸钾 ⑥黄酒,其中
属于混合物的有 ;
属于纯净物的有 。 ① ④ ⑥ ② ③ ⑤A二 物质分类 1,物质分类
单质
纯净物
金属:Cu Al Hg
非金属:Cl2 I2 C
稀有气体: He Ne Ar氧化物 酸性氧化物SO3 CO2
碱性氧化物CuO Fe2O3
其他氧化物:NO CO
酸 含氧酸 H2SO4 HNO3
无氧酸 HCl H2S 碱 NaOH(可) Cu(OH)2(不)盐 正盐 含氧酸盐 K2CO3
无氧酸盐 NaCl 酸式盐 NaHCO3 碱式盐 Cu2(OH)2CO3 化合物晶体从溶液中结晶析出时,结合的一定数目的水分子叫结晶水,含有结晶水的物质叫结晶水合物。
举例
结晶水合物是具有一定组成的化合物,不是混合物。
并不是所有晶体内都含有结晶水。结晶水合物例题1、下列各组物质中,属于纯净物的一组是( )
A、蒸馏水、液态氧、液态氢
B、稀硫酸、稀盐酸、氢氧化钠溶液
C、新鲜空气、纯净食盐水、清洁矿泉水
D、汽水、浓硫酸、大理石A例题3、下列各组物质中,前者是纯净物,后者是混合物的是( )
A、净化后的空气 浓盐酸
B、水和冰的混合物 澄清石灰水
C、汽水 氯化钾
D、纯碱 液态氧B4、下列物质中属于有机物的是( )
A、硫酸铜 B、氢氧化钡 C、硝酸 D、丁烷D例题5、下列物质分类全部正确的是( )
a 纯碱; b 食盐水; c 石灰水;
d 烧碱; e 液态氧; f 氯酸钾
A、碱——a、d;
B、纯净物——c、d、e;
C、混合物——b、e;
D、盐——a、f例题6、今年入夏以来,我省久旱少雨。5月25日凌晨,全省7个地市120多人工降雨点向空中发射炮弹,成功地进行了人工降雨,使降雨量增加了30~40%。人工降雨炮弹中装有碘化银(AgI)、氯化钠、尿素[CO(NH2)2]和干冰等物质。在这些物质中,属于盐的是 ;属于氧化物是 ;可用作化肥的是 ;能用于灭火的是 。AgI NaCl干冰尿素干冰例题7、下列关于酸碱盐组成元素的说法中正确的是( )
A、碱一定含有氧元素,盐不一定含有氧元素
B、酸、碱、盐都一定含有氧元素
C、酸一定含有氢元素,盐一定不含有氢元素
D、盐一定含有金属元素,酸一定不含有金属元素A例题8、在下列离子的溶液中,溶质全部为酸的是( )
A、H+、Na+、SO42-
B、H+、Cl-、NO3-
C、OH-、K+、Ba2+
D、Ag+、K+、NO3-B 对镁、硫、氧气、氧化镁、二氧化硫、盐酸、氢氧化钙、氯化钠、高锰酸钾等九种物质分类, 单质:Mg、S、O2金属: Mg非金属:S、O2化合物:MgO、SO2、 KMnO4
Ca(OH)2、NaCl、 HCl氧化物: MgO、SO2金属氧化物: MgO非金属氧化物:SO2酸: HCl碱: Ca(OH)2盐:NaCl、KMnO4 试一试练习与活动: 在横线上写出物质(主要成分)的化学式,
在括号里标明物质的类别(金属、非金属、金
属氧化物、非金属氧化物、碱、酸、盐)。
氯气 ( )生石灰 ( )
硫酸铝 ( )钡 ( )
干冰 ( )熟石灰 ( )
磷酸 ( )烧碱 ( )
碳酸钙 ( )氧化钠 ( )Cl2 非金属 CaO 金属氧化物Al2(SO4)3 盐 Ba 金属CO2 非金属氧化物 Ca(O H)2 碱H3PO4 酸 NaOH 碱CaCO3 盐 Na2O 金属氧化物巩固练习作业 如何区别稀硫酸、稀盐酸、
氢氧化钠溶液、氢氧化钙溶液、
食盐溶液和碳酸钠溶液等6瓶
溶液?试一试1、网上阅卷,用答题卷;用2B铅笔,黑色签字笔;画图要用签字笔,答题要准确位置,范围之外不给分。
简答题:核心字,关键字,字工整。
2、主观题9题,客观题36题;
如量取10亳升水选择量筒是20亳升,还50毫升或者100毫升?
3、化学计算:化学式、溶液计算、化学方程式
物理计算:力学、电学
4、注重双基,抓住主干。如化学两循环:C和Ca两条线;酸、碱、盐、氧化物的反应规律,金属活动顺序表
5、物理力学:W 、P、v、η
电 学:W、P、I=U/R本章的计算1相对分子质量的计算:
2化合物中元素的质量比:
3化合物中某种元素的质量分数:必考内容=各个原子的相对原子质量之和=相对原子质量与原子个数的乘积之比=元素的相对原子质量与原子个数之积
再与化合物的相对分子质量之比相对分子质量:化学式中各原子的相对原子质量的总和就是相对分子质量。相对分子质量也是一个比,它的国际单位制单位也为1。C6H12O6的相对分子质量=12×6+1×12+16×6=1802C6H10O5的相对分子质量 =2×(12×6+1×10+16×5) =3242Ca(OH)2的相对分子质量=2×[40+(16+1)×2]=148一种或几种物质分散到另一种物质里所形成的均一的、稳定的混合物叫溶液。
溶液首先它必须是混合物。水不是溶液。
其次它具有均一性和稳定性。三 溶液溶质和溶剂的概念:能溶解其它物质的物质叫溶质,被溶解的物质叫溶剂。
溶液是由溶质和溶剂组成的。在质量上它们存在下列关系:
溶液的质量=溶质的质量+溶剂的质量混合物的分离:把混合物里的几种物质分开,得到较纯净的物质一.过滤1.定义:过滤是把不溶于液体的固体物质与液体分离的一种方法2.操作要领:二.结晶1.定义:溶质从其饱和溶液中以固体形式析出的过程叫做结晶。2.结晶的方法:①蒸发溶剂法②.冷却热饱和溶液法一贴二低三靠硝酸钾氯化钠 主板书返回思考:现有5瓶失去标签的溶液,分别是HCl、
H2SO4、BaCl2、NaOH、CuSO4,不用任何
试剂(包括试纸),用简单方法区分。HCl
H2SO4
BaCl2
NaOH
CuSO4蓝色溶液:CuSO4无色溶液:HCl
H2SO4
BaCl2
NaOH蓝色沉淀:CuSO4NaOH白色沉淀:BaCl2无明显现象:HCl
H2SO4HCl
H2SO4BaCl2白色沉淀:无明显现象:HClH2SO4点燃例1(深圳2005)如图是表示物质微粒的示意图(●表示碳原子,○表示氧原子; )。其中表示混合物的是 (填图的编号)人体生命活动中不可缺少的物质是 (填图的编号);碳元素的化合价为+4的化合物是 (填图的编号);D图中的物质在空气中燃烧的化学方程式是 。
例2(安徽2005)据报道,国家有关部门对家庭装饰材料进行抽查,发现具有毒气污染的材料占68%,它们会释放出300多种能引发30多种疾病的有害物质,甲醛就是其中的一种,它的化学式为CH2O.下面关于甲醛的叙述正确的是( ) A.甲醛由碳、氢、氧三种元素组成
B.甲醛由碳原子和水分子构成
C.甲醛分子由碳原子、氢气分子、氧原子构成的
D.甲醛由一个碳元素、二个氢元素、一个氧元素组成例3 目前,世界各国正在开发安全高效的自来水消毒剂,ClO2就是开发的一种,下列对ClO2的叙述中错误的是( )
A.ClO2是一种混合物 B.ClO2是一种氧化物
C.ClO2是一种含氧化合物 D.ClO2是一种化合物例4(黑龙江2004)许多植物的花、果、茎、叶中都含有色素,这些色素在酸性溶液或碱性溶液中会显示出不同的颜色,可以作为酸碱指示剂。现取三种花瓣,分别放在研钵中,加入酒精研磨,各取少许,用稀酸或稀碱检验,结果如下:请回答:
(1)不能用作酸碱指示剂的是 。(2)已知苹果的近似pH为2.9—3.3,将大红花汁滴入苹果汁中,
呈现的颜色是 。例5(安徽2005)(1)在H、O、C、Cl、Ca五种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格中。
①可用于人工降雨的氧化物 ;②可用于金属表面除锈的酸 ;
③可改良酸性土壤的碱 ;④可作建筑材料的盐 ;
⑤可作干燥剂的氧化物 。
(2)用上述五种元素组成适当物质,写出符合下列要求的化学方程式:
化合反应 ;分解反应 ;复分解反应 。溶液中溶质的质量分数1.概念:溶液中溶质的质量分数
是指溶质质量与溶液的质量
之比的。2.公式:溶质的质量分数= ———— = ————————溶质质量溶液质量溶质质量
溶剂质量+溶质质量3.类型一.最简型二.过量型三.结晶水合物型四.同溶质相混合型五.稀释,浓缩型六.化学反应型1.最简型2.气体型3.沉淀型
医院里配制1500克生理盐水,需要食盐13.5克,试确定此生理盐水的质量分数;并计算需水多少克?解: 生理盐水的质量分数=(13.5克/1500克)×100%
=0.9%
水的质量是:1500克-13.5克=1486.5克
答:生理盐水的质量分数是0.9%;需要水的质量是1486.5克一.最简型二.固体过量型例.
20℃时硝酸钾的溶解度为31.6克,将18克硝酸钾晶体溶入36克20 ℃水中,试计算所得溶液的溶质质量分数?解:设36克水中最多能溶解x克硝酸钾晶体
则:x/36=31.6/100
x=11.376
因为11.376克<18克 所以形成的溶液为饱和溶液
此溶液的溶质质量分数为:
11.376克÷(36克+11.376克)×100%
=24%三.结晶水合物型例.
胆矾25克溶于75克水中,试计算所得溶液的溶质质量分数 ?溶质的质量=晶体质量 CuSO4/CuSO4.5H2O
=25克 × (160克/250克)
=16克
溶液中溶质质量分数:16克÷(25克+75克)×100%=16%
答:此溶液中溶质质量分数是16%解:四.同溶质相混合型例.
将20克10%的NaCl溶液与30克5%的NaCl溶液混合,试计算混合后溶液的溶质质量分数?
因为m 浓×a浓%+m稀×a稀%=(m浓+m稀)×a混%
所以:20克×10%+30克×5%=(20克+30克)·x
解之得:x=7%
答:混合后溶液的质量分数是7%解:
配制10%的稀盐酸500克,问需要37%的浓盐酸 和 水 各多少毫升? (37%的盐酸的密度为1.19克/毫升 )五.稀释、浓缩型因为: m稀×a稀%=m浓×a浓%
所以:500克×10%=m浓×37%
解得:m浓=135.14克
V浓=135.14克÷1.19克/毫升=113.56毫升
m水=m稀-m浓=500克-135.14克
=364.86克
v水=m水/p水=364.86克÷1克/毫升
=364.86毫升 练习2.
将50克质量分数为10%的蔗糖溶液蒸发掉20克水后,试计算所得溶液的溶质质量分数?(无晶体析岀)因为:m稀×a稀%=(m稀-m水)×a浓%
所以:50克×10%=(50克-20克)×a浓%
解得:a浓%=16.67%
答:浓缩后溶液的溶质质量分数是16.67%解:六.化学反应型1.最简型例.
将16克SO3投入8克水中,试计算所得溶液的溶质质量分数?解:设:硫酸的质量为x克SO3+H2O=H2SO480 98
16 x80/98=16/x
解得:x=19.6
溶液质量分数:19.6克÷(16克+8克)×100%
=81.67%
答:所得溶液的溶质质量分数是81.67%2.气体型
将6.5克锌投入到93.7克稀盐酸中,恰好完全反应,试计算生成氢气的质量和反应所得溶液的溶质质量分数?解:设:生成氢气的质量为x克,生成氯化锌的质量为y克Zn+2HCl= ZnCl2+ H2↑ 65 136 2
6.5 y x
65/6.5=136/y 65/6.5=2/x解得
x=13.6 y=0.2所得溶液的溶质质量分数:
13.6克÷(6.5克+93.7克-0.2克)×100%=13.6%3.沉淀型
100克BaCl2溶液和100克稀H2SO4溶液恰好完全反应生23.3克白色沉淀(BaCl2+H2SO4=BaSO4 ↓ +2HCl)
(1).试计算原BaCl2溶液和稀H2SO4溶液各自溶质质量分数。
(2).试计算生成的盐酸的质量分数?解:设:原BaCl2溶液的质量分数为x,原H2SO4溶液的质量分数为y;生成HCl的质量为z克
BaCl2+H2SO4=BaSO4↓ +2HCl
208 98 233 73
100x 100 23.3 z
所得HCl%=7.3克÷(200克-23.3克)×100%=4.13%
答:原BaCL2溶液和H2SO4溶液质量分数分别是20.8%和9.8%,生成的盐酸的质量分数是4.13%208/100x=233/23.3 98/100y=233/23.3 73/z=233/23.3
解得:x=20.8% y=9.8% z=7.3克
练习1
Na2CO3和NaCl固体粉末10克,加入100克
稀HCl中完全反应,生成气体0.88克。
(1).试计算固体混合中NaCl固体的质量分数,
(2).试计算固体混合物中钠元素的分数
(3).试计算反应后溶液中溶质的质量分数解:设Na2CO3的质量为x克,生成NaCl的质量y克Na2CO3+2HCl=2NaCl+CO2+H2O 117 44X y 0.88列方程:106 : x = 117 :y = 44:0.88
解之得:x=2.12克 y=2.34克 1. NaCl%=(10克-2.12克)10克100%=7.88%
2. Na%
( 2.12 ×2Na/Na2CO3+7.88×Na/NaCl )÷10×100%
= (2.12×46/106+7.88 × 23/58.5) ÷ 10 × 100%
3溶液NaCl%
( 7.88克+2.34克)÷(10克+100克-0.88克) ×100%练习2: 取Na2CO3和NaCl的固体混合物13.6克与一定质量的稀盐酸恰好完全反应,得到10%的NaCl溶液147克。
计算:
固体混合物中的碳酸钠的质量分数
生成CO2的质量
该盐酸中溶质的质量分数解:设原混合物中Na2CO3质量为x,参加反应的HCl质量为y,生成的CO2质量为z,则NaCl质量为13.6克-x,化学反应产生的NaCl质量为147×10%-(13.6-x)=1.1+xNa2CO3+2HCl=2NaCl+CO2 +H2O106 73 117 44
x y 1.1+x z106:x=117:(1.1+x ) 解得:x=10.6克
106:10.6=73:y 解得:y=7.3克
106:10.6=44:z 解得:z=4.4克 (1)Na2CO3%=(10.6÷13.6 )×100%
(2)CO2质量:4.4克
(3)HCl%=7.3/(147-13.6) ×100%
练习3、现有20克食盐溶液,
经蒸发、结晶得到食盐
晶体4克。试确定这一食
盐溶液中溶质的质量分数。 练习4、医院里配制生理
盐水2000千克。问需
要食盐和水各多少千克?练习5、工业生产上,有时
要用溶质的质量分数为
10%的稀硫酸来清洗钢材。
把50千克溶质的质量分数
为9 8%的浓硫酸稀释成溶
质的质量分数为10%的稀
硫酸,需要水多少千克?练习6、配制1000毫升溶质的
质量分数为10%的稀硫酸,
需要溶质的质量分数为98%
的浓硫酸多少毫升?
⒈我们可以闻到花的香味:______________________
⒉50mL酒精和50mL水混合后体积小于100mL:
_____________________________________________分子的特点:⒈分子很小;⒉分子是不断运动的;⒊分子之间有间隔。分子是不断运动的分子之间有间隔3、下列物质中存在氧气分子的是:( )
A、高锰酸钾 B、过氧化氢 C、水 D、空气4、n个H2CO3和H2SO4中,相同的是( )
A、氢分子数 B、氢原子数
C、元素的种类 D、氢元素的质量分数D在化学式前加上系数:表示?个?分子2个水分子___________2H2O5个硫酸分子_________5H2SO4分子用化学式来表示氢分子_________;高锰酸钾分子____________。H2KMnO43个氮分子__________3N2B二、原子:是化学变化中的最小粒子;电解水变化中的最小粒子是:_____________________;高锰酸钾受热分解变化中的最小粒子是________________________________;氧气与其它物质发生反应中的最小粒子是:___________;原子用元素符号表示氢原子(H)、氧原子(O)氧原子(O) 钾原子(K)、锰原子(Mn)、氧原子(O)氢原子_______; 铝原子_______;氩原子______;HAlAr原子:在元素符号前加上系数:表示?个?原子n个汞原子_________;nHg3个氮原子_________;3N原子由__________和_________构成;原子核由__________和_________构成;构成原子的微粒有 ________、________、_________。原子核电 子质子中子质子中子电 子在原子中:_________数=___________数=___________数核 电 荷核 内 质子核 外 电 子已知电子的质量约为质子(或中子)质量的1/1840,
下表是几种原子的组成和它们的相对原子质量。通过此表可以总结出如“质子数等于核外电子数”等结论,请你再总结出两条:
⑴_______________________________________________________
⑵______________________________________________________
01227148162630质子数决定元素的种类原子的相对质子质量等于质子数加中子数分子和原子的本质区别是:
____________________________________________;在化学变化中,分子可以再分,原子不可以再分分子和原子的联系是:___________________;分子由原子构成用分子、原子的观点解释下列变化:1、汽油挥发:_____________________________________
________________________________________________
2、白磷燃烧生成五氧化二磷:______________________
_________________________________________分子和原子:汽油分子之间的间隔增大,分子本身不变,因此是物理变化。 磷原子和氧原子重新组合成五氧化二磷分子,分子本身发生了变化,是化学变化。三、离子:是带电的原子或原子团;常见的阳离子有:钠离子________;镁离子_______;铝离子________;亚铁离子________;铁离子_____;氢离子_______;铵根离子__________。常见的阴离子有:氧离子________;硫离子________;
氯离子_______;氟离子_______;氢氧根离子_______;硝酸根离子____________;硫酸根离子_____________;碳酸根离子___________;高锰酸根离子____________;锰酸根离子______________。Na+Mg2+Al3+Fe2+Fe3+H+NH4+O2-S2-Cl-F-OH-NO3-SO42-CO32-MnO4-MnO42-下列符号中,表示意义最少的是:______
A、2Cu B、H2 C、H2O D、SiA写出下列符号意义:C:______________________________
N2:____________________________
2Ag:____________________
3H2O2:______________________
Fe3+:__________________________碳元素、一个碳原子、碳这种物质氮气、一个氮分子2个银原子3个过氧化氢分子铁离子写出下列式子中“2”表示的意义:H2O_______________________________;
SO42-_______________________________
2Na+____________;
2O2:_____________________________用符号和数字表示:2个氢原子_________;
2个二氧化硫分子_____________
一个钙离子带有2个单位的正电荷________O:____________-21个水分子中有2个氢原子1个硫酸根离子带2个单位负电荷2个钠离子写出下列式子中“2”表示的意义:H2O_______________________________;
SO42-_______________________________
2Na+____________;
2O2:_____________________________-2价的氧元素2个氧分子、一个氧分子中有2个氧原子2H2SO2Ca2+《超越自我》P82思考:科学上是如何将物质分类的呢?科学家常常根据组成来给物质分类。优点:组成决定性质,性质决定用途,有利于全面认识物质。物质纯净物:混合物:①只由一种物质组成 ①由两种(或两种以上)物质组成 问题1:纯净物如何分类?纯净物元素组成单质:由一种元素组成的纯净物化合物:由不同种元素组成的纯净物问题2:单质如何分类?单质组成元素的性质金属非金属问题3:化合物如何分类?化合物元素组成无机化合物:一般由碳以外的其他元素组成的化合物(包括少数含碳化合物)有机化合物:含碳化合物(除少数)由一种物质组成由两种或多种物质组成能用一个化学式表示不可用一个化学式表式没有固定的性质,各物质保持原有的化学性质纯净物和混合物有固定不变的组成
没有一定的组成问题4:无机化合物如何分类?无机化合物组成和性质氧化物:由两种元素组成,其 中一种是氧元素的化合物酸:电离时产生的阳离子全部是氢离子的化合物碱:电离时产生的阴离子全部是氢氧根离子的化合物盐:由金属阳离子(铵根)
和酸根组成的化合物在组成上的最大区别:是否含有碳元素有机物在组成上最大的特点是:含有碳元素练习:1.在下列几种物质中,从物质的组成分析其中和
另外三种物质不相同的是( )
A.四氧化三铁 B.河水 C.稀盐酸
D.高锰酸钾制氧气后的剩余物2.有下列六种物质:①纯净的空气 ②氮气
③硫磺 ④矿泉水 ⑤氯酸钾 ⑥黄酒,其中
属于混合物的有 ;
属于纯净物的有 。 ① ④ ⑥ ② ③ ⑤A二 物质分类 1,物质分类
单质
纯净物
金属:Cu Al Hg
非金属:Cl2 I2 C
稀有气体: He Ne Ar氧化物 酸性氧化物SO3 CO2
碱性氧化物CuO Fe2O3
其他氧化物:NO CO
酸 含氧酸 H2SO4 HNO3
无氧酸 HCl H2S 碱 NaOH(可) Cu(OH)2(不)盐 正盐 含氧酸盐 K2CO3
无氧酸盐 NaCl 酸式盐 NaHCO3 碱式盐 Cu2(OH)2CO3 化合物晶体从溶液中结晶析出时,结合的一定数目的水分子叫结晶水,含有结晶水的物质叫结晶水合物。
举例
结晶水合物是具有一定组成的化合物,不是混合物。
并不是所有晶体内都含有结晶水。结晶水合物例题1、下列各组物质中,属于纯净物的一组是( )
A、蒸馏水、液态氧、液态氢
B、稀硫酸、稀盐酸、氢氧化钠溶液
C、新鲜空气、纯净食盐水、清洁矿泉水
D、汽水、浓硫酸、大理石A例题3、下列各组物质中,前者是纯净物,后者是混合物的是( )
A、净化后的空气 浓盐酸
B、水和冰的混合物 澄清石灰水
C、汽水 氯化钾
D、纯碱 液态氧B4、下列物质中属于有机物的是( )
A、硫酸铜 B、氢氧化钡 C、硝酸 D、丁烷D例题5、下列物质分类全部正确的是( )
a 纯碱; b 食盐水; c 石灰水;
d 烧碱; e 液态氧; f 氯酸钾
A、碱——a、d;
B、纯净物——c、d、e;
C、混合物——b、e;
D、盐——a、f例题6、今年入夏以来,我省久旱少雨。5月25日凌晨,全省7个地市120多人工降雨点向空中发射炮弹,成功地进行了人工降雨,使降雨量增加了30~40%。人工降雨炮弹中装有碘化银(AgI)、氯化钠、尿素[CO(NH2)2]和干冰等物质。在这些物质中,属于盐的是 ;属于氧化物是 ;可用作化肥的是 ;能用于灭火的是 。AgI NaCl干冰尿素干冰例题7、下列关于酸碱盐组成元素的说法中正确的是( )
A、碱一定含有氧元素,盐不一定含有氧元素
B、酸、碱、盐都一定含有氧元素
C、酸一定含有氢元素,盐一定不含有氢元素
D、盐一定含有金属元素,酸一定不含有金属元素A例题8、在下列离子的溶液中,溶质全部为酸的是( )
A、H+、Na+、SO42-
B、H+、Cl-、NO3-
C、OH-、K+、Ba2+
D、Ag+、K+、NO3-B 对镁、硫、氧气、氧化镁、二氧化硫、盐酸、氢氧化钙、氯化钠、高锰酸钾等九种物质分类, 单质:Mg、S、O2金属: Mg非金属:S、O2化合物:MgO、SO2、 KMnO4
Ca(OH)2、NaCl、 HCl氧化物: MgO、SO2金属氧化物: MgO非金属氧化物:SO2酸: HCl碱: Ca(OH)2盐:NaCl、KMnO4 试一试练习与活动: 在横线上写出物质(主要成分)的化学式,
在括号里标明物质的类别(金属、非金属、金
属氧化物、非金属氧化物、碱、酸、盐)。
氯气 ( )生石灰 ( )
硫酸铝 ( )钡 ( )
干冰 ( )熟石灰 ( )
磷酸 ( )烧碱 ( )
碳酸钙 ( )氧化钠 ( )Cl2 非金属 CaO 金属氧化物Al2(SO4)3 盐 Ba 金属CO2 非金属氧化物 Ca(O H)2 碱H3PO4 酸 NaOH 碱CaCO3 盐 Na2O 金属氧化物巩固练习作业 如何区别稀硫酸、稀盐酸、
氢氧化钠溶液、氢氧化钙溶液、
食盐溶液和碳酸钠溶液等6瓶
溶液?试一试1、网上阅卷,用答题卷;用2B铅笔,黑色签字笔;画图要用签字笔,答题要准确位置,范围之外不给分。
简答题:核心字,关键字,字工整。
2、主观题9题,客观题36题;
如量取10亳升水选择量筒是20亳升,还50毫升或者100毫升?
3、化学计算:化学式、溶液计算、化学方程式
物理计算:力学、电学
4、注重双基,抓住主干。如化学两循环:C和Ca两条线;酸、碱、盐、氧化物的反应规律,金属活动顺序表
5、物理力学:W 、P、v、η
电 学:W、P、I=U/R本章的计算1相对分子质量的计算:
2化合物中元素的质量比:
3化合物中某种元素的质量分数:必考内容=各个原子的相对原子质量之和=相对原子质量与原子个数的乘积之比=元素的相对原子质量与原子个数之积
再与化合物的相对分子质量之比相对分子质量:化学式中各原子的相对原子质量的总和就是相对分子质量。相对分子质量也是一个比,它的国际单位制单位也为1。C6H12O6的相对分子质量=12×6+1×12+16×6=1802C6H10O5的相对分子质量 =2×(12×6+1×10+16×5) =3242Ca(OH)2的相对分子质量=2×[40+(16+1)×2]=148一种或几种物质分散到另一种物质里所形成的均一的、稳定的混合物叫溶液。
溶液首先它必须是混合物。水不是溶液。
其次它具有均一性和稳定性。三 溶液溶质和溶剂的概念:能溶解其它物质的物质叫溶质,被溶解的物质叫溶剂。
溶液是由溶质和溶剂组成的。在质量上它们存在下列关系:
溶液的质量=溶质的质量+溶剂的质量混合物的分离:把混合物里的几种物质分开,得到较纯净的物质一.过滤1.定义:过滤是把不溶于液体的固体物质与液体分离的一种方法2.操作要领:二.结晶1.定义:溶质从其饱和溶液中以固体形式析出的过程叫做结晶。2.结晶的方法:①蒸发溶剂法②.冷却热饱和溶液法一贴二低三靠硝酸钾氯化钠 主板书返回思考:现有5瓶失去标签的溶液,分别是HCl、
H2SO4、BaCl2、NaOH、CuSO4,不用任何
试剂(包括试纸),用简单方法区分。HCl
H2SO4
BaCl2
NaOH
CuSO4蓝色溶液:CuSO4无色溶液:HCl
H2SO4
BaCl2
NaOH蓝色沉淀:CuSO4NaOH白色沉淀:BaCl2无明显现象:HCl
H2SO4HCl
H2SO4BaCl2白色沉淀:无明显现象:HClH2SO4点燃例1(深圳2005)如图是表示物质微粒的示意图(●表示碳原子,○表示氧原子; )。其中表示混合物的是 (填图的编号)人体生命活动中不可缺少的物质是 (填图的编号);碳元素的化合价为+4的化合物是 (填图的编号);D图中的物质在空气中燃烧的化学方程式是 。
例2(安徽2005)据报道,国家有关部门对家庭装饰材料进行抽查,发现具有毒气污染的材料占68%,它们会释放出300多种能引发30多种疾病的有害物质,甲醛就是其中的一种,它的化学式为CH2O.下面关于甲醛的叙述正确的是( ) A.甲醛由碳、氢、氧三种元素组成
B.甲醛由碳原子和水分子构成
C.甲醛分子由碳原子、氢气分子、氧原子构成的
D.甲醛由一个碳元素、二个氢元素、一个氧元素组成例3 目前,世界各国正在开发安全高效的自来水消毒剂,ClO2就是开发的一种,下列对ClO2的叙述中错误的是( )
A.ClO2是一种混合物 B.ClO2是一种氧化物
C.ClO2是一种含氧化合物 D.ClO2是一种化合物例4(黑龙江2004)许多植物的花、果、茎、叶中都含有色素,这些色素在酸性溶液或碱性溶液中会显示出不同的颜色,可以作为酸碱指示剂。现取三种花瓣,分别放在研钵中,加入酒精研磨,各取少许,用稀酸或稀碱检验,结果如下:请回答:
(1)不能用作酸碱指示剂的是 。(2)已知苹果的近似pH为2.9—3.3,将大红花汁滴入苹果汁中,
呈现的颜色是 。例5(安徽2005)(1)在H、O、C、Cl、Ca五种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格中。
①可用于人工降雨的氧化物 ;②可用于金属表面除锈的酸 ;
③可改良酸性土壤的碱 ;④可作建筑材料的盐 ;
⑤可作干燥剂的氧化物 。
(2)用上述五种元素组成适当物质,写出符合下列要求的化学方程式:
化合反应 ;分解反应 ;复分解反应 。溶液中溶质的质量分数1.概念:溶液中溶质的质量分数
是指溶质质量与溶液的质量
之比的。2.公式:溶质的质量分数= ———— = ————————溶质质量溶液质量溶质质量
溶剂质量+溶质质量3.类型一.最简型二.过量型三.结晶水合物型四.同溶质相混合型五.稀释,浓缩型六.化学反应型1.最简型2.气体型3.沉淀型
医院里配制1500克生理盐水,需要食盐13.5克,试确定此生理盐水的质量分数;并计算需水多少克?解: 生理盐水的质量分数=(13.5克/1500克)×100%
=0.9%
水的质量是:1500克-13.5克=1486.5克
答:生理盐水的质量分数是0.9%;需要水的质量是1486.5克一.最简型二.固体过量型例.
20℃时硝酸钾的溶解度为31.6克,将18克硝酸钾晶体溶入36克20 ℃水中,试计算所得溶液的溶质质量分数?解:设36克水中最多能溶解x克硝酸钾晶体
则:x/36=31.6/100
x=11.376
因为11.376克<18克 所以形成的溶液为饱和溶液
此溶液的溶质质量分数为:
11.376克÷(36克+11.376克)×100%
=24%三.结晶水合物型例.
胆矾25克溶于75克水中,试计算所得溶液的溶质质量分数 ?溶质的质量=晶体质量 CuSO4/CuSO4.5H2O
=25克 × (160克/250克)
=16克
溶液中溶质质量分数:16克÷(25克+75克)×100%=16%
答:此溶液中溶质质量分数是16%解:四.同溶质相混合型例.
将20克10%的NaCl溶液与30克5%的NaCl溶液混合,试计算混合后溶液的溶质质量分数?
因为m 浓×a浓%+m稀×a稀%=(m浓+m稀)×a混%
所以:20克×10%+30克×5%=(20克+30克)·x
解之得:x=7%
答:混合后溶液的质量分数是7%解:
配制10%的稀盐酸500克,问需要37%的浓盐酸 和 水 各多少毫升? (37%的盐酸的密度为1.19克/毫升 )五.稀释、浓缩型因为: m稀×a稀%=m浓×a浓%
所以:500克×10%=m浓×37%
解得:m浓=135.14克
V浓=135.14克÷1.19克/毫升=113.56毫升
m水=m稀-m浓=500克-135.14克
=364.86克
v水=m水/p水=364.86克÷1克/毫升
=364.86毫升 练习2.
将50克质量分数为10%的蔗糖溶液蒸发掉20克水后,试计算所得溶液的溶质质量分数?(无晶体析岀)因为:m稀×a稀%=(m稀-m水)×a浓%
所以:50克×10%=(50克-20克)×a浓%
解得:a浓%=16.67%
答:浓缩后溶液的溶质质量分数是16.67%解:六.化学反应型1.最简型例.
将16克SO3投入8克水中,试计算所得溶液的溶质质量分数?解:设:硫酸的质量为x克SO3+H2O=H2SO480 98
16 x80/98=16/x
解得:x=19.6
溶液质量分数:19.6克÷(16克+8克)×100%
=81.67%
答:所得溶液的溶质质量分数是81.67%2.气体型
将6.5克锌投入到93.7克稀盐酸中,恰好完全反应,试计算生成氢气的质量和反应所得溶液的溶质质量分数?解:设:生成氢气的质量为x克,生成氯化锌的质量为y克Zn+2HCl= ZnCl2+ H2↑ 65 136 2
6.5 y x
65/6.5=136/y 65/6.5=2/x解得
x=13.6 y=0.2所得溶液的溶质质量分数:
13.6克÷(6.5克+93.7克-0.2克)×100%=13.6%3.沉淀型
100克BaCl2溶液和100克稀H2SO4溶液恰好完全反应生23.3克白色沉淀(BaCl2+H2SO4=BaSO4 ↓ +2HCl)
(1).试计算原BaCl2溶液和稀H2SO4溶液各自溶质质量分数。
(2).试计算生成的盐酸的质量分数?解:设:原BaCl2溶液的质量分数为x,原H2SO4溶液的质量分数为y;生成HCl的质量为z克
BaCl2+H2SO4=BaSO4↓ +2HCl
208 98 233 73
100x 100 23.3 z
所得HCl%=7.3克÷(200克-23.3克)×100%=4.13%
答:原BaCL2溶液和H2SO4溶液质量分数分别是20.8%和9.8%,生成的盐酸的质量分数是4.13%208/100x=233/23.3 98/100y=233/23.3 73/z=233/23.3
解得:x=20.8% y=9.8% z=7.3克
练习1
Na2CO3和NaCl固体粉末10克,加入100克
稀HCl中完全反应,生成气体0.88克。
(1).试计算固体混合中NaCl固体的质量分数,
(2).试计算固体混合物中钠元素的分数
(3).试计算反应后溶液中溶质的质量分数解:设Na2CO3的质量为x克,生成NaCl的质量y克Na2CO3+2HCl=2NaCl+CO2+H2O 117 44X y 0.88列方程:106 : x = 117 :y = 44:0.88
解之得:x=2.12克 y=2.34克 1. NaCl%=(10克-2.12克)10克100%=7.88%
2. Na%
( 2.12 ×2Na/Na2CO3+7.88×Na/NaCl )÷10×100%
= (2.12×46/106+7.88 × 23/58.5) ÷ 10 × 100%
3溶液NaCl%
( 7.88克+2.34克)÷(10克+100克-0.88克) ×100%练习2: 取Na2CO3和NaCl的固体混合物13.6克与一定质量的稀盐酸恰好完全反应,得到10%的NaCl溶液147克。
计算:
固体混合物中的碳酸钠的质量分数
生成CO2的质量
该盐酸中溶质的质量分数解:设原混合物中Na2CO3质量为x,参加反应的HCl质量为y,生成的CO2质量为z,则NaCl质量为13.6克-x,化学反应产生的NaCl质量为147×10%-(13.6-x)=1.1+xNa2CO3+2HCl=2NaCl+CO2 +H2O106 73 117 44
x y 1.1+x z106:x=117:(1.1+x ) 解得:x=10.6克
106:10.6=73:y 解得:y=7.3克
106:10.6=44:z 解得:z=4.4克 (1)Na2CO3%=(10.6÷13.6 )×100%
(2)CO2质量:4.4克
(3)HCl%=7.3/(147-13.6) ×100%
练习3、现有20克食盐溶液,
经蒸发、结晶得到食盐
晶体4克。试确定这一食
盐溶液中溶质的质量分数。 练习4、医院里配制生理
盐水2000千克。问需
要食盐和水各多少千克?练习5、工业生产上,有时
要用溶质的质量分数为
10%的稀硫酸来清洗钢材。
把50千克溶质的质量分数
为9 8%的浓硫酸稀释成溶
质的质量分数为10%的稀
硫酸,需要水多少千克?练习6、配制1000毫升溶质的
质量分数为10%的稀硫酸,
需要溶质的质量分数为98%
的浓硫酸多少毫升?
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
